Cobalamine
Cobalamine sind chemische Verbindungen, die in allen Lebewesen vorkommen und auch als Vitamin-B12-Gruppe (vereinfachend Vitamin B12) bezeichnet werden. Der wichtigste Vertreter aus der Cobalamin-Gruppe ist das umgangssprachlich ebenfalls als Vitamin B12 bezeichnete Adenosylcobalamin, welches auch als Coenzym B12 bekannt ist. Es ist als Kofaktor (Coenzym) Teil mehrerer Enzyme. Beim Menschen sind zwei Cobalamin-abhängige Enzyme bekannt, die am Stoffwechsel der Aminosäuren teilnehmen. Cobalamine enthalten das Spurenelement Cobalt als Zentralatom.[4][5]
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
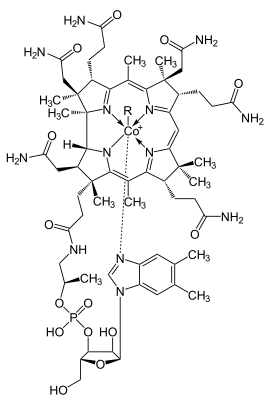 | |||||||||
| Adenosylcobalamin (AdoCbl, Coenzym B12): R = 5′-Desoxyadenosyl Cyanocobalamin: R = –C≡N Aquocobalamin (Vitamin B12a): R = –OH2 Hydroxycobalamin (Vitamin B12b): R = –OH Methylcobalamin (MeCbl, MeB12): R = –CH3 Nitritocobalamin (Vitamin B12c): R = –O–N=O | |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin B12 | ||||||||
| Andere Namen |
| ||||||||
| Summenformel |
| ||||||||
| CAS-Nummer |
| ||||||||
| PubChem | 16072210 | ||||||||
| ATC-Code |
B03BA04 | ||||||||
| DrugBank | DB00115 | ||||||||
| Kurzbeschreibung | roter, kristalliner Feststoff (Cyanocobalamin, Hydroxocobalamin, Methylcobalamin) | ||||||||
| Vorkommen | tierische Produkte (Adenosylcobalamin, Hydroxocobalamin, Methylcobalamin), Dickdarm (durch bakterielle Produktion) | ||||||||
| Physiologie | |||||||||
| Funktion | Zellteilung, Blutbildung, Funktion des Nervensystems | ||||||||
| Täglicher Bedarf | 4 µg[1] | ||||||||
| Folgen bei Mangel | Perniziöse Anämie, neurologische Erkrankungen (z. B. funikuläre Myelose), Glossitis, Diarrhöen | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | |||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt |
zersetzt sich ab 392 °C (Cyanocobalamin) | ||||||||
| Löslichkeit | wenig löslich in Wasser: 12 g·l−1 (Cyanocobalamin), 20 g·l−1 (Hydroxocobalamin), unlöslich in Ether, Aceton und Chloroform (Cyanocobalamin), löslich in Alkohol (Cyanocobalamin) | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Zur Vitamin-B12-Gruppe gehören auch die Speicherformen
- Aquocobalamin bzw. Aquacobalamin (Vitamin B12a, die konjugierte Säure des Hydroxocobalamins),
- Hydroxocobalamin bzw. Hydroxycobalamin (Vitamin B12b) und
- Nitritocobalamin (Vitamin B12c).
Die Medizin verwendet die biologisch inaktiven Formen Cyanocobalamin und Hydroxocobalamin zur Vitamin-B12-Supplementierung und für andere therapeutische Zwecke. Im menschlichen Organismus werden diese Vorstufen in Adenosylcobalamin und Methylcobalamin umgewandelt. Beide sind als Coenzyme biologisch aktiv.[6]
Definitionen
Das Lexikon der medizinischen Laboratoriumsdiagnostik definiert Vitamin B12 als „wasserlösliche Vitamine, welche in Form von zwei Coenzymen im zellulären Stoffwechsel von Fettsäuren und aliphatischen Aminosäuren eine wesentliche Rolle spielen“. Demnach werden unter dem Begriff substituierte Corrinoide bzw. Cobalamine mit biologischer Wirkung zusammengefasst. Forschungsgeschichtlich bedingte Synonymbezeichnungen des Vitamin B12 sind Antiperniziosa-Faktor und Extrinisic-Faktor.[6] Die Definition des Pschyrembel betont die Beteiligung der Vitamingruppe an der Zellteilung, der Erythropoese und der Myelinbildung.[7]
Die International Union of Nutritional Sciences (IUNS) und die International Union of Pure and Applied Chemistry (IUAPC) geben an, dass „Vitamin B12“ als allgemeine Beschreibung für alle Corrinoide verwendet werden sollte, die qualitativ die biologische Aktivität von Cyanocobalamin aufweisen.[8]
In PubChem steht Vitamin B12 synonym für das Cyanocobalamin,[9] ebenso in verschiedener Fachliteratur.
Nicht zu verwechseln mit den eigentlichen Cobalaminen sind die Trans-Cobalamine, bei denen es sich lediglich um Transportproteine für Vitamin B12 handelt.
Geschichte
Nachdem schon Anfang der 1920er Jahre der US-amerikanische Pathologe George H. Whipple entdeckt hatte, dass Hunde, die an perniziöser Anämie (bösartige Blutarmut) litten, durch Fütterung mit roher Leber von dieser sonst tödlich verlaufenden Krankheit geheilt werden konnten, führte die Suche nach der essenziellen Komponente dieser Heilmethode schließlich 1926 zur Beschreibung eines auch beim Menschen wirksamen Antiperniziosa-Faktors durch die beiden US-amerikanischen Ärzte George R. Minot und William P. Murphy,[10] die dafür zusammen mit Whipple 1934 den Nobelpreis für Medizin erhielten.
Die Isolierung des Wirkstoffs in kristalliner Form gelang erst 1948, und das unabhängig voneinander sowohl einem Team amerikanischer Biochemiker um Karl A. Folkers (MSD),[11][12] als auch einem britischen Forscherteam um den Chemiker E. Lester Smith (Glaxo).[13] Die rot-kristalline Verbindung wurde „Vitamin B12“ genannt. Noch im selben Jahr wurde Vitamin B12 in Milchpulver, in Rindfleischextrakt und Flüssigkulturen verschiedener Bakteriengattungen gefunden.[14]
1955 konnte die britische Biochemikerin Dorothy C. Hodgkin mit Hilfe der Röntgenbeugung an Cyanocobalamin-Einkristallen deren Molekülstruktur aufklären, wofür sie u. a. 1964 mit dem Nobelpreis für Chemie geehrt wurde.[15]
Um 1956 glaubte man sicher im Cyanocobalamin das Vitamin B12 gefunden zu haben, was angesichts seiner Verwendung in wirksamen Vitaminpräparaten zur Begriffsverwirrung beitrug, obwohl es tatsächlich eine biologisch inaktive Form ist.
Die darauf aufbauende Totalsynthese des Cyanocobalamins, damals als „das Vitamin B12“ verstanden, gelang 1972 Albert Eschenmoser und Robert B. Woodward[16] und noch heute gilt diese Vitamin B12-Form als eines der größten jemals in einem Labor totalsynthetisierten Moleküle.
Beschreibung
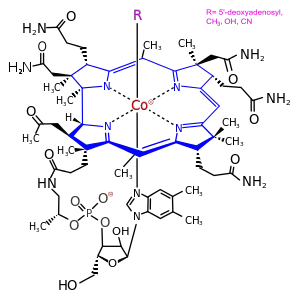
Cobalamine sind organometallische Verbindungen mit einem zentralen ein-, zwei- oder dreifach positiv geladenen Cobalt-Ion und als solche die bisher einzigen bekannten cobalthaltigen Naturstoffe. Natürliche vorkommende Cobalamine mit Vitamin-B12-Wirkung sind das Adenosylcobalamin, das Methylcobalamin und das Hydroxocobalamin. Cyanocobalamin ist hingegen die industriell hergestellte, stabile Cobalamin-Form, die in der Natur nicht vorkommt.[14]
Alle Cobalamine besitzen dieselbe Grundstruktur eines Cobaltkomplexes, in dem das Cobaltkation von fünf Stickstoffatomen und einem sechsten, i. d. R. austauschbaren Liganden umgeben ist, siehe nebenstehende Abbildung. Vier der Stickstoffatome gehören zu einem ebenen Corrin-Ringsystem (blau markiert), das das Cobaltkation so fest umschließt, dass es nur durch Zerstörung des Ringsystems wieder herausgelöst werden kann, während das fünfte Stickstoffatom zu einem nucleotidartig an den Corrinring gebundenen 5.6-Dimethyl-benzimidazol-Ring gehört.
Namensgebend für das jeweilige Cobalamin indes ist der sechste, austauschbare Ligand, der in den chemischen Strukturformeln meist mit R (für Rest) abgekürzt wird: Ist R eine Hydroxygruppe, handelt es sich bei dem Cobalamin um Hydroxycobalamin, ist R eine Cyanogruppe, um Cyanocobalamin, und bei einem 5'-Desoxyadenosylliganden als Rest um 5'-Desoxyadenosylcobalamin, kurz Coenzym B12.
Meist ist der sechste Ligand R nur schwach an das Cobaltkation gebunden, so dass er leicht durch andere Liganden austauschbar ist und der menschliche Organismus zum Beispiel das therapeutisch eingesetzte Hydroxycobalamin oder Cyanocobalamin (Vitamin B12) durch Austausch der Hydroxy- gegen eine Cyanogruppe und dieser wiederum gegen eine 5'-Desoxyadenosylgruppe in das eigentlich biochemisch aktive Coenzym B12 umwandeln kann.
Cyanocobalamin (Vitamin B12) selbst ist eine geruchlose, tief dunkelrote, kristalline hygroskopische Substanz, die sich nur mäßig in Wasser und niederen Alkoholen, dagegen gar nicht in (apolaren) organischen Lösungsmitteln wie Aceton, Chloroform oder Ether löst.
Im leicht sauren pH-Bereich von 4–6 ist Vitamin B12 recht temperaturstabil. In basischen Lösungen oder in Gegenwart von Reduktionsmitteln wie Ascorbinsäure (Vitamin C) und SO2 können jedoch größere Verluste auftreten.[17] So wurde die Halbwertszeit von Vitamin B12 bei einem pH-Wert von 5,5 und 30-mal so viel Vitamin C in Dunkelheit auf unter 15 Stunden bestimmt (Classic Mineralwasser hat pH 5,5 und Multivitamin-Tabletten enthalten teils 32 000-mal so viel Vitamin C wie B12).[18]
In der Zelle kommen Cobalamine im Cytosol vor allem als Methylcobalamin, in den Mitochondrien dagegen überwiegend als 5'-Desoxyadenosylcobalamin (Coenzym B12) vor. Die Abbildung oben zeigt die allgemeine Strukturformel der Cobalamine mit R als austauschbarem Liganden.
Funktion im Organismus
Vereinfachend zusammengefasst ist Vitamin B12 wichtig für die Zellteilung und Blutbildung sowie die Funktion des Nervensystems.
Coenzym B12 nimmt im humanen Organismus als Coenzym an nur zwei enzymatischen Reaktionen teil:
- N5-Methyl-Tetrahydrofolat-Homocystein-S-Methyltransferase (Methionin-Synthase, EC 2.1.1.13) und
- Methylmalonyl-CoA-Mutase (EC 5.4.99.2)
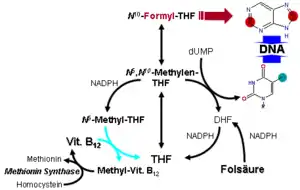
Die Reaktion der Methionin-Synthase[19] dient u. a. der Regeneration des Methylgruppenüberträgers S-Adenosylmethionin (SAM) bzw. der Bildung von Methionin. Dabei wird Homocystein zum Methionin remethyliert. Gelingt dies nicht, bildet sich vermehrt Homocystein, ein Zwischenprodukt beim Abbau der Aminosäure Methionin (erhöhte Homocysteinspiegel werden mit der Bildung von Arteriosklerose in Zusammenhang gebracht). Als Methylgruppendonator fungiert dabei N5-Methyl-Tetrahydrofolat (N5-Methyl-THF). Fehlt Coenzym B12, so reichert sich N5-Methyl-THF an und es kommt zu einem sekundären Mangel an THF, welches für die Synthese der Purinbasen Adenin und Guanin und der Pyrimidinbase Thymin erforderlich ist. Durch einen Mangel an diesen Nukleobasen ist die Synthese insbesondere von DNA aber auch RNA gestört. Dies äußert sich vorrangig in Organen mit hoher Zellteilungsaktivität wie dem Knochenmark. Es kommt zu einer mehr oder minder ausgeprägten Panzytopenie im Blut, wobei der Mangel an Erythrozyten – die Anämie – am offensichtlichsten ist. Die verbleibenden Erythrozyten werden mit Hämoglobin so stark angereichert, dass sie einen höheren Hämoglobingehalt als normale Erythrozyten haben. Auch sind diese Zellen etwas größer. Daher spricht man von einer hyperchromen, makrozytären Anämie. Durch die Gabe von Folsäure kann dieser Block umgangen werden, jedoch löst dieser Ansatz nicht den zugrundeliegenden Vitamin-B12-Mangel, so dass die Behandlung der perniziösen (wörtl. gefährlich) oder megaloblastären Anämie bei Vitamin-B12-Mangel mit Folsäure einen Kunstfehler darstellt.
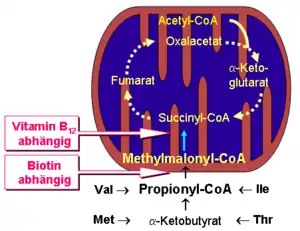
Der Grund hierfür ist die zusätzliche Funktion des Vitamin B12 in der Methylmalonyl-CoA-Mutase. Diese dient der Einschleusung des terminalen Propionyl-CoAs ungeradzahliger Fettsäuren, sowie Teilen des Kohlenstoffgerüstes der Aminosäuren Valin, Isoleucin, Threonin und Methionin in den mitochondrialen Citratzyklus. Das im Rahmen des Abbaus dieser Verbindungen aus Propionyl-CoA (in einem Biotin-abhängigen Schritt) gebildete Methylmalonyl-CoA wird durch die Vitamin-B12-abhängige Methylmalonyl-CoA-Mutase zu Succinyl-CoA, einem Zwischenprodukt des Citratcyclus, umgesetzt.
Ist dieser Schritt gehemmt, kommt es zu einem Anstieg von Methylmalonsäure im Plasma und vor allem im Urin. Dieser Stoffwechselweg spielt offenbar eine besondere Rolle im ZNS, da sich ein Vitamin-B12-Mangel bisweilen sogar vor der typischen Anämie mit Symptomen wie z. B. der funikulären Myelose, einer Störung der Pyramidenbahn und der Hinterstränge, aber auch scheinbaren Altersdemenzen und anderem bemerkbar macht. Daher sollte insbesondere bei älteren Patienten mit neurologischer Symptomatik ein Vitamin-B12-Mangel als mögliche (Mit-)Ursache ausgeschlossen und ggf. behandelt werden. Erste neurologische Symptome äußern sich als so genannte Polyneuropathie in Form von Kribbelparästhesien oder anderen Missempfindungen (z. B. leichtes Brennen) in verschiedenen Körperregionen, die anfangs nur vorübergehend sind.
Vorkommen
| Lebensmittel | Gehalt in µg/100 g (siehe Hinweis[24][25]) |
|---|---|
| Rinderleber | 65 |
| Kalbsleber | 60 |
| Spirulina maxima[24] | (57) |
| Schweineleber | 40 |
| Kalbsniere | 25 |
| Hühnerleber | 20 |
| Schweineniere | 15 |
| Austern | 14,6 |
| Hering | 11 |
| Makrele | 9 |
| Rindfleisch (Muskel) | 5,0 |
| Thunfisch | 4,3 |
| Camembert 30 % Fett i. Tr. | 3,1 |
| Lachs | 2,9 |
| Steppengrille[26] | 2,9 |
| Emmentaler 45 % Fett i. Tr. | 2,2 |
| Hühnereigelb | 2,0 |
| Totentrompete, Echter Pfifferling (Wildform)[27] | 1,1–2,7 |
| Aal | 1 |
| Blutwurst | 1 |
| Schweinefleisch (Muskel) | 0,8 |
| Speisequark 20 % Fett i. Tr. | 0,8 |
| Kabeljau | 0,5–0,8 |
| Kuhmilch 3,5 % Fett | 0,4 |
| Sojasauce | 0,3 |
| Tempeh | 0,3 |
| Ingwer | 0,16 |
| Hühnereiweiß | 0,1 |
| Gemüse | 0,01 |
| Sauerkraut | 0 |
Cobalaminquellen
Tiere sind nicht in der Lage, Vitamin B12 selbst herzustellen. Vitamin B12 wird in der Natur von Mikroorganismen – insbesondere Bakterien – produziert,[28] die als Symbionten sowohl im Verdauungstrakt von Tieren als auch auf der Oberfläche pflanzlicher Wirte (z. B. Leguminosen) vorkommen.[23]
Im menschlichen und tierischen Organismus wird Vitamin B12 vor allem in Leber und Niere akkumuliert, in Pflanzen kann es nur in Spuren vorkommen.[23] In höheren Pflanzen kommt Vitamin B12 vor allem in den Wurzeln vor, in den grünen Teilen dagegen fast nicht.[29]
Alles- und Fleischfresser decken ihren B12-Bedarf durch den Konsum von Fleisch, insbesondere Innereien. Geflügelarten und Schweine können das in ihrem Darm produzierte B12 nur unzureichend resorbieren und sind daher auf eine exogene Versorgung über ihr Futter angewiesen.[30] In der Schweinemast wird dem Futter hierfür entweder Fischmehl oder Vitamin B12 zugesetzt; letzteres in einer Dosierung von 10 µg pro kg Futter.[31] Auch im menschlichen Dickdarm kommen Bakterien vor, die Vitamin B12 produzieren. Allerdings reicht diese Synthese zur Bedarfsdeckung nicht aus und das dort gebildete Vitamin wird überwiegend mit dem Stuhl ausgeschieden.[6][32] Das mit der Nahrung zugeführte Vitamin B12 wird in die Enterozyten aufgenommen.[6] Dieser Zelltyp kommt besonders häufig im Dünndarmepithel vor.
Bei Wiederkäuern wird das Vitamin im Vormagen, bei anderen Pflanzenfressern im Dickdarm gebildet.[33] Ein Mangel bei Wiederkäuern beruht in der Regel auf unzureichender Cobaltzufuhr.[30] In der Tierproduktion wird dem Futter in Spuren Cobalt hinzugefügt, falls die Tiere von cobaltarmen Weideflächen ernährt werden müssen. Hierüber soll Wachstums- und Laktationsstörungen, Blutarmut und Appetitlosigkeit entgegengewirkt werden.[34] Einige Arten von Pflanzenfressern können durch Aufnahme ihres Blinddarmkots Vitamin B12 zuführen. Der Kot ist reich an Vitaminen des B-Komplexes und Vitamin K. Das Verhalten wird Caecotrophie genannt und ist unter anderem von Nagetieren (Rodentia) und Hasenartigen (Lagomorpha) bekannt. Hindert man Kaninchen an der Aufnahme ihres Blinddarmkots, sinkt die Ausnutzung an Nährstoffen einschließlich Vitaminen aus dem Futter.
Cobalamingehalt einiger Lebensmittel
Hinweis zur Tabelle: Die Angaben entsprechen nicht dem Gehalt des vom menschlichen Organismus verwendbaren Vitamins der Lebensmittel. Vor allem der Bestandteil in unvergorenen pflanzlichen Lebensmitteln wie Spirulina ist eher auf Pseudovitamin B12 zurückzuführen, das bei Säugetieren nahezu keine biologische Wirksamkeit besitzt.[25]
Vitamin B12 ist in fast allen Nahrungsmitteln tierischer Herkunft (auch Eiern und Milchprodukten) zumindest in geringen Mengen enthalten. Im Vergleich zu Kuhmilch (0,4 µg/100 g) enthält Muttermilch nur durchschnittlich 0,05 µg/100 g.[35] Andere Quellen sind vitaminsupplementierte Nahrungsmittel und Nahrungsergänzungsmittel.[36]
Nach etablierter Fachmeinung enthält keine pflanzliche Nahrung für den menschlichen Bedarf ausreichende Mengen der verwertbaren Form des Vitamins.[37] Es wurde vermutet, dass Nahrungsmittel wie Spirulina, Nori, blättrige Braunalgen und Chlorella nützliche Mengen des Vitamins liefern könnten, aber wahrscheinlich sind die enthaltenen Cobalamine nicht biologisch aktiv. Für biologische Aktivität müssen alle Teile des Cobalaminmoleküls anwesend sein. Tatsächlich enthalten diese Nahrungsmittel Cobalamin-Analoga, welche die cobalaminabhängigen Enzyme unterdrücken und eine weitere Verschlechterung des B12-Status verursachen können.[36] Durch Milchsäuregärung haltbar gemachte Gemüse und Leguminosen – wie etwa Erbsen, Bohnen und Lupinen – und Zingiberales wie Ingwer besitzen einen, wenn auch geringen, Gehalt an B12-Coenzymen.[20] Aktuell gibt es jedoch zu wenige oder gar keine Belege, dass fermentierte Nahrungsmittel einen ausreichenden B12-Status aufrechterhalten können.[36]
Auf der Suche nach möglicherweise geeigneten Vitamin-B12-Quellen für Vegetarier, die auch Vitaminsupplementierung meiden, stießen Watanabe et al. auf die Koreanische Rotalge (Porphyra sp.). Nach einer 2014 veröffentlichten Berechnung der Autoren könnte der tägliche Konsum von 4 g der getrockneten Meeresalge, die in dieser Form auch unter der kulinarischen Bezeichnung Nori bekannt ist, einen Vitaminbedarf in Höhe von 2,4 µg decken. Diese Aussage beruht auf Daten aus einer In-vitro-Verdauungssimulation von getrocknetem Porphyra sp., die bereits im Jahr 2009 publiziert wurden. Um die Bioaktivität des Cobalamin aus Nori zu belegen, wurde 2001 ein Tierversuch mit gefriergetrocknetem Porphyra yezoensis publiziert.[38] Bereits 1991 veröffentlichten Dagnelie et al. Tests mit Nori, Spirulina und fermentierter pflanzlicher Nahrung an Vitamin-B12-defizitären Kindern und beobachteten eine weitere Erhöhung des mittleren Erythrozyteneinzelvolumens. Die Autoren schlossen daraus, dass die Bioverfügbarkeit des Cobalamin aus diesen Quellen fraglich sei. Sie fanden es ungerechtfertigt, Algen und „andere pflanzliche Nahrung“ als eine sichere Vitamin-B12-Quelle zu empfehlen.[39] Die Übersichtsarbeit von Rizzo et al. aus dem Jahr 2016 bewertete die vorliegenden in-vitro-Tests als vielversprechend, wies jedoch gleichzeitig darauf hin, dass ausreichende Humanstudien fehlen, um die Nutzung von Algen in der Versorgung mit Vitamin B12 als vorteilhaft zu betrachten.[40]
Herstellung
Für die chemische Reindarstellung von Vitamin B12 aus Streptomyces-Kulturen oder aus Leber wird Cyanid hinzugesetzt.[41] Die chemische Synthese von Vitamin B12 ist wegen der Komplexität der Cobalamine sehr aufwendig. Supplemente für den menschlichen Verzehr oder zum Einsatz in Tiernahrung (Geflügel und Schweine) werden daher meist mittels gentechnisch veränderten Mikroorganismen hergestellt.[42] Da lediglich das gereinigte Endprodukt auf den Markt kommt, besteht hierfür keine Kennzeichnungspflicht.
Bedarf

Der tägliche Bedarf kann derzeit nur geschätzt werden.[43] Die Schätzwerte für eine angemessene Zufuhr sind viel geringer als bei den meisten anderen Vitaminen und liegen im µg-(Mikrogramm-)Bereich:
- Säuglinge (bis 12 Monate): 0,5–1,4 µg/Tag[1]
- Kinder (1–15 Jahre): 1,5–4,0 µg/Tag[1]
- Erwachsene: 4,0 µg/Tag[1]
Die biologische Halbwertszeit des Vitamins B12 beträgt 450–750 Tage. Das Vitamin wird ständig mit Gallensäuren in den Dünndarm abgegeben und an dessen Ende – dem terminalen Ileum – mithilfe des intrinsischen Faktors wieder aufgenommen. Hierbei wird es mittels Endocytose in die Zellen der Darmschleimhaut aufgenommen.[44] Der Bedarf ergibt sich also aus den Mengen, die im Ileum nicht wieder rückresorbiert werden konnten, abzüglich der Mengen, die möglicherweise schon dort durch Mikroorganismen produziert werden. Falls es zur Störung bei der Bildung des intrinsischen Faktors kommt, kann das Vitamin nur in geringen Mengen aufgenommen oder rückresorbiert werden, wodurch sich die Speicher im Organismus schnell leeren. Die meisten Fälle von Mangel an Vitamin B12 werden durch Störungen bei der Bildung des intrinsischen Faktors verursacht.
Gesunde Erwachsene speichern in ihrer Leber 2000–5000 µg Vitamin B12. Das gefüllte Depot reicht aus, um eine Unterversorgung über mehrere Jahre hinweg auszugleichen.[36] Anders ist die Situation bei Säuglingen; diese verfügen über wesentlich geringere Reserven.[45] Die Leber eines gut ernährten Neugeborenen enthält nur 25–30 µg des Vitamins.[46] Gestillte Kinder von Frauen, die sich vegan ernähren und nicht ausreichend supplementieren, und deren Muttermilch deshalb arm an Vitamin B12 ist, entwickeln ohne Zufütterung tierischer Lebensmittel oder von Präparaten meist im zweiten Lebenshalbjahr Symptome eines Mangels.[45] Die bei vegetarischer Ernährungsweise typischerweise hohe Folsäurezufuhr vermag die hämatologischen Symptome einer Vitamin-B12-Unterversorgung zu überdecken, so dass der Mangel bis zum Auftreten neurologischer Symptome unentdeckt bleiben kann.[37] Auch bei veganer Ernährung manifestieren sich Defizite unter Umständen erst nach einigen Jahren, pflanzliche Lebensmittel decken nicht den Vitamin B12-Bedarf.[44]
Vitamin-B12-Mangel (Hypovitaminose)
Mangelerscheinungen
Bei einem Mangel an Vitamin B12 kann es zur perniziösen Anämie (Perniziosa), einer Erkrankung des Blutbildes, und zur funikulären Myelose – einer Schädigung des Zentralnervensystems mit neurologischen Dysfunktionen – kommen. In den letzten Jahren mehrten sich zudem die Hinweise auf einen möglichen Zusammenhang zwischen einem Vitamin-B12-Mangel und anderen Krankheitsbildern wie z. B. Demenz und Neuropathien. Grundsätzlich sind niedrige Vitamin-B12-Konzentrationen im Blutserum bei älteren Menschen häufiger zu beobachten.
Ein Mangel kann durch unzureichende Zufuhr mit der Nahrung, durch unzureichende Resorption oder durch erhöhten Bedarf z. B. bei Alkoholismus verursacht werden. Bei mangelhafter Aufnahmefähigkeit im Magen-Darm-Trakt fehlt dem Organismus im Magensaft der intrinsische Faktor, ein Glykoprotein, das von den Belegzellen des Magens produziert wird und für die Vitamin-B12-Aufnahme unabdingbar ist. Der intrinsische Faktor bindet Cobalamin in einem vor Verdauungsenzymen geschützten Komplex und ermöglicht so den Transport in die Darmzellen, von wo aus Vitamin B12 über Bindung an weitere Proteine (Transcobalamine) in die äußeren Gewebe gelangt. Häufigster Grund hierfür ist altersbedingt eine chronisch atrophische Gastritis.[44] Auch eine Störung bei der Aufnahme im terminalen Ileum kann zu einem Mangel führen.
Die ersten Anzeichen von Vitamin-B12-Unterversorgung bei erwachsenen Personen können Kribbeln und Kältegefühl in Händen und Füßen, Erschöpfung und Schwächegefühl, Konzentrationsstörungen und sogar Psychosen sein. Des Weiteren kann auch Haarausfall auftreten.[47]
Typische Folgen eines Vitamin-B12-Mangels sind:
- Methylmalonat-Acidurie (fehlende Methylmalonyl-CoA-Mutase-Aktivität)
- Homocystinurie (fehlende Methionin-Synthase-Aktivität, ggf. sekundär Methionin-Mangel)
- megaloblastäre Anämie (Störung des Folsäurestoffwechsels durch Block der N5-Methyl-THF-Spaltung zu THF)
- Hypersegmentierte Leukozyten (Zeichen der Überalterung aufgrund der Syntheseprobleme)
- sensorische Neuropathie (wohl Folge der fehlenden Methylmalonyl-CoA-Mutase-Aktivität und der Anämie)
Vitamin B12, gebunden an das aus den Belegzellen des Magens stammende Glykoprotein intrinsischer Faktor, wird physiologisch im terminalen Ileum absorbiert. Nach einer Magenresektion oder bei einer Autoimmungastritis (A-Gastritis), bei der sich die Immunreaktion gegen die den intrinsischen Faktor bildenden Belegzellen (= Parietalzellen) richtet, ist daher die Aufnahme des Vitamin B12 – zumindest bei normalem Angebot – kaum möglich, so dass sich in der Folge ein Vitamin-B12-Mangel ausbilden kann. Auch bei einer schweren Entzündung des Ileums, insbesondere dem Morbus Crohn (= Ileitis terminalis), aber auch anderen intestinalen Erkrankungen mit Malabsorptionssyndrom, oder nach Resektionen des terminalen Ileum bzw. des Magens, kommt es typischerweise zu einem Vitamin-B12-Mangel.
In diesen Fällen ist eine regelmäßige Substitution von Vitamin B12 erforderlich, wobei diese jedoch unter Umgehung des Magen-Darm-Traktes in Form von intramuskulärer, subcutaner oder selten auch intravenöser Injektion erfolgen sollte, da entweder der fehlende intrinsic factor oder das fehlende bzw. stark gestörte Ileum die Aufnahme des oral zugeführten Vitamin B12 weitgehend verhindern würde. Nur bei Gabe hoher Dosen wird Vitamin B12 auch unspezifisch aufgenommen. Dabei ist jedoch die Resorptionsquote nicht vorhersehbar und daher ist eine orale Vitamin-B12-Substitution in diesen Fällen im Allgemeinen ungenügend.
Das erste wirksame Präparat zur Behandlung der perniziösen Anämie, das in den 1930er Jahren entwickelte Campolon, beruhte auf gereinigten Extrakten aus Lebern von Schlachttieren und enthielt Vitamin B12 als Hauptbestandteil. Es löste die zuvor praktizierte Leberdiät ab, bei der die Patienten täglich rohe Leber oder daraus hergestellte Speisen zu sich nehmen mussten.
Test auf Vitamin-B12-Mangel
Allgemein verändert ein latenter Vitamin-B12-Mangel bis zu vier im Blut messbare Biomarker (Holotranscobalamin, Gesamt-B12-Spiegel, Homocystein und Methylmalonsäure), je nach Ausprägung des Mangelzustands. Der bei dauerhafter Vitamin-B12-Unterversorgung sensitivste und als erster auffällig werdende Laborwert ist hierbei der Wert für Holotranscobalamin (Holo-TC) im Serum. Insbesondere ein Holo-TC von unter 35 pmol/l weist auf einen Vitamin-B12-Mangel hin.[48] Ist nur der Holo-TC-Wert verringert, so treten in diesem Stadium noch keine klinischen oder hämatologischen Symptome auf. Die Feststellung eines Vitamin-B12-Mangels in diesem Stadium erlaubt eine Substitutionstherapie, bevor irreversible neurologische Schädigungen auftreten.[49]
Bei einem fortschreitenden Mangel können auch erhöhte Homocysteinwerte sowie erhöhte Werte für die Methylmalonsäure (MMA) auftreten. Diese Werte müssen daher in der Regel erst bei Auffälligkeit des Holo-TC-Wertes oder bei anderweitigem Verdacht auf Vitamin-B12-Mangel (bspw. bei erhöhtem Kreatinin)[50] abgeprüft werden. Der Gesamt-Vitamin-B12-Spiegel im Serum ist oft der zuletzt abfallende und dazu relativ unspezifische und unsensitive Bio-Marker zur Feststellung einer latenten Vitamin-B12-Mangelversorgung, demzufolge hat dieser Parameter für die frühzeitige Feststellung eines Vitamin-B12-Mangels nur eine begrenzte Aussagekraft.[49]
Labormethodik
Da es keinen Goldstandard zur Bestimmung des Vitamin-B12-Status eines Menschen gibt (Stand 2013),[51] wird z. B. von der Deutschen Gesellschaft für Ernährung die Bestimmung mehrerer Marker aus dem Blutserum für die Untersuchung der B12-Versorgung empfohlen.[52]
Seit der Jahrtausendwende wird zur Bestimmung des Cobalamin-Spiegels im Blut ein CBLA-Assay durchgeführt (competitive-binding luminescence assay), der die früheren mikrobiologischen und Radioisotopen-Dilutions-Assays der 1970er Jahre abgelöst hat. Einzelfallberichte und kleinere Studien deuten darauf hin, dass diese neueren Assays bei Patienten mit perniziöser Anämie systematische Fehler aufweisen.[51] Kleine klinische Serien bestätigten, dass die Assays eine hohe Rate falsch-negativer Ergebnisse (zwischen 22 und 35 %) produzieren, d. h., in einem von drei bis fünf Fällen wird statt eines Cobalamin-Mangels fälschlicherweise ein Normalspiegel ermittelt.[53]
Überdosierung (Hypervitaminose)
Therapeutische – meist intravenöse – Überdosen werden mit lokalen allergischen Beschwerden[54] sowie einer Form der Akne (Acne medicamentosa) in Verbindung gebracht.[55] Auch die extrem hoch dosierte Verwendung als Gegengift von bis zu 5 g (entspricht 5.000.000 µg) Hydroxocobalamin ist laut EFSA erprobt und sicher.[56]
Die wissenschaftlichen Einschätzungen einer täglichen Höchsteinnahmemenge (engl. UL, Tolerable Upper Intake Level) variieren und basieren auf einfachen Schätzungen, weil – so u. a. das Bundesinstitut für Risikobewertung (BfR) – Untersuchungen mit sehr hohen Einnahmedosen „keine nachteiligen gesundheitlichen Effekte gezeigt haben“ bzw. die zur Berechnung benötigten Toxizitätswerte NOAEL und LOAEL nicht vorliegen.[57][58][56] Einen UL hatte der frühere Wissenschaftliche Lebensmittelausschuss der EU-Kommission (SCF) 2000[58] bzw. die Europäische Behörde für Lebensmittelsicherheit (EFSA) 2006[56] nicht festgelegt.
Für Nahrungsergänzungsmittel hat das BfR 2021 die Einnahme von 25 μg Vitamin B12 pro Tag (2004 noch 9 μg)[59] als sichere Obergrenze angegeben.[58] Gemäß EFSA von 2006 waren von einer zusätzlichen Aufnahme von bis zu 1.000 µg pro Tag bei Patienten mit eingeschränkter Vitamin-B12-Aufnahme keine unerwünschten Wirkungen bekannt, diese wurden aber auch nicht erfasst.[56] Die Datenlage nach Stand 2004 ließ außerdem keine Risikoabschätzung zur oralen Verabreichung explizit von Cyanocobalamin zu.[59]
Nach Einschätzung des Arbeitskreises Nahrungsergänzungsmittel (AK NEM) des Bund für Lebensmittelrecht und Lebensmittelkunde ist die rein theoretische Einstufung des BfR von 2004 spekulativ und basiert nicht auf realen Einnahme-Daten.[60] 2005 stuften die WHO bzw. die FAO Vitamin B12 als Substanz ohne bekannten negativen Gesundheitseffekt ein („Nutrient substances with no identified adverse health effects“).[61] Bei solchen Substanzen wird für die Risikobewertung der „highest observed intake“ („höchste beobachtete Einnahme“) als Richtlinie für die sichere Obergrenze gewählt. Der AK NEM verwies in seiner Stellungnahme auf D. Richardson, der basierend auf der WHO-Einstufung, einen Wert von 2.000 µg täglicher Einnahme als Richtlinie („guidance level“) ermittelte, also einen deutlich höheren Wert als der BfR.[62] Der in Italien gewählte obere Grenzwert liegt laut AK NEM bei 1.000 µg.[60]
Im Rahmen einer 2018 veröffentlichten Studie wurden die Daten aus 20 vorhergegangenen Einzelstudien analysiert sowie eine Mendelsche Randomisierung durchgeführt. Die Autoren konnten die Korrelation zwischen erhöhten Cobalamin-Spiegeln und bestimmten Tumoren (Adenokarzinom, kleinzelliges Bronchialkarzinom) nachweisen und vertreten die Auffassung, dass ihre Ergebnisse die Hypothese eines kausalen Zusammenhangs unterstützen.[63] Die in die Studie eingeschlossenen Patienten wiesen vor allem aufgrund diverser genetischer Varianten erhöhte Cobalamin-Spiegel auf. Unklar bleibt daher, inwiefern risikobehaftete Cobalamin-Spiegel auch durch orale Supplementation erreicht werden können. Unklar bleibt auch, ob ein kausaler Zusammenhang zwischen einem hohen Spiegel und dem Risiko besteht oder ob ein hoher Cobalamin-Spiegel nur ein Indikator für andere Risikofaktoren wie z. B. erhöhten Fleischkonsum und Entzündungen wegen chronischer Erkrankungen ist oder weil die Nahrungsergänzungsmittel wegen anderer Leiden genommen werden.[64]
Weitere Verwendung
Verwendung als Gegengift
Hydroxycobalamin ist ein Antidot bei Vergiftungen durch Cyanide bzw. Blausäure. Cyanidvergiftungen kommen hauptsächlich im Rahmen von Kunststoffbränden vor. Weitere Ursachen können die versehentliche oder absichtliche Einnahme, das Einatmen oder ein Hautkontakt bei Industrieunfällen sein.
Die klinische Symptomatik Koma, Bradykardie und Hypotonie von Rauchgasexponierten im Rahmen eines Brandes sollte an eine Cyanidintoxikation denken lassen. Wie Kohlenmonoxid und Nitrose-Gase ist auch Blausäure im Rahmen der Brandbekämpfung messbar und erhärtet den Verdacht auf eine Intoxikation. Die Therapie mit 4-Dimethylaminophenol (4-DMAP) ist bei Rauchgasexponierten zu meiden, da dies als Met-Hämoglobinbildner die Oxigenierung negativ beeinflusst.
Unter dem Handelsnamen Cyanokit erhielt die Firma Merck KGaA am 29. November 2007 für Hydroxocobalamin über das zentralisierte Verfahren von der Europäischen Kommission die Marktzulassung zur Behandlung erwiesener oder vermuteter Cyanidvergiftung bei Erwachsenen und Kindern.[65] Hydroxocobalamin ist eine Form von Vitamin B12, das Cyanid-Ionen bindet. Dabei entsteht Cyanocobalamin, das über die Nieren mit dem Urin ausgeschieden wird. So wird die Bindung des Cyanids an die Cytochrom-c-Oxidase verhindert. Die Anfangsdosis für Cyanokit bei Erwachsenen liegt bei 5 g des Wirkstoffes, die als intravenöse Infusion zu verabreichen ist. In Abhängigkeit von der Schwere der Vergiftung und der klinischen Reaktion kann eine zweite Dosis von 5 g bis zu einer Gesamtdosis von 10 g verabreicht werden.
Das Risiko-Nutzen-Verhältnis im Rahmen der Behandlung der Cyanidvergiftung mit Hydroxocobalamin ist gut. Als häufige Nebenwirkung kommt es zu einer harmlosen ca. eine Woche andauernden Rotfärbung der Haut und des Urins sowie zu einem leichten Blutdruckanstieg.[66]
Topische Anwendung auf der Haut
Cyanocobalamin wird alternativmedizinisch zur Behandlung des atopischen Ekzems (Neurodermitis) und der Schuppenflechte (Psoriasis) in Form von Salben mit 0,07%igem Vitamin-B12 auf Grundlage von Avocadoöl[67] eingesetzt. Bevor die Salbe im November 2009 unter dem Markennamen Regividerm als Medizinprodukt auf den Markt gebracht wurde, fand sie durch die Fernsehdokumentation Heilung unerwünscht – Wie Pharmakonzerne ein Medikament verhindern, die am 19. Oktober 2009 von der ARD gesendet wurde, ein großes und im Verlauf auch kritisches Medieninteresse.[68][69][70][71] Peter Schönhöfer, ein klinischer Pharmakologe, der vom WDR im Rahmen der Produktion dieser Dokumentation mit der Begutachtung der Studien beauftragt worden war, zog deren Aussagekraft kurz nach der Sendung in Zweifel, da aufgrund der niedrigen Patientenzahlen überhaupt keine belastbare Aussage darstellbar sei. Seine schon während der Produktion dem WDR gegenüber ausgesprochenen Warnungen seien ignoriert worden.[72] Der Dermatologe und Studien-Koautor Peter Altmeyer äußerte gegenüber FOCUS, seine kleine Seitenvergleichsstudie ohne Kontrollgruppe mit 13 Psoriasis- und 49 Neurodermitispatienten sei von der ARD hochgejubelt und falsch interpretiert worden. Für einen Beweis der Wirksamkeit wäre ein Feldversuch mit einigen tausend Patienten notwendig.[69]
Seit März 2010 darf das besagte Produkt nicht mehr unter dem Namen Regividerm vertrieben werden, es heißt nun Mavena B12 Salbe.[73]
In der gültigen S2K-Leitlinie „Neurodermitis“ ist eine Supplementierung von Vitamin B12 nicht als wirksame Therapie gelistet.[74]
Siehe auch
Literatur
- Wolfgang Herrmann, Rima Obeid: Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel. In: Deutsches Ärzteblatt. Band 105, Nr. 40, 2008, S. 680–685. doi:10.3238/arztebl.2008.0680
- Wolfgang Herrmann, Rima Obeid (Hrsg.): Vitamins in the prevention of human diseases. de Gruyter, 2011, ISBN 978-3-11-021448-2.
- Wendy PJ. den Elzen et al.: Subnormal vitamin B12 concentrations and anaemia in older people: a systematic review. In: BMC Geriatrics. Band 10, 2010. doi:10.1186/1471-2318-10-42
- E. V. Quadros: Advances in the understanding of cobalamin assimilation and metabolism. In: British Journal of Haematology. Band 148, Nummer 2, Januar 2010, S. 195–204, doi:10.1111/j.1365-2141.2009.07937.x. PMID 19832808. PMC 2809139 (freier Volltext). (Review).
- R. Carmel: Cobalamin, the stomach, and aging. In: The American journal of clinical nutrition. Band 66, Nummer 4, Oktober 1997, S. 750–759. PMID 9322548. (Review).
Weblinks
- Die Aufnahme von Vitamin B12 (Übersichtsgrafik)
- Deutsche Gesellschaft für Ernährung: Ausgewählte Fragen und Antworten zu Vitamin B12
- Vitamin B12 – alles, was du wissen musst., Quarks, 10. Juni 2021
Einzelnachweise
- Schätzwerte für eine angemessene Zufuhr von Vitamin B12. Deutsche Gesellschaft für Ernährung. Abgerufen am 1. Juni 2019.
- Datenblatt Coenzyme B12, ≥97.0% bei Sigma-Aldrich, abgerufen am 25. Juni 2017 (PDF).
- Eintrag zu Cobamamide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Hans Beyer: Lehrbuch der organischen Chemie. Leipzig 1968, S. 617–618.
- UniProt-Suchergebnis
- R. Driesch: Vitamin B12. In: Axel M. Gressner, Torsten Arndt (Hrsg.): Lexikon der Medizinischen Laboratoriumsdiagnostik. 2. Auflage. Springer Verlag, 2012, ISBN 978-3-642-12920-9, S. 1395. (eingeschränkte Vorschau in der Google-Buchsuche)
- Vitamin B12 In: Pschyrembel Online, Walter de Gruyter GmbH, Juni 2018.
- M. Jägerstad & K. Arkbåge: Cobalamins - Properties and Determination. In: Encyclopedia of Food Sciences and Nutrition, 2. Auflage, 2003, S. 1419–1427. doi:10.1016/b0-12-227055-x/00257-1.
- Cyanocobalamin In: PubChem.
- Geroge R. Minot, William P. Murphy: Treatment of pernicious anemia by a special diet. In: The Yale Journal of Biology and Medicine. Band 74, Nr. 5, 1926, S. 341–353, PMID 11769340, PMC 2588744 (freier Volltext).
- E. L. Rickes et al.: Crystalline Vitamin B12. In: Science. Band 107, Nr. 2781, 16. April 1948, S. 396, doi:10.1126/science.107.2781.396, PMID 17783930 (englisch).
- K. Folkers: Perspectives from research on vitamins and hormones. In: Journal of Chemical Education. Band 61, 1984, S. 747. doi:10.1021/ed061p747.
- E. Lester Smith: Purification of Anti-pernicious Anæmia Factors from Liver. In: Nature. Band 161, Nr. 4095, April 1948, S. 638, doi:10.1038/161638a0, PMID 18856623 (englisch).
- H. Martens, M. Barg, D. Warren, J.-H. Jah (2002): Microbial production of vitamin B 12. In: Applied Microbiology and Biotechnology, 58(3), S. 275–285. doi:10.1007/s00253-001-0902-7. PMID 11935176.
- Manuskript ihres Festvortrages anlässlich der Verleihung des Nobelpreises (PDF; 343 kB).
- Walter Schilling (1974) Totalsynthese von Vitamin B-12: Darstellung von Zwischenprodukten und partialsynthetische Endstufen, Doktorarbeit (aus dem Labor von Eschenmoser / ETH), abgerufen am 25. Aug. 2019
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg 2008, ISBN 978-3-540-73201-3, S. 427, doi:10.1007/978-3-540-73202-0.
- Iqbal Ahmad et al.: Effect of ascorbic acid on the degradation of cyanocobalamin and hydroxocobalamin in aqueous solution: a kinetic study. In: AAPS PharmSciTech. Band 15, Nr. 5, Oktober 2014, S. 1324–1333, doi:10.1208/s12249-014-0160-5, PMID 24920523, PMC 4179674 (freier Volltext).
- Methionine Synthase (Schaubild).
- Mechthild Busch-Stockfisch: Lebensmittel-Lexikon. 4. Auflage. Behr’s Verlag DE, 2005, ISBN 3-89947-165-2.
- H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, 2007, ISBN 978-3-540-73201-3, S. 418.
- Eintrag zu Vitamin B12. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Februar 2013.
- Claus Leitzmann u. a.: 21. Vitamin B12 (Cobalamin). In: Ernährung in Prävention und Therapie: ein Lehrbuch. 2. Auflage. Georg Thieme Verlag, 2003, ISBN 3-8304-5273-X, S. 51. (eingeschränkte Vorschau in der Google-Buchsuche)
- Die Angaben entsprechen nicht dem Gehalt des vom menschlichen Organismus verwendbaren Vitamins der Lebensmittel. Vor allem der Bestandteil in unvergorenen pflanzlichen Lebensmitteln wie Spirulina (wissenschaftlich Arthrospira) oder der echten Spirulina (mit S. maxima) ist eher auf Pseudovitamin B12 zurückzuführen, das bei Säugetieren nahezu keine biologische Wirksamkeit besitzt
- Geoffrey P. Webb: Dietary supplements and functional foods. Wiley-Blackwell, 2006, ISBN 1-4051-1909-8, S. 196.
- Anatol Schmidt, Lisa Call, Lukas Macheiner, Helmut K. Mayer: Determination of vitamin B12 in four edible insect species by immunoaffinity and ultra-high performance liquid chromatography. In: Food Chemistry. 2018. doi:10.1016/j.foodchem.2018.12.039.
- Fumio Watanabe, Joachim Schwarz: Characterization of vitamin B₁₂compounds in the wild edible mushrooms black trumpet (Craterellus cornucopioides) and golden chanterelle (Cantharellus cibarius). In: Journal of Nutritional Science and Vitaminology. 2012. doi:10.3177/jnsv.58.438. PMID 23419403.
- Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs: Naturstoffchemie. Eine Einführung. 2. Auflage. Springer, Berlin 2002, ISBN 3-540-43952-8.
- Zenon Schneider: Comprehensive B12. Walter de Gruyter, 2011, ISBN 978-3-11-084479-5, S. 189.
- Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker: Vitamin B12. In: Pharmakotherapie bei Haus- und Nutztieren. 7. Auflage. Georg Thieme Verlag, 2006, ISBN 3-8304-4160-6, S. 346. (eingeschränkte Vorschau in der Google-Buchsuche)
- H. Lindermayer, G. Probstmeier, W. Preißinger: Grundsätze der Schweinefütterung, Unterrichts- und Beratungshilfe. Teil 1: Ernährungsphysiologische Grundlagen. (PDF; 1,9 MB) LfL Tierernährung, Bayerische Landesanstalt für Tierernährung, 2009, S. 44.
- A. Domke u. a. (Hrsg.): Toxikologische und ernährungsphysiologische Aspekte Teil I – Verwendung von Vitaminen in Lebensmitteln. Bundesinstitut für Risikobewertung, Berlin 2004, ISBN 3-931675-87-4, S. 212, Volltext (PDF; 1,3 MB).
- H.-P. Klöcking: 8.3.2 Vitaminmangel-Anaemie. In: Hans-Hasso Frey, Wolfgang Löscher (Hrsg.): Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. 2. Auflage. Georg Thieme Verlag, 2007, ISBN 978-3-8304-1070-6, S. 216. (eingeschränkte Vorschau in der Google-Buchsuche)
- J. Köhrle, L. Schomburg: 11.4 Kobalt. In: Hans-Konrad Biesalski, Stephan C. Bischoff, Christoph Puchstein (Hrsg.): Ernährungsmedizin: nach dem neuen Curriculum Ernährungsmedizin der Bundesärztekammer. 4. Auflage. Georg Thieme Verlag, 2010, ISBN 978-3-13-100294-5, S. 205. (eingeschränkte Vorschau in der Google-Buchsuche)
- Eintrag zu Humanmilch. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Mai 2013.
- Lindsay H. Allen: Causes of vitamin B 12 and folate deficiency. In: Food and Nutrition Bulletin. vol. 29, no. 2 (supplement), The United Nations University, 2008, S. S21. Volltext (PDF)
- W. J. Craig, A. R. Mangels; American Dietetic Association: Position of the American Dietetic Association: vegetarian diets. In: Journal of the American Dietetic Association. Band 109, Nummer 7, Juli 2009, S. 1266–1282. PMID 19562864, Volltext (PDF; 644 kB)
- Fumio Watanabe, Yukinori Yabuta, Tomohiro Bito, Fei Teng: Vitamin B12-containing plant food sources for vegetarians. In: Nutrients. 6(5), Mai 2014, S. 1861–1873. doi:10.3390/nu6051861 PMID 24803097
- P. C. Dagnelie, W. A. van Staveren, H. van den Berg: Vitamin B-12 from algae appears not to be bioavailable. In: American Journal of Clinical Nutrition. 53(4), Apr 1991, S. 988. PMID 2000824.
- Gianluca Rizzo et al.: Vitamin B12 among Vegetarians: Status, Assessment and Supplementation. In: Nutrients. 8(12), Dez 2016, S. 767. doi:10.3390/nu8120767. PMID 27916823. PMC 5188422 (freier Volltext).
- Eckhart Buddecke: 8. Cobalamin In: Grundriss der Biochemie: Für Studierende der Medizin, Zahnmedizin und Naturwissenschaften, Walter de Gruyter GmbH & Co KG, Reprint 2018; S. 363. ISBN 978-3-11-163720-4.
- transgen.de Website des Forum Bio- und Gentechnologie e. V. zu Vitamin B12 (Cobalamin)
- Fragen und Antworten der DGE zu Vitamin B12. Deutsche Gesellschaft für Ernährung. Abgerufen am 1. Juni 2019.
- Andreas Hahn: Vitamine. In: Reinhard Matissek, Werner Baltes (Hrsg.): Lebensmittelchemie. 8. Auflage. Springer, 2016, ISBN 978-3-662-47111-1, S. 51, doi:10.1007/978-3-662-47112-8_3.
- Berthold Koletzko, Franziska Feldl: Ausgewogene Substratversorgung durch Fleischverzehr. In: Dtsch Arztebl. 95(11), 1998, S. A-606 / B-494 / C-466. (Volltext)
- Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its Panel on Folate, Other B Vitamins, and Choline: 9. Vitamin B12. In: Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. National Academies Press, Washington D.C. 1998, ISBN 0-309-06411-2, S. 324. (online)
- netdoktor.de – Vitamin B12-Mangel vom 7. Oktober 2019
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 31–33.
- Wolfgang Herrmann, Rima Obeid: Causes and Early Diagnosis of Vitamin B12 Deficiency. (auf deutsch: Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel) In: Deutsches Ärzteblatt. Band 105, Heft 40, 2008, S. 680–685. doi:10.3238/arztebl.2008.0680
- Schema für die Labordiagnostik des Vitamin-B12-Mangels aus Ursachen und frühzeitige Diagnostik von Vitamin-B12-Mangel.
- Matthew J. Oberley, David T. Yang – Laboratory testing for cobalamin deficiency in megaloblastic anemia, vom 20. Februar 2013 im American Journal of Hematology, DOI:10.1002/ajh.23421
- dge.de – Ausgewählte Fragen und Antworten zu Vitamin B12, Dezember 2018
- Ralph Carmel, Yash Pal Agrawal: Failures of Cobalamin Assays in Pernicious Anemia. In: New England Journal of Medicine. 367, 2012, S. 385–386.
- F. v. d. Berg, L. Gifford, J. Cabri, L. Arendt-Nielsen, E. Bader: Angewandte Physiologie: Organsysteme verstehen und beeinflussen. 2. Auflage. Thieme, 2005, ISBN 3-13-117082-4, S. 236.
- O. Braun-Falco, H. Lincke: The problem of vitamin B6/B12 acne. A contribution on acne medicamentosa. In: Münchener medizinische Wochenschrift. Band 118, 1976, S. 155–160. PMID 130553
- EFSA: Tolerable upper intake levels for vitamins and minerals (PDF), Seite 48, Februar 2006
- Anke Weißenborn et al.: Höchstmengen für Vitamine und Mineralstoffe in Nahrungsergänzungsmitteln. In: Journal of Consumer Protection and Food Safety. Band 13, Nr. 1, 1. März 2018, S. 25–39, doi:10.1007/s00003-017-1140-y.
- Höchstmengen für Vitamin B12 in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. 2021, abgerufen am 2. Mai 2021.
- Bundesinstitut für Risikobewertung: Verwendung von Vitaminen in Lebensmitteln, 2004, Berlin, ISBN 3-931675-87-4, S. 211–223
- Statement on „BfR recommendations on maximum levels for vitamins and minerals in food supplements“ vom 1. März 2018, abgerufen am 4. Mai 2021
- A model for establishing upper levels of intake for nutrients and related substances : report of a Joint FAO/WHO Technical Workshop on Food Nutrient Risk Assessment, Mai 2005
- David P. Richardson: „Risk Analysis Approaches for Establishing Maximum Levels of Essential Nutrients in Fortified Foods and Food (Dietary) Supplements“, doi:10.1021/bk-2015-1207.ch009, 2015, Kapitel 9, Seite 159 in „Science and the Law: How the communication of science affects policy development in the environment, food, health and transport section.“
- Anouar Fanidi et al.: Is high vitamin B12 status a cause of lung cancer? In: International Journal of Cancer. Band 145, Nr. 6, 15. September 2019, S. 1499–1503, doi:10.1002/ijc.32033, PMID 30499135, PMC 6642017 (freier Volltext).
- Bruce H. R. Wolffenbuttel et al.: Relationship between serum B12 concentrations and mortality: experience in NHANES. In: BMC medicine. Band 18, Nr. 1, 9. Oktober 2020, S. 307, doi:10.1186/s12916-020-01771-y, PMID 33032595, PMC 7545540 (freier Volltext).
- Cyanokit(R) von Merck Serono in der Europäischen Union zugelassen. Pressemitteilung vom 29. November 2007.
- Wolfgang Uhl et al.: Safety of hydroxocobalamin in healthy volunteers in a randomized, placebo-controlled study. In: Clinical Toxicology (Philadelphia, Pa.). 44 Suppl 1, 2006, S. 17–28, doi:10.1080/15563650600811755, PMID 16990190.
- Vitamin-B12-Creme: Mehr als »rosa Hühnerkacke«? In: Pharmazeutische Zeitung. 21. Oktober 2009, abgerufen am 4. März 2017.
- Winfried Köppelle: Schleichwerbung für Quacksalbe und Wunderbuch. In: Laborjournal. November 2009, S. 68–70. (Volltext-Version) (Memento des Originals vom 15. November 2009 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Jochen Niehaus: Zu dick aufgetragen. In: Focus Online. 26. Oktober 2009; abgerufen am 16. November 2009.
- Schuppenflechte-Therapie – Rosarot ist die Hoffnung. In: Frankfurter Allgemeine Zeitung.
- Neurodermitis-Creme – Falsche Heilsversprechen. Öko-Test
- NDR, Magazin ZAPP vom 28. Oktober 2009.
- Namensänderung unserer Vitamin B12 Salbe. (Memento vom 18. Februar 2012 im Internet Archive) Internetseite der Regeneration Pharma GmbH, Stand vom 18. Februar 2012.
- S2K-Leitlinie Neurodermitis. In: AWMF. 2015, abgerufen am 9. November 2021.