Chemische Evolution
Als chemische Evolution oder Abiogenese bezeichnet man Vorgänge bzw. Mechanismen, die die Entstehung von Lebewesen aus anorganischen und organischen Stoffen aufgrund naturwissenschaftlicher Hypothesen erklären.[1][2] Sie begann im Hadaikum (bis vor etwa 4 Milliarden Jahren), dem ersten Abschnitt des Präkambriums. Im Eoarchaikum, dem zweiten Abschnitt des Präkambriums, begann die Evolution zellulärer Organismen. Es entstanden Prokaryoten. Seither bildet sich Leben aus Leben (Biogenese). Die unbekannte Mischung anorganischer Substanzen, welche die Entstehung von Leben ermöglichte, wird häufig als Ursuppe (englisch primordial soup), Urschleim oder auch Urschlamm bezeichnet, wobei diese Vorstellung jedoch umstritten ist.
Kennzeichen der chemischen Evolution ist die spontane Strukturbildung durch Autokatalyse, einschließlich der Entstehung der Homochiralität. Voraussetzung sind Fließgleichgewichte fernab des thermodynamischen Gleichgewichts. Als wahrscheinlicher Antrieb gelten thermische und chemische Gradienten heißer Quellen im Meeresboden.
Zum Ablauf der chemischen Evolution existieren diverse Hypothesen. Sie werden hauptsächlich durch Experimente gestützt, die auf geologischen Erkenntnissen über die damalige chemische Zusammensetzung der Erdatmosphäre, der Hydrosphäre und der Lithosphäre sowie klimatische Bedingungen beruhen. So konnte zwar bereits die chemische Entstehung komplexer Moleküle beobachtet werden, die für biologische Abläufe notwendig sind, jedoch noch keine Bildung eines lebenden Systems. Die Experimente reichen momentan nicht zur Formulierung einer geschlossenen Theorie aus, die erklären kann, wie das Leben entstand.[3]
Sicher scheint zu sein, dass sich nur eine Form von Leben, nämlich die auf Nukleinsäuren (RNA und DNA) beruhende, durchgesetzt hat (falls weitere existiert haben sollten bzw. überhaupt möglich sind). Wesentliche Indizien für diese Theorie sind die Gleichheit der Bausteine der zwei wesentlichsten lebenstypischen Makromoleküle in allen bekannten Lebensformen (die fünf Nukleotide als Bausteine der Nukleinsäuren und die 21 Aminosäuren als Bausteine der Proteine) und der universell gültige genetische Code.
Vorüberlegungen
Hypothesen zur chemischen Evolution müssen verschiedene Aspekte erklären:
- Die abiogene Entstehung der Biomoleküle, das heißt ihre Entwicklung aus nichtlebenden beziehungsweise nichtorganischen Vorläufern (Kosmochemie).
- Die Entstehung sich selbst replizierender und variierender chemischer Informations-Systeme, das heißt die Entstehung von Zellen (vermutlich in Koevolution mit Viren).
- Die Entstehung der gegenseitigen Abhängigkeit von Funktion (Enzyme) und Information (RNA, DNA).
- Die Umweltbedingungen der Erde vor 4,5 bis 3,5 Milliarden Jahren (oder möglicherweise auf vergleichbaren anderen Himmelskörpern in unserem oder anderen Planetensystemen – wie Monde, Exoplaneten, Exo-Monde oder gar Planemos, jetzt oder früher).
Ältere Vorstellungen zur Spontanzeugung waren 1860 durch Experimente von Louis Pasteur nun auch für die Mikrobiologie widerlegt.[4] Die neuen Wissenschaften der Zellbiologie, Virologie und der Biochemie (Molekularbiologie) konnten zwar die Evolutionstheorie erhärten, erhellten aber auch die enorme Komplexität der Lebensvorgänge, sodass eine Beantwortung der Frage nach dem Beginn hoffnungslos schien und zunächst weitgehend ausgeblendet wurde.[5]
Noch steht ein einheitliches Modell zur chemischen Evolution aus, möglicherweise weil grundlegende Prinzipien noch nicht entdeckt wurden.
Biomoleküle
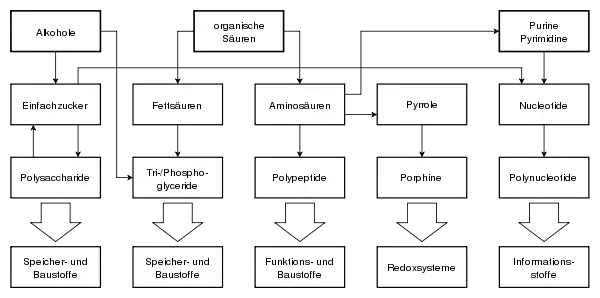
Die präbiotische Entstehung der komplexen organischen Moleküle kann in drei Schritte unterteilt werden:
- Entstehung einfacher organischer Moleküle (Alkohole, Säuren, Heterozyklen wie Purine und Pyrimidine) aus anorganischen Stoffen.
- Entstehung der Grundbausteine (Einfachzucker, Aminosäuren, Pyrrole, Fettsäuren, Nukleotide) komplexer organischer Moleküle aus einfachen organischen Molekülen.
- Entstehung der komplexen organischen Moleküle aus den Grundbausteinen.
Die Elementaranalyse dieser Moleküle führt zu der Frage, welche anorganischen Verbindungen zu ihrer Entstehung notwendig waren.
| C | H | O | N | S | P | |
|---|---|---|---|---|---|---|
| Kohlenhydrate | X | X | X | |||
| Lipide | X | X | X | X | X | |
| Proteine | X | X | X | X | X | |
| Nukleotide | X | X | X | X | X | |
| Porphyrine | X | X | X | X |
| reduziert | oxidiert | |
|---|---|---|
| Kohlenstoff (C) | Methan (CH4) | Kohlenstoffdioxid (CO2), Kohlenstoffmonoxid (CO) |
| Wasserstoff (H) | Wasserstoff (H2) | Wasser (H2O) |
| Sauerstoff (O) | Wasser (H2O) | Sauerstoff (O2) |
| Stickstoff (N) | Ammoniak (NH3) | Nitrate (NO3−) |
| Schwefel (S) | Schwefelwasserstoff (H2S) | Sulfate (SO42−) |
| Phosphor (P) | Phosphin (PH3) | Phosphate (PO43−) |
Alle Hypothesen gehen davon aus, dass neben Wasser und Phosphat zunächst nur die reduzierten Formen der heute üblichen chemischen Verbindungen in ausreichender Menge zur Verfügung standen, da die Uratmosphäre kaum molekularen Sauerstoff enthielt.
Als Energiequelle werden UV-Strahlen und Blitze angenommen.[6] Nach einigen sehr beachtenswerten neueren Theorien käme die nötige Energie für die Entstehung von Bio-Molekülen alternativ dazu auch aus anaeroben Redoxprozessen zwischen reduzierten vulkanischen Gasen und sulfidischen Mineralien wie Pyrit (FeS2).
Rolle der Erdatmosphäre
Die Erdatmosphäre war zur Zeit der Abiogenese kühl, siehe das sogenannte Paradoxon der schwachen jungen Sonne. Sie hatte reduzierenden Charakter, war also weitgehend frei von molekularem Sauerstoff und ohne Ozonschicht. In der Atmosphäre sammelte sich bei heißen Temperaturen Wasserdampf. Dieser kondensierte und Wasser sammelte sich an der Oberfläche der Erde.
Die Rolle des Wassers für die Evolution des Lebens

Leben, wie wir es kennen (bzw. definieren), benötigt Wasser als universelles Lösungsmittel. Es hat Eigenschaften, die nach akzeptiertem naturwissenschaftlichem Verständnis die Entstehung von Leben ermöglichen (siehe auch anthropisches Prinzip). Möglicherweise kann Leben unabhängig von Wasser entstehen und existieren, viele Wissenschaftler nehmen aber an, dass die Anwesenheit von flüssigem Wasser (in einem bestimmten Gebiet oder auf einem bestimmten Planeten, wie dem Mars) unsere Art Leben nicht nur ermöglicht, sondern sein Entstehen sogar sehr wahrscheinlich macht.
Für die Entstehung des Lebens sind folgende Eigenschaften des Wassers relevant:
- Wasser ist in einem Temperaturbereich flüssig, in dem organische Moleküle stabil sind.
- Wasser ist als polares Medium für chemische Reaktionen besonders geeignet, da es eine homogene Durchmischung ermöglicht, Protonen für Katalysen zur Verfügung stellen kann und eine hohe Wärmekapazität hat und somit überschüssige Reaktionswärme aufnimmt.
- Die Anomalie des Wassers verhindert, dass Gewässer vom Grund aus vereisen, und sorgt für einen Bereich gleichmäßiger Temperatur.
- Wasser, in dem Stoffe gelöst sind, wie Meerwasser, bildet beim Ausfrieren Bereiche unterschiedlicher Stoffkonzentrationen, die von Eismembranen umgeben sind. Nach der umstrittenen Meereis-Hypothese des Physikers Hauke Trinks seien so nicht nur Biomoleküle, sondern auch das Leben entstanden.
Hypothesen und Experimente zur chemischen Evolution
Erste Theorien zum Urschleim
Nachdem die vormodernen Überlegungen der Spontanzeugung widerlegt waren, vertraten dennoch Biologen wie Jean-Baptiste de Lamarck die Überzeugung, dass es zumindest eine Urzeugung gegeben haben müsse. Auch Lorenz Oken vertrat 1805 die Theorie, dass alles Leben aus Ansammlungen kleiner Bläschen bestünde (dies war der Vorläufer der Zelltheorie) und mit Urschleim gefüllt sei, welcher sich aus anorganischer Materie zusammensetzte. Diese deutschen Fachbegriffe wurden durch Oken geprägt.[7]
Oparin-Haldane-Hypothese
In den 1920er Jahren veröffentlichten der britische Wissenschaftler J. B. S. Haldane und der sowjetische Biochemiker Aleksandr Oparin unabhängig voneinander eine der bekanntesten Hypothesen zur Evolution. Die Theorie besagt, dass die Bedingungen der Erde schon damals bestimmte chemische Reaktionen begünstigten. Beide Forscher waren der Ansicht, dass organische Moleküle aus abiogenen Materialien unter Einwirkung einer äußeren Energiequelle (z. B. die sehr intensive ultraviolette Strahlung) gebildet werden können und dass die Uratmosphäre, die unter anderem Ammoniak, Wasserdampf und einen geringen Anteil freien Sauerstoff enthielt, dabei reduzierend gewirkt haben könnte. Beide vermuteten auch, dass die ersten Lebensformen im warmen Urozean auftraten und nicht autotroph, sondern heterotroph waren.[8]
Oparin glaubte, dass sich das Leben aus Koazervaten – spontan gebildeten, kugelförmigen Aggregaten aus Lipidmolekülen – entwickelte, die durch elektrostatische Kräfte zusammengehalten wurden und die Vorläufer der Zellen gewesen sein könnten. Oparins Arbeit mit Koazervaten bestätigte, dass Enzyme, welche fundamental für biochemische Reaktionen des Stoffwechsels sind, eingeschlossen in einer Membranhülle effizienter arbeiteten als freischwimmend in wässrigen Lösungen. Haldane, der mit Oparins Koazervaten nicht vertraut war, glaubte, dass sich zuerst einfache organische Moleküle bildeten, die durch Einwirkung von ultraviolettem Licht zunehmend komplexer wurden, bis sich letztendlich Zellen herausbildeten. Haldanes und Oparins Ideen bildeten die Grundlage für einen Großteil der Forschung, die sich in den nächsten Jahrzehnten mit der Abiogenese beschäftigte.[8]
Das Miller-Urey-Experiment
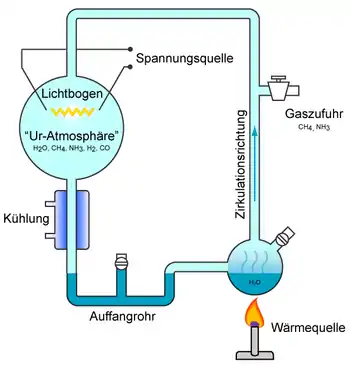
1953 wurde vom Chemiker Stanley Miller und von Harold C. Urey durch das Ursuppen-Experiment diese Hypothese überprüft. In dem Versuch zeigten sie, dass in einer – den angenommenen präbiotischen Bedingungen ähnlichen – Umgebung, mittels Zufuhr von Energie (Blitzen), aus anorganischen Verbindungen (Wasser, Ammoniak und Wasserstoff) sowie Methan komplexere organische Verbindungen wie Aminosäuren und niedere Carbon- und Fettsäuren entstehen können. In späteren, meist komplizierter aufgebauten Ursuppenversuchen konnten sowohl alle wesentlichen Bausteine der Lebewesen [Aminosäuren, Lipide, Purine (Nucleotidbasen) und Zucker], als auch die komplizierten organischen Verbindungen Porphyrine und Isoprene erzeugt werden.
Obwohl damit die grundsätzliche Möglichkeit der natürlichen Bildung organischer Moleküle gezeigt war, wird die Bedeutung dieses Resultats für den tatsächlichen Ablauf der Entstehung irdischen Lebens heute vielfach kritisch gesehen. In dem Ursuppen-Experiment wurde damals davon ausgegangen, dass die irdische Atmosphäre chemisch reduzierenden Charakter hatte, was dem damaligen Wissensstand entsprach. Heute wird dagegen oftmals von einer nur schwach reduzierenden oder gar neutralen Atmosphäre zu dieser Zeit ausgegangen, allerdings ist die Frage noch nicht abschließend geklärt und es werden auch lokale chemische Inhomogenitäten der atmosphärischen Verhältnisse diskutiert, etwa in der Umgebung von Vulkanen. Zwar konnte durch spätere Experimente gezeigt werden, dass auch unter solchen veränderten atmosphärischen Bedingungen organische Moleküle entstehen; sogar solche, die beim ursprünglichen Experiment nicht entstanden sind, wobei aber die Ausbeute stark vermindert ist. Deswegen wird oft argumentiert, dass andere Möglichkeiten der Herkunft organischer Moleküle zumindest eine zusätzliche Rolle gespielt haben müssen. Angeführt werden hierbei meist die Entstehung organischer Moleküle im Weltall und deren Transfer zur Erde durch Meteoriten oder auch die Entstehung in der Umgebung sogenannter Schwarzer Raucher.
Als ein weiteres Argument gegen den Ursprung der biologischen organischen Moleküle gemäß dem Ursuppenversuch wird oftmals angeführt, dass in diesem Versuch ein Racemat, das heißt ein Gemisch aus L-Aminosäuren und D-Aminosäuren, entstand. Viele in lebenden Organismen vorkommende Aminosäuren sind jedoch L-konfiguriert (siehe Biologische Chiralität). Es müsste also einen natürlichen Prozess geben, der chirale Moleküle bestimmter Händigkeit bevorzugt selektiert. Von Astrobiologen wird darauf hingewiesen, dass dies einfacher im Weltall zu erklären sei, da photochemische Prozesse mit zirkular polarisierter Strahlung, wie sie beispielsweise durch Pulsare erzeugt wird, in der Lage sind, nur chirale Moleküle bestimmter Händigkeit zu zerstören. Tatsächlich wurden in Meteoriten chirale organische Moleküle gefunden, bei denen die Häufigkeit der L-Form um bis zu 9 % überwog.[9] Allerdings wurde 2001 gezeigt, dass auch selbstreplizierende Peptidsysteme in der Lage sind, effektiv homochirale Produkte aus einem ursprünglichen Racemat zu verstärken, was nach Ansicht dieser Forscher die Auffassung der irdischen Entstehung der Händigkeit biologischer Moleküle unterstützt.[10]
Grundsätzliche Zweifel an den Bedingungen des Ursuppenexperiments äußert Günter Wächtershäuser. Auch andere Studien kommen zu dem Schluss, dass die urzeitlichen Bedingungen der frühen Erde nicht denen der im Experiment simulierten entsprachen.[11]
Weitere Reaktionen und Reaktionsnetzwerke
Aus den beim Miller-Urey-Experiment auftretenden Zwischenprodukten Formaldehyd (CH2O) und Cyanwasserstoff (HCN) lassen sich unter den simulierten Bedingungen der Erde vor 4,5 Milliarden Jahren weitere Biomoleküle herstellen. So gelang Juan Oro 1961 die Synthese von Adenin:
| Edukte | Produkte | ||
| 2 CH2O | HCN | H2O | Serin |
| 5 CH2O | Ribose | ||
| 5 HCN | Adenin |
Er demonstrierte auch die Bildung von Adenin und Guanin durch Wärmepolymerisation von Ammoniumcyanid in wässriger Lösung.[12] Aus Ribose, Adenin und Triphosphat entsteht das Adenosintriphosphat (ATP), welches in den Organismen als universeller Energieträger und als Baustein (als Monophosphat) der Ribonukleinsäuren (RNA) genutzt wird.
Eine Software, AllChemy,[13] für synthetische chemische Reaktionsnetzwerke zur Erforschung der Abiogenese kann, teils experimentell validierte, Entstehungsrouten für biochemisch relevante Stoffe vorhersagen.[14][15]
Zudem gibt es auch Forschungsmodelle mit chemischen „kontinuierlichen Reaktionsnetzwerken“, in welchen simple Stoffe unter modellierten Bedingungen in Wasser unter Strahlung etwa zu wichtigen Ausgangsstoffen für RNA reagieren.[16][17]
Mitwirkung von Mineralen und Gesteinen
- In winzigen Hohlräumen der Gesteine sind die organischen Moleküle vor UV-Strahlung geschützt.
- Kristalloberflächen können als Matrix für wachsende Makromoleküle dienen. Dabei können die Kristalloberflächen bestimmte Molekülformen bevorzugen. L- und D-Aminosäuren werden auf einem Calcit-Kristall an unterschiedlichen Stellen angelagert.
- Aharon Katchalssky (Weizmann-Institut Israel) konnte in wässriger Lösung mit Hilfe des Tonminerals Montmorillonit Proteine mit einer Kettenlänge von mehr als 50 Aminosäuren in nahezu 100-prozentiger Ausbeute erzeugen.
- Metallionen können als Katalysatoren oder als Elektronendonatoren fungieren oder in Biomoleküle eingebaut werden.
- Tonminerale weisen oft eine elektrische Ladung auf und können so geladene organische Moleküle anziehen und festhalten.
Eisen-Schwefel-Welt
Eine besonders intensive Form der Mitwirkung von Mineralen und Gesteinen bei der präbiotischen Synthese organischer Moleküle kann sich auf der Oberfläche von Eisensulfid-Mineralen abgespielt haben („Ur-Sandwich“, englisch: primordial sandwich). Die Theorie von Miller-Urey weist nämlich schwerwiegende Begrenzungen auf, besonders in Hinblick auf das Fehlen einer Erklärung für die Polymerisation der gebildeten monomeren Bausteine der Biomoleküle.
Ein alternatives Szenario für die frühe Evolution des Lebens wurde daher seit Anfang der 1980er Jahre von Günter Wächtershäuser entwickelt, der für seine alternative Theorie schnell die Unterstützung des Philosophen Karl Popper gewinnen konnte. Danach wäre das Leben auf der Erde an der Oberfläche von Eisen-Schwefel-Mineralen entstanden, also Sulfiden, die sich heute noch durch geologische Prozesse an Tiefsee-Vulkanen bilden, zur Frühzeit der Erde noch wesentlich häufiger aufgetreten und wohl auch auf vielen Exoplaneten, Exo-Monden und Planemos vorhanden sein müssen. Auch in unserem Sonnensystem wird bei einigen der größeren Monde der Gasplaneten unter der Eisschicht ein extraterrestrischer Ozean vermutet.
Der große Vorteil dieses Konzepts gegenüber allen anderen Theorien ist, dass damit erstmals die Möglichkeit besteht, die Bildung komplexer Bio-Moleküle an eine kontinuierlich verfügbare und verlässliche Energieversorgung zu koppeln. Die Energie kommt durch die Reduktion von Schwefel in Eisen-Schwefel-Mineralen wie Pyrit (FeS2) mit elementarem Wasserstoff (H2) zustande (Reaktionsschema: FeS2 + H2 ⇌ FeS + H2S) und liefert genug Energie, um eine präbiotische Ammoniaksynthese und auch um endergone Synthesereaktionen für monomere Bausteine von Biomolekülen und für deren Polymerisierung anzutreiben. Ähnlich wie Eisen-Ionen bilden auch andere Schwermetall-Ionen mit Schwefelwasserstoff unlösliche Sulfide (siehe Schwefelwasserstoffgruppe).
Zusätzlich bieten Pyrit und andere Eisen-Schwefel-Minerale positiv geladene Oberflächen, an denen sich die überwiegend negativ geladenen Biomoleküle (organische Säuren, Phosphatester, Thiolate) anlagern (oft durch Komplexbildungsreaktionen), konzentrieren und miteinander reagieren können. Hierfür erforderliche Stoffe wie Schwefelwasserstoff, Kohlenmonoxid und Eisen-II-Salze gelangen aus der Lösung zudem direkt an die Oberfläche dieser „Eisen-Schwefel-Welt“ (ESW). Wächtershäuser zieht für seine Theorie die heute noch bestehenden Grundmechanismen des Stoffwechsels heran und leitet aus diesen ein in sich konsistentes Szenario der Synthese komplexer organischer Moleküle und Biomoleküle (organische Säuren, Aminosäuren, Zucker, Nucleinbasen, Lipide) aus einfachen anorganischen Vorläufer-Molekülen ab, die in vulkanischen Gasen zu finden sind (NH3, H2, CO, CO2, CH4, H2S).
Im Gegensatz zur Miller-Urey-Hypothese wird keine Kraft von außen in Form von Blitzen oder UV-Strahlung benötigt; zudem laufen die ersten einfachen chemischen Umsetzungen bei erhöhter Temperatur viel schneller ab, ohne dadurch (wie etwa enzym-katalysierte biochemische Reaktionen) behindert zu werden. Da bei Tiefseevulkanen Temperaturen bis 350 °C erreicht werden, kann man sich die Entstehung des Lebens bei diesen hohen Temperaturen gut vorstellen. Erst später, nach der Entstehung temperatursensitiver Katalysatoren (Vitamine, Proteine), muss sich die weitere Evolution in kühleren Nischen vollzogen haben.
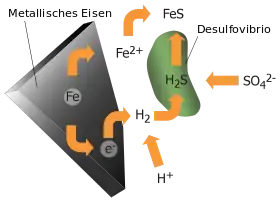
Das Wächtershäuser-Szenario passt deshalb auch gut zu den beobachteten Verhältnissen in schwarzen Rauchern der Tiefsee, weil in diesen Strukturen durch steile Temperaturgradienten von innen nach außen eine solche Einnischung leicht möglich erscheint. Auch sind die gegenwärtig lebenden Mikroorganismen, die als die ursprünglichsten angesehen werden, zugleich die thermophilsten mit einem (bisherigen) Temperaturmaximum für das Wachstum bei +113 °C. Außerdem haben Eisen-Schwefel-Zentren eine wichtige Funktion in vielen aktuellen Enzymen, z. B. der Atmungskette. Dies könnte auf die ursprüngliche Beteiligung von Fe-S-Mineralen an der Evolution des Lebens hindeuten, zumal diese auch heute noch Stoffwechselprodukte anaerober Bakterien darstellen.
Die These der chemoautotrophen Entstehung des Lebens in schwarzen Rauchern wird insbesondere von den Forschern William Martin und Michael Russell vertreten.[18] Im Übrigen ist hier wegen der weitgehenden Unabhängigkeit vom Licht eines Zentralgestirns die Entstehung von Leben auch in größerer Entfernung von diesem (oder ganz ohne), außerhalb der klassischen habitablen Zone, denkbar.
Chemische Evolution in der kontinentalen Kruste
Einen völlig anderen Ansatz zur chemischen Evolution und zur Entstehung des Lebens verfolgen der Geologe Ulrich Schreiber und der Physikochemiker Christian Mayer von der Universität Duisburg-Essen mit einem Modell, das als Reaktionsumgebung die Erdkruste in den Mittelpunkt rückt.[19] Sie beziehen damit einen Reaktionsraum ein, der bisher nicht betrachtet wurde: wasser- und gasführende Bruchzonen (tektonische Störungszonen) innerhalb der ersten kontinentalen Krustenkomplexe (Kratone). Die kontinentale Kruste ist mächtiger und kühler als die ozeanische und wesentlich heterogener aufgebaut. Spannungen innerhalb der Kruste führen zu bis in den Erdmantel reichende Störungszonen, durch die die Mantelgase aufsteigen. In offenen Störungszonen kommen alle erforderlichen Ausgangsstoffe, die für die organische Chemie des Lebens benötigt werden, im Überfluss vor. Phosphat aus aufgelösten Apatiten, CO, H2, CO2, N2, NH3, HCN, Schwefel- und Borverbindungen, alle Alkali- und Erdalkalimetalle, Eisensulfide sowie alle metallischen Katalysatoren. Reaktionen von CO und H2, vergleichbar mit der Fischer/Tropsch-Synthese, führen in allen Tiefenstockwerken mit unterschiedlichsten pH-Werten, Druck- und Temperaturbedingungen zu langkettigen Molekülen, welche die Basis für Zellbestandteile bilden. Weiterhin stellt die hydrothermale Chemie Aminosäuren, organische Basen und Zucker zur Verfügung.
Neben allen notwendigen Ausgangsstoffen gibt es weitere entscheidende Vorteile für den Bildungsort der kontinentalen Kruste. Er war geschützt vor UV-Strahlung und dem in der Frühphase auftreffenden Partikelstrom des Sonnenwinds. Späte Meteoriteneinschläge betrafen nie die gesamte kontinentale Kruste. Die Gase, die bis heute in Mofetten (Mineralbrunnen, Kaltwassergeysire) an der Erdoberfläche austreten, sind ab einer Tiefe von 800 – 1000 Metern überkritisch (abhängig vom Druck und der Zusammensetzung). Das bedeutet, sie stellen einen Zwischenzustand zwischen einer Flüssigkeit und einem Gas dar. Entscheidend ist, dass zum Beispiel Kohlendioxid in diesem Phasenzustand wie ein organisches Lösungsmittel wirkt, in dem hydrophobe organische Substanzen gelöst werden und miteinander (sowie an der Grenzfläche zum Wasser mit hydrophilen Komponenten) reagieren können. Die Störungsflächen besitzen unzählbare Ecken und Vorsprünge, an denen die überkritischen Gase gefangen werden. Hierdurch entstehen zahllose Mikroautoklaven, in denen Reaktionen stattfinden können, die an der Oberfläche nicht möglich sind, und das bei einer Lebensdauer der Störungszonen von Millionen Jahren.
Die interessanteste Zone findet sich in etwa 1000 Meter Tiefe, wo der Phasenübergang vom überkritischen zum unterkritischen Kohlendioxid erwartet werden kann. Hier konzentrieren sich unpolare organische Substanzen auf, da das Kohlendioxid seine Lösemitteleigenschaft verliert. Diese organischen Substanzen konnten in Quarz-Kristallen, die in dieser Umgebung wachsen, nachgewiesen werden.[20] Durch Druckschwankungen (Erdgezeiten oder CO2-gesteuerte Kaltwassergeysire) kommt es darüber hinaus zu periodischen Phasenübergängen, welche Aufbau und Zerfall von Vesikeln herbeiführen.[21] Die Vesikel schließen dabei organische Komponenten in hoher Konzentration ein und akkumulieren amphiphile Substanzen (zum Beispiel Vorläufer von Lipiden oder amphiphile Peptide) in ihren Membranen.[22] Außerdem konnte gezeigt werden, dass unter diesen Bedingungen eine effiziente molekulare Evolution möglich ist.[23]
Die Begrenzungen der Störungsflächen sind sehr heterogen. Neben neu gebildeten Tonmineralen und frischen, bebenbedingten Mikrorissen in allen Mineraltypen treten Tapeten von Eisensulfid-Mineralen und Schwermetallen auf. Somit lassen sich die oben genannten Modelle, zum Beispiel das der Eisen-Schwefel-Welt, problemlos integrieren oder anknüpfen.
Die Bildung von Makromolekülen
Biomakromoleküle sind Proteine und Nukleinsäuren. Die Verlängerung der Molekülketten (Polymerisation) benötigt Energie und erfolgt unter Wasserabspaltung (Kondensationsreaktion). Umgekehrt liefert die Spaltung der Makromoleküle (Hydrolyse) Energie. Da das chemische Gleichgewicht so weit auf der Seite der Monomere liegt, dass diese Reaktionen thermodynamisch irreversibel in Richtung der Polymer-Hydrolyse verlaufen, kann es keine Polymer-Synthese ohne ein zugeschaltetes Energie-lieferndes System geben. Auch durch theoretische Hilfskonstrukte, wie Abdampfen von Wasser, Zugabe von Salz (entzieht Wasser) oder Ausfällung der Produkte, ändert sich dieses Problem nur unwesentlich. Die Entstehung von Leben ist also sehr wahrscheinlich an die Kopplung an eine verlässliche Energiequelle gebunden, die für die Polymersynthese genutzt werden kann.
aber
Als Energiequelle wird heute in der Biochemie vor allem ATP genutzt, dessen Bildung allerdings bereits die Anwesenheit von Enzymen voraussetzt. Unter den Bedingungen der Proto-Erde kann man sich andererseits auch die Energetisierung der Polymersynthese durch hydrolytische Spaltung von Polyphosphat vorstellen, das auch heute noch von einigen Enzymen anstelle von ATP genutzt wird. Allerdings ist es auch bei Polyphosphaten schwierig vorstellbar, dass diese in den notwendigen Mengen zur Verfügung standen, da sie zwar spontan gebildet werden können, wenn phosphathaltige Lösungen eingedampft werden, aber auch relativ schnell wieder spontan hydrolysieren, wenn sie wieder in Lösung kommen. Aus diesen Überlegungen heraus müsste man als Entstehungsort des Lebens eine seichte Meeresbucht fordern, die regelmäßig austrocknet und wieder überflutet wird. Dadurch würden aber auch alle wasserabhängigen Prozesse immer wieder unterbrochen und die Lebensentstehung zumindest stark verzögert. Schließlich kann man sich aber auch ein ganz anderes System vorstellen, in dem sowohl die Synthese der Bausteine als auch die energieabhängige Bildung von Polymeren als kontinuierlicher Prozess in ununterbrochener Kopplung an eine verlässliche Energiequelle stattfindet, nämlich anaerobe Redoxreaktionen mit Metallsulfiden. Diese werden durch vulkanische Tätigkeit auch heute noch in großen Mengen am Grund der Ozeane freigesetzt, wo sie unter anderem Strukturen wie die schwarzen Raucher ausbilden, die von diversen Mikroorganismen und höheren Tieren dicht bevölkert werden.
Das Gleichgewicht der Polymersynthese wird durch Erhöhung der Konzentration der Bausteine (Monomere) und durch Entwässerung der Produkte zugunsten der Bildung der Polymere verschoben. Voraussetzung dafür ist eine Kompartimentierung, das heißt die Abgrenzung von Reaktionsräumen voneinander, die nur noch in begrenztem Stoffaustausch zur Umwelt stehen. In der konventionellen Theorie wurde dies in flachen, kleinen Gewässern (Tümpeln) mit hoher Verdunstungsrate angesiedelt, was als Grundidee noch auf Charles Darwin zurückgeht. Allerdings werden auch heute noch in vulkanischen Gebieten der Tiefsee in den großen Strukturen schwarzer Raucher ausgefällte Metallsulfide in Form kleiner Kavernen beobachtet, die ebenfalls ein attraktives Szenario einer Umwelt darstellen, wo alle Reaktionen von der Monomersynthese über die Aufkonzentrierung und Polymerisation der Monomere mit einem „eingebauten“ Energiekonservierungssystem ablaufen können.
Weitere Lösungsansätze wurden in Betracht gezogen, haben aber alle schwerwiegende Limitationen und sind nicht gut mit den Bedingungen auf der frühen Erde in Einklang zu bringen. Meist wird dabei für einen oder mehrere Schritte Wasserausschluss gefordert, der im Chemielabor einfach zu erreichen ist, schwerer aber auf der Protoerde. Eines dieser Systeme ist die Polymerisation von Carbodiimiden (R–N=C=N–R) oder Dicyan (N≡C–C≡N) in wasserfreiem Medium. Hier wird die Kondensation der Bausteine mit der Reaktion von Carbodiimid gekoppelt, wobei die notwendige Energie entsteht:
(H-X-OH = Monomeres, zum Beispiel Aminosäure oder Ribose)
(wenn R = H entsteht hier Harnstoff)
Zwar bildet sich Dicyan unter UV-Einwirkung aus Cyanwasserstoff, in austrocknenden Tümpeln würde allerdings auch das leichtflüchtige Molekül verloren gehen.
Wird ein trockenes Gemisch von Aminosäuren einige Stunden auf 130 °C erhitzt, bilden sich proteinähnliche Makromoleküle. Sind Polyphosphate zugegen, genügen 60 °C. Diese Bedingungen können sich ergeben, wenn Wasser mit gelösten Aminosäuren in Kontakt mit heißer, vulkanischer Asche kommt.
Erhitzt man ein Nukleotidgemisch in Gegenwart von Polyphosphaten auf 55 °C, entstehen zwar Polynukleotide, allerdings findet die Verknüpfung eher über die 5’- und 2’-C-Atome der Ribose statt, da sie leichter erfolgt als die in allen Organismen vorhandene 5’-3’-Verknüpfung. Aus beiden Typen von Polynukleotiden bilden sich Doppelhelices (vergleiche Bau der DNA). Allerdings ist die 5’-3’-Doppelhelix stabiler als die 5’-2’-Helix.
Fehlt am 2’-C-Atom der Ribose die Hydroxygruppe, liegt die Desoxyribose vor. Jetzt können sich nur 5’-3’-Verknüpfungen bilden, wie sie für die DNA typisch sind.
Bildung präbiotischer Strukturen (Zellvorläufer)
Zellen erhalten ihre Funktion dadurch aufrecht, dass sie mehrere Reaktionsräume (Kompartimente) bilden, in denen die Stoffwechselvorgänge voneinander getrennt ablaufen und unerwünschte Reaktionen vermieden werden können; gleichzeitig können so Konzentrationsgradienten aufgebaut werden. Es gibt mehrere Hypothesen, anhand derer hergeleitet wurde, dass sich solche Strukturen bereits vor dem Entstehen von Zellen herausbilden konnten.
Koazervate
Vor allem Alexander Iwanowitsch Oparin (1894–1980) beschäftigte sich mit der Möglichkeit des Stoffwechsels in Koazervaten (von lateinisch coacervatio: Aufhäufung). Er konnte zeigen, dass abgegrenzte Räume mit einem einfachen Stoffwechsel prinzipiell durch Selbstorganisation entstehen können, vorausgesetzt, dass Katalysatoren mit spezifischen Eigenschaften vorhanden sind. Da die verwendeten Substanzen dem Repertoire der heute lebenden Organismen entstammen, sind Oparins Koazervate nicht als Vorläufer von Zellen zu sehen, sondern als Analogie-Modelle für die Entstehung von Vorläufer-Zellen.
Gibt man zu kolloidalen Lösungen von Biomakromolekülen Salz hinzu, bilden sich kleine Tröpfchen mit einem Durchmesser zwischen 1 und 500 µm, die die Polymere in hoher Konzentration enthalten.
Oparin untersuchte Gemische aus Eiweißen (Histon und Albumin), Eiweißen und Kohlenhydraten (Histon und Gummi arabicum) und Eiweißen und Polynukleotiden (Histon oder Clupein und DNA oder RNA).
Enthalten Tröpfchen aus Histon und Gummi arabicum das Enzym Phosphorylase, so können diese Tröpfchen Glucose-1-phosphat aus der Umgebung aufnehmen, zu Stärke umwandeln und speichern. Das freigesetzte Phosphat diffundiert nach außen. Das Tröpfchen wird durch die Zunahme an Stärke größer, bis es in kleinere Tröpfchen zerfällt, die wieder Phosphorylase enthalten können, allerdings weniger als das Ausgangströpfchen. Damit verlangsamt sich auch der Stoffwechsel. Hier wird deutlich, dass zu einem Erhalt der Eigenschaften einer Zelle die Regeneration der Enzymausstattung nach erfolgter Teilung notwendig ist.
Wird auch das Stärke abbauende Enzym Amylase hinzugegeben, ergeben sich Koazervate mit einem zweistufigen Stoffwechsel:
- Aufnahme von Glucose-1-phosphat → Aufbau von Stärke.
- Abgabe von Phosphat → Spaltung der Stärke und Abgabe von Maltose.
Mikrosphären
Im Jahr 1970 konnte Sydney Fox nachweisen, dass sich aus den proteinartigen Produkten (Proteinoide), die beim Erwärmen trockener Aminosäuregemische entstehen (siehe oben), auch durch Selbstaggregation wachsende Tröpfchen ergeben können, sogenannte Mikrosphären. Sie grenzen sich von der Umgebung durch eine semipermeable Membran ab und nehmen weiteres proteinartiges Material aus der Umgebung auf. Dadurch wachsen sie weiter und zerteilen sich wieder in kleinere Tröpfchen. Des Weiteren fand Fox, dass diese Systeme enzymatische Eigenschaften haben, Glucose abbauen oder sich wie Esterasen oder Peroxidasen verhalten, ohne dass von außen Enzyme hinzugefügt worden wären.[24]
Protozellen
Jack Szostak und Mitarbeiter am Massachusetts General Hospital, Boston, konnten 2008 in Modellversuchen zeigen, dass sogenannte „Protozellen“ (das heißt Vesikel bestehend aus einfachen Fettsäuren, Fettalkoholen und Fettsäure-Glycerinester) folgende Eigenschaften (in Kombination) zeigen: Sie sind thermostabil zwischen 0 und 100 °C; sie können DNA- und RNA-Polymere im Innern einschließen; sie erlauben die Denaturierung (Trennung) der Polynukleotidstränge bei erhöhter Temperatur ohne Verlust der Einzelstränge aus der Protozelle; sie können unspezifisch (das heißt ohne Transmembran-Transportsysteme, z. B. Proteine) und sehr schnell geladene Moleküle wie Nukleotide aufnehmen.[25]
Solche Vesikel bilden sich ebenfalls spontan unter dem Einfluss periodischer Druckschwankungen in der Erdkruste. Diese Vorgänge konnten in einer Druckzelle unter Einstellung der natürlichen Bedingungen nachvollzogen werden, wobei uni- und multilamellare Membranvesikel gebildet wurden.[21] In Gegenwart von Aminosäuren führt eine periodische Bildung von Vesikeln zu einer molekularen Evolution von Peptiden, welche die Vesikel stabilisieren und damit ihr längeres Überdauern ermöglichen.[22][23] Solche Vesikel könnten bereits einfache Funktionalitäten entwickeln, die bis hin zu primitivem Stoffwechsel führen.[23] Schließlich können sie durch die Konvektion der fluiden Phase an die Oberfläche gelangen und dort einer nachfolgenden Evolution unter geänderten Randbedingungen unterliegen.
Die RNA-Welt
Die RNA-Welt-Hypothese geht auf die Ergebnisse aus dem Miller-Urey-Experiment zurück. Sie wurde erstmals 1967 von Carl Woese formuliert.[26] Sie besagt, dass früheres Leben allein auf Ribonukleinsäuren (RNA) basierte sowohl zur Informationsspeicherung als auch zur Katalyse chemischer Reaktionen. Diese Funktionen werden heute durch das chemisch stabilere Informationsspeichermedium DNA bzw. funktionell flexiblere Proteine realisiert. Nach der RNA-Welt-Hypothese seien die ersten zellulären Lebensformen Ribozyten gewesen. Als ein Hinweis auf die Existenz der RNA-Welt werden Ribosomen und die katalytisch aktive ribosomale RNA angesehen, die evolutionäre Überbleibsel (chemische bzw. molekulare Fossilien) dieser Zeit darstellen könnten.[27]
Anreicherung
Das Reaktionsgleichgewicht zwischen Monomeren und Dimeren (von RNA oder anderen organischen Molekülen) liegt bei den auch damals geringen Konzentrationen im freien Ozean auf der Seite der Monomere. Eine Autokatalyse und damit die Entstehung von Leben ist dort unmöglich. Ein Mechanismus zur Anreicherung ist notwendig. Vorgeschlagen wurde eine Kombination von thermischer Konvektion und Thermophorese in porösen Mineralen heißer Quellen.[28]
Alternativ betrachtete Möglichkeiten
Biomoleküle aus dem Weltall
Relativ kleine Impaktoren geben ihre kinetische Energie überwiegend in der Atmosphäre ab und schlagen mit wenigen km/s ein, was Biomoleküle überstehen können.[29] In etlichen Meteoriten wurden einfache organische Moleküle nachgewiesen, unter anderem Aminosäuren und Vorläufer von Zuckermolekülen, und Mechanismen für ihre Entstehung unter Weltraumbedingungen wurden vorgeschlagen und simuliert.[30][31][32] So konnte die Schweizer Astrophysikerin Kathrin Altwegg im Rahmen des Rosetta-Teilprojektes ROSINA auf dem Kometen Tschurjumow-Gerassimenko Aminosäuren nachweisen.[33] Die Zufuhr aus dem All kann jedoch nur nennenswert zur Konzentration solcher Moleküle beigetragen haben, wenn deren Lebensdauer in der Biosphäre ungewöhnlich groß ist. Das ist nicht der Fall. Gerade Minerale in Meteoriten sind katalytisch aktiv und fördern damit nicht nur den Auf-, sondern auch den Abbau komplexer Moleküle auf der Zeitskala von Stunden.[34]
Beachtet man die Homochiralität irdischer Biomoleküle (L-Aminosäuren und D-Zucker), so wäre eventuell eine mögliche Erklärung, dass die Aminosäuren aus dem Weltall stammen, da bei einigen dieser meteoritischen Aminosäuren ein Überschuss des L-Typ um bis zu mehr als 9 % nachgewiesen wurde.[9] Diese Verteilung ist allerdings auch durch anorganische Feststoff-Katalysatoren auf der Erde erklärbar.[35]
Biomoleküle aus Impaktereignissen
Für größere Impaktoren wird diskutiert, dass in der Schockwelle aus den Hauptbestandteilen der frühen Atmosphäre, CO2 und N2, Biomoleküle entstanden sind.[36]
Lebensformen aus dem Weltall
Die noch spekulativere Panspermie-Hypothese besagt, dass durch „Animpfen“ der Erde mit niederen, bakterienähnlichen Lebensformen aus dem Weltall die ersten Lebewesen auf die Erde kamen. Dies verschiebt aber die Entstehung von Leben nur an einen anderen Ort und ist keine Erklärung für die Entstehung des Lebens an sich.
Forscher auf dem Gebiet der Chemischen Evolution
- Alexander Oparin: Koazervate (siehe unten)
- Harold C. Urey und Stanley L. Miller 1953: Entstehung einfacher Biomoleküle in einer simulierten Uratmosphäre (siehe unten)
- Sidney W. Fox: Mikrosphären aus Protenoiden (siehe unten)
- Thomas R. Cech (Universität von Colorado) und Sidney Altman (Yale-Universität New Haven Connecticut) 1981: autokatalytisches RNA-Splicing: „Ribozyme“ vereinigen Katalyse und Information in einem Molekül. Sie vermögen sich aus einer längeren RNA-Kette selbst herauszuschneiden und die verbleibenden Enden wieder zusammenzufügen.
- Walter Gilbert (Harvard-Universität Cambridge) entwickelt 1986 die Idee der RNA-Welt (siehe unten)
- Hans Kuhn (Max-Planck-Institut für biophysikalische Chemie (Karl-Friedrich-Bonhoeffer-Institut) in Göttingen) entwickelte ein Modell zur Entstehung eines ersten, replizierenden Oligomers an einem ganz speziellen Ort auf der präbiotischen Erde unter der Bedingung eines ganz besonderen zyklischen Wechsels von Temperatur und vielen anderen speziellen, zufällig an diesem Ort herrschenden Gegebenheiten.
- Günter von Kiedrowski (Ruhr-Universität Bochum) veröffentlichte 1986 das erste selbstreplizierende System auf der Grundlage eines Hexanukleotids (DNA), wichtige Beiträge zum Verständnis der Wachstumsfunktionen selbstreplizierender Systeme.
- Manfred Eigen (Max-Planck-Institut für biophysikalische Chemie Göttingen): Evolution von RNA-Protein-Ensembles (Hyperzyklus).
- Julius Rebek jr. (MIT Cambridge) stellt ein künstliches Molekül her (Aminoadenosintriazidester), das sich in Chloroformlösung selbst repliziert. Allerdings sind die Kopien identisch mit der Vorlage, so dass eine Evolution für diese Moleküle nicht möglich ist.
- John B. Corliss (Goddard Space Flight Center der NASA): Hydrothermale Schlote der Meere liefern Energie und Chemikalien, die eine von Meteoriten-Einschlägen weitgehend ungestörte chemische Evolution ermöglichen. Heute noch sind sie Lebensraum für die in vielen Merkmalen sehr urtümlichen Archaebakterien (Archaea).
- Günter Wächtershäuser (München): Die ersten sich selbst replizierenden Strukturen mit Stoffwechsel seien auf der Oberfläche von Pyrit entstanden. Das Eisensulfid des Pyrits habe hierzu die notwendige Energie geliefert. Mit den wachsenden und wieder zerfallenden Pyritkristallen hätten diese Systeme wachsen und sich vermehren können und die verschiedenen Populationen seien unterschiedlichen Umweltbedingungen (Selektionsbedingungen) ausgesetzt gewesen.
- A. G. Cairns-Smith (Universität Glasgow) und David C. Mauerzall (Rockefeller-Universität New York) sehen in Tonmineralien ein System, das zunächst selbst einer chemischen Evolution unterworfen ist, wodurch viele verschiedene, sich selbst replizierende Kristalle entstehen. Diese Kristalle ziehen auf Grund ihrer elektrischen Ladung organische Moleküle an und katalysieren die Synthese komplexer Biomoleküle, wobei der Informationsgehalt der Kristallstrukturen zunächst als Matrize dient. Diese organischen Gebilde werden immer komplexer, bis sie sich ohne Hilfe der Tonmineralien vermehren können.
- Wolfgang Weigand, Mark Dörr et al. (Friedrich-Schiller-Universität Jena) zeigen 2003, dass Eisensulfid die Synthese von Ammoniak aus molekularem Stickstoff katalysieren kann.
- Nick Lane (Department of Genetics, Evolution and Environment/University College, London) hat in einem Laborreaktor unter den Bedingungen der alkalinen hydrothermalen Schlote an Eisensulfidmembranen einfache organische Verbindungen (Formiat, Formaldehyd, Ribose, Desoxyribose) erzeugt.
Kritik
Die Hypothesen zur chemischen Evolution und insbesondere deren optimistische Interpretationen hinsichtlich der Klärung der Entstehung des Lebens werden zum Teil kritisch gesehen. So kommt zum Beispiel der Experte für Polymerchemie Prof. Hans R. Kricheldorf nach Analyse der gängigen Hypothesen zur chemischen Evolution zu folgendem Schluss: "Die zahlreichen Kenntnislücken, Negativergebnisse und Gegenargumente, [...], machen es beim augenblicklichen Kenntnisstand schwer, aus distanzierter, wissenschaftlicher Sicht die ehemalige Existenz einer zu Leben führenden chemischen Evolution zu akzeptieren. Trotz zahlreicher Fortschritte, insbesondere im Rahmen der RNA-Welt-Hypothese, reichen die bislang vorliegenden Ergebnisse bei Weitem nicht aus, eine chemische Evolution bis hin zu lebenden Organismen ausreichend zu begründen."[37]
Siehe auch
- Herkunft des irdischen Wassers
- Kohlenstoffchauvinismus
- Paläontologie
- Quasispezies
- Rare-Earth-Hypothese
- Alternative Erklärungen unter Evolutionstheorie
Literatur
- Iris Fry: The Emergence of Life on Earth: A Historical and Scientific Overview. Rutgers University Press, 2000, ISBN 0-8135-2740-6.
- Leslie E. Orgel: Prebiotic Chemistry and the Origin of the RNA World. In: Critical Reviews in Biochemistry and Molecular Biology. Band 39, 2004, S. 99–123, doi:10.1080/10409230490460765 (online)
- Horst Rauchfuss: Chemische Evolution und der Ursprung des Lebens. Springer-Verlag, 2006, ISBN 3-540-27666-1. (online)
- Robert Shapiro: Ein einfacher Ursprung des Lebens. In: Spektrum der Wissenschaft. November 2007, ISSN 0170-2971, S. 64–72.
- Sven P. Thoms: Ursprung des Lebens. Fischer Taschenbuch Verlag, 2005, ISBN 3-596-16128-2.
- Uwe Meierhenrich: Amino Acids and the Asymmetry of Life. Springer, 2008, ISBN 978-3-540-76885-2.
- Günter Wächtershäuser: Die Entstehung des Lebens in einer vulkanischen Eisen-Schwefel-Welt – Von chemischer Notwendigkeit zum genetischen Zufall. In: Oliver Betz, Heinz-Rüdiger Köhler (Hrsg.): Die Evolution des Lebendigen. Attempto, 2008, ISBN 978-3-89308-399-2.
- Muriel Gargaud u. a.: Young Sun, Early Earth and the Origins of Life: Lessons for Astrobiology. Springer, 2012, ISBN 978-3-642-22551-2, (eingeschränkte Vorschau in der Google-Buchsuche).
- William F. Martin u. a.: Energy at life’s origin. In: Science. Band 344, 2014, S. 1092–1093, doi:10.1126/science.1251653.
- Jef Akst: RNA World 2.0. In: The Scientist. 1. März 2014.
- Nick Lane: Der Funke des Lebens. Konrad Theiss Verlag: Darmstadt 2017. (Inhaltsverzeichnis unter https://d-nb.info/1118389840/04).[38]
Weblinks
- Wie das Leben auf die Erde kam – SWR2 Radio Akademie: Evolution: Fluss des Lebens (PDF; 67 kB)
- Wie dünn war die Ursuppe? aus der Fernseh-Sendereihe alpha-Centauri (ca. 15 Minuten). Erstmals ausgestrahlt am 8. Okt. 2000.
- Die chemische Evolution: Hat es sie gegeben und wenn ja, wie sah sie aus? Überblicksartikel mit allen gängigen Argumenten „pro“ und „contra“. PDF-Datei, ca. 640 kB.
- Schritte zum Leben: Moderne Erkenntnisse über die Entstehung des Lebens.
- Michael Marshall: The secret of how life on earth began, auf: BBC – Earth, vom 31. Oktober 2016
Einzelnachweise
- Martina Preiner: Schöne, alte RNA Welt. In: Spektrum.de. 2016, S. 1 (spektrum.de).
- Abiogenese. In: Lexikon der Biochemie. Abgerufen am 26. November 2017.
- Springer-Verlag GmbH: Leben durch chemische Evolution? Eine kritische Bestandsaufnahme von Experimenten und Hypothesen. 1. Auflage 2019. Berlin, Heidelberg 2019, ISBN 978-3-662-57978-7.
- D. Huizuga: Zur Abiogenesis-Frage. In: E.F.W. Pflüger (Hrsg.): Archiv für die gesamte Physiologie des Menschen und der Tiere. Band 7, Cohen, Bonn 1873, S. 549–574, (eingeschränkte Vorschau in der Google-Buchsuche).
- Iris Frey im Interview mit Chris Impey (Hrsg.): Talking about Life: Conversations on Astrobiology. Cambridge 2010, ISBN 978-0-521-51492-7, S. 13–21, (eingeschränkte Vorschau in der Google-Buchsuche).
- Horst Rauchfuß: Chemische Evolution und der Ursprung des Lebens. Springer, 2006, ISBN 3-540-27666-1, (eingeschränkte Vorschau in der Google-Buchsuche).
- Uta Henschel: Porträt Lorenz Oken: Ein Forscher wird entdeckt. In: Geo-Magazin, April 2001, S. 158–176
- Kara Rogers: Abiogenesis. In: Encyclopædia Britannica. Abgerufen am 26. November 2017.
- J. R. Cronin, S. Pizzarello: Enantiomeric excesses in meteoritic amino acids. In: Science. Band 275, 1997, S. 951–955, PMID 9020072, doi:10.1126/science.275.5302.951.
- A. Saghatelian, Y. Yokobayashi u. a.: A chiroselective peptide replicator. In: Nature. Band 409, Nummer 6822, Februar 2001, ISSN 0028-0836, S. 797–801, doi:10.1038/35057238, PMID 11236988 (PDF, freier Volltextzugriff)
- Paolo A. Sossi, Antony D. Burnham, James Badro, Antonio Lanzirotti, Matt Newville, Hugh St C. O’Neill: Redox state of Earth's magma ocean and its Venus-like early atmosphere. In: Science Advances. 6, Nr. 48, 1. November 2020, ISSN 2375-2548, S. eabd1387. doi:10.1126/sciadv.abd1387.
- Abiogenese (Wissenschaft Online).
- AllChemy. Abgerufen am 6. Dezember 2020 (englisch).
- Michelle Starr: A New Chemical 'Tree of The Origins of Life' Reveals Our Possible Molecular Evolution. In: ScienceAlert, 3. Oktober 2020.
- Wolos, Agnieszka: Synthetic connectivity, emergence, and self-regeneration in the network of prebiotic chemistry. In: Science. 369, Nr. 6511, 25. September 2020. doi:10.1126/science.aaw1955.
- Study reveals continuous pathway to building blocks of life (en). In: phys.org. Abgerufen am 2. Juli 2020.
- Ruiqin Yi, Quoc Phuong Tran, Sarfaraz Ali, Isao Yoda, Zachary R. Adam, H. James Cleaves, Albert C. Fahrenbach: A continuous reaction network that produces RNA precursors. In: Proceedings of the National Academy of Sciences. 117, Nr. 24, 16. Juni 2020, ISSN 0027-8424, S. 13267–13274. doi:10.1073/pnas.1922139117. PMID 32487725. PMC 7306801 (freier Volltext).
- W. Martin, M. J. Russell: On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleared cells. In: Philos. Trans. R. Soc. London. Ser 358, 2003, S. 59–85, PMID 12594918, PMC 1693102 (freier Volltext).
- Ulrich Schreiber, O. Locker-Grütjen, C. Mayer: Hypothesis: origin of life in deep reaching tectonic faults. In: OLEB. Band 42, Nr. 1, 2012, ISSN 1932-6203, S. 47–54 (englisch).
- U. Schreiber, C. Mayer, O. J. Schmitz, P. Rosendahl, A. Bronja, M. Greule, F. Keppler, I. Mulder, T. Sattler, H. F. Schöler: Organic compounds in fluid inclusions of Archean quartz-Analogues of prebiotic chemistry on early Earth. In: PLOS ONE. Band 12, Nummer 6, 2017, S. e0177570, doi:10.1371/journal.pone.0177570doi:10.1371/journal.pone.0177570 , PMID 28614348, PMC 5470662 (freier Volltext).
- Christian Mayer, Ulrich Schreiber, María J. Dávila: Periodic Vesicle Formation in Tectonic Fault Zones—an Ideal Scenario for Molecular Evolution. In: Origins of Life and Evolution of Biospheres. Band 45, Nr. 1-2, 27. Februar 2015, ISSN 0169-6149, S. 139–148, doi:10.1007/s11084-015-9411-z (englisch).
- C. Mayer, U. Schreiber, M. J. Dávila: Selection of Prebiotic Molecules in Amphiphilic Environments. In: Life. Band 7, Nummer 1, Januar 2017, S. , doi:10.3390/life7010003doi:10.3390/life7010003 , PMID 28067845, PMC 5370403 (freier Volltext).
- C. Mayer, U. Schreiber, M. J. Dávila, O. J. Schmitz, A. Bronja, M. Meyer, J. Klein, S. W. Meckelmann: Molecular Evolution in a Peptide-Vesicle System. In: Life. Band 8, Nummer 2, Mai 2018, S. , doi:10.3390/life8020016doi:10.3390/life8020016 , PMID 29795023, PMC 6027363 (freier Volltext).
- Sidney W. Fox, Joseph F. Foster: Introduction to Protein Chemistry. Wiley, 1957.
- Sheref S. Mansy, Jack W. Szostak: Thermostability of model protocell membranes. In: PNAS. Band 105, 2008, S. 13351–13355, doi:10.1073/pnas.0805086105doi:10.1073/pnas.0805086105 .
- Carl R. Woese: The Genetic Code: The Molecular Basis for Genetic Expression. Harper & Row, 1967, ISBN 0-06-047176-X.
- M. Yarus: Primordial genetics: phenotype of the ribocyte. In: Annu. Rev. Genet. Band 36, 2002, S. 125–151, doi:10.1146/annurev.genet.36.031902.105056, PMID 12429689 (englisch).
- Eugene V. Koonin: An RNA-making reactor for the origin of life. In: PNAS. Band 104, 2007, S. 9105–9106, doi:10.1073/pnas.0702699104.
- Nicolle E.B. Zellner, Vanessa P. McCaffrey, Jayden H.E. Butler: Cometary Glycolaldehyde as a Source of pre-RNA Molecules. Astrobiology, 2020, doi:10.1089/ast.2020.2216.
- M.P. Bernstein u. a.: Racemic amino acids from the ultraviolet photolysis of interstellar ice analogues. Nature 416, 2002.
- G. Munoz Caro u. a.: Amino acids from ultraviolet irradiation of interstellar ice analogues. Nature 416, 2002.
- Yoshihiro Furukawa, Yoshito Chikaraishi, Naohiko Ohkouchi, Nanako O. Ogawa, Daniel P. Glavin: Extraterrestrial ribose and other sugars in primitive meteorites. In: Proceedings of the National Academy of Sciences. 13. November 2019, ISSN 0027-8424, doi:10.1073/pnas.1907169116, PMID 31740594 (pnas.org [abgerufen am 21. November 2019]).
- Rosettas Komet enthält die Bausteine des Lebens In: ESA Deutschland. 31. Mai 2016, abgerufen am 28. Juni 2018
- R. Saladino u. a.: Catalytic effects of Murchison Material: Prebiotic Synthesis and Degradation of RNA Precursors. In: Orig Life Evol Biosph. Band 41, 2011, S. 437–451, PMID 21484535.
- S. Kojo, H. Uchino, M. Yoshimura, K. Tanaka: Racemic D,L-asparagine causes enantiomeric excess of other coexisting racemic D,L-amino acids during recrystallization: a hypothesis accounting for the origin of L-amino acids in the biosphere. In: Chemical Communications. 2004, S. 2146–2147, doi:10.1039/b409941a.
- Yuto Takeuchi et al.: Impact-induced amino acid formation on Hadean Earth and Noachian Mars. Scientific Reports, 2020, doi:10.1038/s41598-020-66112-8.
- Hans R. Kricheldorf: Leben durch chemische Evolution? 2019, ISBN 978-3-662-57978-7, doi:10.1007/978-3-662-57978-7.
- Populärwissenschaftliches Buch, aber Grundkenntnisse in Chemie und Genetik sind vorteilhaft