Knallgas
Knallgas, im englischen Sprachraum auch Oxyhydrogen oder HHO genannt, ist ein explosives Mischgas aus Wasserstoff (H2) und Sauerstoff (O2). Beim Kontakt mit offenem Feuer (Glut oder Funken) erfolgt die sogenannte Knallgasreaktion. Ein fertiges Gemisch aus Wasserstoff und Sauerstoff im Stoffmengenverhältnis 2:1 ist bereits in geringen Mengen explosiv. Nutzt man hingegen nur Wasserstoff als Ausgangsprodukt und mischt es mit Luft unter atmosphärischem Druck, muss der Volumenanteil des Wasserstoffs zwischen 18 und 76 Vol.-% liegen. Werden diese Grenzwerte unter- bzw. überschritten, kommt es nicht mehr zu einer Explosion/Detonation. Gemische aus Luft und 4 bis max. 18 Vol.-% Wasserstoff sind ebenfalls brennbar aber nicht explosiv. Durch kontrollierte Verbrennung an einer Mischdüse kann eine kontinuierliche Knallgasflamme erzielt werden.

Die Entstehung von Knallgas beobachteten im 17. Jahrhundert Théodore Turquet de Mayerne (um 1620) und auch Robert Boyle (um 1670) durch Einwirkung von Säuren auf Metalle. Es folgten in den 1770er und 1780er Jahren Henry Cavendish und Joseph Priestley.
Herstellung
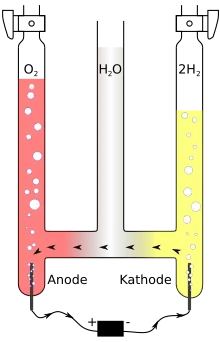
Knallgas lässt sich durch die Wasserelektrolyse, also die elektrolytische Zersetzung von Wasser (H2O) oder durch die thermische Zersetzung von Wasser herstellen. Die thermische Zersetzung von Wasser erfordert Temperaturen oberhalb von 2500 °C.[1]
Bei der Wasserelektrolyse erfolgt die Aufspaltung mit Hilfe von elektrischem Strom. Die Elektroden tauchen in Wasser ein, die elektrische Leitfähigkeit lässt sich durch die Zugabe einer Säure oder Base enorm verbessern. Um das Risiko einer unabsichtlichen Entzündung zu reduzieren werden die von den zwei Elektroden hochperlenden Gase getrennt – also der Wasserstoff über der Kathode (Minuspol) und der Sauerstoff über der Anode (Pluspol) – aufgefangen, in einem sog. Hofmannschen Wasserzersetzungsapparat.
Knallgasreaktion
Die Knallgasreaktion ist eine exotherm und detonationsartig ablaufende Reaktion von Wasserstoff mit Sauerstoff und verläuft mit einer Detonationsgeschwindigkeit von 2820 m/s. Sie ist eine Form der Verbrennung (Oxidation) und oft auch eine Explosion.
Die Reaktionsgleichung lautet:
Es handelt sich um eine stark verzweigte Kettenreaktion unter Beteiligung von Wasserstoff-, Sauerstoff- und Hydroxyl-Radikalen als Kettenträger.
und weitere Reaktionen
Das Reaktionsprodukt ist Wasser.
Die pro molarem Formelumsatz freiwerdende Energie beträgt 571,6 kJ/mol (ΔrH0 = −571,6 kJ/mol). Damit ändert sich die Enthalpie H für ein Mol des entstehenden Wassers um −286 kJ/mol.
Zusätzlich entsteht Wasserstoffperoxid:
Die Knallgas-Reaktion ist stark druck- und temperaturabhängig. Bei sehr niedrigen Drücken können die entstandenen Kettenträger die Gefäßwand erreichen und dort rekombinieren. So wird eine Kettenverlängerung oder -verzweigung unterbunden und es kommt nicht zur Explosion. Wird der Druck erhöht, so erreicht das Gemisch die untere Explosionsgrenze. Die mittlere freie Weglänge ist nun so klein geworden, dass die Kettenträger vor Erreichen der Gefäßwände mit anderen Teilchen zusammenstoßen und die Kettenreaktion fortführen. Wird der Druck weiter erhöht, so gelangt das System an die obere Explosionsgrenze. Durch den hohen Druck nimmt die Wahrscheinlichkeit für Drei-Teilchen-Stöße zu, somit können Kettenträger auch in der Gasphase rekombinieren und die Kettenreaktion wird abgebrochen.
Bei noch höheren Drücken kommt es schließlich zur thermischen Explosion. Hier kann die bei der Reaktion freiwerdende Energie nicht mehr schnell genug abgeführt werden und die Reaktionstemperatur wird erhöht. Dadurch kommt es zu weiteren Reaktionen, deren Energie wiederum nicht mehr abgeführt werden kann. Die thermische Explosion beruht also auf einer drastischen Temperaturerhöhung und nicht auf einer Kettenverzweigungsreaktion.[2]
In den Mitochondrien lebenden eukaryotischen Zellen kommt es bei der Endoxidation im Komplex IV in der Atmungskette zu einer analogen, aber strikt kontrollierten exergonen Reaktion (gelegentlich, nicht ganz zutreffend, als „biologische Knallgasreaktion“ bezeichnet), die der Energiegewinnung der Zelle, d. h. der Bildung von ATP-Molekülen dient:
Die freie Enthalpie ΔG°' der Reaktion ergibt sich aus ihrem Redoxpotential (+0,5 V) und beträgt bei physiologischen Bedingungen (pH 7) −193 kJ/mol.
Die gleiche Reaktion findet auch in der Brennstoffzelle statt. Bei deren Konstruktion wird die bei der Knallgasreaktion freiwerdende Energie (Enthalpiedifferenz), hier genauer: freie Enthalpie oder Gibbs-Energie ΔG genutzt, ohne eine Explosion herbeizuführen. Die dabei freiwerdende Enthalpie wird zum Teil als elektrischer Strom und zum Teil als Wärme freigesetzt. Die Reaktion läuft in der Brennstoffzelle jedoch langsam und kontrolliert ab.
Knallgasprobe
Mit dem Begriff Knallgasprobe bezeichnet man in der Chemie einen Nachweis von Wasserstoff. Dieser ist jedoch unspezifisch, da auch z. B. Methan mit Sauerstoff ein explosionsfähiges Gemisch bildet, und dient daher nur zur Demonstration der Explosion. Ein sicherer Weg, um Knallgas nachzuweisen, ist das Überprüfen des Mischungsverhältnisses, was aber in der Regel nur bei geschlossenen Apparaturen in kleinem Maßstab einfach zu bewerkstelligen ist.
Für den Nachweis wird üblicherweise das zu überprüfende Gas in einem Reagenzglas mit der Öffnung nach unten, damit Wasserstoff wegen der geringeren Dichte als Luft nicht entweichen kann, an eine Zündquelle – wie Bunsenbrenner oder Feuerzeug – gehalten.
Fall 1: Das aufgefangene Gas ist reiner Wasserstoff. Es kommt zu einer ruhigen Verbrennung oder eventuell schwachen Verpuffung (negative Knallgasprobe).
Fall 2: Das aufgefangene Gas ist ein Gemisch aus Wasserstoff und Sauerstoff (Knallgas). Die Verbrennung erfolgt mit einem pfeifenden Geräusch (positive Knallgasprobe).
Aufgrund der unterschiedlichen Geräusche bei reinem Wasserstoff und dem Gemisch Wasserstoff mit Sauerstoff wird die Knallgasprobe auch zur Überprüfung der Reinheit von Wasserstoffgas verwendet, um eine Explosion in einem geschlossenen Gefäß zu vermeiden.
Eine ähnlich reaktionsfreudiges Gasgemisch aus Wasserstoff und Chlor wird als Chlorknallgas bezeichnet.
Verwendung
Dass die Knallgasreaktion auch durch einen Platindraht als Katalysator in Gang gesetzt werden kann, entdeckte Johann Wolfgang Döbereiner. Einige Jahre später gelang ihm die Entzündung eines Knallgasgemisches unter dem Einfluss von Platinschwamm. Diese Entdeckung führte zur Erfindung des ersten Feuerzeuges (des Döbereinerschen Platinfeuerzeugs).
Technische Anwendung (zum Schweißen und Schneiden) findet ein Gemisch aus Wasserstoff und Sauerstoff heutzutage auch in sogenannten Knallgasgebläsen, welche eine Flammentemperatur bis ca. 2000 °C erreichen können (eine Art Autogenschweißgerät). Eines der ersten solchen Gebläse war der „Daniellsche Hahn“ von 1833.
Unfälle
Weltweit gab es bereits sehr viele Unfälle durch Knallgas-Explosionen, einige davon auch katastrophalen Ausmaßes.
Der oft als Beispiel genannte Absturz des Hindenburg-Zeppelins im Jahr 1937, bei welchem beim Anflug auf den Ankermast durch ein kleineres Leck das Traggas Wasserstoff in die Luft-Atmosphäre entwich und dadurch ein gewaltiger Wasserstoff-Brand verursacht wurde, war allerdings keine Knallgasreaktion, weil der Volumenanteil des Wasserstoffs zu hoch und die Sauerstoffkonzentration in der Luft zu niedrig war.[3]
In jüngerer Zeit besonders bekannt wurden Wasserstoff-Explosionen 1986 bei der Katastrophe von Tschernobyl und 2011 bei der Nuklearkatastrophe von Fukushima.
Literatur
- Gerhart Jander, Hans Spandau, Jürgen Fenner, Rolf Minkwitz: Kurzes Lehrbuch der anorganischen und allgemeinen Chemie. 10. Auflage, Springer, Berlin / Heidelberg 1987, ISBN 978-3-540-16749-5.
- Peter W. Atkins, Julio de Paula: Kurzlehrbuch der physikalischen Chemie. 4. Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31807-0, S. 512–513.
Einzelnachweise
- Grundzüge der Anorganischen Chemie I: Hauptgruppenelemente (PDF; 722 kB), 2003.
- Peter W. Atkins, Julio de Paula: Kurzlehrbuch der physikalischen Chemie. 4. Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31807-0, S. 512–513.
- Flugzeug-Katastrophen, Gondrom-Verlag (Hrsg.), 1996.