Endosymbiontentheorie
Die Endosymbiontentheorie (altgriechisch ἔνδον éndon ‚innen‘ und συμβίωσις symbíōsis ‚Zusammenleben‘) besagt, dass Eukaryoten aus einer Endosymbiose prokaryotischer Vorläuferorganismen hervorgegangen sind. Demnach sind chemo- und phototrophe Bakterien von Archaeen aufgenommen worden, in denen sie sich zu Zellorganellen ihrer Wirtszellen entwickelt haben, darunter Mitochondrien und Plastiden. Allerdings gibt es auch Eukaryoten, die weder Zellatmung noch Photosynthese betreiben und keine derartigen Organellen haben, wobei angenommen wird, dass diese Zellbestandteile nachträglich verloren gegangen sind.
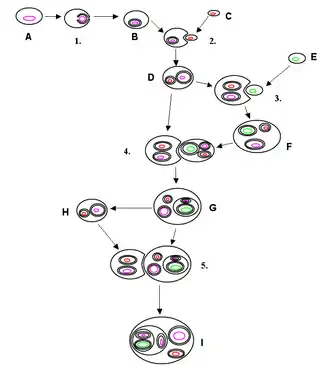
schwarz: Zell- oder Organellmembran;
rosa: eukaryotische DNA;
grün: cyanobakterielle DNA;
rot: proteobakterielle oder mitochondriale DNA
Geschichte
Der Gedanke der Endosymbiontentheorie ist erstmals von dem Botaniker Andreas Franz Wilhelm Schimper im Jahr 1883 veröffentlicht worden, der damit die Entstehung der Chloroplasten zu erklären versuchte.[1] Ähnliche Ideen vertreten zur damaligen Zeit Julius Sachs und Richard Altmann.[2] Die Hypothese wurde erneut 1905 von dem russischen Evolutionsbiologen Konstantin S. Mereschkowski,[3] 1922 von Ivan Wallin[4][5] und 1924 von Boris Koso-Poljanski aufgegriffen. Doch erst 1967 mit der Veröffentlichung von Lynn Margulis wurde sie bekannter.[6][7]
Erläuterung
Die Endosymbiontentheorie geht davon aus, dass Mitochondrien und Plastiden sich aus eigenständigen prokaryotischen Lebewesen entwickelt haben. Im Zuge des Evolutionsprozesses sind diese Einzeller eine Endosymbiose mit einer anderen Zelle eingegangen, das heißt, sie leben in ihrer Wirtszelle zum gegenseitigen Vorteil. Auch heute noch kann man beobachten, dass amöboide Einzeller (also solche mit einer „weichen“ Membran) Cyanobakterien aufnehmen, ohne sie zu verdauen.
Das Zusammenspiel der beiden zellulären Organismen hat sich dann im Verlauf der Evolution zu einer gegenseitigen Abhängigkeit entwickelt, in der keiner der beiden Partner mehr ohne den anderen überleben konnte, das heißt, es entstand eine Symbiose. Diese wird Endosymbiose genannt. Die Abhängigkeit geht so weit, dass die Organellen Teile ihres (nicht mehr benötigten) genetischen Materials verloren haben oder die entsprechenden Gene teilweise in das Kern-Genom integriert wurden. Einzelne Protein-Komplexe in den Organellen, wie z. B. die ATP-Synthase, werden so zum Teil aus kerncodierten, zum Teil aus mitochondrial codierten Untereinheiten zusammengesetzt.
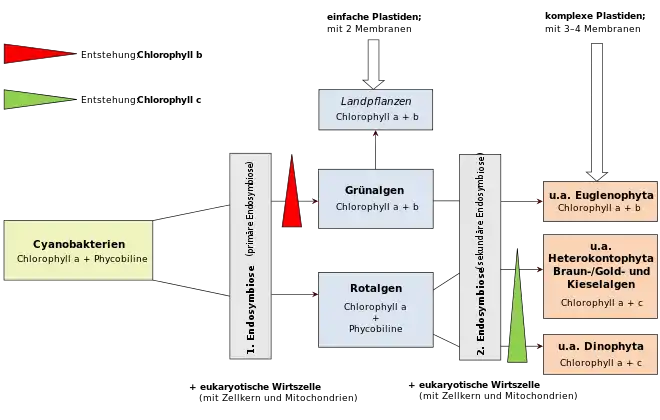
Analysen der Genome deuten darauf hin, dass Plastiden von Cyanobakterien abstammen, während Mitochondrien von aeroben α-Proteobakterien (Rickettsiales) abstammen. Diese Form der Endosymbiose zwischen einem Eukaryoten und einem Bakterium wird als primäre Endosymbiose bezeichnet. Entstand das Zellorganell durch die Aufnahme eines Eukaryoten, der bereits ein primäres Endosymbioseereignis erfahren hat, wird dies als sekundäre Endosymbiose bezeichnet.
Primäre Plastiden
Primäre Plastiden sind von zwei Hüllmembranen umgeben, die den beiden Membranen des aufgenommenen Cyanobakteriums entsprechen, während die bei der Phagocytose entstehende darum herumliegende, ursprüngliche dritte Membran nicht mehr vorhanden ist.[8] Insgesamt gibt es vier Linien von primären Plastiden und somit von autotrophen primären Endosymbionten:[2]
- die Glaucophyten-Linie:
die einzelligen Algen der Glaucophyta (syn. Glaucocystaceae) besitzen Plastiden, die dem Cyanobakterium in vielerlei Hinsicht noch sehr ähnlich sind und daher oft als „Cyanellen“ oder „Cyanoplasten“, gelegentlich auch als „Muroplasten“,[9] bezeichnet werden, - die Rhodophyten-Linie:
Rotalgen (wiss. Rhodophyta) besitzen „Rhodoplasten“ genannte Plastiden, die noch den Antennenaufbau (Phycobilisomen) der Cyanobakterien tragen. - die Chloroplastiden-Linie:
Die Plastiden der Viridiplantae (syn. Chloroplastida, Grünalgen und höhere Pflanzen)[10] stellen die am stärksten entwickelten Plastiden dar und tragen eine große Vielfalt an Antennenkomplexen. Die grünen Plastiden der Algen und höheren Pflanzen werden Chloroplasten genannt. - die Paulinella-Linie:
Die Plastiden der amöboiden Paulinella chromatophora (Euglyphida) nennt man Chromatophoren, manchmal wegen ihres Ursprungs ebenfalls „Cyanellen“.
Bei all diesen Linien wurden die einst aufgenommenen Cyanobakterien so stark angepasst, dass sie frei nicht mehr lebensfähig sind, und zum Organell, dem Plastiden bzw. Chloroplasten wurden. Dies geschah durch ‚endosymbiotischen Gentransfer‘ (EGT, ein Spezialfall des horizontalen Gentransfers HGT) von Genen des Organells auf den Zellkern. Es wurde lange diskutiert, ob so entstandene primäre Chloroplasten aus einem einzigen endosymbiotischen Ereignis oder aus mehreren unabhängigen Ereignissen in verschiedenen eukaryotischen Abstammungslinien stammen. Es wird heute allgemein angenommen, dass praktisch alle Organismen mit primären Chloroplasten einen einzigen gemeinsamen Vorfahren haben, der aus einer primären Endosymbiose vor etwa 600 Millionen bis 2 Milliarden Jahren entstand.[11][12] Das damals aufgenommene Cyanobakterium stand offenbar nahe der heutigen Spezies Gloeomargarita lithophora, diese befindet basal sich im Stammbaum der Cyanobakterien nahe der Gattung Synechococcus.[13][14][15] Die Alge Cyanophora, ein Glaucophyt, gilt als einer der ursprünglichsten Organismen, die einen Chloroplasten enthalten.[16][17] Die Ausnahme ist Paulinella chromatophora. Diese stammt offenbar von einem Vorfahren ab, der unabhängig davon und viel später – vor etwa 90 bis 500 Millionen Jahren – ein Cyanobakterium der Gattung Prochlorococcus (oder Synechococcus) aufgenommen hatte.[12][18][15][12][19][2] Der Heterokont Rhopalodia gibba verschlang ein Cyanobakterium der Gattung Cyanothece und reduzierte diese zu sogenannten Sphäroidkörper (englisch spheroid bodies), die nicht mehr zur Photosynthese, sondern zur N2-Fixierung dienen.[2][20]
Sekundäre Plastiden
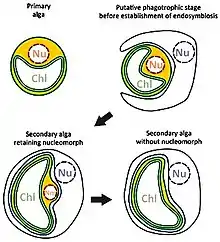
Sekundäre Plastiden verfügen über drei oder sogar vier Hüllmembranen. Es ist kein Fall bekannt, in dem eine Aufnahme eines Glaucophyten zu einer sekundären Endosymbiose geführt hätte. Dagegen existiert eine Fülle von Organismengruppen, die eine Rotalge aufgenommen und sie in unterschiedlichem Maße reduziert haben. Einige Autoren nehmen an, dass dieses Ereignis nur einmal in der Evolution stattgefunden hat, und definieren so das Monophylum der Chromalveolata. In diese Gruppe gehören die Braunalgen, Gelbgrünalgen, Goldalgen, Cryptophyceen, Haptophyceen (Kalkalgen), und die Apicomplexa (z. B. Malaria-Erreger Plasmodium).
Auch sekundäre Endosymbiosen zwischen Eukaryoten und Grün- oder Rotalgen (d. h. primären Endosymbionten) sind bekannt. So wird angenommen, dass die Euglenozoa und die Chlorarachniophyta unabhängig voneinander primäre Endosymbionten in sich aufgenommen haben.
Tertiäre Plastiden
Offenbar ist es auch zu tertiären Endosymbiosen gekommen. Die drei ungewöhnlich pigmentierten Dinoflagellaten-Spezies Gyrodinium aureolum, Gymnodinium galatheanum und Gymnodinium breve haben Plastiden, die 19′-Hexanoyloxy-Fucoxanthin als Hauptcarotinoid besitzen und nicht das für die meisten Dinoflagellaten charakteristische Peridinin. Analysen der SSU rDNA aus dem Plastid und dem Kerngenom dieser Dinoflagellaten deuten darauf hin, dass sie ihre Plastiden durch Endosymbiose eines Haptophyten erworben haben. Bei den Haptophyten selbst geht man davon aus, dass ihre Plastiden sekundären Ursprungs sind; daher scheinen diese Dinoflagellaten tertiäre Plastiden zu besitzen.[21]
Mitochondrien und MROs
Es gibt einige Protozoen („Archezoa“), die keine Mitochondrien (und auch keine Plastiden) besitzen. Zunächst wurde angenommen, sie seien primitiv und unmittelbar aus der urtümlichen Wirtszelle der Endosymbionten hervorgegangen. Dies ist vermutlich falsch. Die meisten dieser Organismen besitzen mit den Hydrogenosomen bzw. Mitosomen Organellen, die offenbar entweder von Mitochondrien abstammen oder mit diesen einen gemeinsamen Ursprung in den α-Proteobakterien haben. In einigen Fällen sind sogar noch eigene DNA und Ribosomen vorhanden.[22][23]
Mitochondrien und ähnliche (d. h. abgeleitete) Organellen wie Hydrogenosomen und Mitosomen werden daher zusammen als „mitochondrienverwandte Organellen“ (englisch mitochondrion-related organelles, MROs), auch „mitochondrien-ähnliche Organellen“ (en. mitochondrion-like organelles, MLOs) genannt, klassifiziert. Zu diesen gehören auch die anaeroben und DNA-freien Organellen von Henneguya salminicola (alias H. zschokkei, Myxozoa).[24][25][26][27]
Eine Ausnahme ist die Gattung Monocercomonoides (Excavata), die keine Organellen aus dieser Gruppe aufweist. Man nimmt an, dass diese Einzeller durch horizontalen Gentransfer ein zytosolisches System erworben hatten, um für die Proteinsynthese erforderliche Eisen-Schwefel-Cluster bereitzustellen. Danach waren ihre mitochondrialen Organellen in all ihren Funktionen überflüssig und gingen verloren.[28][29] In all diesen Fällen enthält die DNA im Zellkern Sequenzen, die eindeutig mitochondrialen Ursprungs sind. Wahrscheinlich haben alle amitochondrialen Eukaryoten ihre Mitochondrien sekundär verloren oder umgewandelt.
Eine im Herbst 2020 veröffentlichte Studie legt anhand von umfangreichen Genomanlysen nahe, dass – obwohl bisher noch keine primär amitochondrialen Eukaryoten gefunden wurden – die Vorfahren der Eukaryoten zuerst ihre komplexes Genom mit den zugehörigen Strukturen und danach die Mitochondrien (oder Vorläufer davon) erworben haben.[30]
Weitere MLOs mit eigenem Genom wurden bei Einzellern der Gattung Blastocystis gefunden.[27][31]
Indizien

- Man kann heute bei unterschiedlichen Lebewesen verschiedene Stadien zwischen Symbiose und Endosymbiose beobachten:
- Korallen, einige Muscheln, der Wurm Convoluta roscoffensis, aber zum Beispiel auch Blattläuse leben in Symbiose mit Algen oder Bakterien, die im Zellinneren ihrer Wirte leben. Bei den endosymbiotischen Bakterien der Blattläuse werden Beschleunigungen der Evolutionsraten — einhergehend mit Genverlusten und einem Anstieg des AT-Gehaltes der DNA — beobachtet, wie sie auch bei Zellorganellen zu finden sind.
- Der Süßwasserpolyp Hydra viridissima (Grüne Hydra) kann durch Endocytose Zoochlorellen aufnehmen und mit deren Hilfe Photosynthese betreiben.
- Manche Acoelomorpha, z. B. die Gattung Waminoa, leben mit Zooxanthellen in Symbiose und ernähren sich unter anderem von deren Photosyntheseprodukten. Symsagittifera roscoffensis (Gattungs-Alias Convoluta, Fam. Convolutidae: Acoela) lebt in Symbiose mit der einzelligen Grünalge Tetraselmis convolutae (die aber auch frei im Ozean leben kann).[32][33]
- Ganz allgemein sind Zooxanthellen Protisten, die als Endosymbionten in einer Reihe von Lebewesen leben können.
- Die Wurzeln einiger Pflanzen leben in Symbiose mit stickstofffixierenden Bakterien (Rhizobien).
- Bei Foraminiferen und Schwämmen kommen Rotalgen als Endosymbionten vor.[32][34]
- Noctiluca scintillans nimmt Grünalgen der Spezies Pedinomonas noctilucae (Pedinophyceae) auf, die im Innern als Endosymbionten weiterleben.[35]
- Bei Dinoflagellaten sind verschiedene Stadien zu finden: Kleptoplastiden, komplexe Rhodoplasten und tertiäre Endosymbiosen, die auf die Aufnahme von Cryptophyceen oder auch Kalkalgen (Haptophyta), eine Gruppe mariner Algen, zurückzuführen sind. Nachgewiesen wurde die tertiäre Endosymbiose zwischen Kalkalgen und Dinoflagellaten bei den Arten Gymnodinium breve, Gymnodinium galatheanum und Gyrodinium aureolum.[36]
- Heterotrophe Dinoflagellaten können auch Symbiosen mit Cyanobakterien bilden. Diese Cyanobionten der Dinoflagellaten werden auch Phaeosomen genannt. Man findet solche Symbiosen am häufigsten in tropischen Meeresumgebungen; die genaue Funktion des Cyanobionten hängt von seiner Wirtsart ab. Häufig vorkommende marine Cyanobakterien der Gattung Synechococcus bilden Symbiosen mit Dinoflagellaten der Gattungen Ornithocercus, Histionesis und Citharistes, von denen man annimmt, dass sie ihrem Wirt durch die Bereitstellung von fixiertem Stickstoff in oligotrophen, subtropischen Gewässern nutzen.[37]Phaeosomen-Symbiosen wurden besonders in geschichteten Umgebungen mit begrenztem Stickstoffangebot dokumentiert; das Leben innerhalb eines Wirts kann für das Cyanobakterium eine für die Stickstofffixierung günstige anaerobe Umgebung bieten.[38]Allerdings gibt es auch widersprüchliche Belege; eine Studie über Phäosomen in Zellen von Ornithocercus spp. hat den Nachweis erbracht, dass Symbionten der Gattung Synechococcus eher organischen Kohlenstoff als Stickstoff liefern, was auf das Fehlen von Nitrogenase in diesen Cyanobakterien zurückgeführt werden könnte.[39]
- Für die 2019 zunächst im meromiktischen Zugersee (Schweiz), dann auch in Seen Frankreichs, Taiwans und Ostafrikas gefundene Gruppe um das Bakterium Candidatus Azoamicus ciliaticola wurde 2021 eine neue Ordnung innerhalb der Gammaproteobacteria mit der provisorischen Bezeichnung eub62A3 group (alias Candidatus Azoamicus group) vorgeschlagen, zusammen mit zwei Untergruppen A (nächst Ca. A. ciliaticola) und B.
Ca. A. ciliaticola lebt endosymbiotisch in Wimpertierchen (Ciliophora) der Klasse Plagiopylea. Das Bakterium kann Nitrat atmen und zur Energieproduktion verwenden, die er seinem Wirt in anaerober Umgebung in den Tiefen des Sees zur Verfügung stellt.[40] - Hatena arenicola beherbergt einen quasi-permanenten, Prasinophyten-ähnlichen Endosymbionten (verwandt mit der Gattung Nephroselmis, Chlorophyta). Bei der Zellteilung bekommt nur eine Tochter den einzelnen Endosymbionten, die andere muss diesen wieder aus der Umwelt erwerben.[2]
- Der Pilz Geosiphon pyriforme (syn. G. pyriformis) enthält endosymbiontische Cyanobakterien der Gattung Nostoc.[41]
- Blattläuse (z. B. die Erbsenlaus) können in besonderen Darmzellen (sog. ‚Bakteriozyten‘) endosymbiontische Bakterien der Gattung Buchnera (ggf. auch Regiella u. a., alle Enterobacteriaceae) beherbergen, die über die Eier an die nächste Generation weitergegeben werden. In den Darmzellen von Motten-Schildläusen (Aleyrodoidea) findet man gleich zwei endosymbiontische Bakterien verschachtelt.[42] Bei Schmierläusen der Spezies Planococcus citri wurde sogar eine verschachtelte ‚sekundäre‘ Endosymbiose gefunden.[43]
- Plastiden und Mitochondrien sind von ihrem Aufbau her Prokaryonten: kein Zellkern, ringförmige DNA, die DNA ist nicht durch Histone assoziiert, sondern durch sogenannte HLPs verdichtet (Analogie), Größe entspricht kleinen Bakterien. Sie stellen ihre eigenen Proteine her, wobei sie einen prokaryotischen Proteinbiosyntheseapparat besitzen. Ihre Ribosomen ähneln denen der Bakterien, nicht denen der Wirtszelle (≤ 70-S- anstatt 80-S-Ribosomen). Die mRNA der beiden Organellen besitzt nicht die für Eukaryoten typische 5'-Cap-Sequenz, und auch die Polyadenylierung fehlt. Die Cyanellen der Glaucophyta sind sogar noch von einer dünnen bakteriellen Zellwand umgeben. Rotalgen und Glaucophyta setzen wie Cyanobakterien Phycobiline zum Auffangen von Photonen in der Photosynthese ein.
- Die DNA-Sequenzen der Mitochondrien ähneln denen der α-Proteobakterien, während Plastiden-DNA-Sequenzen im Cyanobakterien-Stammbaum platziert werden. Ein Vergleich mit der Wirts-DNA weist auf keine Abstammung der Organellen vom Wirt hin.
- Primäre Plastiden und Mitochondrien sind von Doppelmembranen umgeben, wobei, der Hypothese entsprechend, die äußere beim „Verschlucken“ des Bakteriums hinzugekommen ist. Die innere entspricht der von Bakterien (Vorkommen von Cardiolipin, kein Cholesterin; außerdem Vorkommen von Transmembranproteinen (β-barrel-Proteine), die nur in den Membranen von Bakterien und Zellorganellen vorkommen), die äußere der von Eukaryoten.
- Die besten Belege für sekundäre Endosymbiosen finden sich bei den Chlorarachniophyceen, zu den Cercozoa gehörende Amöben, und den Cryptophyceen, einer eigenständigen Algenklasse. Beide Algengruppen enthalten komplexe Plastiden mit vier Hüllmembranen. Zwischen den beiden äußeren und den beiden inneren Hüllmembranen befindet sich der periplastidäre Raum mit einem Nucleomorph, einem stark reduzierten eukaryotischen Zellkern mit je drei linearen kleinen Chromosomen und eukaryotischen 80-S-Ribosomen. Genomsequenzierungen und phylogenetische Analysen zeigten, dass Nucleomorph und Plastid der Chlorarachniophyceen auf eine sekundäre Endosymbiose mit einer Grünalge, der komplexe Plastid der Cryptophyceen jedoch auf eine sekundäre Endosymbiose mit einer Rotalge zurückzuführen sind. Von der Chlorarachniophycee Bigelowiella natans und von der Cryptophycee Guillardia theta wird/wurde das Nucleomorph-Genom vollständig durchsequenziert. Da bei Rotalgen die Stärkesynthese im Cytoplasma stattfindet und nicht wie bei den Grünalgen und Landpflanzen im Plastiden, spricht das Vorkommen von Stärke im periplastidären Raum der Cryptophyceen ebenfalls für eine sekundäre Endosymbiose.
- Mitochondrien und Plastiden vermehren sich durch Teilung und werden bei Teilung der Wirtszelle auf die Tochterzellen verteilt. Sie entstehen nicht de novo, d. h. sie können von der Zelle bei zufälligem Verlust nicht neu gebildet werden.
- Die membrangebundenen ATPasen der Bakterien und Organellen (wie Mitochondrien) sind untereinander nahe verwandt, genauso wie die der Archaeen und die Eukaryoten-eigenen. Zwischen diesen beiden Gruppen besteht nur eine entferntere Verwandtschaft.[44] Bei kleinen Gruppen von Bakterien und Archaeen mit den ‚falschen‘ ATPasen vermutet man horizontalen Gentransfer.[45]
Siehe auch
- Chemische Evolution
- Evolutionstheorie
- Kompartimentierungshypothese
- Ektosymbiose, insbes. mikrobielle E.
- Symbiogenese
- Zooxanthelle
- Kappa-Organismen
Literatur
- A. F. W. Schimper: Über die Entwicklung der Chlorophyllkörner und Farbkörper. In: Bot. Z. Band 41, 1883, S. 102–113.
- C. Mereschkowsky: Über Natur und Ursprung der Chromatophoren im Pflanzenreiche. In: Biologisches Centralblatt. Band 25, 1905, S. 593–604.
- Lynn Margulis, Dorion Sagan: Leben: Vom Ursprung zur Vielfalt. Spektrum Akademischer Verlag, Heidelberg/ Berlin 1997, ISBN 3-8274-0524-6 (Übersetzung der englischsprachigen Originalausgabe von 1995).
- Lynn Margulis: Die andere Evolution. Spektrum Akademischer Verlag, Heidelberg/ Berlin 1999, ISBN 3-8274-0294-8 (Übersetzung der englischsprachigen Originalausgabe von 1998).
- J. M. Archibald, M. B. Rogers, M. Toop, K-i. Ishida, P. J. Keeling: Lateral gene transfer and the evolution of plastid-targeted proteins in the secondary plastid-containing alga Bigelowiella natans. In: Proceedings of the National Academy of Sciences of the USA. Band 100, 2003, S. 7678–7683.
- S. E. Douglas, S. Zauner, M. Fraunholz, M. Beaton, S. Penny, L. T. Deng, X. Wu, M. Reith, T. Cavalier-Smith, U.-G. Maier: The highly reduced genome of an enslaved algal nucleus. In: Nature. (London). Band 410, 2001, S. 1040–1041.
- Karl-Heinz Linne von Berg, Michael Melkonian u. a.: Der Kosmos-Algenführer. Die wichtigsten Süßwasseralgen im Mikroskop. Kosmos, Stuttgart 2004, ISBN 3-440-09719-6.
- G. I. McFadden: Primary and secondary endosymbiosis and the origin of plastids. In: Journal of Phycology. Band 37, 2001, S. 951–959.
- S. B. Gould, R. F. Waller, G. I. McFadden: Plastid Evolution. In: Annual Review of Plant Biology. Band 59, 2008, S. 491–517.
- N. A. Moran: Accelerated evolution and Muller's ratchet in endosymbiotic bacteria. In: Proceedings of the National Academy of Sciences of the USA. Band 93, 1996, S. 2873–2878.
- S. Turner, K. M. Pryer, V. P. W. Miao, J. D. Palmer: Investigating deep phylogenetic relationships among Cyanobacteria and plastids by small subunit rRNA sequence analysis. In: Journal of Eukaryotic Microbiology. Band 46, 1999, S. 327–338.
- A. W. Thompson, R. A. Foster u. a.: Unicellular cyanobacterium symbiotic with a single-celled eukaryotic alga. In: Science. Band 337, Nummer 6101, September 2012, S. 1546–1550. doi:10.1126/science.1222700. PMID 22997339.
- Shinichiro Maruyama, Eunsoo Kim: A Modern Descendant of Early Green Algal Phagotrophs. In: Current Biology. 23, 2013, S. 1081–1084, doi:10.1016/j.cub.2013.04.063.
- William F. Martin, Sriram Garg, Verena Zimorski: Endosymbiotic theories for eukaryote origin. In: Philosophical Transactions of the Royal Society of London B: Biological Sciences. Band 370, Nr. 1678, 31. August 2015, doi:10.1098/rstb.2014.0330 (englisch).
- Wilfried Probst: Frühe Evolution und Symbiose, Europa-Universität Flensburg, Institut für Biologie und Sachunterricht und ihre Didaktik, abgerufen am 19. April 2019
- Przemysław Gagat, Paweł Mackiewicz: Cymbomonas tetramitiformis - a peculiar prasinophyte with a taste for bacteria sheds light on plastid evolution, in: Symbiosis, 10. November 2016, doi:10.1007/s13199-016-0464-1
Weblinks
- M. Neukamm, A. Beyer: Die Endosymbiontentheorie: Allgemeine Grundlagen, Fakten, Kritik. 2011. (PDF; 1,2 MB)
- Energiesparen dank Untermieter. Auf: wissenschaft.de vom 14. Oktober 2005, abgerufen am 8. September 2019
- FR Biologie Hannover: Die Endosymbiontentheorie inklusive einer Erklärung zur Hydrogenhypothese als Alternative zur Endosymbiontentheorie.
- Die Endosymbiontentheorie, Max-Planck-Institut für molekulare Pflanzenphysiologie. Memento im Webarchiv vom 15. Mai 2011. Den dortigen Link zu Hatena findet man jetzt unter:
Christina Schallenberg: Energiesparen dank Untermieter. Auf wissenschaft.de vom 14. Oktober 2005 - Martin Vieweg: Innerer Kompass: Dem „sechsten Sinn“ auf der Spur. Auf wissenschaft.de vom 18. Januar 2022 (Endosymbiotischer Ursprung der Magnetosomen?)
Einzelnachweise
- Andreas Franz Wilhelm Schimper: Über die Entwicklung der Chlorophyllkörner und Farbkörper. In: Botanische Zeitung. Band 41, Nr. 7, 1883, S. 105–114, 121–131, 137–146, 153–162 (archive.org). (via WebArchiv)
- Sven B. Gould, Ross F. Waller, Geoffrey I. McFadden: Plastid Evolution, in: Annu. Rev. Plant Biol., Band 59, 2008, S. 491–517, doi:10.1146/annurev.arplant.59.032607.092915. Siehe insbes. Fig. 1
- Konstantin S. Mereschkowski: Über Natur und Ursprung der Chromatophoren im Pflanzenreiche. In: Biologisches Centralblatt. Band 25, 15. September 1905, S. 593–604 (archive.org). (via WebArchiv). (englisch); (en., alternativ)
- Ivan E. Wallin: On the nature of mitochondria. I. Observations on mitochondria staining methods applied to bacteria. II. Reactions of bacteria to chemical treatment. In: American Journal of Anatomy. 30, Nr. 2, 1922, S. 203–229. doi:10.1002/aja.1000300203.
- Ivan E. Wallin: On the nature of mitochondria. III. The demonstration of mitochondria by bacteriological methods. IV. A comparative study of the morphogenesis of root-nodule bacteria and chloroplasts. In: American Journal of Anatomy. 30, Nr. 4, 1922, S. 451–471. doi:10.1002/aja.1000300404.
- Lynn Sagan: On the origin of mitosing cells. In: J. Theoretical Biology. Band 14, Nr. 3, 1967, S. 255–274. PMID 11541392 doi:10.1016/0022-5193(67)90079-3
- Bernhard Kegel: Die Herrscher der Welt: Wie Mikroben unser Leben bestimmen. DuMont, Köln 2015, ISBN 978-3-8321-9773-5.
- Thomas Cavalier-Smith: Membrane heredity and early chloroplast evolution. In: trends in plant science. Band 5, Nr. 4, 2000, S. 174–182 (englisch).
- J. Kenneth Hoober: The structure and function of plastids. Hrsg.: Robert R. Wise. Springer, Dordrecht 2006, ISBN 978-1-4020-4061-0, S. 3–21 (Online).
- genauer: Chlorophyta und Streptophyta/Charophyta, letztere mit den Landpflanzen, wissenschaftlich Embryophyta
- Geoffrey I. McFadden, Giel G. Van Dooren: Evolution: Red Algal Genome Affirms a Common Origin of All Plastids. In: Current Biology. 14, Nr. 13, 2004, S. R514–6. doi:10.1016/j.cub.2004.06.041. PMID 15242632.
- Patricia Sánchez-Baracaldo, John A. Raven, Davide Pisani, Andrew H. Knoll: Early photosynthetic eukaryotes inhabited low-salinity habitats. In: Proceedings of the National Academy of Sciences. 114, Nr. 37, 12. September 2017, S. E7737–E7745. doi:10.1073/pnas.1620089114.
- Rafael I. Ponce-Toledo, Philippe Deschamps, Purificación López-García, Yvan Zivanovic, Karim Benzerara, David Moreira: An Early-Branching Freshwater Cyanobacterium at the Origin of Plastids. In: Current Biology. 27, Nr. 3, 2017, S. 386–391. doi:10.1016/j.cub.2016.11.056.
- Jan de Vries, John M. Archibald: Endosymbiosis: Did Plastids Evolve from a Freshwater Cyanobacterium?. In: Current Biology. 27, Nr. 3, 2017, S. R103–R105. doi:10.1016/j.cub.2016.12.006.
- Purificación López-García, Laura Eme, David Moreira: Symbiosis in eukaryotic evolution. In: Journal of Theoretical Biology. 434, 2017, S. 20–33. doi:10.1016/j.jtbi.2017.02.031.
- Geoffrey I. McFadden: Chloroplast Origin and Integration. In: Plant Physiology. 125, Nr. 1, 2001, S. 50–3. doi:10.1104/pp.125.1.50. PMID 11154294. PMC 1539323 (freier Volltext).
- M. T. Clegg, B. S. Gaut, G. H. Learn Jr, B. R. Morton: Rates and Patterns of Chloroplast DNA Evolution. In: Proceedings of the National Academy of Sciences. 91, Nr. 15, 1994, S. 6795–6801. bibcode:1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMID 8041699. PMC 44285 (freier Volltext).
- Luis Delaye, Cecilio Valadez-Cano, Bernardo Pérez-Zamorano: How Really Ancient Is Paulinella Chromatophora?. In: PLoS Currents. 2016. doi:10.1371/currents.tol.e68a099364bb1a1e129a17b4e06b0c6b.
- Wilfried Probst: Frühe Evolution und Symbiose, Europa-Universität Flensburg, Institut für Biologie und Sachunterricht und ihre Didaktik: §Auf dem Weg zur Chloroplastenbildung, abgerufen am 19. April 2019
- Lothar Geitler: Zur Entwicklungsgeschichte der Epithemiaceen Epithemia, Rhopalodia und Denticula (Diatomophyceae) und ihre vermutlich symbiontischen Sphaeroidkoerper, in: Plant Syst. Evol., Band 128, 1977, S. 259–275, JSTOR 23642226
- Torstein Tengs, Ole J. Dahlberg, Kamran Shalchian-Tabrizi, Dag Klaveness, Knut Rudi, Charles F. Delwiche, Kjetill S.Jakobsen: Phylogenetic analyses indicate that the 19'Hexanoyloxy-fucoxanthin-containing dinoflagellates have tertiary plastids of haptophyte origin. In: Molecular Biology and Evolution. Band 17, Nr. 5, 2000, S. 718–729, doi:10.1093/oxfordjournals.molbev.a026350, PMID 10779532 (Online).
- Brigitte Boxma, Rob M. de Graaf, Georg W. M. van der Staay, Theo A. van Alen, Guenola Ricard, Toni Gabaldon, Angela H. A. M. van Hoek, Seung Yeo Moon-van der Staay, Werner J. H. Koopman, Jaap J. van Hellemond, Aloysius G. M. Tielens, Thorsten Friedrich, Marten Veenhuis, Martijn A. Huynen, Johannes H. P. Hackstein: An anaerobic mitochondrion that produces hydrogen. In: Nature. Band 434, Nr. 7029, 3. Februar 2005, S. 74–79, doi:10.1038/nature03343.
- A. Akhmanova, F. Voncken, T. van Alen et al: A hydrogenosome with a genome. In: Nature. 396, Nr. 6711, Dezember 1998, S. 527–528. doi:10.1038/25023. PMID 9859986.
- Jan Osterkamp: Erstes Tier ohne Atmung und Mitochondrien, auf: Spektrum.de vom 25. Februar 2020
- Tel Aviv University researchers discover unique non-oxygen breathing animal, auf: EurekAlert! vom 25. Februar 2020
- Siehe auch: H. nuesslini; Pfauen-Lippfisch§Bedrohungen (H. tunisiensis)
- Alexandra Stechmann, Karleigh Hamblin, Vicente Pérez-Brocal, Daniel Gaston, Gregory S. Richmond, Mark van der Giezen, C. Graham Clark, Andrew J. Roger: Organelles in Blastocystis that Blur the Distinction between Mitochondria and Hydrogenosomes. In: Current Biology. 18, Nr. 8, April 2008, S. 580–585. doi:10.1016/j.cub.2008.03.037. PMID 18403202. PMC 2428068 (freier Volltext).
- Anna Karnkowska, Vojtěch Vacek, Zuzana Zubáčová, Sebastian C. Treitli, Romana Petrželková, Laura Eme, Lukáš Novák, Vojtěch Žárský, Lael D. Barlow, Emily K. Herman, Petr Soukal, Miluše Hroudová, Pavel Doležal, Courtney W. Stairs, Andrew J. Roger, Marek Eliáš, Joel B. Dacks, Čestmír Vlček, Vladimír Hampl: A Eukaryote without a Mitochondrial Organelle. In: Current Biology. 26, Nr. 10, 2016, ISSN 0960-9822, S. 1274–1284. doi:10.1016/j.cub.2016.03.053. PMID 27185558.
- Davis, Josh L.: Scientists Shocked to Discover Eukaryote With NO Mitochondria. In: IFL Science. 13. Mai 2016. Abgerufen am 9. April 2019.
- Julian Vosseberg, Jolien J. E. van Hooff, Marina Marcet-Houben, Anne van Vlimmeren, Leny M. van Wijk, Toni Gabaldón, Berend Snel: Timing the origin of eukaryotic cellular complexity with ancient duplications, in: Nature Ecology & Evolution, 26. Oktober 2020, doi:10.1038/s41559-020-01320-z, dazu:
Timeline Unveiled for One of the Most Important and Puzzling Events in the Evolution of Life, auf: SciTechDaily vom 4. November 2020, Quelle: Institute for Research in Biomedicine (IRB Barcelona) – ‚Bakterien‘ ist hier im Sinn von ‚Prokaryoten‘ zu verstehen. - A. D. Tsaousis et al.: The Blastocystis Mitochondrion-like Organelles. In: Anaerobic Parasitic Protozoa: Genomics and Molecular Biology. Caister Academic Press, 2010, ISBN 978-1-904455-61-5, S. 205–19.
- W. Probst, Europa-Universität Flensburg, §Pflanzentiere und Kleptoplasten
- Henrike Semmler, Xavier Bailly, Andreas Wanninger: Myogenesis in the basal bilaterian Symsagittifera roscoffensis (Acoela) Myogenesis in the basal bilaterian Symsagittifera roscoffensis (Acoela). In: Frontiers in Zoology. 5, September 2008, S. 14. doi:10.1186/1742-9994-5-14. PMID 18803837. PMC 2562460 (freier Volltext).
- W. Reisser (Hrsg.): Algae and Symbiosis: Plants, Animals, Fungi, Viruses, Interactions Explored, Biopress Ltd 1. Mai 1992, Lubrecht & Cramer Ltd 1. Juni 1992, ISBN 0-948737-15-8
- Aditee Mitra: Meeresbiologie – Das Beste aus zwei Welten, Spektrum der Wissenschaft, April 2019, S. 54–60, hier S. 57
- Charles F. Delwiche: Tracing the Thread of Plastid Diversity Through the Tapestry of Life. In: The American Naturalist. Vol. 154, Supplement: .Evolutionary Relationships Among Eukaryotes. Okt 1999, S. S164-S177. PMID 10527925. doi:10.1086/303291. (online)
- N. Gordon, D. L. Angel, A. Neori, N. Kress, B. Kimor: Heterotrophic dinoflagellates with symbiotic cyanobacteria and nitrogen limitation in the Gulf of Aqaba. In: Marine Ecology Progress Series. 107, 1994, S. 83–88. doi:10.3354/meps107083.
- R. Jyothibabu, N. V. Madhu P. A. Maheswaran, C. R. A. Devi, T. Balasubramanian, K. K. C. Nair, C. T. Achuthankutty: Environmentally-related seasonal variation in symbiotic associations of heterotrophic dinoflagellates with cyanobacteria in the western Bay of Bengal (en) 1. Januar 2006.
- Sven Janson, Edward J. Carpenter, Birgitta Bergman: Immunolabelling of phycoerythrin, ribulose 1,5-bisphosphate carboxylase/oxygenase and nitrogenase in the unicellular cyanobionts of Ornithocercus spp. (Dinophyceae). In: Phycologia. 34, Nr. 2, 1. März 1995, S. 171–176. doi:10.2216/i0031-8884-34-2-171.1.
- Jon S. Graf, Sina Schorn, Katharina Kitzinger, Soeren Ahmerkamp, Christian Woehle, Bruno Huettel, Carsten J. Schubert, Marcel M. M. Kuypers, Jana Milucka: Anaerobic endosymbiont generates energy for ciliate host by denitrification, in: Nature, 3. März 2021, doi:10.1038/s41586-021-03297-6. Dazu:
- Neue Form der Symbiose entdeckt, Max-Planck-lnstitut für Marine Mikrobiologie, Pressemitteilung vom 3. März 2021 (deutsch)
- Neue Form der Symbiose entdeckt, auf: EurekAlert! vom 3. März 2021 (deutsch), New form of symbiosis discovered (englisch)
- “Unprecedented” New Form of Symbiosis Discovered, auf: SciTechDaily vom 3. März 2021. Quelle: MPI für Marine Microbiologie (englisch)
- Martin Vieweg: Partnerschaft der besonderen Art: Neue Symbiose-Form entdeckt, auf wissenschaft.de vom 3. März 2021 (deutsch)
- W. Probst, Europa-Universität Flensburg, §Auf dem Weg zur Chloroplastenbildung
- W. Probst, Europa-Universität Flensburg, §„Verdauungsendosymbiosen“
- John P. McCutcheon, Carol D. von Dohlen: An Interdependent Metabolic Patchwork in the Nested Symbiosis of Mealybugs. Current Biology 21 (16), S. 1366-1372, doi:10.1016/j.cub.2011.06.051. PMC 3169327 (freier Volltext). Zitat: „an unnamed Gammaproteobacteria, for which we propose the name Candidatus Moranella endobia, lives inside the Betaproteobacteria Candidatus Tremblaya princeps“: eine sekundäre Endosymbiose also.
- Nick Lane: Der Funke des Lebens - Energie und Evolution, Konrad Theiss Verlag, (C) 2017 by WBG, ISBN 978-3-8062-3484-8. Englischer Originaltitel: Nick Lane: The Vital Question - Energy, Evolution, and the Origins of Complex Life, Ww Norton, 2015-07-20, ISBN 978-0-393-08881-6, PDF (Memento des Originals vom 10. September 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Textpassagen nahe Abbildung/Figure 10. (Struktur der ATP-Synthase)
- E. Hilario, J. P. Gogarten: Horizontal transfer of ATPase genes--the tree of life becomes a net of life, in: Biosystems. 1993;31(2-3): S. 111-119. PMID 8155843