Ortho- und Parawasserstoff
Ortho- und Parawasserstoff (kurz o‑H2 und p‑H2) sind zwei Formen des Diwasserstoff-Moleküls, die sich in der Symmetrie ihrer Kernspinkonfiguration und Rotationszustände unterscheiden. Obwohl sie die gleiche chemische Struktur haben, weisen sie teilweise verschiedene physikalische Eigenschaften auf. Wasserstoff ist im Allgemeinen ein Gemisch aus beiden Spezies; das Mischungsverhältnis im thermodynamischen Gleichgewicht ist dabei von der Temperatur abhängig.
Die Existenz der beiden Formen muss z. B. bei der Verflüssigung von Wasserstoff berücksichtigt werden, insbesondere, wenn dieser als Raketentreibstoff genutzt werden soll. Zudem kann die Symmetrieordnung von Parawasserstoff für die Signalverstärkung der Kernspinresonanz (Hyperpolarisierung), für Kernspinresonanzspektroskopie (NMR) und Magnetresonanztomographie (MRT) genutzt werden.
Physikalische Grundlagen
Der Kern eines Wasserstoffatoms ist ein einfaches Proton (wenn man die schwereren Isotope Deuterium und Tritium vernachlässigt, die zusammen einen Anteil von weniger als 0,02 % haben). Das Proton hat einen Spin mit dem Wert , der zwei verschiedene Zustände annehmen kann: nach „oben“ und nach „unten“ .
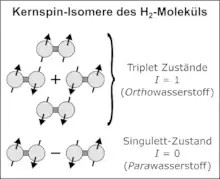
Der Kernspin hat normalerweise nur einen sehr kleinen Einfluss auf das jeweilige Atom und Molekül (in der Größenordnung von maximal einigen µeV, siehe Hyperfeinstruktur). Im Fall von H2 kommt aber noch ein spezieller quantenmechanischer Effekt hinzu: Die beiden Protonen sind ununterscheidbare Teilchen, deshalb muss man sie als Gesamtheit betrachten. Nach den quantenmechanischen Regeln für den Drehimpuls koppeln die beiden Kernspins zu einem Gesamtspin , der die Werte 0 und 1 annehmen kann. Insgesamt gibt es vier Eigenzustände der Kernspin-Wellenfunktion: drei Triplett-Zustände mit und magnetischen Spinquantenzahlen sowie einen Singulett-Zustand mit und . Die drei Triplett-Zustände sind symmetrisch und werden Ortho-Zustände genannt (Orthowasserstoff, kurz o‑H2); der Singulett-Zustand ist antisymmetrisch und wird auch Para-Zustand genannt (Parawasserstoff, kurz p‑H2). In der Dirac-Notation schreiben sich die vier Eigenzustände so:
Da Wasserstoffkerne Spin-1⁄2-Teilchen sind, folgen sie der Fermi-Dirac-Statistik. Das bedeutet, dass der quantenmechanische Zustand des ganzen Wasserstoffmoleküls antisymmetrisch bezüglich einer Vertauschung der beiden Protonen sein muss (Pauli-Prinzip). Dazu muss die Gesamt-Wellenfunktion der beiden Kerne antisymmetrisch sein. Diese ist als Produkt aus Orts- und Spin-Wellenfunktion der beiden Protonen des H2-Moleküls darstellbar und genau dann antisymmetrisch, wenn einer der beiden Faktoren des Produkts antisymmetrisch ist und der andere symmetrisch. Der Spinanteil ist, wie aus den oben angegebenen Wellenfunktionen deutlich wird, beim Ortho-Wasserstoff symmetrisch, beim Para-Wasserstoff antisymmetrisch. Für die Symmetrie der Ortswellenfunktion ist die Rotationsquantenzahl J maßgeblich,[1] die einem Bahndrehimpuls entspricht. Bei geradem J ist die Ortswellenfunktion symmetrisch, bei ungeradem J antisymmetrisch. Bei p‑H2 ist daher J gerade, der niedrigstmögliche Wert ist J = 0. Bei o‑H2 ist J ungerade, der niedrigstmögliche Wert ist J = 1. Die Rotationsenergie des H2-Moleküls ist proportional zu J·(J+1), somit ist der niedrigste Energiezustand von o‑H2 größer als von p‑H2. Der Unterschied beträgt 1,455 kJ/mol (≙ 15,1 meV, ≙ 175 K).[2]
Im Allgemeinen ist Wasserstoff ein Gemisch aus o‑H2 und p‑H2 (bzw. aller vier Kernspin-Eigenzustände); die temperaturabhängige Gleichgewichtsverteilung genügt dabei der Boltzmann-Statistik. Das temperaturabhängige Gleichgewichtsverhältnis von o‑H2/p‑H2 wird beschrieben durch
- ,
wobei Θr = h·c·B/k die Rotationstemperatur ist mit der Rotationskonstanten B. Die Faktoren 3 und 1 in Zähler und Nenner entsprechen der Multiplizität der Kernspin-Zustände (3 bei Ortho- und 1 bei Parawasserstoff); die Faktoren 2J + 1 sind die Multiplizität der einzelnen J-Zustände.
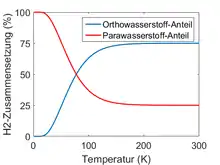
Bei hohen Temperaturen sind viele J-Zustände besetzt, der Grenzwert ist dann und entspricht einer Gleichverteilung der vier Kernspin-Zustände (75 % o‑H2 und 25 % p‑H2). Bei Raumtemperatur ist dieses Verhältnis schon nahezu erreicht. Bei niedrigen Temperaturen hingegen werden nur noch Energieniveaus mit sehr kleinem J besetzt, der Energieunterschied zwischen o‑H2 mit J = 1 und p‑H2 mit J = 0 wirkt sich immer stärker aus. Bei der 77 K (flüssiger Stickstoff) beträgt der Anteil von p-H2 52 %, bei 21 K (flüssiger Wasserstoff) 99,8 %.[3] Im Grenzfall T → 0 K gilt , denn dann ist nur noch der niedrigste Rotationsniveau J = 0 besetzt, und der Anteil von p‑H2 beträgt 100 %.
Physikalische Eigenschaften
Der Übergang o‑H2 → p‑H2 + hν ist als „verbotener Übergang“ stark unterdrückt; isoliertes o‑H2 hat eine Lebensdauer von mindestens mehreren Jahrhunderten.[4] Auch bei normalem Druck und nicht zu hoher Temperatur in der Gasphase hat der Übergang durch die Reaktion H + o‑H2 → H + p‑H2 eine Halbwertszeit von mehreren Jahren.[2] Entsprechend langsam verläuft die Umwandlung, also die Annäherung an die Gleichgewichtsverteilung. Dieser Prozess kann jedoch mit homogener sowie heterogener Katalyse, etwa mit Aktivkohle oder para- oder ferromagnetischen Materialien, beschleunigt werden.[3][5][6][7]
Ortho- und Parawasserstoff unterscheiden sich in einigen grundlegenden physikalischen Eigenschaften. So weisen sie deutlich verschiedene Wärmekapazitäten, aber auch abweichende elektrische Leitfähigkeiten sowie verschiedene Temperaturabhängigkeiten dieser zwei Größen auf. Außerdem ist o‑H2 mit der Methode der Kernspinresonanz (NMR) messbar, während p‑H2 mit Gesamtspin I = 0 „NMR-unsichtbar“ ist. Abgesehen hiervon sind die physikalischen Eigenschaften nur geringfügig verschieden. Beispielsweise liegen der Schmelz- und der Siedepunkt der para-Form etwa 0,1 K unter denen der ortho-Form.[8][9]
Geschichte
Das Verhalten der spezifischen Wärme von Wasserstoff, insbesondere bei tiefen Temperaturen, blieb lange Zeit ungeklärt. 1912 hatte Arnold Eucken den Abfall des Rotationsanteils der spezifischen Wärme beim gasförmigen Wasserstoff zwischen 300 und 60 Kelvin beobachtet, was damals theoretisch nicht erklärt werden konnte. Ebenso hatte Reinhard Mecke um 1922 einen Intensitätswechsel im Verhältnis 1:3 in den Bandenspektren zweiatomiger Moleküle mit identischen Atomen entdeckt. Erst nach der Entwicklung der Quantenmechanik konnte Werner Heisenberg 1926 zeigen, dass die zwei Spin-Isomere des H2-Moleküls ursächlich dafür sind, wobei er in Analogie zu den Elektronen beim Ortho- und Para-Helium vorging. Der experimentelle Nachweis der zwei Isomere gelang 1929 Karl Friedrich Bonhoeffer und Paul Harteck am Kaiser-Wilhelm-Institut für physikalische Chemie und Elektrochemie in Berlin-Dahlem.[2] Heisenberg wurde später „für die Erschaffung der Quantenmechanik, deren Anwendung, unter anderem, zur Entdeckung der verschiedenen Formen des Wasserstoffs geführt hat“ mit dem Nobelpreis für Physik ausgezeichnet.[10][11]
Anwendungen
Herstellung und Lagerung von flüssigem Wasserstoff
Da der Grundzustand des Parawasserstoffs energetisch tiefer liegt als der des Orthowasserstoffs, wird die Energiedifferenz bei der Ortho-para-Umwandlung in Form von Wärme frei. Wie oben erwähnt, ist die Umwandlung jedoch langsam, wodurch sie beim Abkühlen und Verflüssigen (≈ 21 K) unter normalen Bedingungen zeitverzögert abläuft. Die frei werdende Energie (Umwandlungsenthalpie) ist mit 1091 J/mol (3⁄4 der Umwandlungsenthalpie für 100 % o‑H2) größer als die Verdampfungsenthalpie (904 J/mol), die notwendig ist, um flüssigen Wasserstoff in den gasförmigen Zustand zu überführen.[2] Daher verdampft aufgrund der ortho-para-Umwandlung auch bei vollkommener Wärmeisolierung ein signifikanter Teil des flüssigen Wasserstoffs, wenn bei der Verflüssigung nicht entsprechende Vorkehrungen getroffen werden. Bei der industriellen Herstellung von flüssigem Wasserstoff wird die Umwandlung beim Abkühlen daher noch in der Gasphase katalytisch beschleunigt.[12][13]
Raketenantrieb
Flüssiger Wasserstoff wird als Raketentreibstoff bei Wasserstoff-Sauerstoff-basierten Raketentechnologien verwendet, wodurch größere Mengen H2 mitgeführt werden können. Auch hier wäre eine beschleunigte Verdampfung durch die o‑H2-p‑H2-Umwandlung unerwünscht, weshalb flüssiger Wasserstoff im thermischen Gleichgewicht getankt wird.[12]
Parawasserstoff bei NMR und MRT
Angereicherter Parawasserstoff wird in Chemie und Medizin genutzt, um das Kernspinresonanzsignal (Messgröße der NMR und MRT) um mehrere Größenordnungen zu verstärken (Hyperpolarisierung).[14] Dabei wird der reine Zustand genutzt, um die Spin-Ordnung auf ein Zielmolekül zu übertragen. Der Effekt wurde von Bowers und Weitekamp entdeckt und „PASADENA“ (engl. Parahydrogen And Synthesis Allow Dramatically Enhanced Nuclear Alignment) genannt.[15] Heute wird die Methode häufig als „PHIP“ (engl. ParaHydrogen Induced Polarization) bezeichnet. Die Methode wurde verwendet, um Abläufe von Hydrierungsreaktionen zu untersuchen. Aktuelle Forschungen zielen auf die Entwicklung von neuartigen MRT-Kontrastmitteln ab.[16][6]
Ortho- und Parawasser
Wie beim H2-Molekül kann man auch beim Wassermolekül (H2O) einen Ortho- und einen Para-Zustand unterscheiden, je nachdem, ob die Spins der Wasserstoffkerne parallel oder antiparallel sind. (Der Sauerstoffkern hat, außer im Fall des sehr seltenen Isotops 17O, keinen Spin.) Auch hier sind die Rotationszustände des Moleküls mit dem Kernspin verknüpft: Der Grundzustand von Para-Wasser hat die Rotationsquantenzahl j = 0, der von Ortho-Wasser die Rotationsquantenzahl j = 1. Para- und Ortho-Wasser konnten getrennt werden, indem ein H2O-Molekularstrahl einem starken elektrischen Feld ausgesetzt wurde.[17][18] Dabei konnte nachgewiesen werden, dass die beiden Formen des Wassers unterschiedliche chemische Eigenschaften haben: Die Reaktion mit dem Diazenylium-Ion
verläuft bei Para-Wasser um 23 ± 9 % schneller als bei Ortho-Wasser.[18]
Siehe auch
Heliumatom#Ortho- und Parahelium mit analogen Zuständen der Elektronenspins im Heliumatom
Einzelnachweise
- Vibrationszustände spielen hier keine Rolle, weil sie erst bei deutlich höheren Temperatur angeregt werden. Schon der erste Vibrationszustand hat eine Energie von 516 meV (entsprechend 5980 K).
- Die Entdeckung des para-Wasserstoffs. In: mpibpc.mpg.de. Max-Planck-Institut für biophysikalische Chemie.
- Parahydrogen, University of York, Centre for Hyperpolarisation in zmagnetic Resonance, abgerufen am 30. Aug. 2021
- Robert R. Reeves, Paul Harteck: Ortho and Parahydrogen in Interstellar Material. In: Z. Naturforsch. Nr. 34a, 1979, S. 163–166.
- Clifford R. Bowers: Sensitivity Enhancement Utilizing Parahydrogen. In: eMagRes. John Wiley & Sons, Ltd., New York 2007, ISBN 978-0-470-03459-0, doi:10.1002/9780470034590.emrstm0489.
- Johannes Natterer, Joachim Bargon: Parahydrogen induced polarization. In: Progress in Nuclear Magnetic Resonance Spectroscopy. Band 31, Nr. 4, November 1997, ISSN 0079-6565, S. 293–315, doi:10.1016/S0079-6565(97)00007-1.
- D. H. Weitzel et al., Ortho-Para Catalysis in Liquid Hydrogen Production, Journal of Research of the National Bureau of Standards, Vol.60 No. 3, März 1958
- Adalbert Farkas: Orthohydrogen, parahydrogen and heavy hydrogen. University Press, Cambridge 1935, DNB 362436835.
- J. Hord u. a.: Selected Properties of Hydrogen (Engineering Design Data). (Memento vom 20. Februar 2017 im Internet Archive). (PDF; 16,3 MB).
- Important Scientists. Werner Heisenberg (1901–1976). In: physicsoftheuniverse.com. Abgerufen am 16. August 2016.
- Manne Siegbahn: The Physics Prize. In: Nobel Foundation: Nobel: The Man and His Prizes. (New York: Elsevier Publishing co., 1962), S. 492–497.
- N. Getoff: Wasserstoff als Energieträger: Herstellung, Lagerung, Transport. Springer-Verlag, 2013, ISBN 978-3-7091-7694-8.
- A. H. Larsen, F. E. Simon, C. A. Swenson: The Rate of Evaporation of Liquid Hydrogen Due to the Ortho‐Para Hydrogen Conversion. In: Rev. Sci. Instrum. 19, 266 (1948); doi:10.1063/1.1741241.
- J.-B. Hövener u. a.: A continuous-flow, high-throughput, high-pressure parahydrogen converter for hyperpolarization in a clinical setting. In: NMR in Biomedicine. Februar 2013, Band 26, Nr. 2, S. 124–131. doi: 10.1002/nbm.2827.
- C. Russell Bowers, Daniel P. Weitekamp: Transformation of Symmetrization Order to Nuclear-Spin Magnetization by Chemical Reaction and Nuclear Magnetic Resonance. In: Physical Review Letters. Band 57, Nr. 21, November 1986, S. 2645–2648, doi:10.1103/PhysRevLett.57.2645.
- Scharfe Bilder mit dem Erdmagnetfeld. Archiviert vom Original am 14. August 2016; abgerufen am 14. August 2016.
- Daniel A. Horke, Yuan-Pin Chang, Karol Długołecki und Jochen Küpper: Trennung von para- und ortho-Wasser. In: Angewandte Chemie. 2015, 126, S. 12159–12162, doi:10.1002/ange.201405986.
- Ardita Kilaj, Hong Gao, Daniel Rösch, Uxia Rivero, Jochen Küpper & Stefan Willitsch: Observation of different reactivities of para and ortho-water towards trapped diazenylium ions. In: Nature Communications. 2018, 9, S. 2096, doi:10.1038/s41467-018-04483-3.