Cobalt(II)-chlorid
Cobalt(II)-chlorid ist eine chemische Verbindung von Cobalt und Chlor. Es ist ein im wasserfreien Zustand blaues, als Hexahydrat rosafarbenes Salz.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
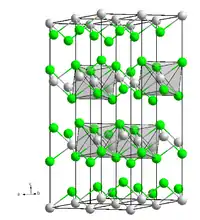 | ||||||||||||||||||||||
| _ Co2+ _ Cl− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cobalt(II)-chlorid | |||||||||||||||||||||
| Andere Namen |
Cobaltdichlorid | |||||||||||||||||||||
| Verhältnisformel | CoCl2 | |||||||||||||||||||||
| Kurzbeschreibung |
blauer kristalliner Feststoff (wasserfrei), als Hexahydrat rot-violetter Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 129,84 g·mol−1 (wasserfrei)
237,93 g·mol−1 (Hexahydrat) | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
3,356 g·cm−3 [1] | |||||||||||||||||||||
| Schmelzpunkt |
735 °C [1] | |||||||||||||||||||||
| Siedepunkt |
1049 °C [1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||||||||
| MAK |
nicht festgelegt, da krebserregend[1] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Cobalt(II)-chlorid lässt sich aus den Elementen oder durch Erhitzen des Hexahydrates in Gegenwart von Thionylchlorid oder Phosgen oder im Chlorwasserstoffstrom gewinnen.[2]
Letzteres kann wiederum durch Reaktion von Cobalt(II)-hydroxid oder Cobalt(II)-carbonat mit Salzsäure gewonnen werden.
Ebenfalls möglich ist die Darstellung aus Cobalt(II)-acetat-Tetrahydrat und Acetylchlorid.[2]
Eigenschaften
Wasserfreies Cobalt(II)-chlorid ist sehr hygroskopisch und nimmt leicht Wasser auf. Dabei ändert es sehr charakteristisch seine Farbe von blau nach rosa. Der entgegengesetzte Farbwechsel von rosa auf blau ist ebenfalls möglich, indem man das Hexahydrat auf Temperaturen oberhalb 35 °C erhitzt.[6] Der Farbwechsel ist von der Hydratform abhängig. Das Anhydrat hat eine blaue Farbe, das Hexahydrat rosa, das Monohydrat blauviolett, das Monohemihydrat dunkelblauviolett, das Dihydrat rosaviolett, das Tetrahydrat pfirsichblütenrot.[1]
_chloride.jpg.webp) Cobalt(II)-chlorid (wasserfrei)
Cobalt(II)-chlorid (wasserfrei)-chloride-hexahydrate-sample.jpg.webp) Cobalt(II)-chlorid-Hexahydrat
Cobalt(II)-chlorid-Hexahydrat
Es sublimiert in Chlorwasserstoff-Atmosphäre bei 500 °C zu lockeren Kristallflittern. Seine Kristallstruktur ist trigonal und entspricht der von Cadmium(II)-chlorid mit der Raumgruppe R3m (Nr. 166) (a = 354,4 pm, c = 1743 pm).[2]
Verwendung
Wegen des typischen Farbwechsels diente es als Feuchtigkeits-Indikator in Trockenmitteln wie etwa Kieselgel. Mit Hilfe von Cobalt(II)-chlorid lässt sich Wasser auch in anderen Lösungen nachweisen.
Auch wird es als so genannte Geheimtinte benutzt, da es als Hexahydrat in wässriger Lösung auf dem Papier kaum sichtbar ist, wenn es aber erhitzt wird (z. B. über einer Kerze), tritt tiefblaue Schrift hervor. Des Weiteren kann es als Zusatz zum Elektrolyten (Schwefelsäure) von Bleiakkumulatoren genutzt werden, um die Batterielebensdauer und Leistung zu erhöhen. Die früher hergestellten Blitzlichtbirnen enthielten innen einen kleinen blauen Punkt aus Cobalt(II)-chlorid, der anzeigte, dass die Birne in Ordnung war. Wurde die Birne undicht, zog sie Luft und damit auch Feuchtigkeit an und der Punkt änderte seine Farbe nach rosa als Zeichen dafür, dass die Birne defekt ist. Der blaue Punkt in Blitzbirnen wurde erstmals 1937 von einer amerikanischen Firma verwendet, die dafür auch ein Patent erhielt.[7]
 Kieselgel (Blaugel) enthält als Farbindikator Cobalt(II)-chlorid (trocken = blau).
Kieselgel (Blaugel) enthält als Farbindikator Cobalt(II)-chlorid (trocken = blau). Feuchtes Kieselgel ist rosa – es hat sich Cobalt(II)-chlorid-Hexahydrat gebildet.
Feuchtes Kieselgel ist rosa – es hat sich Cobalt(II)-chlorid-Hexahydrat gebildet.
Des Weiteren wird Cobalt(II)-chlorid in der Zellkultur verwendet um Sauerstoffmangel nachzuahmen.[8] Dies ist in der Krebsforschung von Bedeutung, da vermutet wird, dass Sauerstoffmangel die Entstehung und Ausbreitung von Tumoren fördert. In Brustkrebszellen kommt es dabei zu einer vermehrten Expression von den Proteinen HIF-1α, CXCR4 und VEGF.[9]
Sicherheitshinweise
Cobalt(II)-chlorid gilt als krebserzeugend sowie fruchtschädigend und ist möglicherweise erbgutverändernd. Der Stoff wurde am 28. Oktober 2008 in die Kandidatenliste der besonders besorgniserregenden Stoffe aufgenommen. Der Eintrag wurde am 20. Juni 2011 um die fortpflanzungsgefährdenden Eigenschaften ergänzt.[10]
Cobalt(II)-chlorid ist außerdem (wie alle wasserlöslichen Verbindungen und das Metall) ein Kontaktallergen.[11]
Cobalt(II)-chlorid fördert die Produktion von Erythrozyten. Es besteht daher Sorge, dass Cobalt(II)-chlorid im Sport als Dopingsubstanz missbraucht wird.[12]
Einzelnachweise
- Eintrag zu Cobalt(II)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band III. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1660.
- Eintrag zu Cobalt dichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 6. Dezember 2019.
- G.J.A. Speijers, E.I. Krajnc, J.M. Berkvens, M.J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats. In: Food and Chemical Toxicology. Band 20, Nr. 3, Juni 1982, S. 311–314, doi:10.1016/S0278-6915(82)80298-6.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1685.
- Deutsches Kameramuseum: Vom Pulverblitz zum Elektronenblitz, abgerufen am 10. Januar 2021.
- S. Li, J. Zhang, H. Yang, C. Wu, X. Dang, Y. Liu: Copper depletion inhibits CoCl2-induced aggressive phenotype of MCF-7 cells via downregulation of HIF-1 and inhibition of Snail/Twist-mediated epithelial-mesenchymal transition. In: Sci Rep. 5, 2015, S. 12410. doi:10.1038/srep12410
- Q. Li, R. Ma, M. Zhang: CoCl2 increases the expression of hypoxic markers HIF-1α, VEGF and CXCR4 in breast cancer MCF-7 cells. In: Oncol Lett. 15(1), 2018, S. 1119–1124. doi:10.3892/ol.2017.7369
- Kobaltdichlorid. in der REACH-CLP Helpdesk der Bundesbehörden, Abgerufen am 16. November 2019.
- K. A. Zug, E. M. Warshaw, J. F. Fowler Jr, H. I. Maibach, D. L. Belsito, M. D. Pratt, D. Sasseville, F. J. Storrs, J. S. Taylor, C. G. Mathias, V. A. Deleo, R. L. Rietschel, J. Marks: Patch-test results of the North American Contact Dermatitis Group 2005–2006. In: Dermatitis. 20(3), 2009, S. 149–160.
- Wolfgang Jelkmann: The Disparate Roles of Cobalt in Erythropoiesis, and Doping Relevance. In: Open Journal of Hematology. Band 3, 2012, ISSN 2075-907X, S. 3–6, doi:10.13055/ojhmt_3_1_6.121211.



