Schweres Wasser
Schweres Wasser (Deuteriumoxid) ist chemisch gesehen Wasser mit der Summenformel D2O. Von herkömmlichen Wasser H2O, das in diesem Zusammenhang auch als „leichtes Wasser“ bezeichnet wird, unterscheidet es sich dadurch, dass die normalen Wasserstoffatome des Isotops Protium (Symbol H) durch schwere Wasserstoffatome des Isotops Deuterium (Symbol D) ersetzt wurden. Protium hat nur ein Proton im Atomkern, Deuterium hingegen ein Proton und ein Neutron. Dementsprechend sind Molekülmasse und Dichte des schweren Wassers höher als die des gewöhnlichen Wassers.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
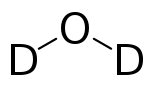 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Schweres Wasser | |||||||||||||||
| Andere Namen |
Deuteriumoxid | |||||||||||||||
| Summenformel | D2O (2H2O) | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 20,0286 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,107 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
101,4 °C[1] | |||||||||||||||
| Brechungsindex |
1,328 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Halbschweres Wasser (Hydrodeuteriumoxid) mit der Summenformel HDO enthält hingegen ein normales und ein schweres Wasserstoffatom. Es kommt in der Natur statistisch gesehen viel häufiger vor als schweres Wasser. Auf der Erde findet sich etwa ein Deuteriumatom auf etwa 7000 Wasserstoffatome (in Schnee bzw. Regenwasser 1:9000, in Seewasser mit hohem Salzgehalt 1:5500).
Überschweres Wasser (Tritiumoxid) mit der Summenformel T2O enthält Tritium (Symbol T) anstelle von normalem Wasserstoff.
Gewinnung
Schweres Wasser wird durch Anreicherung aus herkömmlichem Wasser gewonnen, in dem es in geringer Menge vorkommt. Wird Wasser elektrolysiert, bleibt das schwere Wasser eher unzersetzt zurück (kinetischer Isotopeneffekt), während leichtes Wasser in Wasserstoff und Sauerstoff gespalten wird. Eine Anreicherung ist auch der Girdler-Sulfid-Prozess.
Ein anderes Verfahren verläuft über die Destillation von Ammoniak oder Schwefelwasserstoff. Ausgangsmaterial sind bevorzugt Abwässer aus Galvanikbetrieben und der Herstellung von Wasserstoff durch Elektrolyse, da diese durch die bevorzugte Elektrolyse von leichtem Wasser schon signifikant mit HDO angereichert sind.
Eigenschaften
Schweres Wasser ist weniger reaktionsfähig als normales Wasser und hat eine niedrigere Lösefähigkeit. Die Ursache ist die höhere Kernmasse des Deuteriums. Dadurch haben die Molekülschwingungen eine niedrigere Frequenz, und die Nullpunktenergien dieser Schwingungen liegen niedriger als bei leichtem Wasser. Bei einer Streckschwingung macht der Effekt etwa 125 meV oder 5 kBT bei Raumtemperatur aus. Als Folge davon erfordert die Dissoziation von schwerem Wasser, die für viele biochemische Reaktionen Voraussetzung ist, mehr Energie, und kann stark verlangsamt sein. Neben der Dissoziation wird auch die Ausbildung von Wasserstoffbrückenbindungen, wie sie ebenfalls in biochemischen Systemen von essentieller Bedeutung sind, beeinflusst. Auf Grund des „dynamischen Isotopeneffektes“ ist in der Flüssigkeit die translatorische und rotatorische Beweglichkeit der schweren Wassermoleküle etwas geringer als die der leichten Wassermoleküle.[2] Bei 25 °C ist z. B. der Selbstdiffusionskoeffizient des schweren Wassers um 23 % geringer als der von leichtem Wasser.
Durch diese unterschiedlichen Eigenschaften wirkt schweres Wasser auf die meisten Organismen leicht giftig. Experimente mit Mäusen zeigten, dass die Zellteilung (Mitose) unterdrückt wird. Dadurch wird Gewebe, das schnell erneuert werden muss (z. B. Magenwand), bei fortgesetzter Einnahme von schwerem Wasser in Mitleidenschaft gezogen. Diese Effekte wurden sichtbar, als man Mäusen etwa 50 Prozent ihres Körperwassers durch schweres Wasser ersetzt hatte. Aggressive Krebserkrankungen sollten zwar auch gebremst werden; der Nutzen einer Therapie mit schwerem Wasser würde aber die Nebenwirkungen wahrscheinlich nicht aufwiegen.
Laut einem kurzen Beitrag von Urey und Failla von 1935 sollte sich der Geschmack von schwerem Wasser von dem destillierten „normalen“ Wassers nicht unterscheiden.[3] Neuere Experimente konnten jedoch zeigen, dass schweres Wasser für Menschen einen süßlichen Geschmack hat.[4]
| Wasser | |||||||
|---|---|---|---|---|---|---|---|
| Normales (H2O) |
Halbschweres (HDO) |
Schweres (D2O) |
Überschweres (T2O) |
H217O | H218O | D218O | |
| Molmasse (g/mol) | 18,0153 | 19,017 | 20,0286 | 22,031 | 19,015 | 20,015 | 22,03 |
| Schmelzpunkt-Temperatur[5][6] | 0,00 °C | 2,04 °C | 3,82 °C | 4,49 °C | 0,28 °C | 3,8 °C | |
| Siedepunkt (bei Normaldruck)[5] | 99,97 °C | 100,74 °C | 101,40 °C | 101,51 °C | 100,08 °C | 100,15 °C | 101,4 °C |
| Maximale Dichte bei[5][6] | 3,98 °C | 2,04 °C | 11,24 °C | 13,40 °C | 4,30 °C | ||
| Maximale Dichte (g/cm³)[6] | 0,999975 | 1,1053 | 1,21501 | 1,111249 | |||
| pKw-Wert bei 25 °C[6] | 13,995 | 14,869 | 15,216 | ||||
| Neutralpunkt[7] | pH 7,00 | pH 7,43 | pH 7,61 | ||||
Die höhere Dichte von Eis aus schwerem Wasser lässt einen Schwerwasser-Eiswürfel in normalem Wasser (flüssig) absinken.[8] In Wasser (H2O) von z. B. 2 °C schmilzt ein D2O-Eiswürfel nicht, kann jedoch durch Diffusion in der flüssigen Phase aufgelöst werden.
Mischung mit normalem und halbschwerem Wasser
Durch den Grotthuß-Mechanismus tauschen Wassermoleküle untereinander Wasserstoffionen aus. Daher bildet sich beim Mischen von gleichen Mengen H2O und D2O eine statistische Verteilung aus, die zu 50 % aus HDO und je 25 % aus H2O und D2O besteht. Aus dem gleichen Grund kann es keine Flüssigkeit geben, die nur aus HDO-Molekülen besteht.
Verwendung
Schweres Wasser wird in Schwerwasserreaktoren (zum Beispiel Reaktoren des Typs Candu) als Moderator und Kühlmittel eingesetzt, da es im Vergleich zu gewöhnlichem Wasser bei ähnlicher Moderationswirkung erheblich weniger Neutronen absorbiert. Dadurch kann im Reaktor Natur-Uran verwendet und auf die sonst notwendige Anreicherung verzichtet werden.
Das Deuteron ist zwar NMR-aktiv, taucht aber aufgrund der grob abweichenden Frequenz in H-NMR-Spektren nicht auf. Zugabe von etwas schwerem Wasser lässt daher Linien im Spektrum einer Probe verschwinden, die von H-Atomen stammen, welche innerhalb der Relaxationszeit vielmals mit dem Lösungsmittel ausgetauscht werden.
Entsprechend kann wegen der abweichenden Schwingungsfrequenzen schweres Wasser vorteilhaft in Schwingungsspektroskopie von wasserstoffhaltigen Substanzen in wässriger Lösung benutzt werden.
Weiterhin wird schweres Wasser zur gezielten chemischen Synthese von Verbindungen verwendet, entweder um Deuterium in das Produkt einzubringen, oder um eine Konkurrenzreaktion, in der H bzw. D übertragen wird, abzuschwächen.
Da niedere Organismen auch in reinem schwerem Wasser überleben können, gelingt es, aus solchen Organismen hochkomplexe Naturstoffe zu isolieren, bei denen alle Wasserstoffatome durch Deuterium ersetzt sind.
Kampf um schweres Wasser im Zweiten Weltkrieg

In den Kriegsjahren 1942 bis 1945 wurde das südnorwegische Rjukan in der Provinz Telemark Schauplatz einer brisanten Auseinandersetzung. Dort befand sich seit 1934 im Chemie- und Wasserkraftwerk Vemork die einzige europäische Fabrik (Norsk Hydro), die durch ihren immensen Energieüberschuss schweres Wasser in nennenswerten Mengen herstellen konnte. Durch einen geschickten Schachzug kamen die Franzosen den Deutschen zuvor und sicherten sich zunächst die gesamten Lagerbestände von über 160 kg, die nach dem Einmarsch deutscher Truppen in Frankreich vom französischen Kernphysiker Hans von Halban auf Umwegen über Großbritannien in die Vereinigten Staaten gebracht wurden.
Ende der 1930er Jahre hatten Otto Hahn, Fritz Straßmann und Lise Meitner das Prinzip der nuklearen Kettenreaktion entdeckt, woraus sich nach dem Ausbruch des Zweiten Weltkriegs ein Wettlauf mit den Alliierten um die Kontrolle über die Fabrik entwickelte. Für das deutsche Uranprojekt war dabei die Verwendung von schwerem Wasser als Moderator eines Versuchsreaktors vorgesehen, mit dem unter anderem waffenfähiges Plutonium hätte hergestellt werden können.
Somit richtete sich das Augenmerk der Alliierten auf die Anlage in Rjukan, deren Ausschaltung die deutsche Nuklearforschung auf einen Schlag neutralisieren konnte: Nach mehreren Rückschlägen wurde am 27. Februar 1943 von zwölf norwegischen Widerstandskämpfern (unterstützt durch das Special-Operations-Executive), die sich auf der Hochebene von Hardangervidda versteckt gehalten hatten, die Sprengung an der Hochkonzentrieranlage für schweres Wasser der Norsk Hydro Werke durchgeführt. Bereits wenige Wochen später war der entstandene Schaden jedoch behoben, und die deutschen Besatzer ließen die Produktion verstärkt wieder anlaufen. Die norwegisch-französische Koproduktion Kampf ums schwere Wasser (Kampen om tungtvannet, 1948), der britische Spielfilm Kennwort „Schweres Wasser“ (The Heroes of Telemark, 1965) sowie die norwegisch-dänisch-britische Fernsehminiserie Saboteure im Eis – Operation Schweres Wasser (Kampen om tungtvannet, 2015) handeln von diesen Begebenheiten.
Es folgten mehrere alliierte Bombenangriffe auf das Kraftwerk und die wiederaufgebaute Anlage, bis sich die deutschen Besatzer entschlossen, die Fabrik aufzugeben und 50 Fässer bereits produzierten schweren Wassers mitzunehmen. Die Konzentration des Deuteriumoxids schwankte zwischen 1 % und 99 %, sie wurde durch eine zweistellige Nummer auf den Fässern gekennzeichnet, die für Außenstehende keinen Rückschluss auf die Konzentration zuließ.
Die Eisenbahnfähre der Rjukanbanen namens Hydro, beladen mit schwerem Wasser, wurde am 20. Februar 1944 durch einen Sprengsatz im Maschinenraum sabotiert. Die Fähre sank binnen weniger Minuten auf dem 460 Meter tiefen Tinnsjø (norwegisch für ‚See bei Tinn‘). Fässer mit stark konzentriertem Inhalt, die nur teilweise befüllt waren, trieben nach dem Untergang an der Wasseroberfläche. Sie wurden von den Deutschen geborgen und drei Wochen nach der Versenkung nach Deutschland versandt und später im Forschungsreaktor Haigerloch verwendet. Beim Untergang der Fähre kamen vier deutsche Soldaten und 14 Zivilisten ums Leben.
Der Unterwasserarchäologe Brett Phaneuf erhielt mit einem norwegisch-amerikanischen Forscherteam 60 Jahre nach Untergang der Hydro die Genehmigung zu einer Tauchfahrt zur Hydro, jedoch mit der Auflage, nur genau ein Fass zu heben, da das Wrack offiziell als Kriegsgrab gilt.
Das sehr gut erhaltene Fass Nr. 26 ließ sich nach der Bergung mühelos öffnen, da der Dichtungsgummiring des Spundlochs nach über 60 Jahren noch intakt war. Laut der geheimen Ladeliste von 1944 sollte das Fass ein Destillat von 1,64 % schwerem Wasser enthalten. Tatsächlich ergaben Untersuchungen an Bord sowie später in London einen annähernd hohen Anreicherungsgrad von 1,1 % ± 0,2.[9]
Produktion
Ab 1945 wurde in den Vereinigten Staaten der Girdler-Sulfid-Prozess im großindustriellen Umfang eingesetzt, die ersten Schwerwasserreaktoren gingen 1953 in Betrieb. Die Anreicherungsanlagen wurden zunächst von DuPont betrieben und 1989 von Westinghouse Electric übernommen.
Einer der weltweit größten Produzenten von schwerem Wasser ist gegenwärtig Indien.[10] Die technische Entwicklung begann bereits in den 1960er Jahren im Rahmen des Indischen Atomprogramms. Das Land betreibt sieben Produktionsanlagen.[11] 22 der insgesamt 27 Kernreaktoren, von denen einige noch im Bau sind, werden mit schwerem Wasser als Moderator betrieben.[12]
Im Iran war seit 1996 eine Anlage zur Gewinnung von schwerem Wasser in Khonbad nahe Arak im Bau. Die Kapazität war auf 8 Tonnen pro Jahr ausgelegt. 2003 wurde die Produktionsanlage fertiggestellt, zugleich wurde eine zweite Ausbaustufe angekündigt, so dass sich die Produktion auf 16 Tonnen jährlich verdoppeln würde. Das schwere Wasser wird für den Betrieb des 40-MW-Natururan-Reaktors IR-40 benötigt.[13]
Bis 2015 war Rumänien der größte Produzent in Europa.[14] Schweres Wasser wird auch in Argentinien, Norwegen, Kanada, Pakistan und Russland produziert.
Einzelnachweise
- Datenblatt Deuterium oxide bei Sigma-Aldrich, abgerufen am 23. Juni 2011 (PDF).
- Edme H. Hardy, Astrid Zygar, Manfred D. Zeidler, Manfred Holz, Frank D. Sacher: Isotope effect on the translational and rotational motion in liquid water and ammonia. In: J. Chem Phys. 114, 2001, pp. 3174–3181.
- H. C. Urey, G. Failla: Concerning the Taste of Heavy Water. In: Science Bd. 81, Nr. 2098, S. 273, doi:10.1126/science.81.2098.273-a.
- Human Taste Buds Can Tell The Difference Between Normal And 'Heavy' Water, Beitrag von Peter Dockrill vom 11. April 2021 auf Science Alert, abgerufen am 11. April 2021.
- Roberto Fernandez-Prini, A. H. Harvey, D. A. Palmer: Aqueous Systems at Elevated Temperatures and Pressures Physical Chemistry in Water, Steam and Hydrothermal Solutions. Academic Press, 2004, ISBN 978-0-08-047199-0, S. 290 (eingeschränkte Vorschau in der Google-Buchsuche).
- Martin Chaplin: Water Properties (including isotopologues). In: Water Structure and Science. 11. August 2020, abgerufen am 21. August 2020 (englisch).
- Peter Kurzweil: Das Vieweg Einheiten-Lexikon: Begriffe, Formeln und Konstanten aus Naturwissenschaften, Technik und Medizin. 2., illustrierte Auflage. Vieweg+Teubner Verlag, Wiesbaden 2000, ISBN 3-528-16987-7, S. 432.
- Showing Isotope Differences Using Density (H2O and D2O) Demonstrationsversuch, Brad Sieve, Northern Kentucky University, youtube.com, Video (2:49). 15. Oktober 2012, abgerufen 4. September 2016. – Vergleiche: ChemDemos.NKU.edu (NKU Chemistry Demonstration Database).
- Das ZDF strahlte am 24. Juli 2005 die Bergung im Rahmen einer Dokumentation (Memento vom 6. August 2005 im Internet Archive) (englischer Originaltext) aus.
- About HWB. In: Heavy Water Board. Department of Atomic Energy, Government of India, 21. August 2020, abgerufen am 21. August 2020 (englisch).
- Plants at a Glance. In: Heavy Water Board. Department of Atomic Energy, Government of India, 21. August 2020, abgerufen am 21. August 2020 (englisch).
- Statistik der IAEO. Abgerufen am 9. November 2021 (englisch).
- Arak – Heavy Water Production Plant. In: GlobalSecurity.org. 15. Oktober 2008, archiviert vom Original am 15. Januar 2010; abgerufen am 21. August 2020 (englisch).
- Laurențiu Gheorghe: S-a dus pe Apa Grea a Sâmbetei – moștenirea nucleară pierdută a lui Nicolae Ceaușescu. In: adevarulfinanciar.ro. Adevărul Holding, 22. Mai 2015, archiviert vom Original am 29. Mai 2015; abgerufen am 21. August 2020 (rumänisch).