Wasserstoffherstellung
Mit Wasserstoffherstellung wird die Bereitstellung von molekularem Wasserstoff (H2) bezeichnet. Als Rohstoffe können Wasser (H2O), Erdgas, das vor allem aus Methan (CH4) besteht, andere Kohlenwasserstoffe, Biomasse sowie andere wasserstoffhaltige Verbindungen eingesetzt werden. Als Energiequelle dient chemische Energie oder von außen zugeführte elektrische, thermische oder solare Energie.

Einsatz von Wasserstoff
Wasserstoff wird vor allem in der chemischen Industrie, beispielsweise für die Herstellung von Stickstoffdünger oder beim Cracken von Kohlenwasserstoffen in Erdölraffinerien eingesetzt. Bedeutung hat er als Zwischenstufe bei chemischen Verfahren zur Herstellung von synthetischen Kraftstoffen wie Gas-to-Liquid (GtL), Coal-to-Liquid (CtL) und Biomass-to-Liquid (BtL), die unter anderem die Erzeugung eines wasserstoffreichen Synthesegases erfordern. Angesichts der zunehmenden Bedeutung der erneuerbaren Energien werden Energiespeicher notwendig, damit Produktions- und Bedarfszeiten aufeinander abgestimmt werden können. Eine Option zur Stromspeicherung könnte die Elektrolyse von Wasser zu den Gasen Wasserstoff und Sauerstoff (O2) sein, welche gespeichert und später wieder verstromt werden könnten. Im Rahmen einer sogenannten Wasserstoffwirtschaft könnte der Wasserstoff auch direkt genutzt werden.
Herstellungsverfahren
Im Rahmen der Klima- und Kohlenstoffdioxid-Debatte ist es üblich den Wasserstoff je nach verwendetem Herstellungsverfahren mit Farben zu benennen, obwohl es sich in Wirklichkeit um ein durchsichtiges Gas handelt.[1][2]
- Grauer Wasserstoff
- Herkömmliche Verfahren spalten meist Erdgas (Methan) unter Hitze in Wasserstoff und CO2. Diesen nennt man „grau“, wenn das CO2, etwa 10 Tonnen je Tonne Wasserstoff,[1] ungenutzt in die Atmosphäre gelangt.
- Blauer Wasserstoff
- Herkömmlich erzeugter Wasserstoff, wenn das entstehende CO2 gebunden und nicht in die Atmosphäre abgegeben wird.
- Türkiser Wasserstoff
- Durch thermische Methanspaltung erzeugten Wasserstoff nennt man „türkis“, wenn dabei fester Kohlenstoff statt CO2 anfällt, die thermische Energie aus erneuerbaren Energiequellen stammt und der Kohlenstoff dauerhaft nicht verbrannt wird.
- Grüner Wasserstoff
- Wird unter Nutzung regenerativ erzeugten Stroms durch Elektrolyse erzeugt. Die großtechnische Umsetzung solcher Verfahren gilt manchen als eine Schlüsseltechnologie zur Bekämpfung der globalen Erwärmung.[3] Hingegen ist umstritten, welche Kosteneffizienz und welcher Wirkungsgrad mit ihnen erreichbar ist, wie groß der Gesamtnutzen dieser Technologie in ausgereifter Form wäre und ob für die meisten Sektoren nicht beispielsweise Akkumulatoren vorzuziehen wären.[4]
- Roter Wasserstoff
- Zur Wasserstoffherstellung wird elektrischer Strom aus Kernenergie verwendet.
- Gelber Wasserstoff
- Herstellung durch Elektrolyse aus dem Stromnetz (Strommix)
- Weißer Wasserstoff
- Anfall aus chemischen Prozessen, die nicht das Ziel der Wasserstoffproduktion haben
Nachfolgend werden Wasserstoffherstellungsverfahren erläutert, die teils im industriellen Maßstab eingesetzt werden, sich aber teilweise noch in der Entwicklung befinden. Unterschieden wird dabei zwischen Verfahren, die Kohlenwasserstoffe einsetzen, solchen, die Biomasse verwenden, und solchen, die Wasser spalten:
Verwendung von Kohlenwasserstoffen
Bei der Verwendung von Kohlenwasserstoffen, aber auch Kohle und Biomasse, liefert der Rohstoff die für den Prozess notwendige Energie. Auch der Wasserstoff kann teilweise bereits im Rohstoff gebunden vorliegen oder wird in Form von Wasser hinzugefügt. Eine Ausnahme ist das Kværner-Verfahren, bei dem die benötigte Energie hauptsächlich von außen zugeführt wird.
Dampfreformierung
Bei der Dampfreformierung wird aus Kohlenwasserstoffen in zwei Prozessschritten Wasserstoff erzeugt. Als Rohstoffe können verwendet werden: Erdgas, Biomasse, aber auch langkettigere Kohlenwasserstoffe aus Erdöl wie etwa die Mittelbenzinfraktion. Dieses Verfahren ist etabliert und wird in Anlagen mit Kapazitäten von bis zu 100.000 m³/h umgesetzt.
Im ersten Schritt werden langkettige Kohlenwasserstoffe in einem Pre-Reformer unter Zugabe von Wasserdampf bei einer Temperatur von etwa 450 bis 500 °C und einem Druck von etwa 25 bis 30 bar zu Methan, Wasserstoff, Kohlenstoffmonoxid sowie Kohlenstoffdioxid aufgespalten. Diese Vorstufe vermeidet eine zu starke Verkokung des Reformerkatalysators. Im zweiten Schritt wird im Reformer das Methan bei einer Temperatur von 800 bis 900 °C und einem Druck von etwa 25 bis 30 bar an einem Nickelkatalysator mit Wasser zu Kohlenstoffmonoxid und Wasserstoff umgesetzt. Dem zweiten Schritt ist in der Regel eine Raffinationsanlage zur Gasaufbereitung vorgeschaltet, da Katalysatoren äußerst empfindlich auf Schwefel- und Halogenverbindungen, insbesondere Chlor (Katalysatorgifte), reagieren.
- allgemeine Gleichung:
- Beispiel Methan: ;
Das durch unvollständige Umsetzung erzeugte Zwischenprodukt Kohlenstoffmonoxid wird anschließend noch mit Hilfe der Wassergas-Shift-Reaktion an einem Eisen(III)-oxidkatalysator zu Kohlenstoffdioxid und Wasserstoff umgesetzt. Um im abschließenden Schritt Reinstwasserstoff zu gewinnen, nutzt man in der Praxis häufig Druckwechsel-Adsorptionsanlagen oder Lauge-Absorptionsgaswäschen, die Nebenprodukte wie CO, CO2 und CH4 bis auf einige wenige ppm herausfiltern.
Die Dampfreformierung ist die wirtschaftlichste und am weitesten verbreitete (~90 %) Methode, Wasserstoff zu erzeugen. Aufgrund der Verwendung fossiler Energieträger wird dabei aber genauso viel von dem Treibhausgas Kohlenstoffdioxid CO2 freigesetzt wie bei deren Verbrennung. Durch Verwendung von Biomasse kann die Klimabilanz verbessert werden, da dann nur das Kohlenstoffdioxid freigesetzt wird, das die Pflanzen zuvor beim Wachsen aus der Atmosphäre aufgenommen haben.
Partielle Oxidation
Bei der partiellen Oxidation wird der Rohstoff, wie Erdgas oder ein schwerer Kohlenwasserstoff (Heizöl), substöchiometrisch – also unter Sauerstoffmangel – in einem exothermen Prozess umgesetzt. Reaktionsprodukte sind vor allem Wasserstoff und Kohlenstoffmonoxid:
- allgemeine Reaktionsgleichung:
- Beispiel: typischer Bestandteil von Heizöl:
- Beispiel: typische Zusammensetzung von Kohle:
Meist wird noch Wasser zugesetzt, um sowohl die extremen Temperaturen als auch die Rußbildung in den Griff zu bekommen, sodass man von einer autothermen Reformierung mit wenig Wasser sprechen müsste. Die partielle Oxidation gilt als technisch ausgereift.
In kohlereichen Ländern wie China oder Südafrika kann als Ausgangsstoff für dieses Verfahren auch Kohle genutzt werden, die vorher zermahlen und mit Wasser zu einer Suspension vermischt wird.
Autotherme Reformierung
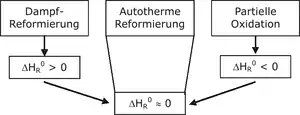
Die autotherme Reformierung ist eine Kombination aus Dampfreformierung und partieller Oxidation, durch die der Wirkungsgrad optimiert wird. Dabei kann beispielsweise Methanol wie auch jeder andere Kohlenwasserstoff beziehungsweise jedes Kohlenwasserstoffgemisch (Erdgas, Benzin, Diesel usw.) verwendet werden. Die beiden Verfahren werden so miteinander kombiniert, dass sich der Vorteil der Oxidation (Bereitstellung von Wärmeenergie) mit dem Vorteil der Dampfreformierung (höhere Wasserstoffausbeute) optimierend ergänzt. Dies geschieht durch genaue Dosierung der Luft- und Wasserdampfzufuhr. An die hier eingesetzten Katalysatoren werden besonders hohe Ansprüche gestellt, da sie sowohl die Dampfreformierung mit der Wassergas-Shift-Reaktion als auch die partielle Oxidation begünstigen müssen.
Gasaufarbeitung
Enthält das Produkt Anteile von CO, so kann die Wasserstoffausbeute noch gesteigert werden. Nach der Reformierung wird das Synthesegas weiter aufgearbeitet. Es folgt in einem nächsten Schritt die CO-Konvertierung mittels der Wassergas-Shift-Reaktion. Gefolgt von einer gegebenenfalls erforderlichen CO-Feinreinigung mittels präferentieller Oxidation oder selektiver Methanisierung wird CO chemisch umgesetzt oder physikalisch durch Druckwechsel-Adsorption oder eine wasserstoffpermeable Membran aus einer Palladium-Silber-Legierung (PdAg) abgetrennt. Großtechnisch besteht auch die Möglichkeit, CO2 und H2S (Schwefelwasserstoff) mit Methanol (Rectisolverfahren) auszuwaschen.
Kværner-Verfahren
Das von dem norwegischen Unternehmen Kværner entwickelte Verfahren trennt Kohlenwasserstoffe in einem Plasmabrenner bei 1600 °C vollständig in Aktivkohle (reinen Kohlenstoff) und Wasserstoff.
- allgemeine Reaktionsgleichung:
- Reaktionsgleichung für Methan:
Eine 1992 in Kanada erbaute Pilotanlage erreichte einen Wirkungsgrad von nahezu 100 % – allerdings nur unter der Voraussetzung, dass die dabei entstehende Abwärme vollständig genutzt wird. Der Energiegehalt der Reaktionsprodukte dieses Verfahrens verteilt sich etwa 48 % auf Wasserstoff, etwa 40 % auf Aktivkohle und etwa 10 % auf Heißdampf.
Biomasse
Biomasse besteht meist hauptsächlich aus Kohlenhydraten und kann in ähnlichen Verfahren umgesetzt werden wie Kohlenwasserstoffe. Eine weitere Option könnte die anaerobe Fermentation mit Hilfe von Mikroorganismen sein.
Dampfreformierung
Biomasse besteht hauptsächlich aus Kohlenhydraten und anderen wasserstoff- und kohlenstoffhaltigen organischen Verbindungen. Diese können mittels allothermer oder autothermer Dampfreformierung in molekularen Wasserstoff umgewandelt werden. Da Biomasse zu etwa 40 % aus Sauerstoff besteht, vergast sie fast von selbst mit nur wenig zusätzlichem Sauerstoff zum Durchführen der endothermen Reaktion. Man erreicht daher deutlich höhere Wirkungsgrade als beispielsweise bei der Vergasung von Kohle.
Pyrolyse und Dampfreformierung
In einem weiteren Verfahren werden Pyrolyse und Dampfreformierung verknüpft. Die erste Stufe ist hierbei die Pyrolyse, bei der als Endprodukte Primärgase, Koks und Methanol entstehen. Diese werden in einem zweiten Teilprozess mit Wasserdampf versetzt, und es entsteht wiederum ein Gemisch aus Wasserstoff, Methan, Kohlenstoffmonoxid und Kohlenstoffdioxid. Auch bei diesem zweiten Schritt muss Energie zugeführt werden, und es wird anschließend durch Dampfreformierung Wasserstoff gewonnen. Diese zweistufige Variante wird vor allem für kleinere Anlagen eingesetzt.
Nach Angaben des dena-Projekts GermanHy kann zukünftig eine großtechnische Biomassevergasung eine Option zur Erzeugung von Wasserstoff aus erneuerbaren Energien werden. Die Wirkungsgrade der wichtigsten Verfahren für die Konversion von Biomasse zu Wasserstoff liegen dabei im Bereich von 30 bis 40 Prozent.[5] Es sind noch keine kommerziellen Anlagen für die Wasserstoffherstellung bekannt. Allerdings steht die Herstellung von Wasserstoff aus Biomasse neben der direkten energetischen Nutzung von Biomasse (bsw. durch Hackschnitzel) auch in Konkurrenz zur Biomasseverflüssigung. Die so gewonnenen flüssigen Kraftstoffe haben als Energieträger eine höhere Energiedichte als Wasserstoff und sind einfacher handhabbar.[6]
Fermentation
Unter Laborbedingungen kann Wasserstoff mit anaeroben Mikroorganismen direkt aus Biomasse gewonnen werden. Werden hierfür Mischkulturen verwendet, muss die Wasserstoffproduktion vom letzten Glied der anaeroben Nahrungskette, der Methanproduktion (Methanogenese), entkoppelt werden. Die Freisetzung von molekularem Wasserstoff durch Mikroorganismen wird aus Gründen der Reaktionskinetik nur bei sehr niedrigem Wasserstoffpartialdruck begünstigt. Daher muss durch Bioreaktoraufbau und -betrieb dieser Druck trotz Abwesenheit methanogener Mikroorganismen oder sulfatreduzierender bzw. wasserstoffverwertender Bakterien niedrig gehalten werden.
Die fermentative Wasserstoffproduktion ist jedoch energetisch relativ ungünstig. Nach Thauer (1976) können auf dem beschriebenen Weg maximal 33 % der Verbrennungswärme aus Glucose in Wasserstoff gespeichert werden. Im Vergleich dazu können durch Methangärung 85 % der Energie aus Glucose in das Gärprodukt überführt werden.
Wasserspaltung
Bei der Wasserspaltung dient Wasser als Wasserstofflieferant. Mit Hilfe von elektrischem Strom wird in einem Elektrolyseur aus dem Wasser Wasserstoff und Sauerstoff erzeugt. Bei verschiedenen chemischen Verfahren, bei denen die Elektrolyse für die Erzeugung anderer Verbindungen eingesetzt wird, kann Wasserstoff als Nebenprodukt anfallen. Bei thermochemischen Verfahren zum Spalten von Wasser in Wasserstoff sind sehr hohe Temperaturen notwendig. Auch biologische Verfahren sind in der Entwicklung, bei denen die während der Photosynthese stattfindende Wasserspaltung zur Erzeugung von Wasserstoff genutzt werden kann. Direkte Verwendung finden die Photonen des Sonnenlichts bei der photokatalytischen Wasserspaltung. Die Photonen erzeugen dabei Elektron-Loch-Paare, deren Energie direkt dafür genutzt werden kann, Wasser in seine Bestandteile zu zerlegen.
Elektrolyse von Wasser
Diese Form der Umwandlung von Wasser in Wasserstoff wurde erstmals um 1800 von dem deutschen Chemiker Johann Wilhelm Ritter nachgewiesen. Die Reaktion findet in einem mit leitfähigen Elektrolyten (Salze, Säuren, Basen) gefüllten Gefäß statt, in dem sich zwei Elektroden befinden, die mit Gleichstrom betrieben werden. Unter alkalischen Bedingungen läuft der Herstellungsprozess dabei in zwei Teilreaktionen ab:
- Kathode:
- Anode:
An der Anode werden im Prinzip Elektronen abgegeben, die von der Kathode wieder aufgenommen werden.[7] In der Gesamtreaktion entsteht aus Wasser also molekularer Wasserstoff und molekularer Sauerstoff:
- Gesamtreaktion:
Das Verfahren ergibt energiewirtschaftlich aber nur dann einen Sinn, wenn auch der erzeugte reine Sauerstoff verwendet werden kann und nicht einfach an die Luft abgegeben wird. Der energetische Wirkungsgrad der Elektrolyse von Wasser liegt bei über 70 %. Mehrere Anlagenhersteller (z. B. Electrolyser Corp., Brown Boveri, Lurgi, De Nora, Epoch Energy Technology Corp.) bieten große Elektrolysegeräte mit einem noch höheren Wirkungsgrad (über 80 %) an. Am Massachusetts Institute of Technology begann 2008 die Entwicklung eines Katalysators, der die Effizienz der Wasserelektrolyse auf nahezu 100 % steigern soll,[8] aber auch 2019 noch nicht über das Forschungstadium hinaus gekommen war.[9]
Ein Verfahrenstyp ist die alkalische Elektrolyse, die wegen der niedrigen Strompreise von Wasserkraftwerken als Energielieferanten vor allem in Norwegen und Island genutzt wird.
Anders als bei der Verwendung von fossilen Energieträgern wird bei der Elektrolyse kein CO2 freigesetzt. Dies gilt allerdings nur, wenn der verwendete Strom nicht aus fossilen Energieträgern erzeugt wurde. Bei der Wasserstoffherstellung, -speicherung und anschließenden Rückverstromung lag der Wirkungsgrad 2013 bei maximal 43 %.[10] Sterner et al. geben Wirkungsgradspannen zwischen 34 und 44 % an.[11] Es wird davon ausgegangen, dass perspektivisch elektrische Gesamtwirkungsgrade von maximal 49 bis 55 % erreicht werden können.[12]
Chloralkali-Elektrolyse
Bei der Chloralkali-Elektrolyse entstehen Wasserstoff und Chlor als Nebenprodukte. Vorrangig dient sie aber der Gewinnung von Natron- und Kalilauge aus Lösungen von Chloriden (z. B. Kochsalz (NaCl)). An den beiden Elektroden finden diese Reaktionen statt:
Das Verfahren wird seit Jahrzehnten großtechnisch angewendet. Es ist dort wirtschaftlich sinnvoll, wo ein Bedarf an Laugen (und gegebenenfalls Chlor) besteht, lohnt sich aber allein zum Zweck der Wasserstoffherstellung nicht.
Thermochemische Verfahren
Thermische Dissoziation
Die thermische Dissoziation bezeichnet den Zerfall von Molekülen in ihre einzelnen Atome durch Wärmeeinwirkung. Oberhalb einer Temperatur von 1.700 °C vollzieht sich die direkte Spaltung von Wasserdampf in Wasserstoff und Sauerstoff. Dies geschieht zum Beispiel in Solaröfen. Die entstehenden Gase können mit keramischen Membranen voneinander getrennt werden. Diese Membranen sind für Wasserstoff, jedoch nicht für Sauerstoff durchlässig. Das Problem dabei ist, dass sehr hohe Temperaturen auftreten und nur teure, hitzebeständige Materialien dafür in Frage kommen. Aus diesem Grund ist dieses Verfahren noch nicht konkurrenzfähig.
Thermochemisches Verfahren
Ein Absenken der Temperatur bei der thermischen Wasserspaltung auf unter 900 °C kann über gekoppelte chemische Reaktionen erreicht werden. Bereits in den 1970er Jahren wurden für die Einkopplung der Wärme von Hochtemperaturreaktoren verschiedene thermochemische Kreisprozesse vorgeschlagen, die zum Teil auch für die Nutzung konzentrierter Solarstrahlung geeignet sind. Die höchsten Systemwirkungsgrade sowie das größte Potenzial für Verbesserungen weist aus heutiger Sicht ein verbesserter Schwefelsäure-Iod-Prozess auf: Iod (I) und Schwefeldioxid (SO2) reagieren bei 120 °C mit Wasser zu Iodwasserstoff (HI) und Schwefelsäure (H2SO4). Nach der Separation der Reaktionsprodukte wird Schwefelsäure bei 850 °C in Sauerstoff und Schwefeldioxid gespalten, aus Iodwasserstoff entsteht bei 300 °C Wasserstoff und das Ausgangsprodukt Iod. Den hohen thermischen Wirkungsgraden der thermochemischen Kreisprozesse (bis zu 50 %) müssen jedoch die heute noch weitgehend ungelösten material- und verfahrenstechnischen Schwierigkeiten gegenübergestellt werden.[13]
Metalloxid-Verfahren
Viele Metalloxide spalten bei sehr hohen Temperaturen Sauerstoff ab, und das entstehende Metall reagiert bei niedrigeren Temperaturen mit Wasser, wobei das Oxid unter Erzeugung von Wasserstoff zurückgewonnen wird. Mehr als 300 Varianten dieser thermochemischen Prozesse sind bekannt. Einige davon, zum Beispiel das Zink-Zinkoxid-Verfahren[13] oder das Cer(IV)-oxid-Cer(III)-oxid-Verfahren, werden als technologisch vielversprechend untersucht (siehe auch Hydrosol-Projekt):
Beispiel (M: Metall; M(II): Metall der Oxidationsstufe II; O: Sauerstoff; H: Wasserstoff):
- Spaltschritt: M(II)Oreduziert + H2O → M(IV)O2 oxidiert + H2
- Regenerationsschritt: M(IV)O2 oxidiert → M(II)Oreduziert + 1/2 O2
Photokatalytische Wasserspaltung
Die Photokatalyse benutzt das Sonnenlicht und einen Katalysator zum Herstellen von Wasserstoff. Der Vorteil der Photokatalyse gegenüber anderen Techniken wie der Elektrolyse besteht darin, dass die Ladungstrennung und Spaltung des Wassers von einem Material an der gleichen Grenzfläche durchgeführt werden kann, wodurch Übertragungsverluste minimiert und Materialeinsparungen erzielt werden können.
Photobiologische Herstellung
Bei der photobiologischen Herstellung von Wasserstoff kann ebenfalls das Sonnenlicht als Energiequelle genutzt werden. Die entsprechenden Katalysatoren werden dabei von lebenden Organismen erzeugt. Bakterien müssen dazu in Wasserstoffbioreaktoren kultiviert werden. Durch Beeinflussung der von ihnen betriebenen Photosynthese wird Energie nicht in Biomasse gespeichert, sondern zur Spaltung von Wasser in Wasserstoff und Sauerstoff verwendet. Dieses Verfahren könnte CO2-neutral bzw. nahezu CO2-neutral sein. Bisher ist jedoch noch keine wirtschaftliche Umsetzung möglich.[14]
Siehe auch
Weblinks
- Brenngaserzeugung für Brennstoffzellen (Memento vom 16. Oktober 2006 im Internet Archive) beim Forschungszentrum Jülich
- Wasserstoffgewinnung mittels einer Artifiziellen Bakterien-Algen-Symbiose (ArBAS), Projektseite der TU-Berlin
- Woher kommt der Wasserstoff in Deutschland bis 2050?. Studie im Rahmen des Projekts GermanHy der Deutschen Energie-Agentur (dena), Stand August 2009, als 62-seitiges PDF
Einzelnachweise
- Bundesministerium für Bildung und Forschung: Eine kleine Wasserstoff-Farbenlehre. Abgerufen am 15. Juni 2020.
- Wasserstoff Farbenlehre. In: solarify.eu. 18. März 2020, abgerufen am 26. Januar 2021.
- Grüner Wasserstoff als Klimaschützer: Der Sauberstoff. Spiegel.de abgerufen am 2. Januar 2020.
- Wasserstoff: Die Energie der Zukunft? auf br.de abgerufen am 2. Januar 2020.
- Woher kommt der Wasserstoff in 2050? Abgerufen am 19. Juni 2020.
- Ulf Bossel, Theorie und Praxis, April 2006: Wasserstoff löst keine Energieprobleme, aufgerufen am 24. September 2014.
- Jan Rösslerven Messerer: Brennstoffzellentechnik – Herstellung von Wasserstoff. (PDF) 2005, S. 5, archiviert vom Original am 4. Oktober 2012; abgerufen am 16. Januar 2015 (Fachhochschule Darmstadt, Gruppenarbeit(?)): „An der Anode werden im Prinzip Elektronen abgegeben und von der Kathode wieder aufgenommen.“
- MIT claims 24/7 solar power. 31. Juli 2008, abgerufen am 19. Oktober 2011.
- Hydrogen electrolysis: cheap, abundant Cobalt Phosphide can replace Platinum. In: Energy Post. 24. Oktober 2019, abgerufen am 23. Oktober 2020 (britisches Englisch).
- Volker Quaschning, Regenerative Energiesysteme. Technologie – Berechnung – Simulation. 8. aktualisierte Auflage. München 2013, S. 373.
- Energiewirtschaftliche und ökologische Bewertung eines Windgas-Angebotes S. 18 (Memento vom 24. Dezember 2014 im Internet Archive). Fraunhofer IWES. Abgerufen am 14. November 2014.
- Dan Gao, Dongfang Jiang, Pei Liu, Zheng Li, Sangao Hu, Hong Xu, An integrated energy storage system based on hydrogen storage: Process configuration and case studies with wind power. Energy 66 (2014) 332-341 doi:10.1016/j.energy.2014.01.095.
- Sven Messerer, Jan Rössler: Brennstoffzellentechnik Herstellung von Wasserstoff (Memento vom 4. Oktober 2012 im Internet Archive), Studienarbeit an der FH Darmstadt 2005
- Bericht des Umweltbundesamts zur Nutzung von Mikroalgen (Memento vom 30. September 2007 im Internet Archive), letzte Aktualisierung am 16. März 2009, abgerufen am 30. März 2010.