Salinität
Als Salinität (von lateinisch salinitas) bezeichnet man (vereinfachend) den Salzgehalt eines Gewässers, Wasserkörpers bzw. Wassers. Im einfachsten Fall wird sie als Massenanteil in g/kg (Gramm Salz pro Kilogramm Salzwasser bzw. Lösung) oder in Prozent angegeben (1 % entspricht 10 g/kg).
Die Salinität kann mit Hilfe eines Salinometers bestimmt werden. Dabei wird ausgenutzt, dass die elektrische Leitfähigkeit des Wassers proportional zum Salzgehalt ist.[1] In der Ozeanographie ist die Salinität eine wichtige Kenngröße bei der Bestimmung von Wassermassen und Meeresströmungen.
Geschichte der Salinitätsbestimmung
Mit der Salinitätsbestimmung will man herausfinden, wie viel Salz in einer Menge von Wasser gelöst ist. Der Salzgehalt ist zusammen mit dem Druck und der Temperatur für die Dichte beziehungsweise die potentielle Dichte des Wassers verantwortlich. Damit haben unterschiedliche Salzgehalte großen Einfluss auf die Meeresströmungen.
Verdunstung
Die ursprünglichste Methode ist die Verdunstung von Wasser und die Wägung dessen, was nicht verdunstet ist. Das Problem ist, dass Wasser dabei in Salzkristallen eingeschlossen werden kann. Um dieses Wasser aus den Salzkristallen zu lösen, sind hohe Temperaturen notwendig. Durch die hohe Temperatur zerfallen jedoch einige Salze (z. B. MgCO3 → MgO + CO2). Schon Robert Boyle stellte im 17. Jahrhundert fest, dass die Trocknung und Wägung von Meerwasser zu wenig reproduzierbaren Ergebnissen für die Konzentration von gelösten Substanzen führte.
Im 19. Jahrhundert wurde das Marcet-Prinzip oder auch das Gesetz der konstanten Proportionen formuliert. Es besagt: Ungeachtet wie stark sich die Salinität von Ort zu Ort unterscheidet, die Anteile der wichtigsten Ionen (engl. Major Ions) im Wasser des offenen Ozeans sind fast konstant.
Anfang des 20. Jahrhunderts kamen neue Methoden zur Bestimmung des Salzgehaltes auf.
Salinität, S‰ (Knudsen, 1902)
Um reproduzierbare Ergebnisse zu bekommen, wurde eine erste strikte Definition eingeführt. „Salinität ist definiert als das Gewicht in Gramm der gelösten anorganischen Stoffe in einem Kilogramm Seewassers, nachdem alle Bromide und Iodide mit der gleichen Menge an Chloriden ersetzt wurden und alle Kohlenstoff-Verbindungen oxidiert wurden.“ D. h. alle Kohlenstoffverbindungen gasen als CO2 aus. Dazu wurde das Seewasser, HCl und gesättigtes Chlorwasser getrocknet, für 72 Stunden bei 480 °C erhitzt und schließlich das rückständige Chlorid titriert.
Diese Methode brachte nun zwar reproduzierbare Ergebnisse, war aber sehr umständlich und zur Anwendung auf See nur sehr bedingt geeignet.
Chlorinität, Cl‰ (Sørensen und Knudsen, 1902)
Durch das Gesetz der konstanten Proportionen ist es möglich, aus dem Gehalt eines Salzes den Gehalt der restlichen Salze recht genau abzuschätzen. Mit Hilfe der Mohr-Titration konnte die Menge der Halogeniden in Seewasser bestimmt werden. Bei der Anwendung mit Seewasser fällt neben Silberchlorid noch Silberbromid und Silberiodid aus, welches nun gewogen werden kann. Damit die Ergebnisse präzise sind, wird die Silbernitrat-Lösung gegen sogenanntes Standard-Seewasser mit bekannter Chlorinität geeicht. Um nun aus der ermittelten Chlorinität die Salinität zu berechnen, maß Sørensen die Salinität von neun Seewasserproben direkt und bestimmte außerdem die Chlorinität. Die daraus abgeleitete Korrelation war: Salinität [‰] = 1,805 · Chlorinität [‰] + 0,030
Diese Methode ist sehr genau und auch auf See wesentlich besser anwendbar als die von 1902.
Chlorinität, Cl‰ (UNESCO, 1962)
Wie die Addition eines konstanten Wertes in der obigen Korrelation schon vermuten lässt, gab es jedoch ein Problem. Die neun Proben stammten zum Teil aus der Ostsee. Die Ostsee hat jedoch eine andere Ionenkomposition als der offene Ozean. Dieser Fehler wurde durch eine neue Kalibrierung nach nun 60 Jahren korrigiert: Salinität [‰] = 1,80655 · Chlorinität [‰]
Practical Salinity Scale, S (1978)
Die heute verwendete Practical Salinity Scale (PSS-78[2][3]) beruht auf der Proportionalität von Salzgehalt und elektrolytischer Leitfähigkeit und ist dimensionslos. Häufig findet man jedoch zur Angabe der Salinität nachfolgend ein PSU, welches für Practical Salinity Unit steht. Dies ist keine physikalische Einheit.
Zur Errechnung des Salzgehaltes aus der Leitfähigkeit wird folgende Formel benutzt:
Dabei gibt K15 das Verhältnis von der gemessenen Leitfähigkeit zur Leitfähigkeit einer Kalium-Chlorid-Lösung von 32.4356 g/kg bei 15 °C und bei einem Druck von einem Bar an. Ist das Verhältnis K15 gleich eins, ist S = 35.
Die Messung der Leitfähigkeit erfolgt heutzutage meist automatisiert mit Hilfe einer Conductivity Temperature Depth-Sonde (CTD), auf deutsch einer Leitfähigkeit-Temperatur-Tiefensonde.
Schwankungen der Salinität in Gewässern
Kurzfristige Schwankungen
Durch den Einfluss von Wetter und Gezeiten unterliegt die Salinität natürlichen Schwankungen. Zum einen das Ansteigen der Salinität durch Verdunstung bei Ebbe in ufernahen Bereichen (Wattenmeer, Gezeitentümpel) bis hin zur Ausbildung von Salzwiesen, zum Beispiel durch längere Sonnenperioden nach Sturmfluten. Bei Vorliegen einer wasserundurchlässigen Bodenschicht kann sich in Marschgebieten stark salzhaltiges flaches Grundwasser bilden, das auf der Insel Læsø im Kattegat eine Salinität von bis zu 15 Prozent erreicht. Eine Herabsetzung der Salinität kann sich durch Süßwassereintrag in Flussmündungen, in Schmelzwasserzonen und bei starkem Regen ergeben.
Auch wenn Meerwasser gefriert, bleibt Salz zurück. Zwar befindet sich das Salz nach dem Gefrieren zunächst im Eis, ein Großteil diffundiert aber heraus und gelangt wieder ins Meerwasser, dessen Salzgehalt dadurch steigt.[Beleg?]
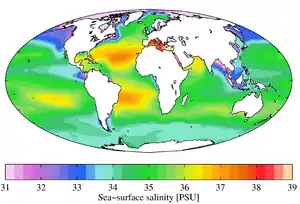
Großräumige Unterschiede
Der Salzgehalt an der Wasseroberfläche unterscheidet sich typischerweise von Meer zu Meer. Im Ostseeraum, wo die Niederschläge (mit eingerechnet die Landfläche, aus der die Ostsee gespeist wird) wesentlich größer sind als die Verdunstung, wird das Oberflächenwasser verdünnt. Je weiter man nach Osten kommt, desto geringer ist die Oberflächensalinität. Die Verdünnung des Oberflächenwassers führt zu einer stabilen Wasserschichtung, wo salzarmes Ostseewasser über salzreicherem, aus der Nordsee stammendem Wasser liegt.
Das Gegenteil passiert im Mittelmeer – dort ist die Verdunstung größer als die Niederschlagsmenge. Das Salz bleibt im Wasser zurück, sein Gehalt steigt. Tritt das Mittelmeerwasser bei Gibraltar aus dem Mittelmeer aus, sinkt es trotz seiner hohen Temperatur in mittlere Tiefen ab. Es kann anhand seines hohen Salzgehaltes quasi im ganzen Nordatlantik identifiziert werden.[4]
Salzgehalte
| Chlorid | 55,04 |
| Natrium | 30,61 |
| Sulfat | 7,68 |
| Magnesium | 3,69 |
| Calcium | 1,16 |
| Kalium | 1,10 |
| Hydrogencarbonat | 0,41 |
| Bromid | 0,19 |
| Borat | 0,07 |
| Strontium | 0,04 |
Die wichtigsten gelösten Salzionen des Meerwassers haben in den Weltmeeren den gleichen Anteil an der Salinität, sie sind konservativ. Das heißt, auch bei unterschiedlicher Salinität ist der Anteil der Ionen zueinander der gleiche. Dies liegt daran, dass sie nach ihrem Eintrag ins Meer nicht mehr nennenswert von biologischen oder geochemischen Prozessen beeinflusst werden. Eine einfache begriffliche Einteilung lautet: „Wasser kann polyhalin sein (über 10 Promille Salze – nur Meerestiere), mesohalin (1,0 bis 10 Promille Salze – spezielle Brackwasserfauna) oder oligohalin (0,1 bis 1,0 Promille Salze – schon Süßwassertiere)“
Einordnung
- Süßwasser weist eine Salinität von unter 0,1 % auf (d. h. unter 1 g/kg.)
- Beim Brackwasser liegt die Salinität zwischen 0,1 % und 1,0 %.
- Ab einer Salinität über 1,0 % spricht man von Salzwasser.
Zum Vergleich:
- Der durchschnittliche Salzgehalt der Ozeane liegt bei ca. 3,5 % (35 g/kg).
- Eine isotonische Kochsalzlösung enthält 0,9 % (9 g/kg) Kochsalz.
- Eine gesättigte Kochsalzlösung enthält 35,6 % (356 g/kg) Natriumchlorid bei 0 °C (359 g/kg bei 25 °C).
Weitere Meere
- Ostsee: 0,8 % im Durchschnitt (westliche Ostsee 1,3 %, Finnischer und Bottnischer Meerbusen < 0,5 %)
- Kieler Bucht: 1,5 %
- Finnischer und Bottnischer Meerbusen: 0,1 %
- Nordsee: 3,5 %
- Flussmündungen: 1,5 % – 2,5 %
- Nördliche Nordsee: 3,2 % – 3,5 %
- Mittelmeer: 3,74 %
- Schwarzes Meer 1,7 % – 1,8 %
- Persischer Golf: 4 %
- Rotes Meer: 4 %
Bei den anderen Nebenmeeren liegt die Salinität zwischen 3 % und 4 %.
Binnenseen
- Kaspisches Meer: 1,3 %
- Mono Lake: 7,3 %
- Qarunsee: 11,8 %
- Lake Natron
- Totes Meer: 28 % (Durchschnitt)
- Totes Meer: 32,66 % in einer Tiefe von 50 Metern
- Aralsee: 0,9 % (1960)
- Kleiner Aralsee: 2 % (2003)
- Großer Aralsee: 7,5 % (2003)
- Assalsee: 34,8 % (Durchschnitt)
- Assalsee: 38,8 % in einer Tiefe von 20 Metern
- Don-Juan-See: 44,2 % (welthöchster Wert für ein Gewässer)
Siehe auch
- Abiotische Umweltfaktoren, Ökologie
- Isotonische Kochsalzlösung (physiologische Kochsalzlösung)
- SMOS
- Wasserhärte
Weblinks
- International oceanographic tables. (PDF; 7,3 MB) UNESCO (englisch)
- Salinometry.com – Website mit Literaturangaben, Methodensammlung, Rechenhilfen und weiteren Informationen
- Gleichungen und Algorithmen für fundamentale Eigenschaften von Seewasser nach UNESCO Standard.
- Salzkarte der Meere
Einzelnachweise
- Günter Dietrich, Kurt Kalle, Wolfgang Krauss, Gerold Siedler: Allgemeine Meereskunde. 3. Auflage. Borntraeger, Berlin 1975. ISBN 3-443-01016-4.
- Temperature And Salinity Scales (Memento vom 11. Januar 2006 im Internet Archive)
- T. Dauphinee: Introduction to the Special Issue on the Practical Salinity Scale 1978. In: IEEE Journal of Oceanic Engineering. Band 5, Nr. 1, 1980, S. 1–2 (PDF – Einleitung zur Sonderausgabe über die PSS-78 – freier Volltext).
- Joseph Moran: Ocean studies: Introduction to oceanography. Hrsg.: American Meteorological Society. 3. Auflage. American Meteorological Society, Boston 2011.