Methanhydrat
Methanhydrat (auch Methanclathrat oder Clathrathydrat (von lateinisch clatratus ‚vergittert‘), Methaneis oder brennbares Eis genannt) ist eine natürlich vorkommende, eisartige Substanz. Es ist aus Wassermolekülen aufgebaut, die über Wasserstoffbrückenbindungen eine Käfigstruktur bilden, in denen Methanmoleküle eingeschlossen sind. Das eingeschlossene Methan stammt vorwiegend aus der mikrobiellen Methanogenese und zum Teil aus geologischen Prozessen. Als eine hochkonzentrierte Form von Methan, die große Mengen Kohlenstoff bindet, ist Methanhydrat eine bedeutende Komponente des globalen Kohlenstoffzyklus.

Der französische Physiker und Chemiker Paul Villard untersuchte gegen Ende des 19. Jahrhunderts die Synthese des Methanhydrats und dessen physikalisch-chemische Eigenschaften. Es galt zunächst als Laborkuriosität, bis es in den 1930er Jahren als Ursache für die Verstopfung von Erdgaspipelines identifiziert wurde.
In den 1960er Jahren wurde Methanhydrat erstmals in der Natur entdeckt. Es findet sich weltweit im Sediment entlang der Kontinentalränder, an Schelfen der Polargebiete, in der Tiefsee sowie innerhalb und unterhalb von Permafrostgebieten. Obwohl der genaue Umfang der Vorkommen unbekannt ist, stellt Methanhydrat, das die höchste Energiedichte aller natürlich vorkommenden Formen von Methan hat, vermutlich eines der größten ungenutzten Energiereservoirs auf der Erde dar. Die Schätzungen über den Umfang der Vorkommen variieren beträchtlich, die Menge an gebundenem Kohlenstoff übersteigt möglicherweise die Summe aller anderen fossilen Brennstoffe. Die Entwicklung technischer Anwendungen auf Basis von Methanhydrat steht noch am Anfang und beinhaltet unter anderem die Gastrennung, die Wasserentsalzung und die Weltraumforschung.
Es wird vermutet, dass Methanhydrat als Quelle für atmosphärisches Methan das erdgeschichtliche Klima beeinflusste. Ein Zerfall des Methanhydrats durch erhöhte Umwelttemperaturen könnte das Treibhausgas Methan in enormem Ausmaß freisetzen und damit den vom Menschen verursachten Klimawandel beschleunigen.
Als Teil der Meeressedimente stabilisiert es diese, die Rolle des Zerfalls von Methanhydrat bei unterseeischen Bergstürzen und Hangrutschen ist nicht abschließend geklärt. Methanhydratfelder am Grund des Golfs von Mexiko dienen als Habitat für Eiswürmer. Deren mutmaßliche Nahrungsquelle sind Bakterien, die auf dem Methanhydrat leben und sich von Methan ernähren.
Das mögliche Vorkommen von Methanhydrat auf dem Mars, Pluto, den Monden von Saturn und Jupiter, transneptunischen Objekten, Kometen und Asteroiden ist Gegenstand mannigfaltiger wissenschaftlicher Untersuchungen. Methanhydrat bildet möglicherweise die Quelle für die Methanatmosphäre des Titan. Vermutete Methanhydratvorkommen auf dem Mars könnten bedeutend für die Marskolonisation sein.
Einordnung und Nomenklatur

Methanhydrat gehört zur Gruppe der Einschlussverbindungen. Dies sind chemische Substanzen, bei denen eine Wirtskomponente einen Hohlraum in Form von Tunneln, Kanälen oder Schichten ausbildet, in dem andere Atome oder Moleküle als Gastkomponente eingelagert sind. Eine Untergruppe der Einschlussverbindungen sind die Clathrate oder Käfigverbindungen. Die IUPAC definiert Clathrate als „Einschlussverbindungen, bei denen sich das Gastmolekül in einem Käfig befindet, der durch das Wirtsmolekül oder durch ein Gitter von Wirtsmolekülen gebildet wird.“ (IUPAC: Gold Book[1]) Es gibt keine kovalente oder ionische Bindung zwischen Gast und Wirt, die Anziehungskraft ist auf die Van-der-Waals-Kräfte zurückzuführen.[2]
Gashydrate oder Clathrathydrate, oft nur Hydrate genannt, sind nichtstöchiometrische Verbindungen, in denen Wassermoleküle die Wirtskäfige bilden, in deren Hohlräumen kleine Gastatome oder -moleküle eingeschlossen sind. Handelt es sich bei dem eingeschlossenen Molekül um Methan, wird das Gashydrat als Methanhydrat bezeichnet.[3]
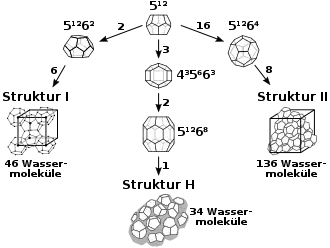
Methanhydrat liegt in drei verschiedenen Strukturen vor, die Methanhydrat I, II und H genannt werden. Die Struktur I ist die häufigste Form des natürlich vorkommenden Methanhydrats. Die Struktur der Wirtskäfige wird mit der Notation AB beschrieben, wobei A die Anzahl der Seiten pro Käfigfläche und B die Anzahl der Flächentypen ist, aus denen ein bestimmter Käfig besteht.[4] Im Methanhydrat I bilden Wassermoleküle pentagondodekaedrische Käfige, die aus 12 fünfeckigen Flächen mit gemeinsamen Kanten bestehen und die als 512-Käfige bezeichnet werden sowie etwas größere Käfige, die aus sechseckigen und fünfeckigen Flächen bestehen und als 51262-Käfige bezeichnet werden.[5] Das Verhältnis der 512-Käfige zu den 51262-Käfigen beträgt etwa 1 : 3. Im Methanhydrat II bilden die Wassermoleküle 512- und 51264-Käfige. Diese Struktur, Hexakaidekaeder genannt, wird durch Gastmoleküle gebildet, die größer als Methan sind.[4]
Methanhydrat der Struktur I, das aus Methan biogenen Ursprungs gebildet wurde, enthält als eingeschlossene Gaskomponente fast ausschließlich Methan (> 99 %). Diese Form macht über 95 % aller Methanhydratvorkommen aus. In Methanhydrat der Struktur II, das thermogenen Ursprungs ist, liegen neben Methan noch andere Kohlenwasserstoffe wie Propan vor. Die Struktur H enthält noch größere Moleküle wie Hexan, Methylcyclopentan, Cyclohexan und Methylcyclohexan.[6] Methan ist bei natürlich vorkommendem Methanhydrat in den beiden Strukturen dennoch die vorherrschende Komponente.
Geschichte
Erste Beobachtungen

Die erste Beobachtung eines Clathrathydrats geht wahrscheinlich auf Joseph Priestley zurück, der 1778 die Bildung von Kristallen beobachtete, als er Schwefeldioxid durch Wasser bei etwa 0 °C leitete.
“I had observed that with respect to marine acid air and alkaline air that they dissolve ice, and that water impregnated with them is incapable of freezing, at least in such degree of cold as I had exposed them to. The same I find, is the case with fluor acid air, but it is not so at all with vitriolic acid air, which, entirely contrary to my expectation, I find to be altogether different. […] But whereas water impregnated with fixed air discharges it when it is converted into ice, water impregnated with vitriolic acid air, and then frozen retains it as strongly as ever.”
„Ich hatte in Bezug auf marinsaure Luft (Chlorwasserstoff) und alkalische Luft (Ammoniak) beobachtet, dass sie Eis lösen, und dass Wasser, das mit ihnen imprägniert ist, unfähig ist, zu gefrieren, zumindest bei einem solchen Grad der Kälte, dem ich es ausgesetzt hatte. Das gleiche finde ich, ist der Fall mit fluorsaurer Luft (Tetrafluorsilan), aber es ist überhaupt nicht so mit vitriolsaurer Luft (Schwefeldioxid), die ich, ganz im Gegensatz zu meiner Erwartung, ganz anders zu sein finde. […] Aber während Wasser, das mit fixierter Luft (Kohlenstoffdioxid) imprägniert ist, sie abgibt, wenn es in Eis umgewandelt wird, behält Wasser, das mit vitriolsaurer Luft imprägniert und dann gefroren ist, sie so stark wie immer zurück.“
Humphry Davy bemerkte 1810 ein ähnliches Phänomen, als er mit Chlor versetztes Wasser auf 9 °C abkühlte.[8] Michael Faraday bestimmte die chemische Zusammensetzung des Hydrats mit einem Mol Chlor auf zehn Mole Wasser, wobei die tatsächliche Zusammensetzung näher bei einem Mol Chlor auf acht Molen Wasser liegt. In der ersten Hälfte des 19. Jahrhunderts widmeten sich weitere Chemiker der Untersuchung der Gashydrate. So synthetisierte der Chemiker Carl Löwig 1829 das Bromhydrat und Friedrich Wöhler entdeckte 1840 das Hydrat des Schwefelwasserstoffs.[9] Die erste Synthese des Kohlenstoffdioxidhydrats gelang Zygmunt Wróblewski 1882. Um 1884 untersuchte Bakhuis Roozeboom weitere Hydrate, unter anderem das bereits von Priestley beschriebene Hydrat des Schwefeldioxid.[10]
Entdeckung des Methanhydrats

Ab 1888 untersuchte Paul Villard die Hydrate der Kohlenwasserstoffe. Er entdeckte in diesem Jahr das Methanhydrat, die Hydrate von Ethan, Ethen, Ethin, und Distickstoffmonoxid sowie 1890 das Hydrat des Propans. Methanhydrat wird bei niedrigen Temperaturen unter Druck mit einem Überschuss des Gases hergestellt, überschüssiges Methan wird durch Druckentlastung entfernt. Villard stellte die Regel auf, nach der die allgemeine Zusammensetzung der Gashydrate durch die Formel M + 6 H2O beschrieben werden; die Regel gilt annähernd für kleine Moleküle, die in der Struktur I auftreten.
In Zusammenarbeit mit Villard synthetisierte Robert Hippolyte de Forcrand die Hydrate des Chlormethans, sowie gemischte Gashydrate. Die Darstellung der Hydrate von Inertgasen wie Argon gelang ihm 1896, von Krypton 1923, und Xenon 1925.[8] Weiterhin wurde die Existenz von Doppelhydraten, die Moleküle von zwei hydratbildenden Substanzen enthalten, entdeckt.
Der Schwerpunkt der wissenschaftlichen Arbeit konzentrierte sich zu dieser Zeit auf die Identifikation von Verbindungen, die Hydrate bildeten, sowie deren quantitative Zusammensetzung. Obwohl sich weitere Wissenschaftler der Untersuchung der Hydrate zuwandten und ihre Eigenschaften und chemische Zusammensetzung erforschten, erweckte das Gebiet der Hydratforschung zunächst kein industrielles Interesse.
Verstopfung von Pipelines

Dies änderte sich in den 1930er Jahren, als die Erdgasförderung und der -transport in Pipelines unter hohem Druck ökonomische Bedeutung erlangte. In bestimmten Abschnitten von Erdgaspipelines nahm durch den Joule-Thomson-Effekt die Temperatur stark ab. In diesen Abschnitten wurde eine eisähnliche Substanz gefunden, welche die Pipelines verstopfte. Hammerschmidt wies 1934 nach, dass Methan mit dem im Erdgasstrom vorhandenen Wasser Methanhydrat bildete, und dass dieses die Pipelines verstopfte und nicht Eis, wie ursprünglich angenommen.[11] Seine Entdeckung löste eine neue Phase der Methanhydratforschung aus, da die Methanhydratpfropfen in Erdgaspipelines für die Erdgasindustrie problematisch waren und wirtschaftliche Verluste und Umweltrisiken verursachten.
Die damit verbundenen Probleme und Unfälle führten zu vielfältigen Forschungsaktivitäten mit dem Ziel, die Bildung von Methanhydrat beim Umgang mit Erdgas und Erdöl zu verhindern. Sie beinhalteten unter anderem die Erforschung von Additiven, welche Methanhydrat auflösen oder seine Bildung hemmen. Die Untersuchung seiner thermodynamischen Stabilitätsgrenzen sowie die Kinetik der Bildung und Auflösung erlaubte die Vorhersage der Bildung von Methanhydratblockaden in Gaspipelines.[9] Die Öl- und Gasindustrie intensivierte die Forschung nochmals, nachdem sie begann, Erdölvorkommen in der Tiefsee zu fördern, wo die erforderlichen Bedingungen für die Methanhydratbildung herrschen.
Bereits Mitte der 1930er Jahre wurde vermutet, dass Methanhydrat eine Clathratverbindung ist. Dies wurde in den 1940er und 1950er Jahren bestätigt, als erste Untersuchungen bezüglich der Kristallstruktur von Clathratstrukturen durchgeführt und die Strukturen I und II identifiziert wurden.[12][13] Ebenso wurde entdeckt, dass Mischhydrate stabiler sein können und einen um 10 bis 15 °C erhöhten Schmelzpunkt haben können.[14] In den 1950er Jahren entwickelte der niederländische Physiker Johannes Diderik van der Waals jr., der Sohn des Nobelpreisträgers Johannes Diderik van der Waals, zusammen mit J. C. Plateeuw ein thermodynamisches Modell des Methanhydrats.[15]
Funde von natürlichem Methanhydrat
Bereits in den 1940er Jahren wurde über natürliche Methanhydratvorkommen in der Permafrostzone Kanadas spekuliert. Die Vermutungen konnten zu dieser Zeit noch nicht durch Funde bestätigt werden. Dies änderte sich Anfang der 1960er Jahre, als Yuri Makogon entdeckte, dass Methanhydrat natürlich in Sedimenten vorkommt. Russische Bohrtrupps brachten Ende der 1960er Jahre in Sibirien am Oberlauf des Messojacha eine Bohrung nieder, die im oberen Teil eines Erdgasfelds erstmals auf eine Lagerstätte von Methanhydrat stieß. Es war die erste Bestätigung für das Vorkommen von natürlichem Methanhydrat.[9] Zu Beginn der 1970er Jahre wurde Methanhydrat in weiteren arktischen Gebieten, etwa in Alaska und im kanadischen Mackenzie-Delta nachgewiesen.[16]
Damit wandelte sich Methanhydrat von einer Laborkuriosität und Betriebsgefahr für Erdgaspipelines zu einer möglichen Energiequelle, die Funde lösten eine weitere Welle der Methanhydratforschung aus. Von Interesse waren die Untersuchung der geologischen und chemischen Parameter, die das Vorkommen und die Stabilität von Methanhydrat in der Natur steuern sowie die Abschätzung des Methanvolumens in den verschiedenen Methanhydratvorkommen. Zu dieser Zeit begannen erste Untersuchungen des Abbauverhaltens.[17]
Deep Sea Drilling Project


Das US-amerikanische Forschungsschiff Glomar Challenger, eine Bohrplattform für das Studium von Methanhydrat, der Plattentektonik und der Paläozeanographie, förderte in den 1970er und 1980er Jahren bei mehreren Expeditionen im Rahmen des Deep Sea Drilling Project Methanhydrat-haltiges Sediment aus der Tiefsee. Die Wissenschaftler erhielten durch das Bohrprogramm Beweise für die Existenz von Methanhydrat in einer Vielzahl von geologischen Gegebenheiten.[18]
Ein Missionsziel der Glomar Challenger war, die Natur der anomalen akustischen Reflexionen zu untersuchen, die am Blake Ridge, einem tiefen Bereich des Atlantischen Ozeans, der entlang der Ostküste der Vereinigten Staaten verläuft, entdeckt wurden. Dabei stellten die Geologen fest, dass Methanhydratvorkommen am Meeresboden durch reflektionsseismische Verfahren nachweisbar sind. Beim Übergang der seismischen Laufzeiten aus einem dichten in ein weniger dichtes Medium, wie er an der Basis der Methanhydratstabilitätszone auftritt, entsteht ein sogenannter Boden-simulierender Reflektor, der charakteristisch für Methanhydrat ist.[18] Dies bestätigten Sedimentkerne, die hohe Methankonzentrationen aufwiesen. Die Vorkommen, die etwa in einer Tiefe von über 2500 Metern unter dem Meeresspiegel in Tiefen von etwa 700 bis 750 Metern unter dem Meeresboden liegen, wurden auf 15 Gigatonnen Kohlenstoff geschätzt.[19]
Im Rahmen des Programms fanden die Wissenschaftler Methanhydrat in Bohrkernen aus dem Mittelamerikagraben vor Mexiko sowie vor Guatemala. Sie wiesen ebenfalls Methanhydratvorkommen nach, bei denen kein zugehöriger Boden-simulierender Reflektor vorhanden war. Die Ergebnisse legten nahe, dass Methanhydrat in den Kontinentalrändern auf der ganzen Welt zu finden ist.[18]
Erstmals wurde zu jener Zeit die Theorie aufgestellt, dass sich auflösendes Methanhydrat der Auslöser für unterseeische Rutschungen sein könnte, und dass der Zerfall von Methanhydrat in der erdgeschichtlichen Vergangenheit zu einem klimabeeinflussenden Ausstoß von Methan in die Atmosphäre geführt haben könnte.[20] Ein großflächiger Zerfall wurde als Erklärungsversuch für das Paläozän/Eozän-Temperaturmaximum erwogen.
Ende der 1990er Jahre begannen in Mallik an der Beaufortsee erste Tests zum Abbau von Methanhydrat im dortigen Permafrostgebiet. Wissenschaftler aus den USA, Europa, darunter Deutschland, Japan, Indien und China erarbeiteten dort Abbaumethoden.[21]
Deepwater Horizon

Im April 2010 kam es auf der Deepwater Horizon, einer Bohrplattform für die Erdölexploration im Golf von Mexiko, zu einer Explosion. In der Folge traten etwa 550 bis 800 Millionen Liter Erdöl sowie etwa 147.000 Tonnen Methan ins Meer aus, was zur Ölpest im Golf von Mexiko führte, der schwersten Umweltkatastrophe dieser Art in der Geschichte.[22] Möglicherweise war Methanhydrat ein Faktor, der zur Entstehung der Katastrophe beigetragen hat. Die Bohrung könnte auf Methanhydrat in Sediment gestoßen sein, das durch einen Druckabfall oder eine Erwärmung zerfallen konnte. Das Methan konnte eventuell durch einen Defekt in das Bohrloch eindringen und zu einem hohen Druck im Bohrloch beigetragen haben, der schließlich zum Blowout führte, bei dem die Plattform in Brand geriet.[23]
Nach der Explosion platzierte BP eine etwa 125 Tonnen schwere Kuppel über dem größten Leck des Bohrlochs. In der Kuppel sollte sich das austretende Erdöl sammeln und über eine Leitung zu einem Lagerbehälter an der Oberfläche geleitet werden. Austretendes Methan bildete jedoch unter den herrschenden Temperaturen und Drücken mit dem Meerwasser Methanhydrat, das die abführende Leitung verstopfte und so den Abfluss behinderte.[24]
Produktionstests
In einer Machbarkeitsstudie wurde 2012 an der Ignik-Sikumi-Bohrung Nr. 1 im Prudhoe-Bay-Feld der Austausch von Kohlenstoffdioxid gegen in Methanhydrat gebundenes Methan getestet. Das freigesetzte Methan wurde durch eine Druckentlastung des Reservoirs gefördert.[25] Basierend auf seismischen Untersuchungen, die auf Methanhydratvorkommen hindeuten, begann Japan Ende 1999 mit Probebohrungen im nordwestlichen Pazifik vor Japan. Die Bohrungen in einer Wassertiefe von 945 Metern bestätigten Methanhydratvorkommen. Basierend auf den Ergebnissen der Exploration rief die japanische Regierung ein Forschungsprogramm zur Untersuchung des Abbaus von Methanhydrat ins Leben.[26] In Produktionsversuchen im April 2017 wurde vor der Insel Honshu erstmals auf offener See Methan aus Methanhydrat gefördert, anfangs bis zu 20.000 Kubikmeter pro Tag.[27] Für die aufgetretenen Probleme siehe den Abschnitt zur Druckentlastungsmethode.
In der Prudhoe Bay wurde 2018 eine stratigrafische Testbohrung abgeteuft und der Nachweis von Methanhydratreservoiren erbracht. Die Hydrate-01 genannte Bohrung ist als Überwachungsbohrung für langfristig angelegte Produktionstests vorgesehen. Unter anderem soll die Reaktion von Methanhydratlagerstätten auf Druckentlastung untersucht werden.[28]
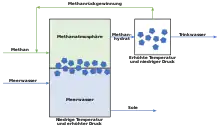
Vorkommen
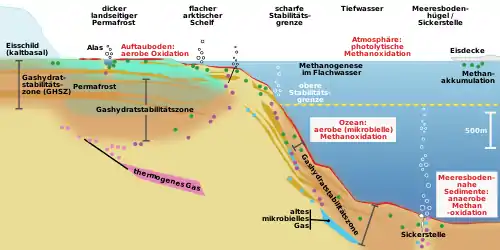
Große Methanhydratvorkommen befinden sich in den Ozeanen, unter dem Eisschild Grönlands und der Arktis, in der Antarktis sowie in und unter den Permafrostböden an Land sowie in überschwemmten Permafrostböden. Insgesamt sind 71 % der Erdoberfläche von Ozeanen, deren Nebenmeeren und Binnengewässern bedeckt, etwa 90 % dieser Fläche haben eine für die Methanhydratbildung notwendige Wassertiefe.[29]
Erste Schätzungen hinsichtlich des Vorkommens und der Verteilung submariner Methanhydratvorkommen stammen aus den 1970er Jahren und basierten auf der Annahme, dass sie ab einer Wassertiefe über 500 Metern fast im gesamten Ozean auftreten. Eine Abschätzung in den 1990er Jahren aufgrund von seismischen Studien kam zu dem Ergebnis, dass etwa 11.000 Gigatonnen Kohlenstoff im Methanhydrat gebunden sei.[30]
Schätzungen, die auf neueren Forschungstätigkeiten beruhen, gehen von einer Menge zwischen 500 bis 2500 Gigatonnen im Methanhydrat gebundenen Kohlenstoffs aus, während die Menge des gesamten organisch gebundenen Kohlenstoffs ohne Methanhydrat bei etwa 9000 Gigatonnen liegt.[31] Der United States Geological Survey (USGS), eine wissenschaftlichen Behörde der Vereinigten Staaten im Bereich der Geologie, schätzt die Vorkommen auf 1800 Gigatonnen, eine Größenordnung, die auch von anderen Wissenschaftlern als realistisch angesehen wird.[32]
In der Literatur wird die Größe der Methanhydratvorkommen meist auf Basis Methanvolumen oder Kohlenstoffmasse angegeben. Typische Volumenangaben werden in Kubikmeter und, vor allem in der englischsprachigen Literatur, in Trillion Cubic Feet (TCF) gemacht. Ein Trillion Cubic Feet entspricht 28,3 Milliarden Kubikmeter. Weiterhin ist die Angabe in Gigatonnen oder Petagramm Kohlenstoff gängige Praxis, vor allem zum Vergleich mit anderen organischen Kohlenwasserstoffreservoiren. Als Methan unter Standardbedingungen haben 1800 Gigatonnen Kohlenstoff ein Volumen von 3,4 Mio km3. Das ist mehr als das 800fache der weltweiten Erdgasproduktion im Jahre 2019.[33]
Marine Vorkommen
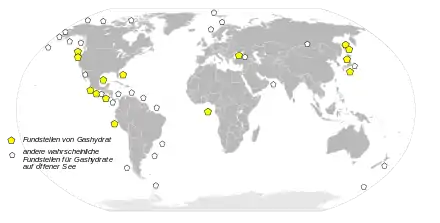
Marine Methanhydrate kommen in Kontinentalhängen, Inselhängen, ozeanischen Anstiegen und Tiefwasserzonen im Landesinneren sowie in Randmeeren vor. Dort findet die größte Methanproduktion statt, da eine große Menge Material biologischen Ursprungs den Meeresboden erreicht, das in den oberen Zonen des Meeres produziert wird. Auf den großen Tiefseeebenen ist dies nicht der Fall, daher sind die Vorkommen dort seltener.
Bei geeigneten Voraussetzungen, also niedrigen Temperaturen, höheren Drücken und genügend verfügbarem Methan, ist die Bildung und Ansammlung von Methanhydrat wahrscheinlich. Die Stabilitätszone von Methanhydrat wird durch verschiedene Faktoren beeinflusst. Salz im Meerwasser führt zu einer Verkleinerung der Stabilitätszone, mit steigendem Salzgehalt werden niedrigere Temperaturen und höhere Drücke notwendig. Längerkettige Kohlenwasserstoffe in gemischten Hydraten haben eine entgegengesetzte Wirkung und können die Stabilitätszone erheblich ausdehnen.[34]
An den Kontinentalhängen und den Rändern von Binnenmeeren und -seen ist die Planktonbildung hoch. Die Sedimentation des organischen Materials bietet den Methan-produzierenden Mikroben die Grundlage für die Produktion von großen Methanmengen. Methanhydrat findet sich daher an allen Kontinentalhängen sowie im Schwarzen Meer oder im Kaspischen Meer. Die bei weitem größten Vorkommen befinden sich in der Tiefsee unterhalb einer Tiefe von mindestens 200 Metern und sind mikrobiologischen Ursprungs, außer in thermogenen Becken wie dem Golf von Mexiko. Die gesamten Vorkommen der Tiefsee werden vom United States Geological Survey auf etwa 1700 Gigatonnen Kohlenstoff geschätzt und repräsentieren mehr als 95 % aller Methanhydratvorkommen, wobei die antarktischen Vorkommen ausgenommen sind.[35]
Methanhydrat kommt sowohl in fein- als auch in grobkörnigen Sedimenten vor, wobei grobkörnige Sedimente höhere Konzentrationen von Methanhydrat aufweisen. Sie sind typischerweise in der Nähe des Meeresbodens bis zu einer Tiefe von etwa 50 bis 160 Metern unter dem Meeresboden vorhanden.[31] Bedeutende marine Methanhydratvorkommen wurden vor den Vereinigten Staaten, in Japan und in Indien im Krishna-Godarvi-Becken vor Andhra Pradesh entdeckt.[36] An der Subduktionszone vor Oregon wird durch Plattentektonik taucht die ozeanische Juan-de-Fuca-Platte unter die kontinentale Nordamerikanische Platte ab. Dabei wird das subduzierte Sediment in größeren Tiefen ausgepresst und Porenwasser mit hohem Methangehalt wird nach oben transportiert. In der Nähe der Sedimentoberfläche kommt dieses gelöste Methan durch Abkühlung in das Stabilitätsfeld von Methanhydrat, und es bildet sich Methanhydrat im Sediment beziehungsweise an der Sedimentoberfläche. Durch diesen Prozess wird das meiste aufsteigende Methan im Sediment gebunden und nahe der Sedimentoberfläche abgelagert.[37] Als ökonomisch abbaubar werden Vorkommen in Sandlagerstätten mit hoher Porosität angesehen. Die Größe der abbaubaren Tiefseevorkommen wird auf etwa 657 Gigatonnen geschätzt.[38]
1997 wurde der erste Nachweis von Methanhydrat in den Sedimenten des russischen Baikalsees erbracht. Im Zuge des „Baikal-Drilling“-Projektes wurde in dem Sedimentkern BDP-97 das Hydrat nachgewiesen.[39] Bislang wurden dort 21 Stellen mit Methanhydratvorkommen entdeckt, die thermogenen, mikrobiellen und gemischten Ursprungs sind. An 15 Stellen wurde Methanhydrat in Schlammvulkanen gefunden.[40]
Die Ostsibirische See ist ein flaches Schelfmeer, das durch die Überflutung Nordostsibiriens während der Anstiegs des globalen Meeresspiegels im frühen Nacheiszeitalter entstand. Der unterseeische Permafrost der Ostsibirischen See enthält wahrscheinlich bedeutende, aber wenig erforschte Vorkommen von Methan. Diese können als Methanhydrat im oder unter dem unterseeischen Permafrost vorliegen oder als thermogenes Gas.[35]
Terrestrische Vorkommen
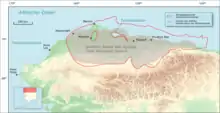
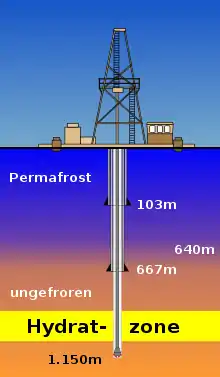
Die Methanhydratvorkommen an Land liegen hauptsächlich in Permafrostgebieten, die auf der Nordhalbkugel große Teile Alaskas, Russlands und weiterer Länder der ehemaligen Sowjetunion umfassen. Das im Permafrost vorhandene, als Methanhydrat gebundene Methan am North Slope, einer Region im US-Bundesstaat Alaska, wird auf 16,7 Billionen Kubikmeter Methan geschätzt.[41] Damit übersteigt die Menge des in Methanhydrat gebundenen Methans die Ressourcen von konventionell förderbarem Gas im North Slope bei weitem.
Die thermischen Bedingungen zur Bildung von Permafrost und Methanhydrat bestehen in der Arktis etwa seit dem Ende des Pliozäns vor etwa 2,58 Millionen Jahren. Die im Permafrost vorhandenen Methanhydratansammlungen entwickelten sich wahrscheinlich aus konventionellen Gaslagerstätten und sind thermogenen Ursprungs.[41]
Über die Größe der antarktischen Vorkommen ist wenig bekannt, die Schätzungen liegen zwischen 80 und 400 Gigatonnen Kohlenstoff. Die Vorkommen an den oberen Kontinentalhängen werden auf 63 Gigatonnen geschätzt und stellen etwa 3,5 % der Methanhydratvorkommen. Die Vorkommen in Permafrostböden an Land und in überschwemmten Permafrostgebieten umfassen etwa 20 Gigatonnen und stellen etwa 1,1 % der Methanhydratvorkommen dar.[35]
Extraterrestrische Vorkommen
Die ursprüngliche Bildung von Methan erfolgte wahrscheinlich im interstellaren Medium, bevor es ein Teil des Sonnennebels wurde. Beobachtungen in der Nähe von jungen Sternobjekten haben gezeigt, dass ein Großteil des interstellaren Methans durch die Hydrierung von Kohlenstoff auf Staubkörnern gebildet wird.[42] Während der Abkühlung des protosolaren Nebels wurde es als Methanhydrat gebunden. In dieser Form bildete es die Bausteine von Kometen, Eiskörpern und Riesenplaneten. Methanhydrat spielte möglicherweise eine wichtige Rolle bei der Entwicklung von Planetenatmosphären.[43] Basierend auf den Daten von Voyager 2 wird vermutet, dass die Monde des Uranus etwa 7 % Methanhydrat enthalten.[44] Bei Pluto deutet die Lage von Sputnik Planitia in der Nähe des Äquators auf das Vorhandensein eines unterirdischen Ozeans und einer lokal ausgedünnten Eishülle hin. Um einen flüssigen Ozean aufrechtzuerhalten, muss Pluto die Wärme im Inneren halten. Das Vorhandensein einer dünnen Schicht von Methanhydrat an der Basis der Eisschale könnte als thermischer Isolator wirken und verhindern, dass der Ozean vollständig gefriert.[45] Auf dem Zwergplaneten Ceres, dem wasserreichsten Körper im Sonnensystem nach der Erde, wurde Kohlenstoff in Form von Carbonaten und organischen Verbindungen gefunden. Es wird vermutet, dass Methan in Form von Methanhydrat in der Kruste vorhanden ist.[46]
Vermutete Vorkommen auf dem Mars
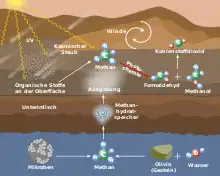
Seit 2004 wurden bei verschiedenen Missionen, etwa durch den Marsrover Curiosity und Beobachtungsstudien, Spuren von Methan in der Marsatmosphäre im Bereich von 60 parts per billion by volume (ppbv) festgestellt. Die Quelle von Methan auf dem Mars und die Erklärung für die temporären Abweichungen in den beobachteten Methankonzentrationen sind bislang unbekannt. Als kondensierte Phasen auf der Marsoberfläche wurden bislang festes Kohlendioxid und Wassereis beobachtet. Dennoch könnten Methanhydrat oder gemischte Clathrathydrate im Untergrund vorhanden sein und eine mögliche Quelle für atmosphärisches Methan darstellen.[48] Die nachgewiesenen Methankonzentrationen entsprechen dem Zerfall eines Volumens von etwa 2750 Kubikmetern Methanhydrat.[49]
Die thermodynamischen Bedingungen erlauben die Existenz gemischter Clathrathydrate, deren Zusammensetzung der Marsatmosphäre mit Kohlenstoffdioxid, Stickstoff, Argon und Methan entspricht.[50] Mit Methan angereicherte Clathrathydrate im Untergrund des Mars können jedoch nur stabil sein, wenn eine primitive Methan-reiche Atmosphäre existiert hat oder eine Quelle von Methan vorhanden war oder noch ist.
Vermutete Vorkommen auf dem Titan

Die Atmosphäre von Titan, dem größten Saturnmond, besteht zu etwa 94,2 % aus Stickstoff, zu 5,65 % aus Methan und etwa 0,099 % aus Wasserstoff. Die Sonde Voyager 1 lieferte im November 1980 die ersten detaillierten Beobachtungen der Titanatmosphäre und zeigte, dass die Temperatur bei etwa 95 Kelvin liegt und dass der Oberflächendruck 1,5 bar beträgt.[52]
Die Cassini-Huygens-Sonde lieferte ab Juli 2004 nach dem Eintritt in die Umlaufbahn eine Fülle von Informationen über den Titan. Die Sonde Huygens landete im Januar 2005 auf dem Titan und sendete Informationen über den Aufbau der Atmosphäre und der Oberfläche des Mondes. Neben Ethan wurden dabei komplexere organische Moleküle nachgewiesen.[53]
Die dichte Atmosphäre des Titans wird durch den Treibhauseffekt des Methans aufrechterhalten. Ohne diesen Treibhauseffekt könnte die atmosphärische Temperatur unter den Siedepunkt des Stickstoffs sinken und ein Großteil der Stickstoffatmosphäre würde sich verflüssigen. Photochemische Prozesse wandeln Methan jedoch irreversibel in einem Zeitraum von etwa 10 bis 100 Millionen Jahren in höhere Kohlenwasserstoffe wie Ethan um, das sich verflüssigt und in Ethanseen ablagert. Als plausible Quelle, die den Methangehalt in der Atmosphäre erneuern könnte, wird eine Schicht aus Methanhydrat unter der Oberfläche postuliert. Möglicherweise waren die Temperaturen bei der Bildung des Saturnmonds so tief, dass Methan in Form von Methanhydrat in beträchtlichen Mengen in Titan eingebaut wurde.[54] Methan könnte zum Teil durch Serpentinisierung oder Kometeneinschläge entstanden sein und sich mit dem vorhandenen Wasser zu Methanhydrat verbunden haben.[55]
Der fehlende Nachweis der Edelgase Xenon und Krypton in der Atmosphäre des Titans könnte ein weiterer Hinweis auf das Vorkommen von Methanhydrat sein. Die Gase könnten bei der Entstehung des Titan in Methanhydrat eingebaut worden sein.[43] Obwohl die thermodynamischen Voraussetzungen gegeben sind und es viele Indizien für das Vorkommen von Methanhydrat auf dem Titan gibt, gelang ein direkter Nachweis bislang nicht.
Vermutete Vorkommen auf Enceladus
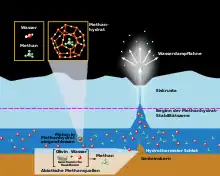
Aufgrund der thermodynamischen Bedingungen ist zu erwarten, dass ein vermuteter interner subglazialer Ozean von Enceladus die notwendigen Bedingungen für die Bildung von Methanhydrat liefert.[56] Mittels eines Ionen-Neutral-Massenspektrometers an Bord der Cassini-Sonde konnten in den Wasserdampffahnen neben Kohlenstoffdioxid und Ammoniak auch Methan und höhere organische Verbindungen nachgewiesen werden. An der Oberseite des Ozeans könnten Methanhydrat und andere Gashydrate eine Schicht an der Grenzfläche zwischen Eis und Ozean bilden.[56] Methanhydrat könnte sich in der Spalte, die den Ozean mit der Oberfläche verbindet, zersetzen und dabei Methan freisetzen.
Entstehung
Herkunft des Methans
Das Methan im Methanhydrat stammt aus biologischen oder thermogenen Quellen sowie aus der Serpentinisierung von Olivin. Der überwiegende Teil des Methans stammt aus der Methanogenese durch die Reduktion von Kohlenstoffdioxid durch biologisch erzeugten Wasserstoff. Dies ist die Bildung von Methan durch Mikroben aus der Domäne der Archaeen oder Urbakterien, bei denen die Produktion von Methan eine weit verbreitete Form des Stoffwechsels ist. Wenn organisches Material im Meeresboden versinkt, durchläuft es zunächst verschiedene oxidative Zonen. Unterhalb der oxidativen Zonen beginnt die anaerobe methanbildende Zone.[31] In einer anoxischen Umgebung ist es der letzte Schritt bei der Zersetzung von Biomasse.
Thermogenes Methan entsteht durch thermokatalytischen Abbau komplexer organischer Moleküle. Es kann durch direktes Cracken von organischem Kerogen oder aus Erdöl erzeugt werden. Thermogene Methanquellen enthalten oft andere leichte Kohlenstoffverbindungen wie Ethan und Propan, die ebenfalls Gashydrate bilden. Die gemischten Gashydrate weichen in ihren physikalisch-chemischen Eigenschaften von denen des reinen Methanhydrats ab. Im Golf von Mexiko und im Kaspischen Meer tritt hauptsächlich thermogenes Methan in Methanhydrat auf.[57]
Die Serpentinisierung von Olivin mit Wasser läuft unter Bildung von Magnetit und Wasserstoff ab. Der freiwerdende Wasserstoff kann mit Kohlenstoffdioxid zu Methan und Wasser weiterreagieren.
Methan aus den verschiedenen Quellen kann anhand der Delta-C-13-Methode (δ13C) unterschieden werden. Dabei ist δ13C als das Isotopenverhältnis der stabilen Kohlenstoff-Isotope 13C und 12C zwischen einer Probe und einem Standard definiert. Methan hat eine stark abgereicherte δ13C-Signatur. Ein Wert von δ13C größer als -55 ‰ ist charakteristisch für Methan biogenen Ursprungs, ein Wert kleiner -55 ‰ ist charakteristisch für Methan thermogenen Ursprungs.[58]
Entstehung von Methanhydrat
Die Menge an Methanhydrat, die am Ort der mikrobiellen Methanbildung entsteht, ist gering. Die Sättigung des Wassers beträgt oft nur einige Prozent der zur Methanhydratbildung benötigten Konzentration. Zur Bildung von größeren Methanhydratschichten muss Methan durch Strömungstransport oder Diffusion zu einem Ort wandern, an dem sich höhere Methankonzentrationen ansammeln können. Der Transport von freiem Gas durch grobkörnige Sedimentschichten wurde in vielen Methanhydratansammlungen beobachtet.[31]
Methanhydrat bildet sich aus Wasser und Methan bei einem Druck ab etwa 2 Megapascal, also ab etwa 200 Meter Wassertiefe, und Temperaturen, die niedriger als 2 °C bis 4 °C sind. Methanhydrat tritt in drei verschiedenen Formen auf. Methanhydrat der Struktur I ist die weitest verbreitete Form und enthält überwiegend mikrobielles Methan sowie Spuren anderer Gase. Die Struktur II und Struktur H enthalten oft thermogenes Methan und höhermolekulare Kohlenwasserstoffe.[59] Methan ist das bei weitem vorherrschende Gas in allen natürlich vorkommenden Gashydraten, die bislang gefunden wurden.
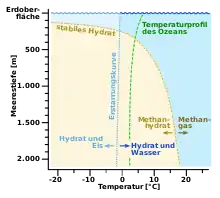
Das Phasendiagramm zeigt die Druck- und Temperaturbereiche, in denen sich Methanhydrat bilden kann. Auf der Abszissenachse ist die Temperatur aufgetragen, die Ordinatenachse zeigt die Meerestiefe und damit den Flüssigkeitsdruck. Die gebogene gestrichelte Linie, die den gelben Bereich umfasst, ist die Methanhydrat-Phasengrenze. Oberhalb und rechts von dieser Grenze sind die Temperaturen zu hoch und die Drücke zu niedrig für die Bildung von Methanhydrat, so dass dort gasförmiges Methan vorhanden ist. Unterhalb und links dieser Grenze bildet sich festes Methanhydrat. Es bleibt stabil, da die Temperaturen genügend niedrig und die Flüssigkeitsdrücke ausreichend hoch sind, um die feste Phase aufrechtzuerhalten.[60]
Bei der Entstehung von Methanhydrat muss das Wasser mit Methan übersättigt sein, ferner müssen bestimmte Druck- und Temperaturbedingungen herrschen. Nur bei hohen Drücken und niedrigen Temperaturen ist Methanhydrat stabil. Durch den Einschluss von anderen Gasen wie Schwefelwasserstoff oder Kohlenstoffdioxid kann sich Methanhydrat schon bei niedrigeren Drücken und etwas höheren Temperaturen bilden. Der Prozess der Methanhydratbildung ähnelt der Kristallisation und kann in eine Keimbildungs- und eine Wachstumsphase unterteilt werden.[61]
Abbaumethoden
Da Methanhydrat als Feststoff vorliegt, beruhten frühe Konzepte auf Bergbautechnologien, bei denen festes Methanhydrat oder Methanhydrat-haltiges Sediment mechanisch gewonnen wurde. Methanhydratvorkommen in großen, zusammenhängenden Lagerstätten, in denen sich das Hydrat in den durchlässigen Porenräumen von Sand oder Schlick befindet, können mit Techniken zur Förderung von Kohlenwasserstoffen abgebaut werden.[62] Zum Abbau werden die Druck und Temperaturbedingungen im Vorkommen so verändert, dass das Methanhydrat in seine Bestandteile zerfällt. Das freie Methan kann mit konventionellen industriellen Erdgasfördermethoden gewonnen werden.
Die ersten Produktionsversuche fanden im kanadischen Permafrostgebiet bei Mallik statt. Die Forschungsanlage befindet sich auf der nordwestlichen Seite der Richards Islands und ist Teil des Mackenzie-Deltas, das in die Beaufortsee mündet. Dort wurde 1998 im Rahmen eines Forschungsprojekts Methanhydrat gefunden. Die Auswertung von Bohrkernen zeigte zehn Methanhydratschichten, die in einer Tiefe von 890 bis 1106 Metern unter dem Erdboden liegen, mit einer Gesamtdicke von über 110 Metern. Mit Methanhydratsättigungswerten von teilweise über 80 % des Porenvolumens zählt das Feld in Mallik zu einem der konzentriertesten Methanhydratlagerstätten der Welt.[63] Die dort durchgeführten wissenschaftlichen Studien dienten zur Entwicklung von Sicherheitstechniken bei der Förderung von Methan aus Methanhydrat und erlaubten die Untersuchung von Bohr- und Fördertechniken im Hinblick auf eine industrielle Anwendung.[64] Eine ökonomische Förderung erfordert Produktionsraten von etwa 100.000 Kubikmeter pro Tag und Bohrloch.
Die Gewinnung von Methan aus Methanhydratvorkommen stellt eine technische und ökologische Herausforderung dar. Bei ersten Bohrungen, die auf den konventionellen Bohrtechniken beruhten, kam es zu thermischen und mechanischen Beeinflussungen der Methanhydratschichten. Probleme bereiteten etwa die Freisetzung von Erdgas, wenn ein unter hohem Druck stehendes, freies Erdgasreservoir unerwartet unter einer Methanhydratschicht angebohrt wurde. Ebenso kann Methan aus zerfallendem Hydrat außerhalb der Bohrung austreten.[62]
Bei allen Abbauverfahren entstehen große Wassermengen, da pro Molekül Methan sechs bis sieben Moleküle Wasser freigesetzt werden. Der Wärmebedarf zum Aufbrechen des Methanhydratkäfigs entspricht etwa 10 % des Heizwerts des Methans. Beim Abbau des Methanhydrats wird eine Absenkung der Erdoberfläche erwartet, wie sie bei der Ausbeutung konventioneller Lagerstätten zu beobachten ist.[29]
Injektionsmethode
Die Zerstörung von Methanhydrat ist durch das Einspritzen von heißem Wasser in den Methanhydrat-haltigen Untergrund möglich. Das entstehende Methangas kann über eine Bohrung gefördert werden.[64] Dabei ist es von Vorteil, wie bei allen anderen Fördermethoden, eine Bohrlochheizung einzusetzen, um die Neubildung von Methanhydrat im Bohrloch und in den Förderrohren zu vermeiden.
Druckentlastung
Weiterhin kann Methanhydrat durch Druckentlastung zersetzt werden. Die Energiebilanz ist gegenüber der Injektionsmethode erheblich verbessert, die Förderraten vergrößert.[64] Die Wärme zur Zersetzung des Methanhydrats kommt bei geringen Massenanteil des Gashydrats aus der Wärmekapazität des Wirtsgesteins, sonst zusätzlich aus der umgebenden Formation, bei mangelnder Permeabilität durch Wärmeleitung (schnell erschöpfend, siehe Thermische Welle), sonst durch Zustrom von Wasser.
Letzteres war der Fall beim Offshore-Produktionstest vor Honshu.[27] Dort wurden anfangs bis zu 20.000 Kubikmeter pro Tag gefördert. Allerdings blieb der in Simulationen gefundene Anstieg der Gasproduktion auf etwa das Vierfache aus. Dabei hätte sich durch Hydratabbau eine Zone erhöhter Permeabilität symmetrisch um das Bohrloch allmählich erweitert, mit erniedrigtem Druck in der ganzen Zone. Tatsächlich sank jedoch die Produktion bei gleichzeitigem Anstieg der abzupumpenden Wassermenge. Eine der drei Bohrungen lieferte 222.500 Kubikmeter Methan, bevor nach 24 Tagen der Test abgebrochen wurde, weil trotz maximaler Pumpleistung der Druck zu hoch blieb. Die beiden anderen Bohrungen waren weniger ergiebig und schneller von Versandung betroffen.
Laborexperimente zeigten, dass bei hohem anfänglichen Hydratanteil die Ausbeute erhöht werden kann, indem abwechselnd die Injektions- und die Druckentlastungsmethode angewendet werden, mit insgesamt geringerem Energieaufwand und höherer Ausbeute als per Injektionsmethode allein.[65]
Die Förderung von Methan aus Methanhydratvorkommen erfordert maßgeschneiderte Bohrtechnologien. Große Ressourcen befinden sich in sandreichen Lagerstätten, in denen sich durch die hohe Durchlässigkeit des Sediments hohe Konzentrationen von Methanhydrat ansammeln können. Die Bildung von Methanhydrat reduziert die Permeabilität signifikant, sie reicht jedoch aus, um Druckänderungen von einer Bohrung aus in ein Reservoir zu leiten.[18]
Austausch von Methan gegen Kohlenstoffdioxid
Die Gewinnung von Methan aus Methanhydrat kann unter anderem durch eine Austauschreaktion mit Kohlenstoffdioxid erfolgen. Durch die damit verbundene Sequestrierung von Kohlenstoffdioxid wäre die Gewinnung und energetische Verwendung des so gewonnenen Methans weitgehend klimaneutral.[30] Bei der Umwandlung entsteht Wärme, da Kohlenstoffdioxidhydrat stabiler als Methanhydrat ist. Die Bildungsenthalpie von Kohlenstoffdioxidhydrat aus Methanhydrat wird auf etwa 10 bis 11 kJ/mol pro Mol ausgetauschtes Gas geschätzt. Die Wärme der Kohlenstoffdioxidhydratbildung reicht daher für die Dissoziation des Methanhydrats.[66] Durch den Austausch entsteht eine Schicht aus Kohlenstoffdioxidhydrat, die eine weitere Reaktion kinetisch hemmt. Die theoretische Ausbeute wird bei diesem Prozess nicht erreicht.[67] Vielversprechend sind Methoden, welche Druckabsenkung, Wärmezufuhr und Kohlenstoffdioxidaustausch kombinieren.
Chemische Inhibition
Bei der chemischen Inhibitionsmethode wird das Methanhydrat aufgelöst, indem Chemikalien wie Methanol, welche die Hydratbildungstemperatur senken, sogenannte thermodynamische Inhibitoren, in die methanhydrathaltigen Schichten injiziert werden. Neben Methanol gehören Glycole wie Ethylenglycol, Ammoniak, sowie Chloride zu diesen Chemikalien.[68] Dieser Ansatz wird zur Prävention der Bildung von Methanhydrat sowie Beseitigung von Ablagerungen in Erdgaspipelines verwendet.[69] Die Wirksamkeit der Methode hängt ab vom Typ des Inhibitors, der Inhibitorkonzentration, des Drucks und der Zusammensetzung des hydratbildenden Gases. Thermodynamische Inhibitoren müssen in relativ großen Mengen verwendet werden.
Alternativ können kinetische Hydratinhibitoren und Anti-Agglomerantien verwendet werden, welche die Methanhydratbildung verhindern. Kinetische Hydratinhibitoren sind typischerweise wasserlösliche Polymere wie Polyvinylpyrrolidon oder Polyvinylcaprolactam mit niedrigem Molekulargewicht, die hydrophile Amid- sowie hydrophobe funktionelle Gruppen enthalten, die an die Grenzfläche zwischen Methanhydrat und flüssigem Wasser binden und so eine Verzögerung der Hydratbildung bewirken.[70]
Die Methanhydratagglomeration besteht aus den Schritten der Hydratkeimbildung, dem Hydratkristallwachstum und der Assoziation von Hydratagglomeraten unter Bildung größerer Aggregate. Anti-Agglomerate, typischerweise amphiphile, oberflächenaktive Verbindungen, stören die molekularen Wechselwirkungen zwischen Hydrataggregaten und Wassermolekülen, die eine entscheidende Rolle bei der Agglomeration spielen.[70]
Thermische In-Situ-Stimulation
Eine Methode nutzt die thermische In-situ-Stimulation durch den Wärmeeintrag in die Methanhydratzone über eine Luft-Gas-Verbrennung in einem Behälter vor Ort. Die Verbrennung liefert die notwendige Wärme für die Zersetzung des Methanhydrats. Bei dieser Methode werden etwa 1,1 bis 1,7 % des Methans verbrannt, um das Methanhydrat zu zersetzen. Da die Wärmeerzeugung in einem Behälter erfolgt, wird das entstehende Methan nicht mit den Abgasen vermischt.[71]
Eigenschaften
Physikalische Eigenschaften
Methanhydrat bildet eine gelbe bis graue, transparente bis durchscheinende Masse, welche die Porenräume des Sediments ausfüllt und zusammenhängende Ablagerungen bildet. Unter Normbedingungen hat es eine Dichte von etwa 900 Kilogramm pro Kubikmeter. In der Natur kommt es vermengt mit schwererem Material, etwa Sand oder Gestein vor, die seinem Auftrieb im Wasser entgegenwirken. Das Sediment wird dabei mit stabilisierender Wirkung zementiert. Aufgrund des gegenüber Wasser etwa 4,5-fach höheren Kompressionsmoduls von Methanhydrat bleibt dieser Auftrieb in jeder Meerestiefe erhalten, ja vergrößert sich mit der Tiefe geringfügig.
Bei einer Temperatur von 0 °C enthält 1 Kubikmeter Methanhydrat etwa 164 Kubikmeter Methan.[30] Die Konzentration von Methan im Methanhydrat I ist etwa 5500 mal größer als seine Löslichkeit im flüssigen Wasser.[73] Durch den hohen Gehalt an Methan entzündet sich dissoziierendes Methanhydrat an einer offenen Flamme, die Substanz sieht dann aus wie brennendes Eis.
Bisher wurden drei Kristallstrukturen von Methanhydraten gefunden: Typ I bei Einlagerung von Methan und Ethan sowie bei Kohlenstoffdioxid und Dihydrogensulfid, Typ II bei Propan und Isobutan und Typ H bei längerkettigen Kohlenwasserstoffen wie zum Beispiel Methylcyclohexan. Die Stabilitätszone von reinem Methanhydrat beginnt bei einer Temperatur von etwa 5 °C und einem Druck von 5 Megapascal oder 50 Bar, entsprechend einer Wassertiefe von etwa 500 Metern. Andere Gase, etwa Schwefelwasserstoff, die mit Methan und Kohlenstoffdioxid gemischte Hydrate bilden, können den stabilen Bereich bei konstanter Temperatur um etwa 1 MPa erniedrigen oder um etwa 2 °C bei konstantem Druck erhöhen.
Struktur I weist eine kubisch-raumzentrierte Struktur auf. Struktur II, eine Diamantstruktur, bildet sich, wenn das Hydrat neben Methan Moleküle aus thermogenen Gas, die größer als Ethan und kleiner als Pentan sind, enthält. In der Struktur H besetzt Methan die kleinen Käfige, daneben kann es Moleküle bis zur Größe von Ethylcyclohexan enthalten.[72]
| Eigenschaft | Eis | Methanhydrat I | Methanhydrat II |
|---|---|---|---|
| Raumgruppe | P63/mmc (Nr. 194) | Pm3m (Nr. 221) | Fd3m (Nr. 227) |
| Anzahl Wassermoleküle | 4 | 46 | 136 |
| Gitterparameter bei 273 K | a = 4,52 c = 7,36 | 12,0 | 17,3 |
Bei einem Druck von etwa 2500 Bar lagert sich reines Methanhydrat I in Methanhydrat II um, bei 6000 Bar in die H-Form.[74] Da in tiefliegenden Sedimenten diese Drücke herrschen, könnten diese Formen dort gegenüber der herkömmlichen Form I vorherrschen.
Molekulare Eigenschaften

Mit der Bildung von 8 Käfigen pro 46 Wassermolekülen im Methanhydrat I beträgt das molare Verhältnis von Methan zu Wasser bei vollständiger Belegung aller Käfige 1 : 5,75 Mol Wasser, die Formelschreibweise lautet daher CH4 · 5,75 H2O. In natürlich vorkommenden Methanhydrat ist die Belegung der Käfige, Hydratzahl genannt, geringer und das molare Verhältnis beträgt etwa 1 : 6,0 bis 1 : 6,2 Mol Wasser. Die gebundene Masse an Methan ist daher bei natürlich vorkommenden Methanhydrat etwa um 4 bis 7 % geringer als im Idealfall.[75]
| Methanhydrat | sI | sII | sH | ||||
|---|---|---|---|---|---|---|---|
| Käfiggröße | klein | groß | klein | groß | klein | mittel | groß |
| Bezeichnung | 512 | 51262 | 512 | 51264 | 512 | 435663 | 51268 |
| Anzahl der Käfige pro Einheitszelle | 2 | 6 | 16 | 8 | 3 | 2 | 1 |
| mittlerer Käfigradius in pm | 395 | 433 | 391 | 473 | 391 | 406 | 571 |
| Anzahl der Sauerstoffatome pro Käfig | 20 | 24 | 20 | 28 | 20 | 20 | 36 |
Der Zerfall des Methanhydrats wurde auf molekularer Ebene mittels 13C-Magic-Angle-Spinning-Kernspinresonanzspektroskopie untersucht. Dabei zeigte sich, dass die Art der Käfigbesetzung während der Dissoziation konstant blieb. Die gesamte Einheitszelle zersetzte sich während der Dissoziation, keine Hydratkäfigart erwies sich stabiler als eine andere.[76]
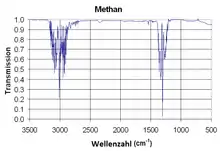
Die C-H-Streckschwingungsbande von Methan Struktur I in den 51262-Käfigen liegt im Ramanspektrum bei einer Wellenzahl von 2904 cm–1, in den 512-Käfigen bei 2916 cm–1. Anhand der Integralintensitäten der Peaks der verschiedenen C-H-Streckschwingungen lässt sich die Struktur des Methanhydrats abschätzen.[30]
Verwendung
Rohstoff

Die Nutzung fossiler Energieträger entsprach zwischen 1880 und 1998 etwa 250 Gigatonnen Kohlenstoff. Die Schätzungen über den Anteil der Methanhydratvorkommen, der als Brennstoff gewonnen und genutzt werden kann, sind mit großen Unsicherheiten behaftet, doch selbst bei konservativen Schätzungen birgt Methanhydrat ein enormes Energiepotenzial für die Zukunft.[77]
Unter der Voraussetzung, dass Methan aus Methanhydrat sicher, wirtschaftlich und umweltverträglich gefördert werden kann, sind die Folgen für die Energieversorgung und der Einfluss auf das Klima möglichenfalls weitreichend. Durch das hohe molare Verhältnis von Wasserstoff zu Kohlenstoff von 4 : 1 im Methan wird bei der Verbrennung von Methan eine größere Menge an Energie pro freigesetztem Kohlenstoffdioxidmolekül geliefert als bei allen anderen kohlenstoffhaltigen Energieträgern.
Im Erdöl beträgt das ungefähre molare Verhältnis von Wasserstoff zu Kohlenstoff etwa 2 : 1 und bei Kohle etwa 1 : 1. Gegenüber reinem Kohlenstoff ist der Brennwert von Methan mehr als doppelt so hoch. Methan wird daher als Energiequelle gegenüber anderen Kohlenwasserstoffen bevorzugt.[62]
Verstopfung von Erdgaspipelines
Zur Unterdrückung der Methanhydratbildung in Pipelines können chemische, hydraulische, thermische und mechanische Methoden angewandt werden.[79] Additive wie Ethylenglycol oder Methanol verschieben die Gleichgewichtstemperatur der Methanhydratbildung und unterdrücken so ihre Entstehung. Methanol ist ein oft verwendeter Inhibitor, da es sich in Kondensatableitern anreichern kann, nachdem es vorher in das vorgelagerte Erdgas verdampft wurde.[80] Dispergiermittel wie quartäre Ammoniumverbindungen unterdrücken die Agglomeration des Methanhydrats. Polymere verlangsamen das Wachstum der Methanhydratkristalle. Sowohl Dispergiermittel als auch Polymere unterdrücken die Bildung von Methanhydrat bereits in geringen Konzentrationen.[79]
Durch die hydraulische Methode der Druckentlastung lassen sich in Pipelines bereits gebildete Methanhydratkristalle entfernen. Bei der thermischen Methode wird die Rohrleitung durch Begleitheizungen erwärmt. Diese Methode eignet sich vor allem bei Instrumenten wie Ventilen oder Probenahmestellen.

Als mechanische Methode eignet sich das Molchen von Rohrleitungen. Die Molche bewegen sich durch den Produktstrom durch die Rohrleitung und entfernen Ablagerungen von Methanhydraten. Die Verfahren können zur Steigerung der Effizienz kombiniert werden.[79] Die Beseitigung von Pipelineblockaden durch den Zerfall von Methanhydrat birgt einige Risiken. Beim Aufheizen von außen löst sich der Hydratpfropfen von der Rohrleitungswand ab. Die Freisetzung des Methans führt zu einer starken Volumen- oder Druckerhöhung. Diese können den Methanhydratpfropfen in der Pipeline beschleunigen, es wurden Geschwindigkeiten von bis zu 300 km/h gemessen. Dies wiederum kann zur Druckerhöhung im transportierten Erdgas oder zum Bruch der Pipeline führen.[81]
Bei der Triethylenglycoltrocknung entwässert Triethylenglycol Erdgas durch die Absorption des darin enthaltenen Wassers und senkt so dessen Taupunkt. Dazu rieselt Triethylenglycol im Gegenstromverfahren vom oberen Ende einer Kolonne nach unten und entwässert dabei das feuchte, aufsteigende Erdgas.[82] Getrocknetes Erdgas tritt am oberen Ende der Kolonne aus, während das Triethylenglycol getrocknet und wiederverwendet wird. Durch die Trocknung fällt der Wassergehalt im Erdgas unter die notwendige Grenzkonzentration zur Bildung von Methanhydrat.[83]
Einsatz als Speicher
Der Transport und die Lagerung von Erdgas erfolgt konventionell als Flüssigerdgas oder in komprimierter Form. Dies erfordert tiefe Temperaturen oder hohe Drücke. Bei der Nutzung von Methanhydrat kann Methan zunächst als Methanhydrat gespeichert und bei Bedarf daraus freigesetzt werden. Die Bildung reinen Methanhydrats erfordert jedoch immer noch relativ hohe Drücke und niedrige Temperaturen. Die Verringerung des Hydratbildungsdrucks durch Bildung gemischter Hydrate, die neben Methan etwa Propan, Tetrahydrofuran oder Promotoren wie Natriumlaurylsulfat enthalten, ist ein zentrales Thema der Hydratforschung.[84] Die Methanfreisetzung kann durch die Regulierung der Hydrattemperatur gesteuert werden. Methanhydrat ist zwar bei einer höheren Temperatur als verflüssigtes Erdgas stabil, dafür ist das benötigte Volumen für den Transport ungefähr 7,5 mal größer. Der Verlust an Transportvolumen gegenüber Flüssigerdgas macht eine technische Anwendung eher unwahrscheinlich.
Gastrennung
Methan als Bestandteil des Grubengases kann durch die Bildung von Methanhydrat angereichert werden und so von Stickstoff und Sauerstoff getrennt werden. Für die Abtrennung von Methan aus niedrig konzentriertem Grubengas eignet sich zum Beispiel eine Mischung aus Wasser und Tetrahydrofuran bei Temperaturen um 5 °C und Drücken zwischen 3 und 10 bar.[85] Tenside wie Natriumlaurylsulfat scheinen die Trennwirkung zu verstärken.[86]
Meerwasserentsalzung
Die Idee der Meerwasserentsalzung mit Methanhydrat und anderen Gashydraten wurde schon früh verfolgt. Koppers entwickelte in den 1960er Jahren ein Verfahren auf Basis von Propan. Andere Verfahrensvarianten beruhten auf der Verwendung des Kühlmittels von 1,1-Dichlor-1-fluorethan (R-141b) oder von Kohlenstoffdioxid. Die Trennung von Sole und Hydraten erfordert eine Filtration.
Mit Methanhydrat konnten auf Basis der „hydratbasierten Desalinierung (HBS)“ von Meerwasser zwischen 70 und 95 % der Kationen und 73 bis 83 % der Anionen entfernt werden.[87] Wird das feste Methanhydrat von der flüssigen Sole abgetrennt, wird nach der Hydratdissoziation das Süßwasser gewonnen und Methan kann in den Kreislauf zurückgespeist werden. Dies ist der grundlegende Entsalzungsprozess auf Methanhydratbasis. Gegenüber etablierten Methoden wie der Umkehrosmose oder der mehrstufigen Entspannungsverdampfung spielt die Seewasserentsalzung auf Basis von Hydraten eine untergeordnete Rolle.[88]
Hydratkältespeicherung
Für die Technik der Hydratkältespeicherung wird Methan in Kombination mit anderen Substanzen wie einem Kältemittel und Kohlenstoffdioxid eingesetzt. Die technische Umsetzung befindet sich noch im Entwicklungsstadium. Der erste Schritt der Hydratkältespeicherung ist die Senkung der Temperatur auf den Hydratbildungspunkt. Dort erfolgt die exotherme Methanhydratbildung, die den Hauptteil der Kältespeicherung darstellt. Die gespeicherte Kälteenergie kann durch endotherme Hydratdissoziation durch Aufnahme von Wärme aus der Umgebung freigesetzt werden. Die Wahl eines geeigneten Gasgemischs ist für die hydratbasierte Kältespeicherung von großer Bedeutung. Wegen Sicherheitsbedenken, besonders hinsichtlich Gasleckagen, sind momentan keine industriellen Systeme auf Basis von Methan im Einsatz.[70]
Biologische Bedeutung
Bakterien
Bei einer Untersuchung der Bakterienvorkommen in den tiefen hydrathaltigen Sedimenten vom Blake Ridge und der Cascadia Margin wurden sowohl methanoxidierende als auch methanbildende Bakterien nachgewiesen. Methan, das mikrobiologisch in tieferen Sedimenten gebildet wird, steigt nach oben und bildet dort Methanhydrat. Die Hydratstabilitätszone war ein Habitat methanoxidierender Populationen, dort waren die Methanoxidationsraten am höchsten. Hauptsächlich wurden dort Gemeinschaften von Proteobacteria nachgewiesen.[89] Diese nutzen die eisenhaltige Methan-Monooxygenase für die Oxidation des Methans zu Methanol.[90] In der Zone direkt darunter stieg die Rate der Methanogenese stark an. Als Methanbildner wurden hauptsächlich Methanosarcinales und Methanobacteriales gefunden.
Eiswürmer

Im nördlichen Golf von Mexiko kommt es an Cold Seeps zu Austritten von thermogenem Methan aus unterirdischen Reservoiren. Das austretende Methan bildet zum Teil Methanhydratablagerungen am Meeresgrund. Im Juli 1997 wurde im Golf von Mexiko in einer Tiefe von über 500 Metern eine Population rosafarbener, etwa 2 bis 4 Zentimeter langer Vielborster entdeckt, die auf Methanhydraten leben. Die Würmer, auch „Eiswürmer“ oder „Methaneiswürmer“ (Sirsoe methanicola) genannt, gehören zur Familie der Hesionidae.[91][92] Die Eiswürmer graben sich in das Methanhydrat ein und schaffen dadurch kleine Vertiefungen. Die Würmer besiedeln nicht nur freiliegendes Methanhydrat, sondern auch Hydrat, das von Sediment bedeckt ist. Die Besiedlungsdichte liegt bei etwa 2500 Individuen pro Quadratmeter.
Die Isotopenuntersuchung des Gewebes der Eiswürmer deutet auf eine chemoautotrophe Nahrungsquelle hin. Dabei handelt es sich um chemoautotrophe Bakterien, die frei auf dem Methanhydrat leben und Methan verstoffwechseln. Die Würmer versorgen ihren Lebensraum mit Sauerstoff und tragen so zur Auflösung des Methanhydrats bei.[93]
Bathymodiolus-Muscheln

Auf den Methanhydratvorkommen werden neben den Eiswürmern die Miesmuscheln Bathymodiolus childressi gefunden. Diese beherbergen in den Kiemen bakterielle chemoautotrophe Symbionten, die sich vom Methan ernähren, das aus dem Meerwasser aufgenommen wird.[94] Das in den Tieren gefundene Kohlenstoffisotopenverhältnis δ13C von -51 bis -57 ‰ unterstützt die Annahme, dass Methan die primäre Kohlenstoffquelle sowohl für die Muschel als auch für die Symbionten ist.[95]
Röhrenwürmer
An Methanhydratablagerungen wurden größere Hügel von Ansammlungen von Röhrenwürmern der Gattung Vestimentiferans besiedelt. Ihre primäre Nahrung stammt aus den sulfidreichen Flüssigkeiten, die von symbiotischen Schwefelwasserstoff- oder Methan-oxidierenden Bakterien verstoffwechselt werden, die in einem inneren Organ, dem Trophosom, leben. Wenn der Wurm stirbt, werden die Bakterien freigesetzt und kehren zur freilebenden Population im Meerwasser zurück.[96]
Klimarelevanz
Methan absorbiert die von der Erde emittierte Infrarotstrahlung stärker als Kohlenstoffdioxid, was durch sein globales Erwärmungspotenzial relativ zu Kohlenstoffdioxid beurteilt wird; für einen Zeithorizont von 100 Jahren beträgt der Wert 28. In der Atmosphäre wird Methan durch Hydroxyl-Radikale über Zwischenstufen wie Formaldehyd letztendlich zu Kohlenstoffdioxid und Wasser oxidiert. Die atmosphärische Halbwertszeit wird auf 12 Jahre geschätzt.[97]
Paläoklima

Die Variation in der atmosphärischen Methan-Konzentration beeinflusste mit hoher Wahrscheinlichkeit die Oberflächentemperatur der Erde im Laufe der Erdgeschichte.[98] Methankonzentrationen von 1000 Parts per million oder höher sollen die geringere Strahlungsleistung der schwachen jungen Sonne in der fernen Vergangenheit kompensiert haben. Sie werden als Erklärung für Oberflächentemperaturen über dem Gefrierpunkt zu jener Zeit angenommen. Die Oxidation des atmosphärischen Methans während der großen Sauerstoffkatastrophe, dem Anstieg der Konzentration von molekularem Sauerstoff und die damit verbundene Abnahme der Methankonzentration in der Atmosphäre vor etwa 2,4 Milliarden Jahren, und der dadurch fehlende Treibhauseffekt soll verantwortlich für die paläoproterozoische Vereisung sein.[99]
Sich auflösendes Methanhydrat als Quelle für atmosphärisches Methan wurde als Erklärung für verschiedene paläoklimatische Ereignisse diskutiert. So wird der Rückgang der globalen Vereisungen der Schneeball Erde im späten Präkambrium auf die Auflösung von Methanhydrat im äquatorialem Permafrost zurückgeführt.[100] Die Hypothese einer Gesamtvereisung der Erde ist jedoch fachwissenschaftlich umstritten.
Eine starke Freisetzung von Methan scheint vor 55 Millionen Jahren während des Paläozän/Eozän-Temperaturmaximums und des Eocene Thermal Maximum 2 erfolgt zu sein. Damals kam es zu einer weltweiten Erwärmung der Atmosphäre. In den Gesteinen jener Zeit finden sich heute Belege für einen schnellen Anstieg des Methangehaltes der Luft. Das Muster der Isotopenverschiebungen, das als Ergebnis einer massiven Freisetzung von Methan aus Methanhydrat erwartet wird, stimmt jedoch nicht mit den beobachteten Mustern überein. Das Deuterium-zu-Wasserstoff-Isotopenverhältnis deutet darauf hin, dass das Methan in Feuchtgebieten freigesetzt wurde.[31] Es wurden bei der Untersuchung grönländischer Eisbohrkerne keine Hinweise dafür gefunden, dass massive Methanemissionen, die mit einem großräumigen Zerfall von Methanhydrat verbunden sein könnten, Wärmeperioden wie das Alleröd-Interstadial ausgelöst oder verstärkt haben könnten.[101]
Im Zuge der globalen Erwärmung kann es durch eine chronische Methanfreisetzung über Jahrhunderte hinweg zu hohen Methankonzentrationen in der Atmosphäre, zu einer sich verstärkenden Rückkopplung kommen, da das Methan den Treibhauseffekt verstärkt. Abschmelzendes Kontinentaleis, dessen Wasser den Meeresspiegel ansteigen lässt und somit den Druck auf den Meeresboden erhöht, kann die Hydratvorkommen nur in geringem Maße stabilisieren. Dabei ist ungeklärt, ob beim Zerfall tatsächlich genügend Methan in die Atmosphäre gelangen kann, um einen Klimawandel auszulösen. Ein Hinweis darauf sind die Kohlenstoff-Isotopenverteilungen in marinen Carbonaten des Paläozäns.
Treibhauspotenzial
Der Zerfall von Methanhydraten trug im Jahr 2017 mit etwa 6 Millionen Tonnen freigesetztem Methan nur im geringen Umfang zur Methanbilanz der Atmosphäre bei. Methanemissionen aus Feuchtgebieten und der Landwirtschaft dagegen setzten je über 200 Millionen Tonnen Methan frei.[35] Die Erwärmung der Ozeane und der Atmosphäre reduziert jedoch das Methanhydratstabilitätsfeld und führt zu einer Freisetzung des in Methanhydrat gebundenen Methans in die darüber liegenden Sedimente und Böden. Das freie Methan kann diffusiv oder als Gas aufsteigend aus dem Meeresboden in das Ozeanwasser entweichen. Herausgebrochene einzelne Methanhydratbrocken ohne Sedimentanhaftungen sind leichter als Wasser, steigen auf und zerfallen teilweise auf ihrem Weg nach oben und transportieren das Methan schnell in höhere Wasserschichten. Diese Art des Transports ist selten und trägt kaum zur Methanfreisetzung bei.
Faktoren wie die mikrobiologische Verstoffwechslung von Methan vermindern überdies die Auswirkungen der Methanhydratdissoziation auf die atmosphärische Methankonzentration.[35] Auf dem Weg an die Meeresoberfläche kann Methan auf zwei Arten abgebaut werden. Einerseits durchläuft das Methan noch im Meeresboden eine anaerobe Methanoxidationszone, in der eine Oxidation durch Sulfate gemäß folgender Reaktionsgleichung erfolgt:
Das entstehende Hydrogencarbonat fällt als Calciumcarbonat aus und bildet und dadurch eine wichtige Senke für aus Methanhydrat freigesetztes Methan. In der darüberliegenden aeroben Zone wird es durch den dort gelösten Sauerstoff bakteriell oxidiert, wobei Kohlenstoffdioxid freigesetzt wird. Das gebildete Kohlenstoffdioxid senkt den pH-Wert und trägt somit zur Versauerung der Meere bei. Der Einfluss der marinen Tiefseevorkommen auf die atmosphärische Methanbilanz ist vernachlässigbar und wird auch längerfristig als gering eingestuft, denn wegen des hohen hydrostatischen Drucks ist dort Methanhydrat dauerhaft unempfindlich gegen anthropogene Erwärmung.[35]
Einen größeren Einfluss auf das Klima könnten marine Methanhydratvorkommen in der Nähe des marinen Stabilitätsfelds und in terrestrischen und überschwemmten Permafrostböden der kontinentalen arktischen Regionen haben. Im Arktischen Ozean werden aufgrund der niedrigen Temperatur Methanhydratvorkommen bereits ab einer Wassertiefe von etwa 300 Metern im Sediment erwartet.[102] Methan ist in geringeren Meerestiefen aufgrund des dortigen geringeren Drucks schlechter löslich in Wasser, kann in Bläschen aufsteigen und in die Atmosphäre gelangen.
Eine Erwärmung der Permafrostböden kann Methan freisetzen, sobald der Boden auftaut. Eine Studie von 2016 schätzte den Beitrag des aus Permafrost freigesetzten Methans zur globalen Erwärmung als „noch relativ gering“ ein. Im Jahr 2020 wurden vor der ostsibirischen Küste Hinweise dafür gefunden, dass im Arktischen Ozean über einem Bereich des Kontinentalhangs Methan aus Methanhydraten freigesetzt werden könnte.[103] Gelangt Methan aus diesen Sedimenten und Böden in die Atmosphäre, könnte es einen positiven Rückkopplungseffekt auf den aktuellen Klimawandel haben und eine Beschleunigung der globalen Erwärmung verursachen.[104]
Georisiken
Storegga-Rutschung
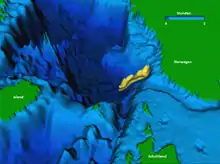
Am Rande des norwegischen Kontinentalschelfs in der Norwegischen See ereigneten sich jeweils gegen Ende der letzten Eiszeiten submarine Erdrutschungen. Die drei bekannten Storegga-Rutschungen zählen zu den größten bekannten Rutschungen. Die letzte Rutschung mit einem Volumen von 3500 Kubikkilometern Geröll ereignete sich vor etwa 8200 Jahren und verursachte einen Megatsunami im Nordatlantik.
Als Auslöser für die Rutschungen wurde sich auflösendes Methanhydrat in einer Tiefe von etwa 170 bis 260 Metern unterhalb des Kontinentalhangs angesehen. Einströmendes warmes Wasser soll die Stabilitätszone des Methanhydrats verlagert und den Druckeffekt eines steigenden Meeresspiegels durch den Rückgang des Eisschilds überkompensiert haben.
Andere Theorien gehen davon aus, dass die Wasserströme schmelzender Gletscher Billionen Tonnen Sediment in den Ozean beförderten. Dieses sammelte sich am Rande des Kontinentalschelfs an, wo der flachere Meeresboden um Skandinavien in die Tiefen der Norwegischen See abfällt. Ein Erdbeben in einem Gebiet 150 Kilometer hangabwärts vom Ormen-Lange-Gasfeld machte die Unterwasserablagerungen instabil und löste die Rutschung aus.[105]
Cape-Fear-Rutschungen
Seismische Daten deuten darauf hin, dass sich am Cape Fear in der Nähe von Wilmington in North Carolina in den letzten 30.000 Jahren mindestens fünf große submarine Rutschungen ereignet haben. Nachdem dort Vorkommen von Methanhydrat gefunden wurden, wurden sich auflösende Methanhydratvorkommen als Auslöser der Rutschungen diskutiert. Obwohl der genaue Auslösemechanismus für die Cape-Fear-Rutschereignisse nur unzureichend bekannt ist, deuten neuere Untersuchungen darauf hin, dass zumindest bei vier von fünf Ereignissen die Rutschung weit oberhalb der Methanhydratvorkommen stattfand.[106]
Methanentgasungtektonik
In der Nähe von Hudiksvall in Schweden gibt es eine Reihe von deformierten Gesteinsoberflächen und granitischen Höhlen. Wahrscheinlich war das Gebiet in prähistorischer Zeit von einem starken Erdbeben betroffen. Der Bereich der dortigen Boda-Höhle ist deformiert und in Blöcke zerschnitten. Die Entfernung der Boda-Höhle vom Epizentrum des damaligen Erdbebens beträgt etwa 12 Kilometer. Es wird vermutet, dass die dort angetroffene Deformation durch einen explosiven Methanhydratzerfall, der durch die seismische Schockwelle des Erdbebens ausgelöst wurde, entstanden ist.[107]
Einfluss auf die Schifffahrt
.svg.png.webp)
Der Zerfall von großen Mengen Methanhydrat und daraus aufsteigende Methanblasen wurden wiederholt für den Untergang von Schiffen im Bermudadreieck verantwortlich gemacht. Das archimedische Prinzip besagt, dass der statische Auftrieb eines Körpers in einem Medium genauso groß ist wie die Gewichtskraft des vom Körper verdrängten Mediums. Aufsteigende Methangasblasen reduzieren die Dichte des Meerwassers. Diese Abnahme verringert die Auftriebskraft auf das schwimmende Objekt, wodurch es möglicherweise sinken kann. Ebenfalls könnten einzelne, große Methanblasen Schiffe untergehen lassen.
Die Energie für den Zerfall von Methanhydrat erfordert eine hohe Wärmezufuhr oder einen signifikanten Druckabfall.[108] Es gibt Hinweise darauf, dass ein Methanhydratabbau durch Druckreduktion in Zusammenhang mit den Eiszeiten stattfand. Da das Meerwasser in den großen kontinentalen Eisschilden gebunden wurde, senkte sich der Meeresspiegel ab. Dadurch verringerte sich der Druck auf das Methanhydrat, was eine Methanfreisetzung zur Folge hatte. Dieser Mechanismus verläuft jedoch langsam und die Freisetzung erfolgt über einen langen Zeitraum. Bei Methanhydratvorkommen, die nahe an der Grenze der Methanhydratstabilitätszone liegen, gibt es Hinweise darauf, dass Druckänderungen durch den Tidenhub Methan freisetzen können.[109] Neben der Tatsache, dass im Bermudadreieck keine ungewöhnliche Anzahl von Schiffen gesunken ist, treffen die bislang in Betracht gezogenen Möglichkeiten einer spontanen Gasfreisetzung aus Methanhydrat nicht auf das Bermudadreieck zu.
Nachweis

Der Nachweis von Methanhydrat an den Kontinentalrändern erfolgt meist mit seismischen Methoden. Dabei wird die Struktur des Untergrunds durch reflektierte akustische Signale untersucht. Als Schallquelle werden Luftpulser verwendet, die Aufnahme der reflektierten Schallwellen erfolgt durch Hydrophone.
Der akustische Wellenwiderstand ist unterhalb des Meeresbodens im Sediment höher als in der darüberstehenden Wassersäule. An der Grenzfläche zweier Stoffe mit einem großen Unterschied im Wellenwiderstand wird der Schall stark reflektiert. Das Signal eines methanhydratfreien Meeresbodens ist durch eine spezielle Art der Reflexion gekennzeichnet, bei der das unterirdische Volumen härter ist als das darüber liegende Volumen.[110]
Bei methanhydratführenden Schichten ist der bodensimulierende Reflektor durch eine andere Art der Reflexion gekennzeichnet, die auf einen hohen Wellenwiderstand im Methanhydrat über methangasgefüllten Sedimenten mit niedrigem Wellenwiderstand hinweist. Die Erkundung der Lage von Methanhydratgebieten mittels seismischer Methoden ist in Gegenden, in denen der bodensimulierende Reflektor leicht erkennbar ist, relativ einfach. Der bodensimulierende Reflektor markiert normalerweise die Basis einer Methanhydratschicht, unter der sich freies Gas befindet. Die Bestimmung des genauen Anteils des Methanhydrats im Sediment allein durch seismische Methoden ist jedoch schwierig und gegebenenfalls ungenau. In Gebieten ohne freies Gas unterhalb des Methanhydrats ist kein bodensimulierender Reflektor vorhanden, der Nachweis von Methanhydrat erfordert dort andere Methoden, etwa die Gewinnung von Bohrkernen.[110]
In der Weltraumforschung könnte der Einsatz von Infrarotspektroskopie eine Möglichkeit zum Nachweis von Methanhydrat sein. Die eingeschlossenen Methanmoleküle zeigen bei niedrigen Temperaturen von 10 bis 200 Kelvin im nahen bis mittleren Infrarotbereich in den Wasserkäfigen ein gasförmiges Verhalten, deren Schwingungsspektren einzigartig für Methanhydrat sind.[111]
Weblinks
Literatur
- E. Dendy Sloan Jr., Carolyn A. Koh: Clathrate hydrates of natural gases. CRC Press, 2008, Boca Raton, ISBN 978-0-8493-9078-4, 730 Seiten.
- Yuri F. Makogon: Hydrates of Hydrocarbons. Penn Well Publishing Company, Tulsa, 1997, ISBN 0-87814-718-7, 482 Seiten.
Einzelnachweise
- Eintrag zu Clathrate. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01097 – Version: 3.0.1.
- Eintrag zu Einschlussverbindung. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.I02998 – Version: 3.0.1.
- Erich Rummich: Energiespeicher. Grundlagen, Komponenten, Systeme und Anwendungen. Expert Verlag, Renningen, 2009, ISBN 978-3-8169-2736-5, S. 56–59.
- Keith C. Hester, Peter G. Brewer: Clathrate Hydrates in Nature. In: Annual Review of Marine Science. 1, 2009, S. 303–327, doi:10.1146/annurev.marine.010908.163824.
- Marco Lauricella u. a.: Methane clathrate hydrate nucleation mechanism by advanced molecular simulations. In: The Journal of Physical Chemistry. C 118.40, 2014, S. 22847–22857.
- Hailong Lu u. a.: Complex gas hydrate from the Cascadia margin. In: Nature. 445, 2007, S. 303–306, doi:10.1038/nature05463.
- E. Dendy Sloan Jr., Carolyn A. Koh: Clathrate hydrates of natural gases. CRC Press, 2008, Boca Raton, ISBN 978-0-8493-9078-4, S. 1–2.
- Yuri F. Makogon: Hydrates of Hydrocarbons. Penn Well Publishing Company, Tulsa, 1997, ISBN 0-87814-718-7, S. 1–3.
- S. V. Goshovskyi, Oleksii Zurian: Gas Hydrates – History of Discovery. In: Мінеральні ресурси України. 2019, S. 45–49, doi:10.31996/mru.2019.1.45-49.
- Yu A. Dyadin u. a.: Half-century history of clathrate chemistry. In: Journal of Structural Chemistry. 40.5, 1999, S. 645–653.
- E. G. Hammerschmidt: Formation of Gas Hydrates in Natural Gas Transmission Lines. In: Industrial & Engineering Chemistry. 26, 1934, S. 851–855, doi:10.1021/ie50296a010.
- M. von Stackelberg: Feste Gashydrate. In: Naturwissenschaften. 36, 1949, S. 327–333, doi:10.1007/BF00596788.
- M. v. Stackelberg, H. R. Müller: Feste Gashydrate II. Struktur und Raumchemie. In: Zeitschrift für Elektrochemie, Berichte der Bunsengesellschaft für physikalische Chemie. 1954, S. 25–39, doi:10.1002/bbpc.19540580105.
- M. v. Stackelberg, W. Meinhold: Feste Gashydrate III. Mischhydrate. In: Zeitschrift für Elektrochemie, Berichte der Bunsengesellschaft für physikalische Chemie. 1954, S. 40–45, doi: 10.1002/bbpc.19540580106.
- J.C. Platteeuw, J.H. van der Waals: Thermodynamic properties of gas hydrates. In: Molecular Physics. 1, 2010, S. 91–96, doi:10.1080/00268975800100111.
- E. Dendy Sloan Jr., Carolyn A. Koh: Clathrate Hydrates of Natural Gases. CRC Press, Boca Raton, London, New York, ISBN 978-0-8493-9078-4, S. 23.
- Timothy Collett u. a: Historical methane hydrate project review. Consortium for Ocean Leadership, 2013. Project Number: DE‐FE0010195, S. 1.
- Y. C. Beaudoin, W. Waite, R. Boswell, S. R. Dallimore (Hrsg.): Frozen Heat: A UNEP Global Outlook on Methane Gas Hydrates. Volume 1. United Nations Environment Programme, 2014, ISBN 978-92-807-3429-4, S. 7.
- Gerald R. Dickens, Charles K. Paull, Paul Wallace: Direct measurement of in situ methane quantities in a large gas-hydrate reservoir. In: Nature. 385, 1997, S. 426–428, doi:10.1038/385426a0.
- Gerald R. Dickens, James R. O'Neil, David K. Rea, Robert M. Owen: Dissociation of oceanic methane hydrate as a cause of the carbon isotope excursion at the end of the Paleocene. In: Paleoceanography. 10, 1995, S. 965–971, doi:10.1029/95PA02087.
- Masanori Kurihara u. a.: Analysis of Production Data for 2007/2008 Mallik Gas Hydrate Production Tests in Canada. Paper presented at the International Oil and Gas Conference and Exhibition in China, Beijing, China, June 2010. Paper Number: SPE-132155-MS, doi:10.2118/132155-MS.
- Shari A. Yvon-Lewis, Lei Hu, John Kessler: Methane flux to the atmosphere from the Deepwater Horizon oil disaster. In: Geophysical Research Letters. 38, 2011, S.&L01602, doi:10.1029/2010GL045928.
- Peter Folger: Gas hydrates: Resource and hazard. Congressional Research Service, 2010, 7-5700, RS22990, S. 5.
- Juwon Lee, John W. Kenney III.: Clathrate Hydrates. In: Solidification. 2018, S. 129, doi:10.5772/intechopen.72956.
- Joel Parshall: Production method for methane hydrate sees scientific success. In: Journal of Petroleum Technology. 64.08, 2012, S. 50–51.
- Yoshihiro Tsuji u. a.: Overview of the MITI Nankai Trough wells: A milestone in the evaluation of methane hydrate resources. In: Resource Geology. 54.1, 2004, S. 3–10.
- K. Yamamoto, X.-X. Wang, M. Tamaki, K. Suzuki: The second offshore production of methane hydrate in the Nankai Trough and gas production behavior from a heterogeneous methane hydrate reservoir. In: RSC Advances. 9, 2019, S. 25987–26013, doi:10.1039/C9RA00755E.
- National Energy Technology Laboratory: NETL Methane Hydrate R&D Program: Program Highlights 2000–2020. Januar 2020, S. 24–25.
- Hans Carsten Runge: Methan-Hydrate-ein brauchbarer Vorrat „unkonventionellen“ Erdgases? Zentralbibliothek, Forschungszentrum Jülich, Spezielle Berichte Nr. 577, Juli 1990, ISSN 0343-7639, S. 1–6.
- Judith Schicks: Methan im Gashydrat. Gefangen im Wasserkäfig. In: Chemie in unserer Zeit. 42, 2008, S. 310–320, doi:10.1002/ciuz.200800457.
- K. You, P.B. Flemings, A. Malinverno, T.S. Collett, K. Darnell: Mechanisms of Methane Hydrate Formation in Geological Systems. In: Reviews of Geophysics. 57, 2019, S. 1146–1231, doi:10.1029/2018RG000638.
- Alexei V. Milkov: Global estimates of hydrate-bound gas in marine sediments: how much is really out there?. In: Earth-Science Reviews. 66, 2004, S. 183–197, doi:10.1016/j.earscirev.2003.11.002.
- IEA: Key World Energy Statistics 2021.
- Judith Maria Schicks, Manja Luzi-Helbing, Erik Spangenberg: Eingeschlossene Ressource: Methan in natürlichen Gashydraten. In: System Erde. 1.2, 2011, S. 52–59, doi:10.2312/GFZ.syserde.01.02.5.
- Carolyn D. Ruppel, John D. Kessler: The interaction of climate change and methane hydrates. In: Reviews of Geophysics. 55, 2017, S. 126–168, doi:10.1002/2016RG000534.
- M. Riedel, T.S. Collett, P. Kumar, A.V. Sathec, A. Cook: Seismic imaging of a fractured gas hydrate system in the Krishnae-Godavari-Basin offshore India. In: Marine and Petroleum Geology. 27, 2010, S. 1476–1493, doi:10.1016/j.marpetgeo.2010.06.002.
- Gerhard Bohrmann, Jens Greinert, Erwin Suess, Marta Torres: Authigenic carbonates from the Cascadia subduction zone and their relation to gas hydrate stability. In: Geology. 26, 1998, S. 647–650, doi:10.1130/0091-7613(1998)026<0647:ACFTCS>2.3.CO;2.
- Arthur H. Johnson: Global resource potential of gas hydrate–a new calculation. In: Nat. Gas Oil. 304, 2011, S. 285–309.
- M. I. Kuzmin, G. V. Kalmychkov, V. A. Geletiy u. a.: The First Discovery of the Gas Hydrates in the Sediments of the Lake Baikal. In: Annals of the New York Academy of Sciences. 912, 2000, S. 112, doi:10.1111/j.1749-6632.2000.tb06764.x.
- Oleg Khlystov u. a: Gas hydrate of Lake Baikal: Discovery and varieties. In: Journal of Asian Earth Sciences. 62, 2013, S. 162–166, doi:10.1016/j.jseaes.2012.03.009.
- Timothy S. Collett: Assessment of gas hydrate resources on the North Slope, Alaska, 2008. In: AGU Fall Meeting Abstracts. Fact Sheet 2008–3073O, 2008, 4 Seiten.
- D. Qasim, G. Fedoseev, K.-J. Chuang, J. He, S. Ioppolo, E. F. van Dishoeck, H. Linnartz: An experimental study of the surface formation of methane in interstellar molecular clouds. In: Nature Astronomy. 4, 2020, S. 781–785, doi:10.1038/s41550-020-1054-y.
- Olivier Mousis u. a.: Methane clathrates in the solar system. In: Astrobiology. 15.4, 2015, S. 308–326.
- J. D. Anderson u. a.: Radio science with Voyager 2 at Uranus: Results on masses and densities of the planet and five principal satellites. In: Journal of Geophysical Research: Space Physics. 92.A13, 1987, S. 14877–14883.
- Shunichi Kamata u. a.: Pluto’s ocean is capped and insulated by gas hydrates. In: Nature Geoscience. 12.6, 2019, S: 407–410, doi:10.1038/s41561-019-0369-8.
- Roger R. Fu u. a.: The interior structure of Ceres as revealed by surface topography. In: Earth and Planetary Science Letters. 476, 2017, S. 153–164, doi:10.1016/j.epsl.2017.07.053.
- Possible Methane Sources and Sinks bei Mars.Nava.gov, abgerufen am 1. März 2021
- Olivier Mousis u. a.: Volatile trapping in Martian clathrates. In: Space Science Reviews. 174.1-4, 2013, S. 213–250, doi:10.1007/s11214-012-9942-9.
- S.R. Gainey, M.E. Elwood Madden: Kinetics of methane clathrate formation and dissociation under Mars relevant conditions. In: Icarus. 218, 2012, S. 513–524, doi:10.1016/j.icarus.2011.12.019.
- Caroline Thomas u. a.: Variability of the methane trapping in martian subsurface clathrate hydrates. In: Planetary and Space Science. 57.1, 2009, S. 42–47, doi:10.1016/j.pss.2008.10.003.
- Layers of Titan (Abgerufen am 1. März 2021).
- G.F. Lindal, G.E. Wood, H.B. Hotz, D.N. Sweetnam, V.R. Eshleman, G.L. Tyler: The atmosphere of Titan: An analysis of the Voyager 1 radio occultation measurements. In: Icarus. 53, 1983, S. 348–363, doi:10.1016/0019-1035(83)90155-0.
- Nicholas A. Lombardo u. a.: Ethane in Titan’s Stratosphere from CIRS Far- and Mid-infrared Spectra. In: The Astronomical Journal. 157, 2019, S. 160–170, doi:10.3847/1538-3881/ab0e07.
- Jonathan I. Lunine, Sushil K. Atreya: The methane cycle on Titan. In: Nature Geoscience. 1, 2008, S. 159–164, doi:10.1038/ngeo125.
- Ralph Pudritz, Paul Higgs, Jonathon Stone: Planetary Systems and the Origin of Life. Cambridge Ambridge University Press, Cambridge, New York, Melbourne, Madrid, Cape Town, Singapore, São Paulo, ISBN 978-0-521-87548-6, S. 280.
- Alexis Bouquet, Olivier Mousis, J. Hunter Waite, Sylvain Picaud: Possible evidence for a methane source in Enceladus' ocean. In: Geophysical Research Letters. 42, 2015, S. 1334–1339, doi:0.1002/2014GL063013.
- Keith A. Kvenvolden: A review of the geochemistry of methane in natural gas hydrate. In: Organic geochemistry. 23.11-12, 1995, S. 997–1008.
- Yuri F. Makogon: Hydrates of Hydrocarbons. Pennwell Publishing Company, Oklahoma, 1997, ISBN 0-87814-718-7, S. 340.
- Ross Chapman u. a.: Thermogenic gas hydrates in the northern Cascadia margin. In: Eos, Transactions American Geophysical Union. 85.38, 2004, S. 361–365.
- National Energy Technology Laboratory: Methanehydrate Science and Technology: A 2017 Update. U.S. Department of Energy, July 2017, S. 5.
- Maninder Khurana, Zhenyuan Yin, Praveen Linga: A Review of Clathrate Hydrate Nucleation. In: ACS Sustainable Chemistry & Engineering. 5, 2017, S. 11176 –11203, doi:10.1021/acssuschemeng.7b03238.
- Y. C. Beaudoin, W. Waite, R. Boswell, S. R. Dallimore (Hrsg.): Frozen Heat: A UNEP Global Outlook on Methane Gas Hydrates. Volume 2. United Nations Environment Programme, 2014, ISBN 978-92-807-3319-8, S. 60.
- George J. Moridis, Timothy S. Collett, Scott R. Dallimore, Tohru Satoh, Steven Hancock, Brian Weatherill: Numerical studies of gas production from several CH4 hydrate zones at the Mallik site, Mackenzie Delta, Canada. In: Journal of Petroleum Science and Engineering. 43, 2004, S. 219–238, doi:10.1016/j.petrol.2004.02.015.
- Klaus Wallmann u. a.: Zukünftige kommerzielle Nutzung von Methanhydratvorkommen im Meeresboden. In: Wissenschaftliche Auswertungen 2011, S. 285–288.
- Yongchen Song u. a.: Evaluation of gas production from methane hydrates using depressurization, thermal stimulation and combined methods. In: Applied Energy. 145, 2015, S. 265–277, doi:10.1016/j.apenergy.2015.02.040.
- Solomon Aforkoghene Aromada, Bjørn Kvamme, N. a. Wei, Navid Saeidi: Enthalpies of Hydrate Formation and Dissociation from Residual Thermodynamics. In: Energies. 12, 2019, S. 4726, doi:10.3390/en12244726.
- Huen Lee, Yongwon Seo, Yu-Taek Seo, Igor L. Moudrakovski, John A. Ripmeester: Recovering Methane from Solid Methane Hydrate with Carbon Dioxide. In: Angewandte Chemie. 115, 2003, S. 5202–5205, doi:10.1002/ange.200351489.
- J.H. Sira, S.L. Patil, V.A. Kamath: Study of Hydrate Dissociation by Methanol and Glycol Injection. SPE Annual Technical Conference and Exhibition, New Orleans, Louisiana, September 1990. Paper Number: SPE-20770-MS, doi:10.2118/20770-MS.
- Ayhan Demirbas: Methane hydrates as potential energy resource: Part 2 – Methane production processes from gas hydrates. In: Energy Conversion and Management. 51.7, 2010, S. 1562–1571, doi:10.1016/j.enconman.2010.02.014
- Aliakbar Hassanpouryouzband u. a.: Gas hydrates in sustainable chemistry. In: Chemical Society Reviews. 49.15, 2020, S. 5225–5309, doi: 10.1039/c8cs00989a.
- Constantin Cranganu: In-situ thermal stimulation of gas hydrates. In: Journal of Petroleum Science and Engineering. 65, 2009, S. 76–80, doi:10.1016/j.petrol.2008.12.028.
- E. Dendy Sloan: Gas Hydrates: Review of Physical/Chemical Properties. In: Energy & Fuels. 12, 1998, S. 191–196, doi:10.1021/ef970164+.
- S. Alireza Bagherzadeh, Saman Alavi, John A. Ripmeester, Peter Englezos: Evolution of methane during gas hydrate dissociation. In: Fluid Phase Equilibria. 358, 2013, S. 114–120, doi:10.1016/j.fluid.2013.08.017.
- I-M. Chou, A. Sharma, R. C. Burruss, J. Shu, H.-k. Mao, R. J. Hemley, A. F. Goncharov, L. A. Stern, S. H. Kirby: Transformations in methane hydrates. In: Proceedings of the National Academy of Sciences. 97, 2000, S. 13484–13487, doi:10.1073/pnas.250466497.
- C. D. Ruppel, W. F. Waite: Grand Challenge: Timescales and Processes of Methane Hydrate Formation and Breakdown, with Application to Geologic Systems. In: Journal of Geophysical Research: Solid Earth. 125, 2020, doi:10.1029/2018JB016459.
- Arvind Gupta, Steven F. Dec, Carolyn A. Koh, E. D. Sloan: NMR Investigation of Methane Hydrate Dissociation. In: The Journal of Physical Chemistry C. 111, 2007, S. 2341–2346, doi:10.1021/jp066536+.
- Erwin Suess, Gerhard Bohrmann: Brennendes Eis - Vorkommen, Dynamik und Umwelteinflüsse von Gashydraten. In: Marum, Universität Bremen, 2010. S. 234–243.
- Rudolph Hopp: Grundlagen der Chemischen Technologie: für Praxis und Berufsbildung. Wiley-VCH, Weinheim, 2001, ISBN 3-527-29998-X, S. 452.
- Imen Chatti, Anthony Delahaye, Laurence Fournaison, Jean-Pierre Petitet: Benefits and drawbacks of clathrate hydrates: a review of their areas of interest. In: Energy Conversion and Management. 46, 2005, S. 1333–1343, doi:10.1016/j.enconman.2004.06.032.
- E. Dendy Sloan Jr., Carolyn A. Koh: Clathrate hydrates of natural gases. CRC Press, 2008, Boca Raton, ISBN 978-0-8493-9078-4, S. 9–11.
- E. Dendy Sloan: Fundamental principles and applications of natural gas hydrates. In: Nature. 426, 2003, S. 353–359, doi:10.1038/nature02135.
- C. I. C. Anyadiegwu, Anthony Kerunwa, Patrick Oviawele: Natural Gas Dehydration using Triethylene Glycol (TEG). In: Petroleum & Coal, 56, 4, 2014, S. 407–417.
- Pezhman Kazemi, Roya Hamidi: Sensitivity Analysis of a Natural Gas Triethylene Glycol Dehydration Plant in Persian Gulf Region. In: Petroleum & Coal, 53, 1, 2011, S. 71–77, ISSN 1337-7027.
- Hongjun Yang, Shuanshi Fan, Xuemei Lang, Yanhong Wang: Phase Equilibria of Mixed Gas Hydrates of Oxygen + Tetrahydrofuran, Nitrogen + Tetrahydrofuran, and Air + Tetrahydrofuran. In: Journal of Chemical & Engineering Data. 56, 2011, S. 4152–4156, doi:10.1021/je200676k.
- Jianzhong Zhao, Yangsheng Zhao, Weiguo Liang: Hydrate-Based Gas Separation for Methane Recovery from Coal Mine Gas using Tetrahydrofuran. In: Energy Technology. 4, 2016, S. 864–869, doi:10.1002/ente.201600047.
- Xiao-Sen Li, Jing Cai, Zhao-Yang Chen, Chun-Gang Xu: Hydrate-Based Methane Separation from the Drainage Coal-Bed Methane with Tetrahydrofuran Solution in the Presence of Sodium Dodecyl Sulfate. In: Energy & Fuels. 26, 2012, S. 1144–1151, doi:10.1021/ef201804d.
- Kyung Chan Kang, Praveen Linga, Kyeong-nam Park, Sang-June Choi, Ju Dong Lee: Seawater desalination by gas hydrate process and removal characteristics of dissolved ions (Na+, K+, Mg2+, Ca2+, B3+, Cl–, SO42–). In: Desalination. 353, 2014, S. 84–90, doi:10.1016/j.desal.2014.09.007.
- Sabine Lattemann u. a: Global desalination situation. In: Sustainability Science and Engineering. 2, 2010, S. 7–39.
- David W. Reed u. a: Microbial Communities from Methane Hydrate-Bearing Deep Marine Sediments in a Forearc Basin. In: Applied and Environmental Microbiology. 68.8, 2002, S. 3759–3770, doi:10.1128/AEM.68.8.3759–3770.2002.
- Harold Basch u. a.: Mechanism of the Methane → Methanol Conversion Reaction Catalyzed by Methane Monooxygenase: A Density Functional Study. In: Journal of the American Chemical Society. 121, 1999, S. 7249–7256, doi:10.1021/ja9906296.
- Daniel Desbruyeres, André Toulmond: A new species of hesionid worm, Hesiocaeca methanicola sp nov (Polychaeta: Hesionidae), living in ice-like methane hydrates in the deep Gulf of Mexico. In: Cahiers de biologie marine. 39.1, 1998, S. 93–98.
- Greg W. Rouse, Jose Ignacio Carvajal, Fredrik Pleijel: Phylogeny of Hesionidae (Aciculata, Annelida), with four new species from deep-sea eastern Pacific methane seeps, and resolution of the affinity of Hesiolyra. In: Invertebrate Systematics. 32, 2018, S. 1050–1068, doi:10.1071/IS17092.
- C. R. Fisher u. a.: Methane ice worms: Hesiocaeca methanicola colonizing fossil fuel reserves. In: Naturwissenschaften. 87.4, 2000, S. 184–187.
- Ian R. MacDonald, William W. Sager, Michael B. Peccini: Gas hydrate and chemosynthetic biota in mounded bathymetry at mid-slope hydrocarbon seeps: Northern Gulf of Mexico. In: Marine Geology. 198, 2003, S. 133–158, doi:10.1016/S0025-3227(03)00098-7.
- J. J. Childress u. a.: A Methanotrophic Marine Molluscan (Bivalvia, Mytilidae) Symbiosis: Mussels Fueled by Gas. In: Science. 233, 1986, S. 1306–1308, doi:10.1126/science.233.4770.1306.
- Julia Klose u. a.: Endosymbionts escape dead hydrothermal vent tubeworms to enrich the free-living population. In: Proceedings of the National Academy of Sciences. 112, 2015, S. 11300–11305, doi:10.1073/pnas.1501160112.
- G. Myhre u. a.: Anthropogenic and Natural Radiative Forcing. In: Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge/ New York 2013, S. 714, (PDF)
- Hans Oeschger: Klimavergangenheit – Klimazukunft. In: Hubert Markl u. a. (Hrsg.): Wissenschaft in der globalen Herausforderung. S. Hirzel Wissenschaftlich Verlagsgesellschaft, Stuttgart, 1995, ISBN 3-8047-1417-X, S. 115–126.
- J. Kasting: Methane and climate during the Precambrian era. In: Precambrian Research. 137, 2005, S. 119–129, doi:10.1016/j.precamres.2005.03.002.
- M. Kennedy, D. Mrofka, C. von der Borch: Snowball Earth termination by destabilization of equatorial permafrost methane clathrate. In: Nature. 453, 2008, S. 642–645, doi:10.1038/nature06961.
- Edward J. Brook u. a.: On the origin and timing of rapid changes in atmospheric methane during the Last Glacial Period. In: Global Biogeochemical Cycles. 14, 2000, S. 559–572, doi:10.1029/1999GB001182.
- Tina Treude: Methanhydrate: Erwärmung, Freisetzung und mikrobiologischer Abbau. In: J. L. Lozán, H. Graßl, K. Reise (Hrsg.): Warnsignal Klima: Die Meere – Änderungen und Risiken. Wissenschaftliche Auswertungen, Hamburg, ISBN 978-3-9809668-5-6, S. 178–182.
- Denis Chernykh u. a.: First quantitative estimation of growing methane release from the East Siberian Arctic seas: from a single flare to vast seepage area. In: EGU General Assembly Conference Abstracts. 2020.
- Martin Kappas: Klimatologie: Klimaforschung im 21. Jahrhundert-Herausforderung für Natur-und Sozialwissenschaften. Springer-Verlag, 2009, ISBN 978-3-8274-1827-2, S. 202.
- Petter Bryn, Kjell Berg, Carl F. Forsberg, Anders Solheim, Tore J. Kvalstad: Explaining the Storegga Slide. In: Marine and Petroleum Geology. 22, 2005, S. 11–19, doi:10.1016/j.marpetgeo.2004.12.003.
- Matthew J. Hornbach, Luc L. Lavier, Carolyn D. Ruppel: Triggering mechanism and tsunamogenic potential of the Cape Fear Slide complex, U.S. Atlantic margin. In: Geochemistry, Geophysics, Geosystems. 8, 2007, S. 1–16, doi:10.1029/2007GC001722.
- Nils-Axel Mörner: Methane hydrate in crystalline bedrock and explosive methane venting tectonics. In: Earth-Science Reviews. 169, 2017, S. 202–212, doi:10.1016/j.earscirev.2017.05.003.
- David Deming: ‘Can a Single Bubble Sink a Ship?’. In: Journal of Scientific Exploration. 18.2, 2004, S. 307–312.
- Nabil Sultan, Andreia Plaza-Faverola, Sunil Vadakkepuliyambatta, Stefan Buenz, Jochen Knies: Impact of tides and sea-level on deep-sea Arctic methane emissions. In: Nature Communications. 11, 2020, S. 5087, doi:10.1038/s41467-020-18899-3.
- Pinnelli S.R. Prasad, Vangala Dhanunjana Chari: Preservation of methane gas in the form of hydrates: Use of mixed hydrates. In: Journal of Natural Gas Science and Engineering. 25, 2015, S. 10–14, doi:10.1016/j.jngse.2015.04.030.
- Emmanuel Dartois, Mehdi Bouzit, Bernard Schmitt: Clathrate hydrates: FTIR spectroscopy for astrophysical remote detection. In: EAS Publications Series. 58, 2012, S. 219–224.