Hexan
Hexan ist eine den Alkanen (gesättigte Kohlenwasserstoffe) zugehörige chemische Verbindung. Es ist eine farblose Flüssigkeit mit der Summenformel C6H14. Es ist das unverzweigte Isomer der fünf Hexan-Isomere.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Hexan | |||||||||||||||
| Andere Namen |
n-Hexan | |||||||||||||||
| Summenformel | C6H14 | |||||||||||||||
| Kurzbeschreibung |
farblose, schwach benzinartig riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 86,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
69 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,3727 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
Hexan ist eine farblose, flüchtige Flüssigkeit, die leicht nach Benzin riecht. Der Siedepunkt unter Normaldruck liegt bei 68,8 °C.[6] Die Verbindung schmilzt bei −95,4 °C.[7] Die relative Dielektrizitätskonstante ist bei 20 °C 1,8. In Wasser ist es praktisch unlöslich. In organischen Lösungsmitteln wie Alkoholen (mit Ausnahme von Methanol), Ethern und Benzol ist es gut löslich.
Die Verbindung bildet mit einer Reihe anderer Lösungsmittel azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Cyclohexan, Pentan, Heptan, Octan, Toluol, Ethylbenzol, Xylol, Cyclohexanol und Diethylether gebildet.
| Azeotrope mit verschiedenen Lösemitteln (nach Smallwood[8]) | ||||||||||||
| Lösungsmittel | Wasser | Methanol | Ethanol | 1-Propanol | 2-Propanol | |||||||
| Gehalt Hexan | in Ma% | 94 | 72 | 79 | 96 | 77 | ||||||
| Siedepunkt | in °C | 62 | 50 | 59 | 66 | 63 | ||||||
| Lösungsmittel | 1-Butanol | i-Butanol | 2-Butanol | Ethylenglycolethylether | Acetonitril | |||||||
| Gehalt Hexan | in Ma% | 97 | 98 | 92 | 95 | 72 | ||||||
| Siedepunkt | in °C | 68 | 68 | 67 | 66 | 52 | ||||||
| Lösungsmittel | Chloroform | Essigsäure | Aceton | Methylethylketon | Diisopropylether | |||||||
| Gehalt Hexan | in Ma% | 16 | 95 | 41 | 71 | 47 | ||||||
| Siedepunkt | in °C | 60 | 68 | 50 | 64 | 67 | ||||||
| Lösungsmittel | Dioxan | THF | Methylacetat | Ethylacetat | Isopropylacetat | |||||||
| Gehalt Hexan | in Ma% | 98 | 50 | 39 | 62 | 91 | ||||||
| Siedepunkt | in °C | 60 | 63 | 52 | 65 | 69 | ||||||
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,45604, B = 1044,038 und C = −53.893 im Temperaturbereich von 177.70 bis 264.93 K[7] bzw. mit A = 4,00266, B = 1171,530 und C = −48,784 im Temperaturbereich von 286.18 bis 342.69 K.[9]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−198,7 kJ·mol−1[10] −167,1 kJ·mol−1[10] |
als Flüssigkeit als Gas |
| Standardentropie | S0liquid S0gas |
296,06 J·mol−1·K−1[11] 388,82 J·mol−1·K−1[12] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −4163,2 kJ·mol−1[10] | |
| Wärmekapazität | cp | 194,97 J·mol−1·K−1 (25 °C)[11] 2,30 J·g−1·K−1 (25 °C)[11] 142,6 J·mol−1·K−1 (25 °C)[13] 1,65 J·g−1·K−1 (25 °C)[13] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 507,5 K[14] | |
| Kritischer Druck | pc | 29,9 bar[14] | |
| Kritisches Volumen | Vc | 0,368 l·mol−1[15] | |
| Kritische Dichte | ρc | 2,72 mol·l−1[15] | |
| Azentrischer Faktor | ωc | 0,30126[16] | |
| Schmelzenthalpie | ΔfH0 | 13,08 kJ·mol−1[17] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 ΔVH |
31,73 kJ·mol−1[18] 28,85 kJ·mol−1[18] |
beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 43,85 kJ/mol, α = −0,039, β = 0,397 und Tc = 507,4 K im Temperaturbereich zwischen 298 K und 444 K beschreiben.[18]
 Dampfdruckfunktion von Hexan
Dampfdruckfunktion von Hexan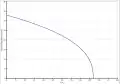 Temperaturabhängigkeit der Verdampfungsenthalpie von Hexan
Temperaturabhängigkeit der Verdampfungsenthalpie von Hexan
Sicherheitstechnische Kenngrößen
n-Hexan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −20 °C. Der Explosionsbereich liegt zwischen 1 Vol.‑% (35 g/m3) als untere Explosionsgrenze (UEG) und 8,9 Vol.‑% (319 g/m3) als obere Explosionsgrenze (OEG).[19] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −28 °C sowie einen oberen Explosionspunkt von 7 °C. Die Explosionsgrenzen sind druckabhängig. Eine Erniedrigung des Druckes führt zu einer Verkleinerung des Explosionsbereiches. Die untere Explosionsgrenze ändert sich bis zu einem Druck von 100 mbar nur wenig und steigt erst bei Drücken kleiner als 100 mbar an. Die obere Explosionsgrenze verringert sich mit sinkendem Druck analog.[20]
| Explosionsgrenzen unter reduziertem Druck (gemessen bei 100 °C)[20] | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 0,9 | 0,9 | 0,9 | 0,9 | 1,0 | 1,0 | 1,0 | 1,1 | 1,2 | 1,6 | 3,5 |
| in g·m−3 | 30 | 31 | 32 | 33 | 34 | 35 | 37 | 39 | 43 | 58 | 125 | |
| Obere Explosionsgrenze (OEG) | in Vol.‑% | 8,9 | 8,7 | 8,3 | 7,8 | 7,6 | 7,5 | 7,4 | 7,3 | 7,2 | 6,0 | 4,7 |
| in g·m−3 | 319 | 312 | 297 | 279 | 272 | 269 | 265 | 262 | 258 | 215 | 168 | |
Die untere Explosionsgrenze sinkt mit steigender Temperatur. Nach der linearen Funktion UEG(T) = UEG(T0)·[1+ku(T-T0)] (mit T0 = 20 °C) ergibt sich ein Temperaturkoeffizient ku von −0,0027 K−1.[21]
| Untere Explosionsgrenzen mit steigender Temperatur[21] | ||||||||||||
| Temperatur | in °C | 20 | 100 | 150 | 200 | 250 | ||||||
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 1,0 | 0,9 | 0,6 | 0,5 | 0,4 | ||||||
Die Sauerstoffgrenzkonzentration liegt bei 20 °C bei 9,1 Vol.‑%, bei 100 °C bei 8,3 Vol.‑%.[20] Tendenziell steigt der Wert mit sinkenden Druck bzw. verringert sich mit steigender Temperatur.[20] Der maximale Explosionsdruck beträgt 9,5 bar.[19] Der maximale Explosionsdruck verringert sich mit sinkenden Ausgangsdruck.[20]
| Maximaler Explosionsdruck und Sauerstoffgrenzkonzentration unter reduziertem Druck [20] | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 200 | 150 | 100 | |||
| Maximaler Explosionsdruck | in bar | bei 20 °C | 9,6 | 7,4 | 5,6 | 3,7 | 2,8 | 1,8 | 1,4 | 1,1 | ||
| Sauerstoffgrenzkonzentration | in Vol% | bei 20 °C | 9,1 | 9,5 | 10,1 | 10,8 | ||||||
| bei 100 °C | 8,3 | 8,3 | 8,8 | |||||||||
Mit einer Mindestzündenergie von 0,24 mJ sind Dampf-Luft-Gemische extrem zündfähig.[19] Die Grenzspaltweite wurde mit 0,93 mm bestimmt.[19] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[19] Die Zündtemperatur beträgt 230 °C.[19] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung

Hexan wird in der organischen Chemie als Lösungsmittel und Reaktionsmedium bei Polymerisationen, als Verdünnungsmittel für schnelltrocknende Lacke, Druckfarben und Klebstoffe und als Elutions- und Lösungsmittel in der Dünnschichtchromatographie verwendet. Es wird weiterhin zur Herstellung von Kunststoffen und synthetischem Kautschuk sowie zur Öl- und Fettextraktion eingesetzt.[2] Da es Polystyrol im Gegensatz zu vielen organischen Lösemitteln nicht angreift und leicht flüchtig ist, dient es als Lösungsmittel für Styroporkleber. Ferner ist es Bestandteil von Wundbenzin.
Sicherheitshinweise/Toxikologie
Hexan weist Suchtpotential auf und ist gesundheitsschädlich. Hexan ist wassergefährdend (WGK 2).
Hexan wird gasförmig rasch über die Lunge aufgenommen und wieder abgegeben (pulmonale Retention 22 bis 24 %). Auch bei dermalem Kontakt wird Hexan aufgenommen. Im Körper wird Hexan in der Leber zunächst zu 1-Hexanol, 2-Hexanol und 3-Hexanol verstoffwechselt. 2-Hexanol wird danach entweder über 2-Hexanon oder über 2,5-Hexandiol zu 5-Hydroxy-2-hexanon oxidiert. Aus letzterem werden γ-Valerolacton und 2,5-Hexandion metabolisiert.[22] Das 2,5-Hexandion, das zu Nervenschäden führen kann, wird dann über den Urin ausgeschieden. Zur Vermeidung der schädlichen Wirkung kann Hexan durch Heptan ersetzt werden.
Hexan wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Hexan waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung fand ab 2012 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[23][24]
Weblinks
Einzelnachweise
- Datenblatt n-Hexan (PDF) bei Merck, abgerufen am 15. Februar 2010.
- Eintrag zu Hexan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Hexan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- Eintrag zu N-hexane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 110-54-3 bzw. N-Hexan), abgerufen am 2. November 2015.
- L.-C. Feng, C.-H. Chou, M. Tang, Y. P. Chen: Vapor-Liquid Equilibria of Binary Mixtures 2-Butanol + Butyl Acetate, Hexane + Butyl Acetate, and Cyclohexane + 2-Butanol at 101.3 kPa. In: J. Chem. Eng. Data. 43, 1998, S. 658–661, doi:10.1021/je9800205.
- G. F. Carruth, R. Kobayashi: Vapor Pressure of Normal Paraffins Ethane Through n-Decane from Their Triple Points to About 10 Mm mercury. In: J. Chem. Eng. Data. 18, 1973, S. 115–126, doi:10.1021/je60057a009.
- I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 12–13.
- C. B. Williamham, W. J. Taylor, J. M. Pignocco, F. D. Rossini: Vapor Pressures and Boiling Points of Some Paraffin, Alkylcyclopentane, Alkylcyclohexane, and Alkylbenzene Hydrocarbons. In: J. Res. Natl. Bur. Stand. (U.S.). 35, 1945, S. 219–244.
- W. D. Good, N. K. Smith: Enthalpies of combustion of toluene, benzene, cyclohexane, cyclohexene, methylcyclopentane, 1-methylcyclopentene, and n-hexane. In: J. Chem. Eng. Data. 14, 1969, S. 102–106, doi:10.1021/je60040a036.
- D. R. Douslin, H. M. Huffman: Low-temperature thermal data on the five isometric hexanes. In: J. Am. Chem. Soc. 68, 1946, S. 1704–1708, doi:10.1021/ja01213a006.
- D. W. Scott: Correlation of the chemical thermodynamic properties of alkane hydrocarbons. In: J. Chem. Phys. 60, 1974, S. 3144–3165, doi:10.1063/1.1681500.
- D. W. Scott: Chemical Thermodynamic Properties of Hydrocarbons and Related Substances. Properties of the Alkane Hydrocarbons, C1 through C10 in the Ideal Gas State from 0 to 1500 K. In: U.S. Bureau of Mines, Bulletin. 666, 1974.
- S. K. Quadri, K. C. Khilar, A. P. Kudchadker, M. J. Patni: Measurement of the critical temperatures and critical pressures of some thermally stable or mildly unstable alkanols. In: J. Chem. Thermodyn. 23, 1991, S. 67–76, doi:10.1016/S0021-9614(05)80060-6.
- D. Ambrose, C. Tsonopoulos: Vapor-Liquid Critical Properties of Elements and Compounds. 2. Normal Alkenes. In: J. Chem. Eng. Data. 40, 1995, S. 531–546, doi:10.1021/je00019a001.
- J. Schmidt: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10. In: Chem. Ing. Techn. 83, 2011, S. 796–812, doi:10.1002/cite.201000202.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1996, S. 1–525, doi:10.1063/1.555985.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- D. Pawel, E. Brandes: Abschlussbericht zum Forschungsvorhaben Abhängigkeit sicherheitstechnischer Kenngrößen vom Druck unterhalb des atmosphärischen Druckes. (Memento vom 2. Dezember 2013 im Internet Archive), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- W. Hirsch, E. Brandes: Abschlussbericht des Forschungsvorhabens Kenngrößen bei nichtatmosphärischen Bedingungen. Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 2014. (PDF-Datei)
- Hexan (n‐Hexan) MAK Value Documentation in German language, 1997, abgerufen am 15. Oktober 2019.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): n-hexane, abgerufen am 26. März 2019.



