Große Sauerstoffkatastrophe
Die Große Sauerstoffkatastrophe (GOE, nach englisch great oxygenation event) war der Anstieg der Konzentration von molekularem Sauerstoff (O2) in flachen Gewässern und der Atmosphäre um mehrere Größenordnungen in relativ kurzer Zeit vor etwa 2,4 Milliarden Jahren, an der Archaikum-Proterozoikum-Grenze, als die Erde halb so alt war wie jetzt. In der Entwicklung der Erdatmosphäre stellt die Große Sauerstoffkatastrophe den Übergang von der zweiten zur dritten Atmosphäre dar.
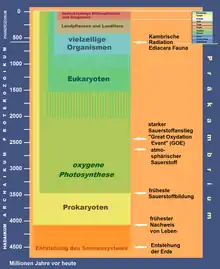
Einige der damals sämtlich anaeroben Lebewesen erzeugten Sauerstoff als giftiges Abfallprodukt der Photosynthese, wahrscheinlich bereits seit vielen hundert Millionen Jahren. Aber zunächst hielten leicht oxidierbare Stoffe vulkanischen Ursprungs (Wasserstoff, Kohlenstoff, Schwefel, Eisen) die O2-Konzentration sehr niedrig, unter 0,001 % des heutigen Niveaus (10−5 PAL, englisch present atmospheric level), wie charakteristische Verhältnisse von Schwefelisotopen belegen. In dieser Zeit änderte sich die Farbe der Erde von basaltschwarz zu rostrot. Abnehmender Vulkanismus, der Verlust von Wasserstoff ins Weltall und eine Zunahme der Photosynthese führten dann zum GOE, das heute als Periode mit mehrfachem Anstieg und Abfall der O2-Konzentration verstanden wird.
Dem GOE folgten unmittelbar eine Vereisung des Planeten, weil das Treibhausgas Methan und Ablagerungen großer Mengen organischen Materials unter oxidierenden Bedingungen schneller abgebaut wurden, siehe Lomagundi-Jatuli-Isotopenexkursion. Die δ13C-Werte deuten auf eine Menge freigesetzten Sauerstoffs entsprechend dem 10- bis 20-fachen des jetzigen O2-Inventars der Atmosphäre. Anschließend fiel die O2-Konzentration für lange Zeit auf mäßige Werte, wahrscheinlich meist unter 10−3 PAL, um erst vor weniger als 1 Mrd. Jahren wieder anzusteigen, was schließlich vielzelliges Leben ermöglichte.
Ablauf

Oben: Atmosphäre, Mitte: flache Ozeane, unten: tiefe Ozeane
Abszisse: Zeit in Milliarden Jahren (Ga). Ordinaten: O2-Partialdruck der Atmosphäre in atm bzw. molare O2-Konzentration im Meerwasser in µmol/L. Die beiden Kurven in jeder Grafik bezeichnen jeweils die obere bzw. untere Grenze des Schätzbereichs (Holland, 2006).[2]
.jpg.webp)
Die Uratmosphäre der Erde enthielt freien Sauerstoff (O2) allenfalls in sehr geringen Konzentrationen. Vor vermutlich etwa 3,2 bis 2,8 Milliarden Jahren entwickelten Mikroorganismen, nach gegenwärtigen Kenntnissen Vorläufer der heutigen Cyanobakterien, aus einer einfacheren Photosyntheseform eine neue, bei der im Gegensatz zur älteren Form O2 als Abfallprodukt entsteht und die deshalb als oxygene Photosynthese bezeichnet wird. Dadurch wurde O2 in beträchtlichen Mengen in den Ozeanen gebildet, sowohl vor als auch nach der Großen Sauerstoffkatastrophe. Es gab jedoch einen wesentlichen Unterschied: Vor der Großen Sauerstoffkatastrophe wurde der gebildete Sauerstoff in der Oxidation von organischen Stoffen, Schwefelwasserstoff und gelöstem Eisen (als zweiwertiges Eisen-Ion Fe2+ vorliegend) vollständig gebunden. Der GOE war der Zeitpunkt, an dem diese Stoffe, vor allem Fe2+, weitgehend oxidiert waren und der Neueintrag dieser Stoffe den gebildeten Sauerstoff nicht mehr vollständig binden konnte. Der überschüssige freie Sauerstoff begann sich nun im Meerwasser und in der Atmosphäre anzureichern.
Man nimmt mehrheitlich an, dass zwischen dem Auftreten der oxygenen Photosynthese mit der damit verbundenen Produktion von O2 und dem Beginn der Anreicherung von freiem Sauerstoff eine lange Zeit verging, weil große Mengen an mit O2 oxidierbaren Stoffen vorhanden waren und aus Verwitterung und Vulkanismus nachgeliefert wurden, das gebildete O2 also sogleich gebunden wurde.
Die Oxidation von Fe2+ zu dreiwertigen Eisen-Ionen Fe3+ führte zur Ablagerung von Bändererz (Banded Iron Formation), wo Eisen hauptsächlich in Form von Oxiden, nämlich Hämatit Fe2O3 und Magnetit Fe3O4 vorliegt. In alten Kontinentschilden, die in der langen Zeit relativ wenig tektonisch verändert wurden, sind solche Bändererze bis heute erhalten, beispielsweise Hamersley Basin (Westaustralien), Transvaal Craton (Südafrika), Animikie Group (Minnesota, USA). Sie sind global die wichtigsten Eisenerze. Sauerstoff begann erst kurz (etwa 50 Mio. Jahre) vor dem GOE in der Atmosphäre zu verbleiben.[3][4]
Theorie des späten Erscheinens der oxygenen Photosynthese
Dieser Theorie zufolge entwickelten sich die phototrophen Sauerstoffproduzenten erst unmittelbar vor dem größeren Anstieg der atmosphärischen Sauerstoffkonzentration. Die Theorie stützt sich auf die massenunabhängige Fraktionierung von Schwefel-Isotopen, der man eine Indikator-Funktion für Sauerstoff zuschreibt.[5] Bei dieser Theorie muss die Zeitspanne zwischen der Evolution oxygen photosynthetischer Mikroorganismen und dem Zeitpunkt des O2-Konzentrationsanstiegs nicht erklärt werden.
Es besteht jedoch die Möglichkeit, dass der Sauerstoffindikator fehlinterpretiert wurde. Im Verlauf des vorgeschlagenen Zeitversatzes der oben genannten Theorie fand ein Wechsel von massenunabhängiger Fraktionierung (MIF) zu einer massenabhängigen Fraktionierung (MDF) von Schwefel statt. Es wird angenommen, dass dies das Ergebnis des Auftauchens von Sauerstoff O2 in der Atmosphäre war. Sauerstoff hätte die MIF verursachende Photolyse von Schwefeldioxid unterbunden. Dieser Wechsel von MIF zu MDF der Schwefel-Isotope hätte auch von einem Anstieg glazialer Verwitterung verursacht worden sein können. Ebenso in Frage kommt eine Homogenisierung der marinen Schwefelvorkommen als Ergebnis eines vergrößerten Temperaturgradienten während der Huronischen Vereisung.[5]
Nachlauf-Theorie

Unter dem Nachlauf (der bis zu 900 Mio. Jahre betragen haben könnte) versteht man den Zeitversatz zwischen dem Zeitpunkt, an dem die Sauerstoffproduktion photosynthetisch aktiver Organismen startete, und dem (in geologischen Zeiträumen) schnellen Anstieg atmosphärischen Sauerstoffs vor ca. 2,5 bis 2,4 Milliarden Jahren. Mit Hilfe einer Reihe von Hypothesen wird versucht, diesen Zeitversatz zu erklären.
Tektonischer Auslöser
Dieser Theorie zufolge wird der Zeitversatz damit erklärt, dass der Sauerstoffanstieg auf tektonisch bedingte Veränderungen der „Anatomie“ der Erde warten musste. Es war das Erscheinen von Schelfmeeren, wo reduzierter Kohlenstoff die Sedimente erreichen und dort abgelagert werden konnte.[7] Daneben wurde der neu produzierte Sauerstoff zunächst in verschiedenen Oxidationen im Ozean gebunden, in erster Linie in einer Oxidation von zweiwertigem Eisen. Für dieses Phänomen gibt es Belege in älteren Gesteinsformationen, nämlich große Mengen Bändererze, die offensichtlich durch die Eisenoxidation abgelagert wurden. Bändererze machen den größten Teil der kommerziell abbaubaren Eisenerze aus.
Nickelmangel
Chemosynthetische Organismen waren eine Methan-Quelle. Methan war aber eine Falle für molekularen Sauerstoff, denn Sauerstoff oxidiert Methan im Beisein von UV-Strahlung ohne weiteres Zutun zu Kohlendioxid und Wasser. Heutige methanbildende Mikroben benötigen Nickel als Koenzym. Als sich die Erdkruste abkühlte, wurde die Nickel-Zufuhr und damit die Methan-Produktion reduziert, was erlaubte, dass Sauerstoff die Atmosphäre dominierte. In der Zeit von 2,7 bis 2,4 Milliarden Jahren vor heute nahm die abgelagerte Nickelmenge stetig ab; sie lag ursprünglich beim 400-fachen des heutigen Niveaus.[8]
Folgen der Großen Sauerstoffkatastrophe
Der steigende Sauerstoffgehalt in den Ozeanen hat möglicherweise einen großen Teil der obligat anaeroben Organismen ausgelöscht, die zu dieser Zeit die Erde bevölkerten.[9] Der Sauerstoff war für obligat anaerobe Organismen tödlich und für das wahrscheinlich größte Massenaussterben wesentlich verantwortlich. Bei nicht an O2 angepassten Lebewesen bilden sich im Zuge ihres Stoffwechsels Peroxide, die sehr reaktiv sind und lebenswichtige Bestandteile der Lebewesen beschädigen. Vermutlich entwickelten Lebewesen während der Zeit, als zwar O2 gebildet, aber stets in Oxidationen verbraucht wurde, Enzyme (Peroxidasen), welche die sich bildenden Peroxide zerstören, so dass die Giftwirkung des O2 ausgeschaltet wurde.
Der Umwelteinfluss der Großen Sauerstoffkatastrophe war global. Die Anreicherung von Sauerstoff in der Atmosphäre hatte drei weitere schwerwiegende Konsequenzen:
- Atmosphärisches Methan (ein starkes Treibhausgas) wurde zu Kohlenstoffdioxid (einem schwächeren Treibhausgas) und Wasser oxidiert, was die Huronische Eiszeit auslöste. Letztere könnte eine vollständige und, sofern überhaupt, die längste Schneeball-Erde-Episode in der Erdgeschichte gewesen sein, die von ca. −2,4 bis −2,0 Milliarden Jahre andauerte.[5][10]
- Freier Sauerstoff führte zu enormen Änderungen der chemischen Interaktion zwischen Feststoffen der Erde auf der einen Seite und der Erdatmosphäre, den Weltmeeren und anderen Oberflächengewässern auf der anderen Seite. So vergrößerte sich die Vielfalt der auf der Erde vorkommenden Mineralien stark. Es wird geschätzt, dass das GOE alleine für mehr als 2500 der insgesamt etwa 4500 Mineralien verantwortlich ist. Der Großteil dieser Mineralien waren Aquakomplexe oder oxidierte Formen der Mineralien, die sich aufgrund dynamischer Erdmantel- und Erdkrustenprozesse nach dem GOE bildeten.[11]
- Der erhöhte Sauerstoffgehalt öffnete der Evolution der Lebewesen neue Wege. Trotz des natürlichen Recyclings organischer Stoffe sind anaerobe Lebewesen energetisch limitiert. Die Verfügbarkeit freien Sauerstoffs in der Atmosphäre war ein Durchbruch der Evolution des Energiestoffwechsels, sie erhöhte das Angebot thermodynamisch freier Energie für Lebewesen sehr stark. Denn bei einer großen Anzahl von Stoffen setzt die Oxidation mit O2 wesentlich mehr nutzbare Energie frei als ein Stoffumsatz ohne Oxidation mit O2.
Mitochondrien entstanden nach der Großen Sauerstoffkatastrophe, die kambrische Explosion fand am Übergang zwischen Stufe 4 und 5 (siehe Liniendiagramm oben) statt.
Hinweise auf freien Sauerstoff vor der Großen Sauerstoffkatastrophe
Es gibt Hinweise darauf, dass es bereits vor dem GOE Episoden mit O2-Partialdrücken von mindestens einem 3000stel des heutigen Niveaus gegeben haben muss. So zeigen ca. 3 Mrd. Jahre alte Paläoböden und Evaporite in Südafrika starke Anzeichen für Sauerstoffverwitterung. Dies könnte ein Hinweis auf zu dieser Zeit entstehende Photosynthese betreibende Protocyanobakterien sein.[12]
Literatur
- Timothy W. Lyons, Christopher T. Reinhard, Noah J. Planavsky: The rise of oxygen in Earth’s early ocean and atmosphere. Nature 506, 2014, doi:10.1038/nature13068 (online).
- GOE und Eisen als wichtiger Rohstoff für Leben:
Iron integral to the development of life on Earth – and the possibility of life on other planets, auf EurekAlert! vom 6. Dezember 2021
Carly Cassella: This Element Could Have Been Crucial to The Evolution of Complex Life on Earth, auf sciencealert vom 7. Dezember 2021
Einzelnachweise
- https://www.mpg.de/forschung/eukaryoten-evolution
- Heinrich D. Holland: The oxygenation of the atmosphere and oceans (PDF; 781 kB). In: Phil. Trans. R. Soc. B, Band 361, 2006, S. 903–915.
- Ariel D. Anbar, Yun Duan, Timothy W. Lyons, Gail L. Arnold, Brian Kendall, Robert A. Creaser, Alan J. Kaufman, Gwyneth W. Gordon, Clinton Scott, Jessica Garvin und Roger Buick: A whiff of oxygen before the great oxidation event? In: Science. Band 317, Nr. 5846, 28. September 2007, S. 1903–1906, doi:10.1126/science.1140325.
-
Sarah P. Slotznick, Jena E. Johnson, Birger Rasmussen, Timothy D. Raub, Samuel M. Webb, Jian-Wei Zi, Joseph L. Kirschvink, Woodward W. Fischer: Reexamination of 2.5-Ga “whiff” of oxygen interval points to anoxic ocean before GOE. In: Science Advances, Band 8, Nr. 1, 5. Januar 2022, doi:10.1126/sciadv.abj7190. Dazu:
- New, High-Resolution Evidence Questions “Whiff of Oxygen” in Earth’s Early History, auf: SciTechDaily vom 5. Januar 2022. Quelle: Dartmouth College (englisch),
- Nadja Podbregar: Wie lebensfreundlich war die Urerde? Der UV-Schutz durch die Ozonschicht entwickelte sich später als angenommen, auf: scinexx.de vom 6. Januar 2022. Quelle: University of Leeds (deutsch).
- Robert E. Kopp, Joseph L. Kirschvink, Isaac A. Hilburn, and Cody Z. Nash: The Paleoproterozoic snowball Earth: A climate disaster triggered by the evolution of oxygenic photosynthesis. In: Proc. Natl. Acad. Sci. U.S.A. Vol. 102, Nr. 32, 2005, S. 11131–11136, doi:10.1073/pnas.0504878102, PMID 16061801, PMC 1183582 (freier Volltext), bibcode:2005PNAS..10211131K (englisch, pnas.org).
- G. P. Fournier, K. R. Moore, L. T. Rangel, J. G. Payette, L. Momper, T. Bosak: The Archean origin of oxygenic photosynthesis and extant cyanobacterial lineages, Band 288, Nr. 1959, 29. September 2021, doi:10.1098/rspb.2021.0675, PMID 34583585
- T. M. Lenton, H. J. Schellnhuber, E. Szathmáry: Climbing the co-evolution ladder. In: Nature. Vol. 431, Nr. 7011, 2004, S. 913, doi:10.1038/431913a, PMID 15496901, bibcode:2004Natur.431..913L (englisch).
- Kurt O. Konhauser et al.: Oceanic nickel depletion and a methanogen famine before the great oxidation event. In: Nature. Vol. 458, Nr. 7239, 2009, S. 750–753, doi:10.1038/nature07858, PMID 19360085, bibcode:2009Natur.458..750K (englisch).
- Adriana Dutkiewicz, Herbert Volk, Simon C. George, John Ridley, Roger Buick: Biomarkers from Huronian oil-bearing fluid inclusions: An uncontaminated record of life before the Great Oxidation Event. In: Geology. Band 34, Nr. 6, 6. Januar 2006, S. 437–440, doi:10.1130/G22360.1 (englisch).
- First breath: Earth's billion-year struggle for oxygen. In: New Scientist, Band 2746, 5. Februar 2010, Nick Lane: A snowball period, c2.4 – c2.0 Gya, triggered by the oxygen catastrophe (Memento vom 6. Januar 2011 im Internet Archive).
- Robert M. Hazen: Evolution of Minerals. In: Scientific American 302, 2010, doi:10.1038/scientificamerican0310-58 (Volltext online).
- Sean A. Crowe, Lasse N. Døssing, […] Donald E. Canfield: Atmospheric oxygenation three billion years ago. In: Nature. Band 501, 26. September 2013, S. 535–538, doi:10.1038/nature12426 (englisch, nature.com).