Ethin
Ethin (selten: Äthin; Trivialname: Acetylen von lateinisch acetum ‚Essig‘ und altgriechisch ὕλη hýlē, deutsch ‚Holz, Stoff‘[7]) ist ein farbloses Gas mit der Summenformel C2H2. Es ist der einfachste Vertreter aus der homologen Reihe der Alkine.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | Ethin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, brennbares Gas, in reiner Form mit schwach etherischem, technisch bedingt jedoch meist mit knoblauchartigem Geruch[1][2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 26,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Sublimationspunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Dipolmoment |
0[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 1000 ml·m−3 bzw. 1080 mg·m−3[5] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
226,73 kJ·mol−1[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ethin ist von großer industrieller Bedeutung. Es dient als Ausgangsverbindung bei der großtechnischen Herstellung wichtiger Grundchemikalien. Zum Autogenschweißen, autogenen Brennschneiden und zum Hartlöten wird es gewöhnlich in Gasflaschen transportiert und dazu in einem darin befindlichen Lösungsmittel (z. B. Aceton oder Dimethylformamid[8]) gebunden. In dieser gelösten Form wird es auch als Dissousgas ([dɪˈsuˌɡaːs], von frz. dissoudre, dissous: auflösen) bezeichnet.
Ethin ist das Gas mit dem höchstmöglichen Kohlenstoffgehalt. Die Folge ist ein besonders hoher Heizwert, wodurch sich mit Ethin die höchsten Verbrennungstemperaturen realisieren lassen. Verbrennt aus Düsen ausströmendes Ethin in Umgebungsluft, so ergeben – nur vorübergehend bestehende – glühende Kohlenstoffpartikel eine besonders hell leuchtende Flamme, die eine simple, gute Lichtquelle abgibt. Wird die Flamme an einer kühlenden Fläche abgeschreckt, kann feiner, reiner Ruß gewonnen werden.
Geschichte
Ethin wurde 1836 von Edmund Davy entdeckt, als er calciniertes Kaliumtartrat mit Holzkohle erhitzt hatte, um Kalium herzustellen; er schrieb seine Beobachtungen jedoch lediglich in sein Laborjournal. Im Jahre 1862 wurde Ethin zum ersten Mal von Friedrich Wöhler aus Calciumcarbid hergestellt und öffentlich dokumentiert. Marcellin Berthelot konnte im selben Jahr Ethin aus den Elementen Kohlenstoff und Wasserstoff herstellen. Bereits 1866 beobachtete Berthelot, dass Ethin bei hohen Temperaturen an Metalloberflächen zu Benzol cyclisiert. 1881 wurde von Michail Kutscheroff beobachtet, dass Ethanal aus Ethin durch Wasseranlagerung zugänglich ist.[9] Karbidlampen, die Ethin als Brenngas verwenden, kamen in den 1890er Jahren auf.
Um 1930 entwickelte sich in Deutschland die Reppe-Chemie (Ethin-Chemie). Da Walter Reppe die Explosionsgefahr des unter Druck gelagerten Ethins minimieren konnte, konnten viele neue Reaktionen industriell durchgeführt werden. Die fensterlosen Labors von Reppe befinden sich in den obersten Gebäudeetagen auf dem Gelände der BASF AG in Ludwigshafen am Rhein.
Die Reppe-Chemie wird in vier Hauptreaktionen zusammengefasst: die Vinylierung, die Cyclisierung, die Ethinylierung und die Carbonylierung des Ethins, die alle bei höheren Drücken ablaufen. Ethin wurde in der organischen Synthese jedoch nach dem Zweiten Weltkrieg vom Ethen weitestgehend verdrängt, weil Ethin teurer herzustellen ist, während Ethen bei industriellen Prozessen in Massen anfällt, seitdem sich die Petrochemie nach dem Zweiten Weltkrieg auf das Erdöl stützt. Noch bis 1950 war Ethin aus Kohle eine wichtige organische Ausgangssubstanz neben den Aromaten des Steinkohleteers. Noch in den 1980er Jahren wurde ein Pilotreaktor zur Gewinnung von Ethin aus Kohle in den alten Bundesländern gebaut (s. Lichtbogen-Plasma-Reaktor). Es wird auch heute noch für eine bedeutende Anzahl an Synthesen verwendet.
Giulio Natta polymerisierte Ethin 1958 zum ersten Mal zu Polyethin, dem ersten Halbleiterpolymer, das jedoch an Luft unbeständig ist. Alan Heeger und Alan MacDiarmid aus den USA, sowie der Japaner Hideki Shirakawa zeigten 1976, dass es bei einer Dotierung des Polyethins durch Oxidationsmittel zu einem sehr starken Anstieg der elektrischen Leitfähigkeit kommt. Die drei Wissenschaftler erhielten im Jahr 2000 den Chemienobelpreis für ihre Arbeit bei der Entwicklung elektrisch leitfähiger Polymere.
Acetylenzentralen
Die erste Acetylenzentrale wurde 1897 in Totis in Ungarn durch die Wiener Acetylengesellschaft errichtet. In Süddeutschland baute die Firma Keller & Knappich (heute KUKA) in Augsburg Apparate und Zentralen.[10] Im ganzen gab es um 1901 29 Acetylenzentralen und 1904 bereits etwa 60–70 mit Acetylenbeleuchtung versehene Ortschaften und Städte in Deutschland.[11][12] Neben Wohnhäusern, die an das Rohrnetz angeschlossen waren, wurden auch Straßenlaternen versorgt.
Vorkommen und Herstellung
Es gibt auf der Erde kein natürliches Vorkommen von Ethin. Außerhalb der Erde wurde es in der Atmosphäre des Jupiters sowie in interstellarer Materie nachgewiesen.

Die jährliche Weltproduktion lag 1998 bei 122.000 Tonnen. Großtechnisch wird Ethin mittels Hochtemperaturpyrolyse (s. a. HTP-Verfahren) von leichten oder mittleren Erdölfraktionen oder Erdgas bei 2.000 °C hergestellt. Nach der Pyrolyse wird das entstandene Gasgemisch schnell unter 200 °C abgekühlt (gequencht), um die weitere Zersetzung zum elementaren Kohlenstoff und Wasserstoff zu vermeiden. Man erhält ein Ethin-Ethen-Gemisch, aus dem das Ethin fraktioniert wird. Die Wärmeübertragung kann verschieden erfolgen; das modernste Verfahren ist die Wasserstoff-Lichtbogen-Pyrolyse, ein älteres, noch häufig verwendetes Verfahren ist die Lichtbogen-Pyrolyse.
Ein weiteres Verfahren zur Herstellung von Ethin ist die Reaktion von Calciumcarbid mit Wasser:
Der Kalkrest (Ca(OH)2) aus dieser Reaktion wird als Blaukalk bezeichnet.
Das dabei entstehende Ethin besitzt aufgrund von Verunreinigungen (z. B. Monophosphan) einen knoblauchartigen Geruch.
Die direkte Herstellung aus Wasserstoff und Kohlenstoff ist technisch unbedeutend. Sie erfolgt im Lichtbogen bei ungefähr 2.500 °C.
Weiter wird Ethen, das bei der Erdölverarbeitung anfällt, zu Ethin dehydriert. Außerdem entsteht es bei der unvollständigen Verbrennung von Methan, dieses Verfahren ist aber nicht wirtschaftlich.
Hochreines Ethin kann man aus handelsüblichem technischen Ethin (Reinheit ca. 99,5 %) herstellen, indem man das technische Gas durch eine mit feinkörniger Aktivkohle und Molekularsieb gefüllte Adsorbersäule leitet. Das Säulenmaterial entfernt Spurenverunreinigungen, z. B. Monophosphan (PH3), Monoarsan (AsH3), Ammoniak (NH3) und Schwefelwasserstoff (H2S), aus dem Rohalkin und beseitigt außerdem Reste des Lösungsmittels, in dem das Gas in der Druckgasflasche gelöst ist. Feinporige Filter verhindern das Mitreißen von Feinstaub. Die Reinheit des Ethins, das die Reinigungssäule verlässt, liegt zwischen 99,99 % und 99,9999 %. Das in Japan entwickelte Verfahren wird in der Patentanmeldung US4863493[13] aus dem Jahr 1989 im Detail beschrieben. Die Patentanmeldung JP2004148257[14] aus dem Jahr 2004 stellt ein portables System zur Herstellung von ultrareinem Ethin aus technischem Ethin vor, das die gleiche Reinigungstechnik anwendet.
Eigenschaften und Gefahren

Physikalische Eigenschaften
Ethin ist bei Standardbedingungen ein farbloses Gas. Da der Tripelpunkt oberhalb des Normaldrucks liegt, kann Ethin ähnlich wie Kohlendioxid bei Normaldruck nicht verflüssigt werden. Festes Ethin tritt in zwei polymorphen Kristallformen auf. Unterhalb von −140,15 °C wird ein kubisches Kristallgitter gebildet.[15] Die oberhalb des Umwandlungspunktes existierende orthorhombische Kristallform sublimiert unter Normaldruck bei −83,8 °C.[8][15] Die Umwandlungsenthalpie zwischen den beiden polymorphen Formen beträgt 2,54 kJ·mol−1.[15]
Die Löslichkeit von Ethin in Wasser beträgt bei Atmosphärendruck nur 1,23 g/kg, wohingegen die Löslichkeit in Ethanol und Aceton (27,9 g/kg unter Standardbedingungen) sehr gut ist. Letzteres wird beim Transport von Ethin in Druckgasflaschen benutzt. Die meisten Druckgasflaschen für Ethin sind heutzutage mit einer porösen Masse aus Calciumsilikathydrat gefüllt, in welche Aceton gegeben wird, das wiederum Ethin in großen Mengen lösen und damit speichern kann. Die poröse Masse verhindert bei einem Flammenrückschlag (Schweißen) durch das Ventil einen möglichen explosionsartigen Zerfall des Ethins in der Flasche.
Der Heizwert ist 57.120 kJ/m³ (i. N.) oder 48,5 MJ/kg. Ethin verbrennt an der Luft mit leuchtender, stark rußender Flamme. Die Flamme wird bei der Verbrennung mit Luft ca. 1900 bis 2300 °C heiß, bei der Verbrennung mit reinem Sauerstoff bis zu 3200 °C (Anwendung beim autogenen Schweißen). Dies ist eine der höchsten durch chemische Reaktion (ab Raumtemperatur) erreichbaren (Flammen-)temperaturen.
Acetylen bildet im Temperaturbereich zwischen −4 °C und 16 °C oberhalb von einem Druck von 5 bar ein festes, stöchiometrisches Hydrat (ein Clathrat analog zu Methanhydrat) mit der Zusammensetzung C2H2·5,75H2O.[16]
Struktur
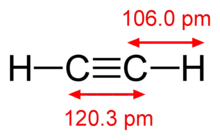
Das Molekül ist aufgrund der sp-Hybridisierung der Kohlenstoffatome vollkommen linear gebaut; alle Bindungswinkel betragen somit 180°. Die Kohlenstoff-Dreifachbindung hat eine Länge von 120 Pikometer, die Kohlenstoff-Wasserstoff-Bindung ist 106 Pikometer lang.
Die Dreifachbindung im Ethin besteht aus einer sp-Hybridbindung (σ-Bindung) und zwei orthogonalen π-Bindungen. Letztere bilden zwei rotationsinvariante Orbitale. Durch starken s-Charakter der sp-Hybridorbitale ist die Aufenthaltswahrscheinlichkeit der Elektronen der C–H-Bindung in der Nähe des Kohlenstoffs größer als beim Ethen mit sp2-hybridisierten Kohlenstoff bzw. beim Ethan mit sp3-hybridisiertem Kohlenstoff. Daher ist die C–H-Bindung relativ sauer (pKs = 25). Eine ganze Reihe von Salzen des Ethins, sogenannte Acetylide, sind bekannt.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,66141, B = 909,079 und C = 7,947 im Temperaturbereich von 214,6 K bis 308,3 K.[17] Die Temperaturabhängigkeit der molaren Wärmekapazität von gasförmigen Acetylen kann mittels der Shomate-Gleichung cp = A + B·t + C·t2 + D·t3 + E/t2 (cp in J·mol−1·K−1, t = T/1000, T in K) mit A = 40,68697, B = 40,73279, C = −16,17840, D = 3,669741 und E = −0,658411 im Temperaturbereich von 298 bis 1000 K beschrieben werden.[6]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Größe | Formelzeichen | Wert | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0gas | 226,73 kJ·mol−1[6] | |
| Verbrennungsenthalpie | ΔcH0gas | −1255,6 kJ·mol−1[8] | 298,15 K |
| Wärmekapazität | cp | 44,04 J·mol−1·K−1 (298,15 K)[18] | als Gas |
| Tripelpunkt | Ttriple | 192,4 K[19] | = −80,75 °C. Lt. Gestis: −80,6 °C. |
| Tripelpunkt | ptriple | 1,2825 bar[19] | |
| Kritische Temperatur | Tc | 308,3 K[20] | |
| Kritischer Druck | pc | 61,38 bar[20] | |
| Kritisches Volumen | Vc | 0,1122 l·mol−1[20] | |
| Kritische Dichte | ρc | 8,91 mol·l−1[20] |
Sicherheitstechnische Kenngrößen
Ethin bildet wie alle niederen Kohlenwasserstoffe mit Luft leicht entzündbare Gemische. Zusätzlich neigt die Verbindung resultierend aus ihrem endothermen Charakter zum explosiven Selbstzerfall in die Elemente.[8][21] Die sicherheitstechnischen Kenndaten können neben den auf Verbrennungsprozessen beruhenden Eigenschaften mit zunehmender Konzentration an Ethin durch die Zersetzungsreaktion beeinflusst werden. So basiert die untere Explosionsgrenze (UEG) mit 2,3 Vol.‑% (24 g/m3)[1][22] sicher auf einer reinen Verbrennung. Angaben zur oberen Explosionsgrenze (OEG) mit 82 Vol.‑%,[8] resultierend aus korrekt angewandten, genormten Prüfverfahren, sind wegen der für eine Verbrennung notwendigen, aber geringen Sauerstoffkonzentration eher mit der Selbstzersetzung begründbar. Da für die Selbstzersetzung kein Sauerstoff notwendig ist, wird die obere Explosionsgrenze auf 100 Vol.‑% gesetzt,[1][22] da im Ergebnis bzw. Ausmaß einer Explosion die physikalisch-chemische Ursache eher zweitrangig ist.
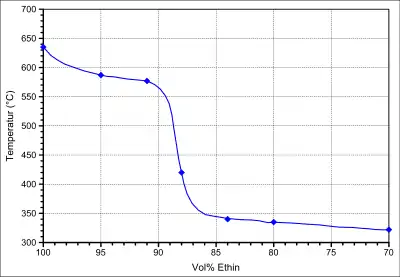
Der maximale Explosionsdruck bei einer Verbrennungsreaktion beträgt 11,1 bar.[22] Die Mindestzündenergie ist mit 0,019 mJ extrem niedrig und ist vergleichbar mit der von Wasserstoff.[22] Die Grenzspaltweite wurde mit 0,37 mm bestimmt.[22] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIC. Die Zündtemperatur beträgt 305 °C.[22] Dieser Wert gilt für ein Gemisch von 38 Vol.‑% Ethin in Luft bei atmosphärischem Druck.[16] Der Stoff fällt somit in die Temperaturklasse T2. Für eine effektive Selbstentzündung ist ein Luftanteil von etwa 10 Vol.‑% notwendig. Selbstentzündungsversuche im Quarzrohr zeigen im Bereich ab 10 Vol.-% Luft einen signifikanten Abfall der Zündtemperatur von etwa 550–600 °C auf etwa 300–350 °C, was mit einem Übergang vom Selbstzerfall zu einem oxidativen Verbrennungsprozess interpretiert werden kann.[23] Die Temperatur des Selbstzerfalls von Acetylen beträgt unter diesen Bedingungen bei Atmosphärendruck 635 °C.[23]
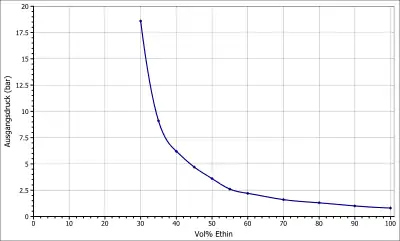
Der Selbstzerfall von Acetylen kann durch verschiedene Quellen wie Reaktionswärmen, durch heiße Oberflächen, elektrostatische Entladungen, durch Kompressionswärme oder mechanische Schockwellen ausgelöst werden.[8] Bei Vorhandensein einer der genannten Zündquellen kann Acetylen unter Normaldruck schon ab 160 °C detonativ zerfallen.[2] Dagegen ist ein Gemisch von 72 Vol.‑% Stickstoff und 28 Vol.‑% Acetylen bei der gleichen Temperatur bis zu einem Druck von 20 bar stabil.[2] Die Stabilitätsgrenzdrücke in Abhängigkeit vom Stickstoffgehalt sind experimentell bestimmt worden.[24] Mit einer hinreichend starken Zündquelle kann der Zerfall von reinem Acetylen schon bei einem Druck von 0,8 bar ausgelöst werden.[25] Die Neigung zum Selbstzerfall ist unter anderem von der Geometrie der Gefäße abhängig.[8] Die Zerfallsneigung in Rohrleitungssystemen und Pipelines ist umfangreich untersucht worden.[16][26][27] Wandflächen, die bei einer beginnenden Kettenreaktion Radikale abfangen und Energie aufnehmen, können die Gasphase damit stabilisieren. Insgesamt ist der Selbstzerfall von Acetylen von einer Vielzahl von Faktoren abhängig, was bei einem geplanten Umgang mit diesem Stoff in jedem Fall eine Einzelfallbetrachtung notwendig macht. Der Umgang mit Acetylen insbesondere unter Druck ist gefährlich und erfordert das unbedingte Einhalten der technischen Regelwerke.[16]
Auf Grund seiner Neigung zur Deflagration bzw. Detonation kann Acetylen nicht wie andere Gase verflüssigt in Druckbehältern bzw. Druckgasflaschen gelagert werden. Hier wird es in Lösungsmitteln wie Aceton oder Dimethylformamid, in denen es eine hohe Löslichkeit besitzt, gelöst. Diese Lösung ist wiederum in einem porösen Material verteilt.[8] Der Gesamtdruck im Behälter hängt vom Verhältnis zwischen Lösungsmittel und Acetylen und der Temperatur ab.[15] So ergibt sich z. B. für ein Acetylen-Aceton-Verhältnis von 1 : 1 bei 20 °C ein Druck von 25 bar.[15]
Ethin darf nicht mit kupferhaltigen Materialien in Berührung kommen, da sich ansonsten das hochexplosive Kupferacetylid bilden kann. Ähnliches gilt für Silber.
Wird Ethin inhaliert, führt es zu Schwindel und Teilnahmslosigkeit. Eine Maximale Arbeitsplatz-Konzentration ist jedoch nicht festgelegt.
Brandfall
Gasflaschen (in der Regel aus Stahl) mit unter Druck gelöstem Ethin (Acetylenflaschen), die auch nur stellenweise einer bedeutenden oder ungewissen Erhitzung ausgesetzt waren, werden als sehr gefährlich erachtet, da sich eine von außen nicht beobachtbare Zersetzungsreaktion entwickeln kann, die durch das Freiwerden von Reaktionswärme den Inhalt weiter erhitzen kann, was zum Bersten der Flasche durch Überdruck führen kann. Dabei könnten Teile der Flasche mit großer Energie durch die Luft geschleudert werden und auch dünnere Wände durchbrechen. Durch Beobachtung des Brandverlaufs und Strahlungstemperaturmessung kann das Risiko abgeschätzt werden. Erste Maßnahme – falls frühzeitig risikoarm möglich – ist, die Flasche aus dem Bereich der Flammeneinwirkung zu entfernen und ins Freie zu bringen. Zweitens wird aus sicherer Entfernung versucht die Flasche langanhaltend durch Wasser zu kühlen. Drittens wird die Flasche idealerweise durch Beschuss mit Spezialmunition punktuell geöffnet, damit Ethin – im Freien – ausströmt und den Innendruck abbaut. Das Gas – etwas leichter als Luft – wird dabei abgefackelt, um sich nicht anderswo zu entzünden.[28]
Chemische Eigenschaften und Reaktionen
In reinem Zustand riecht Ethin schwach etherisch und ist ungiftig. Aus technischem Calciumcarbid (CaC2) – z. B. aus Schweißcarbid – hergestelltes Ethin hat oft einen unangenehmen, leicht knoblauchähnlichen Geruch, der von Verunreinigungen herrührt. Meistens handelt es sich dabei um Phosphin (PH3), Arsin (AsH3), Ammoniak (NH3) und Schwefelwasserstoff (H2S), die bei der technischen Herstellung aus Calciumcarbid mitentstehen. Das Auftreten von Divinylsulfid in Ethin bei dessen Herstellung aus Calciumcarbid kann auf das Vorhandensein von Spuren von Calciumsulfid in handelsüblichem Calciumcarbid zurückgeführt werden, das mit Ethin zu Divinylsulfid reagiert[29].
Ethin ist eine CH-acide Verbindung. Es ist mit einem pKs-Wert von 25 aber deutlich schwächer sauer als Wasser (pKs-Wert 15,7) und saurer als Ammoniak (pKs-Wert 35). Dies bedeutet, dass es in Wasser praktisch nicht dissoziiert. Unter drastischeren Bedingungen (z. B. mit Natriumamid, NaNH2 in flüssigem Ammoniak) wird Ethin leicht deprotoniert und bildet Acetylide:
Die geringe Dissoziation in wässrig-ammoniakalischer Lösung genügt jedoch zur Reaktion des gebildeten Acetylid-Anions mit Übergangsmetall-Kationen, also z. B. Ag+ oder Cu2+, zu sehr schwer löslichen Metallacetyliden, wie z. B. mit Ag+ zu Silberacetylid oder mit Cu2+ zu Kupferacetylid. Das Reaktionsgleichgewicht wird dabei durch die Ausfällung der Acetylide in Produktrichtung verschoben:
Solche Metallacetylide sind in trockenem Zustand extrem schlagempfindlich und explodieren leicht.
Bei hohem Druck zerfällt Ethin zu Ruß und Wasserstoff:
Es kann zu Ethen und schließlich zu Ethan hydriert werden:
Mit vielen Katalysatoren lässt sich diese Hydrierung nicht auf der Alkenstufe stoppen. Mit einigen Palladium- oder Nickelkatalysatoren gelingt jedoch bei sorgfältiger Wahl der Reaktionsbedingungen die Ethensynthese aus Ethin.
Ethin reagiert mit Chlor zu Kohlenstoff und Chlorwasserstoff:
Auch die Addition von Halogenen ist möglich. Dabei polarisiert die Pi-Elektronenwolke des Ethins das angreifende Halogenmolekül und teilt mit diesem seine Pi-Elektronen, es entsteht ein Dreiring aus zwei Kohlenstoffatomen und einem (positiv geladenen) Halogeniumion (die Ladung ist über den gesamten Ring verteilt); außerdem wird ein Halogenatom mit negativer Ladung abgegeben. Dieses wirkt im zweiten Schritt als Nucleophil und greift den instabilen Ring an, es entsteht ein vicinales Dibromid.[30] Bei der ersten Addition mit Chlor bildet sich 1,2-Dichlorethen und bei erneuter Addition Tetrachlorethan. Die Addition von Halogen an Ethin erfolgt aber langsamer als beim Ethen, da die C≡C-Dreifachbindung weniger nucleophil ist als eine C=C-Doppelbindung:
Analog kann es unter Entfärbung der Reaktionslösung mit Brom reagieren.
Mit Halogenwasserstoffen können Vinylhalogenide hergestellt werden. So reagiert Ethin mit Chlorwasserstoff zu Vinylchlorid:
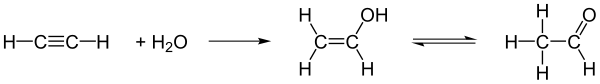
Es kann mit Hilfe eines Katalysators zu Vinylalkohol hydratisiert werden, welches das Enol von Acetaldehyd ist und dazu tautomerisiert.
Ethin kann – mit Hilfe von Katalysatoren – zu Styrol oder Cyclooctatetraen cyclisiert werden; es werden jeweils 4 Ethinmoleküle zum Endprodukt umgesetzt:
Unter Katalyse durch Kupfer(I)-chlorid in wässriger Phase entsteht Butenin (Vinylacetylen).[31]
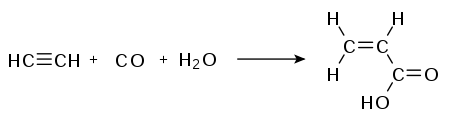
Bei der Carbonylierung wird Ethin mit Kohlenmonoxid und Wasser an Katalysatoren wie zum Beispiel Nickeltetracarbonyl zu ungesättigten Carbonsäuren umgesetzt. So entsteht bei obiger Reaktion Propensäure:
Es können Alkohole und Carbonsäuren an Ethin addiert werden. Werden Alkohole addiert, so ergeben sich Vinylether, Carbonsäuren ergeben Vinylester:
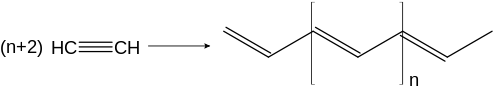
Beim Erhitzen an Ziegler-Natta-Katalysatoren polymerisiert Ethin zu Polyethin (im Bild trans-Polyethin). An Kupfer-Katalysatoren kann es zum Cupren polymerisieren.
Verwendung
Während der Zeit der sogenannten "Acetylenchemie" war Ethin der wichtigste Chemierohstoff. Nach 1965 wurde die Ethin-Kapazität praktisch nicht mehr erhöht, da viele Acetylen-Folgeprodukte aus den billigeren Rohstoffen Ethen (Ethylen) und Propen (Propylen) zugänglich wurden.[32]
| Produkt | Konkurrierender Rohstoff | Verfahren |
|---|---|---|
| Acrylnitril | Propen | Ammonoxidation |
| Acetaldehyd | Ethen | Oxidation mit O2 oder Luft |
| Vinylchlorid | Ethen | Oxychlorierung |
| Vinylacetat | Ethen | Oxidation mit O2 |
| Tetrahydrofuran | Maleinsäureanhydrid | Hydrierung |
Ungefähr 80 % des Ethins wird für die organische Synthese verwendet. Durch Addition von Halogenwasserstoffen werden Vinylhalogenide und Polyvinylhalogenide, zum Beispiel Vinylchlorid oder Polyvinylchlorid hergestellt. Durch Addition von Essigsäure wird Vinylacetat und Polyvinylacetat hergestellt, durch Addition von Ethanol Vinylether und Polyvinylether. Außerdem werden Cyclooctatetraen, Acrylsäure, Essigsäure, 1,3- sowie 1,4-Butandiol, Propargylalkohol, 2-Butin-1,4-diol, Vinylethin, Bernsteinsäure, Neopren, Chloropren, Vinylester, Polyvinylester, höhere Alkohole, und Monochlorethansäure aus Ethin synthetisiert. Besonders die hergestellten Polymere sind von industrieller Bedeutung. Seltener wird aus Ethin Benzol, 1,3-Butadien, Ethanol, Acrylnitril und Polyacrylnitril, Vinylhalogenide, Acrylsäure und Acetaldehyd hergestellt.
Der aus Ethin gewonnene Acetylenruß wird als Kautschukzusatz bei der Herstellung von schwarzem Gummi oder zur Produktion von Druckerschwärze sowie in Batterien eingesetzt. Aufgrund der hohen Bindungsenergie der Dreifachbindung wurde Ethin zu Beleuchtungszwecken (Karbidlampe) verwendet, erstmals auf dem Leuchtturm Gåsfeten auch für den Schiffsverkehr. Heute dient es häufig als Dissousgas zum Autogenschweißen und Autogenschneiden. Im Handel wird es in kastanienbraunen (früher gelben) Flaschen verkauft. Bis in die 1950er Jahre wurde reines Ethin gemischt mit 60 % Sauerstoff, Narcylen genannt, als inhalierbares Narkosemittel verwendet. Als es jedoch zu Explosionen kam, wurde es nicht mehr verwendet. In der industriellen Terpen-Synthese, die vor allem als Duft- und Aromastoffe verwendet werden, spielt die Ethinylierung eine Rolle, schon im Grundschritt für alle Terpen-Synthesen wird Ethin mit Aceton in Gegenwart einer Base zum 3-Butin-2-ol ethinyliert, auch in weiteren höheren Schritten findet sich die Ethinylierung immer wieder. Auch bei der Synthese von Vitamin A findet eine Ethinylierung statt: so wird in einem Schritt β-Ionon zu Ethinylionol ethinyliert.
Auch in der Mikroelektronik und Mikrotechnik wird Ethin eingesetzt. Hier dient es z. B. zum Abscheiden von Diamant-, Graphit- oder Polyacetylenschichten und zur Herstellung von Nanoröhren.
In der Analytischen Chemie wird Ethin als Brennstoff für die Gasflamme des Atomabsorptionsspektrometers eingesetzt. Durch die hohe Flammentemperatur werden die Bestandteile einer Probe atomisiert.
Nachweis
Der Nachweis von Ethin ist durch Einleiten des Gases in eine ammoniakalische Silber(I)- oder Kupfer(I)-Salzlösung möglich, wobei schwerlösliche Acetylide ausfallen:[2]
Literatur
- Julius A. Nieuwland, R. R. Vogt: The Chemistry of Acetylene. Reinhold, New York 1945.
- S. A. Miller: Acetylene, its Properties, Manufacture and Uses, Vol. 1. Ernest Benn, London 1965.
- Walter Reppe: Chemie und Technik der Acetylen-Druck-Reaktionen. Verlag Chemie, 1952.
- Heinz Gunter Viehe: Chemistry of Acetylenes. M. Dekker, New York 1969.
- Paul Hölemann, Rolf Hasselmann: Die Druckabhängigkeit der Zündgrenzen von Acetylen-Sauerstoffgemischen. Westdt. Verlag, 1961.
- G. W. Jones, R. E. Kennedy: Effect of Pressure on Ignition Temperature of Acetylene and Acetylene-Air Mixtures. Report of Investigations, Bureau of Mines, Schwaz 1945.
Weblinks
- Eintrag zu Acetylene in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
- Reaktionen des Ethins
Einzelnachweise
- Eintrag zu Acetylen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. März 2019. (JavaScript erforderlich)
- Eintrag zu Acetylen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Oktober 2013.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- Eintrag zu Acetylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-86-2 bzw. Acetylen), abgerufen am 15. September 2019.
- M. W. Chase, Jr.: NIST-JANAF Themochemical Tables. (= J. Phys. Chem. Ref. Data. Monograph 9). 4. Auflage. 1998.
- Renate Wahrig-Burfeind (Hrsg.): Wahrig. Illustriertes Wörterbuch der deutschen Sprache. ADAC-Verlag, München 2004, ISBN 3-577-10051-6, S. 85.
- P. Pässler, W. Hefner, K. Buckl, H. Meinass, A. Meiswinkel, H.-J. Wernicke, G. Ebersberg, R. Müller, J. Bässler, H. Behringer, D. Mayer: Acetylene. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2008. doi:10.1002/14356007.a01_097.pub3.
- M. Kutscheroff: Über eine neue Methode direkter Addition von Wasser (Hydratation) an die Kohlenwasserstoffe der Acetylenreihe. In: Berichte der deutschen chemischen Gesellschaft. Vol. 14, 1881, S. 1540–1542. doi:10.1002/cber.188101401320.
- Geschichte der Firma KUKA.
- Acetylenzentralen von Prof. Dr. J. H. Vogel 1901.
- Acetylen. In: Otto Lueger: Lexikon der gesamten Technik und ihrer Hilfswissenschaften. Band 1, Stuttgart/ Leipzig 1904, S. 56–61.
- Patent US4863493: Anmelder: Nichigo Acetylene Kabushiki.
- Patent JP2004148257: Veröffentlicht am 27. Mai 2004, Anmelder: Nichigo Acetylene & Taiyo Toyo Sanso.
- W. Wiechmann: Amts- und Mitteilungsblatt der Bundesanstalt für Materialforschung und -prüfung (BAM). 3, 1987, S. 505.
- EIGA-IGC-Dokument 123/13/D Praxisleitfaden zum sicheren Umgang mit Acetylen (PDF; 669 kB)
- D. Ambrose, R. Townsend: Vapour Pressure of Acetylene. In: Trans. Faraday Soc. 60, 1964, S. 1025–1029; doi:10.1039/TF9646001025.
- L. V. Gurvich, I. V. Veyts, C. B. Alcock: Thermodynamic Properties of Individual Substances. 4. Auflage. Vols. 1 and 2, Hemisphere, New York 1989.
- A. M. Clark, F. Din: Equilibria Between Solid, Liquid, and Gaseous Phases at Low Temperature binary systems acetylene - carbon dioxide, acetylene - ethylene and acetylene - ethane. In: Trans. Faraday Soc. 46, 1950, S. 901–911. doi:10.1039/TF9504600901.
- C. Tsonopoulos, D. Ambrose: Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons. In: J. Chem. Eng. Data. 41, 1996, S. 645–656. doi:10.1021/je9501999.
- W. Rimarski: Brand- und Explosionsgefahren beim Acetylen. In: Angew. Chem. 42, 1929, S. 933–936. doi:10.1002/ange.19290423802.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- G. W. Jones, R. E. Kennedy: Effect of Pressure on Ignition Temperature of Acetylene and Acetylene-Air Mixtures. Report of Investigations, Bureau of Mines, Schwaz 1945. (dig.Library)
- Th. Schendler, H.-P. Schulze: Stabilitätsgrenzdrücke von Acetylen/Gas-Gemischen. In: Chem. Ing. Techn. 62, 1990, S. 41–43. doi:10.1002/cite.330620111.
- D. Lietze, H. Pinkofsky, T. Schendler, H.-P. Schulze: Stabilitätsgrenzdruck von Acetylen. In: Chem. Ing. Techn. 61, 1989, S. 736–738. doi:10.1002/cite.330610915.
- H. B. Sargent: Chem. Eng. 64, 1957, S. 250.
- M. E. Sutherland, M. W. Wegert: Chem. Eng. Prog. 69, 1973, S. 48.
- Explosionsgefahr in Graz: Cobra rückte an. ORF.at vom 7. Juli 2014.
- B. A. Trofimov, S. V. Amosova: Divinyl Sulfide: Synthesis, Properties, and Applications. In: Sulfur reports. 3, 2007, S. 323, doi:10.1080/01961778408082463.
- Paula Yurkanis Bruice: Organische Chemie. 5. Auflage. Pearson Education, 2007, ISBN 978-3-8273-7190-4, S. 211.
- Klaus Weissermel, Hans-Jürgen Arpe: Industrielle organische Chemie: Bedeutende Vor- und Zwischenprodukte. Wiley-VCH, 2007, ISBN 978-3-527-31540-6, S. 132.
- Ernst Bartholomé: Die Entwicklung der Verfahren zur Herstellung von Acetylen durch partielle Oxidation von Kohlenwasserstoffen. In: Chemie Ingenieur Technik. Band 49, Nr. 6, Juni 1977, S. 459–463, doi:10.1002/cite.330490602.