Cycloalkane
Die Cycloalkane (Cyclane, ältere Bezeichnung: Naphthene, Cycloparaffine) sind eine Stoffgruppe von ringförmigen, gesättigten Kohlenwasserstoffen. Die Ringe können Seitenketten tragen.[1] In der Systematik der organischen Chemie zählt man sie zu den alicyclischen Verbindungen. Die Cycloalkane ohne Seitenketten bilden eine homologe Reihe mit der allgemeinen Summenformel CnH2n, wobei n ≥ 3 ist. Somit ist das kleinste vorkommende Cycloalkan das Cyclopropan.
Historische Informationen
Natürlich vorkommende Cycloalkane (Cyclopentan, Cyclohexan, Cycloheptan) wurden als erstes vom Chemiker Wladimir Wassiljewitsch Markownikow in der Rohbenzin-Fraktion, auch Naphtha genannt, des kaukasischen Erdöls gefunden. Die Bezeichnung Naphthen, die gelegentlich für alle Cycloalkane verwendet wird, stammt daher. Meist wird diese unpräzise Bezeichnung aber nur auf die Derivate des Cyclopentans und -hexans angewandt. In der Erdölindustrie ist sie noch heute gebräuchlich.
Klassifizierung

Ein Einteilungskriterium für Cycloalkane ist die Größe des Kohlenstoffrings. Cycloalkane, deren cyclische Kohlenstoffkette drei oder vier Kohlenstoffatome enthält, werden als klein, von fünf bis sieben als normal, von acht bis elf als mittlere und mehr als elf als größere bezeichnet.
Neben einfachen Ringen der Monocyclen gibt es Cycloalkane, die aus mehreren miteinander verbundenen Ringen bestehen, sie werden polycyclische Alkane genannt. Dabei gibt es wiederum unterschiedliche Möglichkeiten, die Ringe zu verbinden: Man unterscheidet verbundene (kondensierte) und verbrückte Polycyclen sowie Spiroverbindungen.
Nomenklatur
Die Namen der Cycloalkane werden aus denjenigen der entsprechenden offenkettigen Alkane mit gleicher Kohlenstoffanzahl durch die Vorsilbe Cyclo gebildet.
Polycyclische Alkane werden ebenfalls nach den Alkanen mit gleicher Anzahl an Kohlenstoffen benannt. Die Anzahl der Ringe wird durch die Vorsilbe Bicyclo, Tricyclo usw. angegeben. Die Kohlenstoffanzahl zwischen Kohlenstoff-Atomen, die Ringe verbinden (so genannte "Brückenkopfatome"), wird in absteigender Reihenfolge in eckigen Klammern dem Namen vorangestellt. Die Benennung von Spiroverbindungen geschieht in gleicher Weise, jedoch wird statt der Vorsilbe Bicyclo, Tricyclo usw. Spiro verwendet. Weist das Molekül Substituenten auf, wird deren Ort mit einer Zahl am Anfang gekennzeichnet, darauf folgt, getrennt durch ein -, der Name des Substituenten und schließlich der Name des Cycloalkanrings.
Struktur
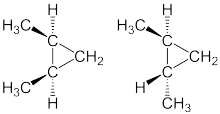
In Strukturformelzeichnungen der Cycloalkane werden die Ringe verkürzt durch Vielecke dargestellt. Cycloalkane kann man sich als eine Form der Alkane vorstellen, bei der die beiden Enden der Kohlenstoffkette miteinander verknüpft sind. Es handelt sich nicht um Isomere der Alkane. Sie sind wie die Alkane gesättigte Verbindungen.
Isomerie
Da die Rotation eines Substituenten um ein Ringkohlenstoffatom unmöglich ist, tritt eine spezielle Form der Isomerie auf, die cis-trans-Isomerie. Bei cis-trans-Isomeren ist die räumliche Anordnung von Substituenten unterschiedlich. Die Substituenten können auf der gleichen Seite (cis) oder auf unterschiedlichen Seiten (trans) der Ringbindung liegen.
Konformationen
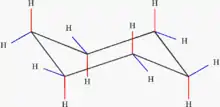
Um Molekülspannungen zu umgehen, sind die Cycloalkane nicht, wie häufig dargestellt, planar. Sie liegen vielmehr in Konformationen vor, in denen der Innenwinkel der Tetraederform (109,45°) möglichst erhalten bleibt. Bei Cyclopropan, Cyclobutan und Cyclopentan wird dieser Winkel nicht ganz erreicht, es kommt zur sogenannten Baeyer-Spannung; wegen dieser Spannung sind diese Moleküle reaktiver. Im Cyclohexanmolekül hat diese Spannung aber bereits nahezu keinen Einfluss mehr.
Eigenschaften
Die ringförmige Struktur der Cycloalkane wirkt sich auf ihre Reaktivität und die Schmelz- und Siedepunkte aus. Schmelz- und Siedepunkt eines monocyclischen Alkans sind immer höher als die des entsprechenden n-Alkans, da die Londonsche Wechselwirkung beim Cycloalkan wegen seiner starreren Struktur stärker ist als beim flexibleren n-Alkan. Die Siedetemperatur ist 3 bis 7 % höher, die Dichte steigt um ca. 15 bis 19 % und das Molvolumen nimmt bei 20 °C auf 83 % ab.
Cyclopropan, Cyclobutan und Cyclopentan sind reaktiver als die höheren Cycloalkane, weil bei ihnen die Baeyer-Spannung eintritt.
Monocyclische unsubstituierte Alkane mit drei oder vier Kohlenstoffatomen sind unter Normalbedingungen gasförmig, ab fünf Kohlenstoffatomen sind sie flüssig.
In Wasser sind Cycloalkane schlecht löslich bis unlöslich. Cycloalkane sind leicht entflammbar, jedoch relativ reaktionsträge. Sie gehen im Wesentlichen die gleichen Reaktionen wie die Alkane ein.
Vorkommen
Neben dem in vielen Steroiden und Terpenen vorkommenden Sechsring des Cyclohexans gibt es in der Natur viele weitere Derivate von kleinen Ringen und Makrocyclen. Die Steroide bauen auf dem Cycloalkan Gonan auf.
Viele Cycloalkane wie Cyclohexan, Methylcyclohexan und Cyclopentan kommen im Erdöl vor. Dort wurden auch geringe Mengen der kristallinen Feststoffe der Diamantoide gefunden, deren einfachster Vertreter das Adamantan ist.
Cycloalkane mit einem Kohlenstoffanteil von 14 bis 18 kommen zum Beispiel in Riechstoffen wie dem Moschus vor, der aus einer Drüse der Moschustiere (Moschidae) gewonnen wird.
Verwendung
Cyclohexan sowie Cyclododecan sind Ausgangsmaterialien für die Synthese von Caprolactam beziehungsweise Laurinlactam. Ebenso wie die daraus abgeleiteten Dicarbonsäuren werden diese für die Herstellung von Polyamiden benötigt.
Cyclohexan, Decalin, Cyclopentan und Methylcyclohexan werden als Lösungsmittel verwendet.
Einzelnachweise
- Eintrag zu cycloalkanes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01497 – Version: 2.1.5.
Literatur
- Josef Houben, Theodor Weyl: Methods of Organic Chemistry, Ln; Methoden der organischen Chemie, Ln, Bd.5/1a, Alkane, Cycloalkane. Thieme, Stuttgart 1994, ISBN 3-13-202204-7