Sulfochlorierung
Die Sulfochlorierung oder Reed-Reaktion ist eine durch Licht oder Radikalstarter ausgelöste chemische Reaktion, bei der in einer Kohlenwasserstoff-Verbindung Wasserstoff durch die Chlorsulfongruppe (-SO2Cl) unter Bildung von Alkylsulfonylchloriden ersetzt wird. Die Reaktion wird meist photochemisch initiiert und erfolgt in einer radikalischen Kettenreaktion zwischen Alkanen, Schwefeldioxid und Chlor.
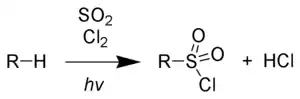
Diese Produkte der Reaktion werden unter anderem zu Sulfonsäureamiden oder Alkylsulfonsäuresalzen, die als Tenside eingesetzt werden, weiterverarbeitet. Da eine direkte Sulfonierung der Alkane mit Oleum oder Schwefeltrioxid kaum möglich ist, hat sich diese Reaktion als nützlich erwiesen. Durch das direkt am Schwefel gebundene Chlor sind die entstehenden Produkte äußerst reaktiv. Als Nebenprodukte finden sich im Reaktionsgemisch Alkylchloride, die durch reine Photochlorierung entstehen, sowie mehrfach sulfochlorierte Produkte. Als Koppelprodukt entsteht bei der Reaktion Chlorwasserstoff.[1]
Geschichte

Die Erstbeschreibung der Sulfochlorierung stammt von Cortes F. Reed aus dem Jahr 1936. Die Reaktion wird daher auch als Reed-Reaktion bezeichnet.[2] Reed nahm an, dass die Reaktion über die Bildung des Hypochlorsulfochlorids verläuft, einem instabilen Isomer des Sulfurylchlorid mit vierwertigem Schwefel, in dem Chlor direkt und über eine Hypochlorit-Gruppe an den Schwefel gebunden ist. Das Hyposulfochlorid sollte mit Alkanen zu Alkylsulfitesterchloriden reagieren.
Der eigentliche Radikalkettenmechanismus wurde Anfang der 1940er Jahre von Friedrich Asinger aufgeklärt.[3] Als Leiter der Forschungsgruppe für die Entwicklung neuer Tenside im Zentralen Versuchslaboratorium der Ammoniakwerke Merseburg in Leuna hatte er entscheidenden Anteil an der technischen Umsetzung des Verfahrens.[4] Die Rohstoffbasis bildeten Alkanfraktionen der Fischer-Tropsch-Synthese, die durch Sulfochlorierung in sekundäre Alkylsulfonate überführt und anschließend verseift wurden.[5] Mit diesen sogenannten Mersolaten wurde die Versorgung mit Waschmitteln im Zweiten Weltkrieg aufrechterhalten, ohne wertvolle Fette und Öle zu verbrauchen.[4]
Hintergrund
Eine photochemische Primärreaktion wird nur durch absorbiertes Licht ausgelöst. Daher muss einer der Reaktionspartner dieses Licht absorbieren. Im Falle der Sulfochlorierung ist das Chlor der absorbierende Reaktionspartner. Chlor absorbiert Licht in einem Wellenlängenbereich von etwa 250 bis 450 Nanometern, entsprechend einer Absorption im langwelligen ultravioletten und im sichtbaren violetten Spektralbereich.[6] Für die homolytische Spaltung von Chlor ist eine Energie von 244 Kilojoule pro Mol notwendig.[7]
Gemäß dem Photochemischen Äquivalenzgesetz verursacht jedes absorbierte Photon eine Photochemische Primärreaktion.[8]
mit NA als Avogadro-Konstante (NA = 6,022 1023 mol−1), dem planckschen Wirkungsquantum (h = 6,626 10−34 Js) und der Lichtfrequenz mit der Einheit s−1.
Über die Beziehung:
mit für die Lichtgeschwindigkeit (c = 299.792.458 ms−1) ergibt sich
und damit für die Wellenlänge in der Einheit nm:
Durch Einsetzen der Werte ergibt sich ein Wert für die Wellenlänge von 491 Nanometern, die das eingestrahlte Licht maximal aufweisen darf, um eine Spaltung von Chlor zu bewirken. Das Absorptionsmaximum von Chlor liegt bei etwa 340 Nanometern.[9] Licht dieser Wellenlänge strahlt etwa eine Energie von 377 Kilojoule pro Mol ein und ist damit mehr als ausreichend für eine Photolyse des Chlors. Die Menge des absorbierten Lichts wird durch das lambert-beersche-Gesetz beschrieben und hängt ab von der Konzentration der absorbierenden Substanz, dem Absorptionskoeffizienten des Materials und der Schichtdicke.[10][11]
Für photochemische Prozesse ist es wichtig, wie sich die Zahl der umgesetzten Moleküle zur Zahl der absorbierten Lichtquanten verhält. Dieses Verhältnis wird als Quantenausbeute (QA) bei einer bestimmten Lichtwellenlänge bezeichnet. Das Verhältnis von umgesetzten Molekülen des lichtabsorbierenden Stoffs zur Anzahl der absorbierten Photonen berechnet sich als:
Die Quantenausbeute sollte beim photochemischen Primärprozess, der Absorption des Lichtquants, den Wert 1 nicht übersteigen. Bei der Sulfochlorierung ist dieses Verhältnis jedoch nicht gleich oder kleiner 1, sondern wegen der Sekundärprozesse, bei denen die gleichen Stoffe entstehen wie beim photochemischen Primärprozess, oft beträchtlich größer.[5]
Reaktion
Alkane reagieren mit einer Mischung aus Schwefeldioxid und Chlor zu Alkylsulfonylchloriden:[12]
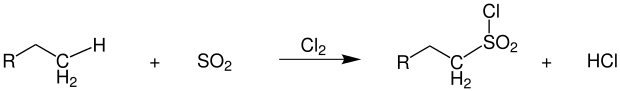 Übersichtsreaktion der Reed-Reaktion
Übersichtsreaktion der Reed-Reaktion
Als Koppelprodukt entstehen stöchiometrische Mengen Chlorwasserstoff. Die Kettenreaktion wird photolytisch durch Zufuhr geeigneter Energie in Form von Ultraviolettstrahlung gestartet. Auch höherenergetische Gammastrahlung kann eingesetzt werden.[13] So kommt es zum homolytischen Bindungsbruch der Chlor-Chlor-Bindung:
Das Chlormolekül zerfällt homolytisch in zwei Chlorradikale. Ein Chlor-Radikal reagiert mit dem Alkan unter Bildung eines Alkylradikals und Chlorwasserstoff. Anschließend verbindet sich das Alkylradikal mit dem Schwefeldioxid. Zuletzt entsteht das Alkylsulfonylchlorid unter Freisetzung eines neuen Chlorradikals. Die Kettenreaktion beginnt von Neuem und das im letzten Schritt gebildete Chlorradikal reagiert mit dem Alkan unter Bildung eines Alkylradikals und Chlorwasserstoff. Der Kettenabbruch erfolgt durch Rekombination von Radikalen. Neben den Alkanen können auch Polymere wie Polyethylen sulfochloriert werden.[14]
Reaktionstechnik
Die Sulfochlorierung erfolgt in flüssiger Phase durch gleichzeitiges Einleiten von Chlor und Schwefeldioxid in das flüssige Alkan, etwa Dodekan. Die Sulfochlorierung ist nicht selektiv, es entsteht oft ein Gemisch stellungsisomerer Alkylsulfonylchloride.[15] Die Substitution der Wasserstoffatome in einem Kohlenwasserstoff erfolgt rein statistisch, wobei tertiäre Wasserstoffatome schneller reagieren als sekundäre und diese schneller als primäre, wobei tertiärer Wasserstoff bevorzugt der reinen Chlorierung unterliegt.
Als Nebenreaktionen erfolgt unter bestimmten Bedingungen lediglich eine Photochlorierung des Alkans:
Diese Nebenreaktion lässt sich durch das Arbeiten in einem leichten, etwa zehnprozentigen Schwefeldioxidüberschuss minimieren. Die Reaktion wird bei Temperaturen zwischen 20 und 30 °C durchgeführt, höhere Temperaturen begünstigen die Photochlorierung.
Außerdem können sich mehrfach sulfochlorierte Substanzen bilden. Wird die Reaktion bei Tageslicht im Labor ausgeführt, bilden sich chlorierte und sulfochlorierte Produkte etwa im selben Verhältnis. Durch die Verwendung von ultravioletten Licht lässt sich die Bildung von Nebenprodukten weitgehend unterdrücken. Ein Teil der Produkte zerfällt unter Bestrahlung wieder in das Chlorid und freies Schwefeldioxid:[16]
Die Reaktion wird bei einem Umsatz von etwa 50 % abgebrochen, um eine Mehrfachsubstitution zu minimieren. Die aus mehrfach sulfochlorierten Alkanen hergestellten Tenside, besonders solche mit Alkylkette bis 14 Kohlenstoffatomen, weisen schlechte Wascheigenschaften auf. Bei längerkettigen Alkanen tritt der Effekt in den Hintergrund.[17]
Produkte
Alkylsulfonsäuresalze
Die durch diese Reaktion hergestellten Alkylsulfonylchloride sind wichtige Zwischenprodukte bei der technischen Synthese von Detergentien. Durch Umsetzung mit Natronlauge werden die Natriumsalze der Alkylsulfonsäuren erhalten.
Die als Nebenprodukt entstehenden Chloralkane werden bei diesem Verfahrensschritt in wasserlösliche Alkohole überführt. Die Alkylsulfonsäuren sind unter aeroben Bedingungen leicht biologisch abbaubar.[18] Die Alkylsulfonsäuren werden in der Emulsionspolymerisation eingesetzt und dienen außerdem dem Emulgieren von Ölen und Mineralölen. Die Aminsalze sind öllöslich und finden Anwendung in der Herstellung selbstemulgierender Öle wie die Calcium- oder Zinksalze der Sulfonsäuren.[19]
Sulfonsäureamide
Durch Reaktion mit Ammoniak oder Alkylaminen entstehen Sulfonsäureamide:
Dabei ist ein Überschuss an Ammoniak notwendig, da es ansonsten zur Bildung von Disulfimiden kommt:
Alkylsulfonsäureester
Die Alkylsulfonylchloride lassen sich mit Alkoholen oder Natriumphenolat zu Alkylsulfonsäureestern umsetzen:
Sulfochloriertes Polyethylen
Sulfochloriertes Polyethylen lässt sich mit Benzidin zu Kautschukähnlichen Verbindungen vernetzen. Die Markenbezeichnung Hypalon von DuPont hat sich als Trivialname für alle chlorsulfonierten Polyethylene (Kurzz. CSM) eingebürgert, obwohl es weitere Hersteller dieser Produktgruppe gibt.[20]
Verfahrensvarianten
Arbeiten mit Radikalstartern
Die Durchführung der Sulfochlorierung gelingt auch in einer Dunkelreaktion in Anwesenheit von Radikalstartern wie Azobis(isobutyronitril). Peroxide wie Wasserstoffperoxid oder Acetonperoxid können die Kettenreaktion ebenfalls starten.[21]
Sulfobromierung
Beim Ersatz von Chlor durch Brom findet keine nennenswerte Reaktion zu Sulfobromiden statt. Wird mit einem Gemisch gearbeitet, bei dem das Brom auf molekularer Basis zur Hälfte durch Chlor ersetzt ist, reagieren Alkane mit Schwelfeldioxid, Brom und Chlor zu Sulfobromiden unter Freisetzung von Chlorwasserstoff.
Thioharnstoffverfahren
Alkylisothioharnstoffhydrochloride lassen sich durch Reaktion von Chloralkanen mit Thioharnstoff unter Freisetzung von Chlorwasserstoff gewinnen.[22] Thioharnstoff reagiert dabei in der Iso-Form. Die Alkylisothioharnstoffhydrochloride reagieren mit Chlor in wässriger Lösung und setzen sich zu Sulfochloriden um.[23]
Literatur
- E. Müller, O. Bayer, H. Meerwein, K. Ziegler: Houben-Weyl: Methods of Organic Chemistry. Vol. IX: Sulfur, Selenium, Tellurium Compounds, Thieme Verlag, 1955, ISBN 978-3-13-208104-8
Weblinks
Einzelnachweise
- Eintrag zu Sulfochlorierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- Patent US2046090: Method of halogenating compounds and product resulting therefrom. Veröffentlicht am 30. Juni 1936, Erfinder: Cortes F. Reed.
- Friedrich Asinger, Walter Schmidt, Franz Ebeneder: Zur Kenntnis der Produkte der gemeinsamen Einwirkung von Schwefeldioxyd und Chlor auf aliphatische Kohlenwasserstoffe im ultravioletten Licht, I. Mitteil.: Die Produkte der gemeinsamen Einwirkung von Schwefeldioxyd und Chlor auf Propan in Tetrachlorkohlenstofflösung. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 75, 1942, S. 34–41, doi:10.1002/cber.19420750105.
- Egon Fanghänel: Prof. em. Dipl.-Ing., Dr. techn., Dr. phil. habil., Dr. rer. tech. h. c., Dr. rer. nat. h. c. Friedrich Asinger (1907–1999). In: Sitzungsberichte der Leibniz-Sozietät der Wissenschaften zu Berlin, 92 (2007), S. 189–192.
- E. Müller, O. Bayer, H. Meerwein, K. Ziegler: Houben-Weyl: Methods of Organic Chemistry. Vol. XIV/I: Macromolecular Compounds, Thieme Verlag, 1961, ISBN 978-3-13-214904-5, S. 196.
- Hans Von Halban: Die Lichtabsorption des Chlors. In: Zeitschrift für Elektrochemie und angewandte physikalische Chemie. 28, 1922, S. 496–499, doi:10.1002/bbpc.19220282304.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 71.
- Arthur John Allmand: Part I.—Einstein’s law of Photochemical equivalence. Introductory address to Part I. In: Trans. Faraday Soc. 21, 1926, S. 438, doi:10.1039/TF9262100438.
- Theodor Weyl (Begr.), Josef Houben (Hrsg.), Eugen Müller (Hrsg.): Methoden der organischen Chemie. IV/5a Photochemie . Thieme Verlag, Stuttgart 1975, ISBN 978-3-13-201904-1, S. 91.
- August Beer: Bestimmung der Absorption des rothen Lichts in farbigen Flüssigkeiten. In: Ann. Phys. Chem, 86.2, 1852, S. 78.
- Johann Heinrich Lambert: Photometria, sive de mensura et gradibus luminis, colorum et umbrae. Sumptibus Vidae Eberhardi Klett, Augsburg 1760 (Digitalisat im Angebot der Universität Straßburg [abgerufen am 16. Mai 2016]).
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1364.
- Alfred Schneider, Ju Chin Chu: Sulfochlorination of Cyclohexane Induced by Gamma Radiation. In: Industrial & Engineering Chemistry Process Design and Development. 3, 1964, S. 164, doi:10.1021/i260010a012.
- M. A. Smook, E. T. Pieski, C. F. Hammer: Derivatives of Chlorosulfonated Polyethylene and Their Infrared Spectra. In: Industrial & Engineering Chemistry. 45, 1953, S. 2731, doi:10.1021/ie50528a050.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2311.
- Hans Kroepelin, A. W. Frh. v. Eberstein, W. Freiss, G. Käbisch, W. Opitz: Beobachtungen bei der photochemischen Sulfochlorierung von Kohlenwasserstoffen. In: Angewandte Chemie. 64, 1952, S. 273–274, doi:10.1002/ange.19520640908.
- Friedrich Asinger, Franz Ebeneder, Gerd Richter: Zur Kenntnis der Produkte der gemeinsamen Einwirkung von Schwefeldioxyd und Chlor auf aliphatische Kohlenwasserstoffe im ultravioletten Licht. VI. Über den Einfluß von Disulfonaten auf die oberflächenaktiven und waschtechnischen Eigenschaften von Monosulfonaten. In: Journal für Praktische Chemie. 2, 1955, S. 203–227, doi:10.1002/prac.19550020403.
- John Texter: Reactions and Synthesis in Surfactant Systems., Verlag Marcel Dekker Inc., 2001, ISBN 978-0-8247-0255-7, S. 6.
- E. Müller, O. Bayer, H. Meerwein, K. Ziegler: Houben-Weyl: Methods of Organic Chemistry. Vol. I/2 General Laboratory Practice 1. Thieme Verlag, 1959, ISBN 978-3-13-197404-4, S. 118–120.
- Hype about discontinuing Hypalon
- George F. Lisk: Sulfonation. In: Industrial & Engineering Chemistry. 40, 1948, S. 1671–1683, doi:10.1021/ie50465a019.
- Henry L. Wheeler, H. Stanley Bristol: Research in Pyrimidines: The Structure of Some Substitution Products. In: Amer. Chem. Jour., 33, 437. Centr. B. 1905, I, 1709.
- Treat B. Johnson, James M. Sprague: A New Method for the Preparation of Alkyl Sulfonyl Chlorides. In: Journal of the American Chemical Society. 58, 1936, S. 1348, doi:10.1021/ja01299a011.