Nitrierung
Die Nitrierung ist in der Chemie das Einführen einer Nitrogruppe (–NO2) in ein organisches Molekül. Aus historischen Gründen werden Nitrate zum Teil als Nitroverbindung bezeichnet, so Glycerintrinitrat als Nitroglyzerin. Nitroverbindungen besitzen jedoch eine C-N-O-Bindung, im Gegensatz zu Nitraten, die eine C-O-N-Bindung aufweisen.
Geschichte

Die erste Umsetzung von Benzol mit rauchender Salpetersäure zu Nitrobenzol beschrieb Eilhard Mitscherlich im Jahr 1834.[1] Das daraus durch Hydrierung gewonnene Anilin bildete einen wichtigen Grundstoff für die Pharma- und Farbenindustrie. Schon 1847 wurde die industrielle Produktion von Nitrobenzol aufgenommen, zunächst in England. 1863 berichtete Julius Wilbrand über die Nitrierung des Toluols zu Trinitrotoluol mittels Nitriersäure, einem Gemisch aus konzentrierter Salpeter- und Schwefelsäure.[2]
Friedrich Konrad Beilstein untersuchte 1880 die Einwirkung von Salpetersäure auf eine aliphatische Benzinfraktion und wies neben Oxidationsprodukten auch die Bildung von Nitroverbindungen im geringen Maßstab nach.[3] Die Arbeiten über die Nitrierung der aliphatischen Kohlenwasserstoffe wurden in den 1890er Jahren von Wladimir Wassiljewitsch Markownikow und Michail Iwanowitsch Konowalow fortgeführt, gerieten aber bis in die 1930er Jahre in Vergessenheit.[4][5]
Die Nitrierung höhermolekularer Kohlenwasserstoffe gelang Christoph Grundmann, dem Entdecker der Grundmann-Aldehyd-Synthese, Anfang der 1940er Jahre durch Nitrierung von bei 160 bis 180 °C flüssigen Kohlenwasserstoffen durch überhitzten Salpetersäuredampf.[6] Von Grundmann stammte auch die Idee der Drucknitrierung von Cyclohexan durch Stickstoffdioxid.[7]
Nitrierung von Aromaten
Synonym steht der Begriff Nitrierung meist für die Nitrierung aromatischer Verbindungen, welche als elektrophile aromatische Substitution charakterisiert werden kann.
Da in den nitrierten organischen Verbindungen Kohlenstoffatome durch Stickstoffatome von Sauerstoffatomen getrennt sind, kann es passieren, dass das Stickstoffatom die Bindung verlässt und das Kohlenstoffatom mit dem Sauerstoffatom heftig reagiert. Daher sind einige nitrierte organische Verbindungen als Sprengstoffe zu gebrauchen. Bekannte Beispiele sind Trinitrotoluol (TNT) und Pikrinsäure.
Reaktionsmechanismus
Die Nitrierung eines Aromaten ist das klassische Beispiel für die elektrophile aromatische Substitution. Als elektrophiles Teilchen fungiert das Nitroniumion (NO2+). Dieses entsteht durch Dehydratisierung (Wasserabspaltung) aus der protonierten Salpetersäure und ist in stark saurem Medium recht stabil. Die Dehydratisierung der Salpetersäure geschieht durch das Zusetzen von konzentrierter Schwefelsäure. Das dabei entstehende Gemisch an konzentrierter Schwefel- und Salpetersäure wird als „Nitriersäure“ bezeichnet. Die schwächere Salpetersäure wird durch die Schwefelsäure protoniert, wodurch Wasser als Fluchtgruppe aus der Salpetersäure abgespalten wird und das Nitroniumion (NO2+) entsteht. Das freiwerdende Wasser wird wiederum von der Schwefelsäure protoniert und es entsteht das Oxoniumion.
Letztendlich entstehen aus der mehrstufigen Protonierungsreaktion vier Spezies: das Nitroniumion, das Oxoniumion H3O+ und zwei Hydrogensulfat-Anionen HSO4−. Die Oxoniumionen generieren das stark saure Milieu, welches das Nitroniumion stabilisiert.
Das entstandene Nitroniumion ist in einigen gut spektroskopisch untersuchten Verbindungen isolierbar (z. B. (NO2)(BF4) oder (NO2)(S2O7H)).
Ein erster Hinweis auf den vermuteten Mechanismus lieferten Analysen zur Kinetik der Reaktion. Man fand folgende Geschwindigkeitsgleichung für die Reaktion:
k ist hierbei eine reaktionsspezifische Geschwindigkeitskonstante. Anhand dieser Gleichung wird deutlich, dass einerseits Ar–H (wobei Ar ein beliebiger Arylrest sei) als auch NO2+ an der Gesamtreaktionsgeschwindigkeit beteiligt sind.
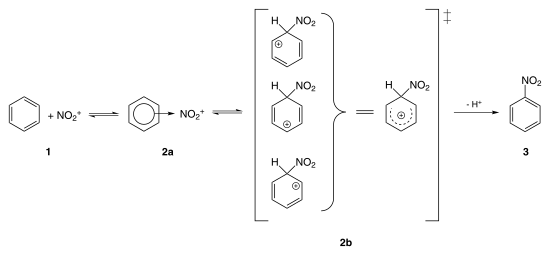
Der Aromat (1) tritt in lose Wechselwirkung mit dem Nitroniumion, das als π-Komplex bezeichnet wird (2a). Daraus bildet sich der sogenannte σ-Komplex, dessen positive Ladung über den Ring delokalisiert ist (2b). Die auftretenden Zwischenstufen werden auch als Wheland-Komplex bezeichnet. Bei diesem Vorgang wird die Aromatizität aufgehoben. Schließlich erfolgt eine Deprotonierung des Sigma-Komplexes, so dass der nitrierte Aromat freigesetzt wird (3).
Nitrierung von Aliphaten
Die technische Gewinnung von Nitromethan erfolgt durch die Nitrierung von Methan[8] beziehungsweise durch eine Gasphasennitrierung von Propan, wo es mit etwa 25 % im resultierenden Nitroalkangemisch enthalten ist.[9] Die Nitrierung erfolgt in der Gasphase entweder mit gasförmiger Salpetersäure oder Stickstoffdioxid bei Temperaturen von etwa 200 bis 400 °C.[10]
Spezielle Reagenzien zur Nitrierung
Nitrierungen lassen sich auch mit speziellen Reagenzien durchführen. Beispiel ist das Acetylnitrat, das u. a. CH-acide Verbindungen wie Acetoacetatester nitriert.[11]
Weblinks
Literatur
- Peter Sykes: Wie funktionieren organische Reaktionen? 2. Auflage. Wiley-VCH, 2001, ISBN 3-527-30305-7, S. 36 ff.
- J. G. Hoggett, R. B. Moodie, J. R. Penton, K. Schofield: Nitration and aromatic reactivity. Cambridge University Press, 1971, ISBN 0-521-08029-0.
- G. A. Olah, R. Malhotra, S. C. Narang: Nitration: Methods and Mechanisms. Wiley-VCH, 1989, ISBN 0-471-18695-3.
Einzelnachweise
- Eilhard Mitscherlich: Ueber die Zusammensetzung des Nitrobenzids und Sulfobenzids;. In: Annalen der Pharmacie. 12, 1834, S. 305, doi:10.1002/jlac.18340120281.
- Julius Wilbrand: Notiz über Trinitrotoluol. In: Annalen der Chemie und Pharmacie. 128, 1863, S. 178–179, doi:10.1002/jlac.18631280206.
- Friedrich Konrad Beilstein, A. Kurbatov: Btr. dtsch. chem. 13, 1880, S. 2029.
- Michail Iwanowitsch Konowalow: Btr. dtsch. chem. 26, 1893, S. 878.
- Wladimir Wassiljewitsch Markownikow: Btr. dtsch. chem. 32, 1899, S. 1441.
- Christoph Grundmann: Über die Nitrierung höhermolekularer Paraffinkohlenwasserstoffe. In: Die Chemie. 56, 1943, S. 159–163, doi:10.1002/ange.19430562303.
- Christoph Grundmann, H. Haldenwanger: Über die Nitrierung des Cyclohexans. In: Angewandte Chemie. 62, 1950, S. 556–558, doi:10.1002/ange.19500622303.
- S. Hauptmann, J. Gräfe, H. Remane: Lehrbuch der Organischen Chemie. Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 480.
- Brockhaus ABC Chemie. Band 2. F.A. Brockhaus Verlag, Leipzig 1971, S. 951.
- H. B. Hass, Julian Dorsky, E. B. Hodge: Nitration of Propane by Nitrogen Dioxide. In: Industrial & Engineering Chemistry. 33, 1941, S. 1138–1143, doi:10.1021/ie50381a011.
- S. Sifniades: Nitration of acetoacetate esters by acetyl nitrate. High yield synthesis of nitroacetoacetate and nitroacetate esters. In: J. Org. Chem. 40, 1975, S. 3562–3566, doi:10.1021/jo00912a020.