Tocopherol
Vitamin E (oder Tocopherol) ist ein Sammelbegriff für alle fettlösliche Substanzen mit meist antioxidativen Wirkungen, die die biologische Aktivität von (RRR)-α-Tocopherol aufweisen;[4] damit handelt es sich um sogenannten Vitamere. Die am häufigsten vorkommenden Vitamin-E-Formen werden Tocopherole und Tocotrienole genannt (abgeleitet von den altgriechischen Wörtern τόκος tókos „Geburt, Nachkommen“ und φέρειν phérein „tragen, bringen“). Es kommen acht verschiedene Formen vor.[5]
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
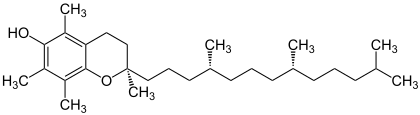 | |||||||||
| (RRR)-Isomer von Tocopherol (α-Tocopherol) | |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin E | ||||||||
| Andere Namen | |||||||||
| Summenformel | C29H50O2 | ||||||||
| CAS-Nummer |
| ||||||||
| PubChem | 14985 | ||||||||
| ATC-Code |
A11HA03 | ||||||||
| DrugBank | DB00163 | ||||||||
| Kurzbeschreibung | gelbe bis braune Flüssigkeit | ||||||||
| Vorkommen | Getreide, Nüsse, Samen, Pflanzenöle, Milch, Eier | ||||||||
| Physiologie | |||||||||
| Funktion | Antioxidans | ||||||||
| Täglicher Bedarf | 10 mg | ||||||||
| Folgen bei Mangel | Unfruchtbarkeit, unspezifische Symptome wie: trockene, faltige Haut, Müdigkeit, verminderte Wundheilung | ||||||||
| Überdosis | >300 mg/Tag | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 430,71 g/mol | ||||||||
| Aggregatzustand | flüssig[3] | ||||||||
| Dichte | 0,95 g·cm−3[3] | ||||||||
| Schmelzpunkt |
2,5–3,5 °C | ||||||||
| Siedepunkt |
| ||||||||
| Löslichkeit | fettlöslich, <1 mg/l in Wasser | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Vitamin E ist Bestandteil aller Membranen tierischer Zellen, wird jedoch nur von photosynthetisch aktiven Organismen wie Pflanzen und Cyanobakterien gebildet. Häufig wird der Begriff Vitamin E allein für α-Tocopherol, die am besten erforschte Form von Vitamin E, verwendet.
Geschichte
Vitamin E wurde als „Fruchtbarkeits-Vitamin“ entdeckt und als „Fortpflanzungsvitamin“[6] sowie als „Antisterilitätsvitamin“ beschrieben.[7] Herbert M. Evans und Katherine S. Bishop wiesen 1922 als erste auf einen bis dahin unbekannten fettlöslichen Faktor hin, der für die Reproduktion von Ratten notwendig war.[8] In den Folgejahren wurde dieser Faktor in Form von α-Tocopherol[5] vor allem aus Weizenkeimöl, Hafer und Mais isoliert, als Vitamin erkannt und aufgrund der bereits bekannten Vitamine A, B, C und D nun Vitamin „E“ genannt. Die antioxidative Wirkung wurde durch Harold S. Olcott und Oliver H. Emerson (Gladys Anderson Emersons Ehemann) 1937 beschrieben.[4][9] 1938 wurde die Struktur von Vitamin E (hier α-Tocopherol) von Erhard Fernholz aufgeklärt, zudem kam es im gleichen Jahr zur ersten chemischen Synthese durch Paul Karrer. Vertreter der ebenfalls zu den Vitamin-E-Formen zählenden Tocotrienole wurden erstmals 1956 beschrieben und synthetisiert.
1968 wurde Vitamin E als essentieller Nährstoff durch das Food and Nutrition Board anerkannt.[5]
Beschreibung
Die Grundstruktur aller Vitamin-E-Formen bildet ein an Position 6 hydroxylierter Chromanring, dessen Methylierung diese in eine α-, β-, γ- oder δ-Form unterteilt. Durch unterschiedlich gesättigte Seitenketten werden wieder vier Familien unterschieden, nämlich die
- Tocopherole mit einer gesättigten Seitenkette
- Tocomonoenole (T1) und marinen Tocopherole (MDT) mit einer einfach ungesättigten Seitenkette und die
- Tocotrienole (T3) mit einer dreifach ungesättigten Seitenkette.
Weitere natürlich vorkommende Tocopherole sind 5,7-Dimethyltocol und 7-Methyltocol. Beide wurden 1956 aus Reiskeimöl isoliert. Die Synthese für 5,7-Dimethyltocol erfolgte bereits 1938 und für 7-Methyltocol 1958.[10]
Die C2-Position am Chormanring sowie die C4'- und C8'-Positionen der Phythylseitenkette bei Tocopherol sind chiral, es sind damit acht Stereoisomere möglich. Tocopherole liegen natürlicherseits ausschließlich in einer (RRR)-Konfiguration vor.[5] Die natürlich vorkommende (RRR)-Form von Vitamin E wurde auch als D-Form bezeichnet (D-α-Tocopherol). Die synthetisch hergestellte Form bildet ein Gemisch aus acht Stereoisomeren (all-rac), sie wurde ehemals DL-Form genannt (DL-α-Tocopherol). Im Handel sind ferner Ester als Acetate, Succinate oder Nicotinate beziehbar.[5]
Tocopherole erscheinen gelblich-braun bzw. bernsteinfarben und sind in Wasser unlöslich.[4][5] In organischen Lösungsmitteln wie Aceton, Dichlormethan und Ether ist die Löslichkeit erhöht. Zwar sind Tocopherole oxidationsempfindlich (außer in veresterter Form), gegenüber Säuren und Alkalien aber sehr stabil. Bei Raumtemperatur ist Tocopherol flüssig-viskos.[4]
| Name | Struktur der (RRR)-Isomere | R1 | R2 |
|---|---|---|---|
| α-Tocopherol | -Tocopherols_Structural_Formulae_V.1.svg.png.webp) | CH3 | CH3 |
| β-Tocopherol | CH3 | H | |
| γ-Tocopherol | H | CH3 | |
| δ-Tocopherol | H | H |
| Name | Struktur der (R)-Isomere | R1 | R2 |
|---|---|---|---|
| α-Tocotrienol | -Tocotrienol_(R3%253DCH3)_V.1.svg.png.webp) | CH3 | CH3 |
| β-Tocotrienol | CH3 | H | |
| γ-Tocotrienol | H | CH3 | |
| δ-Tocotrienol | H | H |
| Name | Struktur der (RRR)-Isomere | R1 | R2 |
|---|---|---|---|
| α-Tocomonoenol | -Tocomonoenols_Structural_Formulae_V.1.svg.png.webp) | CH3 | CH3 |
| β-Tocomonoenol | CH3 | H | |
| γ-Tocomonoenol | H | CH3 | |
| δ-Tocomonoenol | H | H |
| Name | Struktur der (RRR)-Isomere | R1 | R2 |
|---|---|---|---|
| α-MDT | -Tocomonoenols_terminal_Structural_Formulae_V.1.svg.png.webp) | CH3 | CH3 |
| β-MDT | CH3 | H | |
| γ-MDT | H | CH3 | |
| δ-MDT | H | H |
Plastochromanol
Plastochromanole sind eine Gruppe von Molekülen die von Pflanzen gegen die Lipidperoxidation produziert werden und die mögliche prooxidative Aktivität von alpha-Tocopherol verhindern können.[11] Bei gamma-Tocotrienol handelt es sich um Plastochromanol-3. Plastochromanole kommen beispielsweise in Leinöl, Leindotteröl, Sacha Inchi und Arabidopsis[12] vor.
Aufgabe/Funktion im Körper
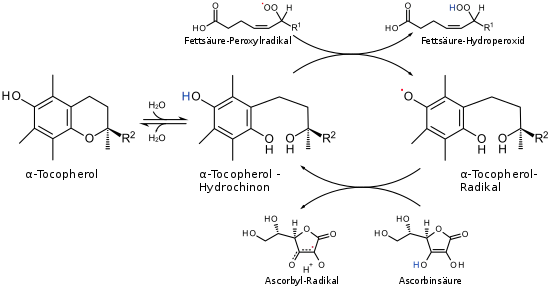
Eine seiner wichtigsten Funktionen ist die eines lipidlöslichen Antioxidans,[13] das in der Lage ist, mehrfach ungesättigte Fettsäuren in Membranlipiden, Lipoproteinen und Depotfett vor einer Zerstörung durch Oxidation (Lipidperoxidation) zu schützen. Freie Radikale würden die Doppelbindungen der Fettsäuren der Zell- und Organellmembranen angreifen. Tocopherol wirkt als Radikalfänger, indem es selbst zu einem reaktionsträgen, da mesomeriestabilisierten Radikal wird. Das Tocopherol-Radikal wird dann unter Bildung eines Ascorbatradikals reduziert. Das Ascorbatradikal wird mit Hilfe von Glutathion (GSH) regeneriert. Dabei werden zwei Monomere (GSH) zu einem Dimer (GSSG) oxidiert.
Vitamin E hat Funktionen in der Steuerung der Keimdrüsen und wird daher auch als Antisterilitätsvitamin bezeichnet.
Der menschliche Körper kann am besten (RRR)-α-Tocopherol speichern und transportieren. Der Grund hierfür: Das in der Leber befindliche α-Tocopherol-Transfer-Protein (α-TTP), welches für den Transport des Vitamin E via VLDL in den Blutkreislauf verantwortlich ist, hat die höchste Affinität zum natürlichen α-Tocopherol. Durch die Speicherkapazität kann eine einmalige Gabe für längere Zeit wirken. Das im Wesentlichen in Sojaprodukten vorkommende γ-Tocopherol zeigt eine geringere Aktivität. Neuerdings wird aber diskutiert, ob diesem eine besondere Rolle zugeschrieben werden muss.[14] In humanem LDL, einem Lipoprotein, sind α-Tocopherol und in geringer Konzentration auch γ-Tocopherol vorhanden.
Die biologische Aktivität unterscheidet sich unter den Vitameren. Bezogen auf α-Tocopherol (100 %) weist β-Tocopherol 50 %, γ-Tocopherol 10 %, δ-Tocopherol 3 %, α-Tocotrienol 30 % und β-Tocotrienol 5 % der Aktivität auf.[15]
Besondere Eigenschaften von α-Tocopherol
α-Tocopherol, das am meisten verwendete und auch synthetisch hergestellte Isomer von Vitamin E hat einige positive und weniger positive Eigenschaften im Vergleich zu anderen Tocochromanolen:
- Es wird vom Transportprotein TTP in Säugetieren bevorzugt transportiert und in der Leber gespeichert.
- Es kann sogar pro-oxidativ wirken, also die Haltbarkeit von Lipiden (Speiseölen) verschlechtern.[16] Diese pro-oxidative Wirkung wird von Plastochromanolen verhindert.[11]
- Während sehr geringe Mengen die Cholesterinproduktion leicht drosseln, bewirken größere Mengen (im Tierversuch bei Meerschweinchen ab 5 mg/d) eine deutliche Steigerung des Plasma-Cholesterins.[17]
- Die cholesterinsenkende Eigenschaft von Tocotrienolen wird durch alpha-Tocopherol stark reduziert.[17]
α-Tocopherol-Äquivalente
1 mg α-Tocopherol entsprechen 2,32 µmol.[5] Angaben über den Vitamin-E-Bedarf und die biologische Wirksamkeit werden in mg RRR-α-Tocopherol-Äquivalente (auch α-TE oder TÄ) angegeben, was eine Umrechnung der Tocotrienol- und Tocopherole-Vitamere erleichtert.
1 mg aTE entsprechen:[18]
- 1 mg α-Tocopherol (RRR-α-Tocopherol)
- 2 mg β-Tocopherol
- 4 mg γ-Tocopherol
- 100 mg δ-Tocopherol
- 3,3 mg α-Tocotrienol
- 6,6 mg β-Tocotrienol
- 13,2 mg γ-Tocotrienol
- für δ-Tocotrienol existiert keine offizielle Umrechnung
Für die (RRR)-α-Tocopherol-Ester gilt: 1 mg α-TE entsprechen 1,10 mg α-Tocopherylacetat oder 1,23 mg α-Tocopherylsuccinat. Beim synthetischen all-rac-α-Tocopherol gilt der Umrechnungsfaktor 1 mg α-TE = 1,35 mg all-rac-α-Tocopherol.[5]
Die Angabe der aTE korreliert nicht mit der antioxidativen Wirkung. Im Gegenteil zeigen Tocotrienole sowie generell γ- und δ-Isomere eine wesentlich höhere antioxidative Aktivität. Bei Tocotrienolen wurde eine um 40-fach höhere antioxidative Schutzwirkung gegen Lipid-Peroxidation an Zellmembranen nachgewiesen.[19]
Synthetische Erzeugnisse mit Vitamin-E-Wirkung haben im Vergleich zu natürlichem Vitamin E eine reduzierte Wirkung, da sie aus Gemischen („all-RAC“) verschiedener Isomere im Aufbau des Phytyl-Restes bestehen. Die älteren IE (bzw. USP-Units) basierten auf der relativen Vitamin-E-Aktivität von all-rac-α-Tocopherylacetat (1,49) und sollen nicht mehr verwendet werden.
Die biologische Aktivität der synthetischen all-rac-α-Tocopherol-Isomere ist geringer als die der natürlichen Form.[5] Bezogen auf (RRR)-α-Tocopherol liegt sie wie folgt: RRS bei 90 %, RSS bei 73 %, RSR bei 57 %, SRS bei 37 %, SRR bei 31 % und SSR bei 21 %.
Vorkommen
| Lebensmittel | Gehalt mg/100 g |
|---|---|
| Weizenkeimöl | 215,4 |
| Sonnenblumenöl | 55,8 |
| Erdnussöl | 17,2 |
| Olivenöl | 12,0 |
| Weizenkleie | 2,4 |
| Mais | 2,0 |
| Haferflocken | 1,5 |
| Spargel | 2,0 |
| Tomate | 0,9 |
| Möhre | 0,6 |
| Blumenkohl | 0,1 |
| Mandel | 25,0 |
| Haselnuss | 25,0 |
| Walnuss | 6,2 |
In tierischen Nahrungsmitteln liegen erheblich niedriger als die pflanzlicher Nahrungsmittel. Besonders hohe Gehalte an Vitamin E weisen pflanzliche Öle auf, in der Regel überwiegt der Anteil von α-Tocopherol.[5] Dagegen dominiert in Sojaöl γ-Tocopherol. Je mehr ungesättigte Fettsäuren in den Ölen enthalten ist, desto mehr Vitamin E kommt darin vor. Raffination dieser Öle kann zu starken Verlusten (bis zu etwa 40 %) an Vitamin E führen.
Gemüse enthält im Vergleich zu den Ölen wenig Vitamin E, allgemein kommen in grünen Pflanzenteilen abhängig von der Menge an Chloroplasten viel α-Tocopherol vor. Daneben findet man es auch in anderen, „gelben“ Pflanzenteilen wie Wurzeln oder Früchten, dort korreliert es mit dem Gehalt an Chromoplasten (überwiegend als γ-Tocopherol).[5] Eine weitere Vitamin E-Quelle sind Getreide und Getreideprodukte.[5] Beim Weizenkorn wird das enthaltene Vitamin E während der Keimung verbraucht.[20] Abhängig von der Schicht des Weizenkorns liegen unterschiedliche Vitamere vor.
Vitamin E wird nur in Pflanzen aufgebaut, die Biosynthese startet aus Homogentisinsäure sowie Phytylpyrophosphat größtenteils in den Plastiden.[21]
Vitamin E wird auch synthetisch (u. a. von BASF, E. Merck (India) und DSM Nutritional Products) als ein racemisches Gemisch hergestellt. Synthetisches Tocopherol ist jedoch relativ instabil und wird daher meist noch mit einer Acetyl-Gruppe versehen (siehe auch dl-α-Tocopherylacetat). Dieses besitzt keine antioxidativen Eigenschaften.[14] Es kann aber im Körper im Umfang von bis zu 50 % in natürliches Vitamin E umgewandelt werden.
In Palmöl wurde auch α-Tocomonoenol nachgewiesen, während manche marinen Organismen das sogenannte marine Tocopherol (marine derived tocopherol, MDT) enthalten.[22][23]
Stabilität
Vitamin E ist relativ stabil gegen Hitze. Selbst nach mehrstündigem Erhitzen auf bis zu 180 °C (etwa beim Frittieren) blieben die Verluste im Bereich von 15 %−60 %. Alle acht Vitamin-E-Vitamere haben dabei einen deutlich positiven Einfluss gegen die Entstehung unerwünschter Oxidationsprodukte. Je niedriger die Temperatur und je kürzer die Erhitzung, desto mehr Vitamin E wird erhalten.[24]
Bedarf
Der Mindestbedarf beträgt 4 mg/d, zuzüglich etwa 0,4 mg pro Gramm Zufuhr an mehrfach ungesättigten Fettsäuren.[14] Um die von verschiedenen Autoren als protektiv angesehenen Plasmaspiegel zu erreichen, ist eine Zufuhr von 20 bis 35 mg/d erforderlich. Aufgrund der geringen Toxizität[14][25] werden teilweise Dosierungen von 268 mg/d empfohlen.[26] Der Plasmaspiegel sollte oberhalb von 30 µmol/l liegen (bei einem Cholesterinwert von 220 mg/dl).[27]
Vitamin E verstärkt durch seine Prostaglandin-Interaktion die Wirkung von Antikoagulanzien (Gerinnungshemmer), deshalb muss bei Anwendung oraler Antikoagulanzien und bei Vitamin-K-Mangel die Therapie sorgfältig überwacht werden, um ein erhöhtes Blutungsrisiko zu vermeiden.
Pharmakoepidemiologische Untersuchungen zum Tocopherol
Zur Pharmakoepidemiologie des α-Tocopherols liegen umfangreiche Daten aus den Nationalen Untersuchungs-Surveys der Deutschen Herz-Kreislauf-Präventionsstudie (DHP)[28] und aus dem Bundes-Gesundheitssurvey für die Bevölkerung vor.[29][30] Durch die regelmäßige Anwendung α-tocopherolhaltiger Präparate kommt es danach zu einer dosisabhängigen und statistisch signifikanten Verringerung des β- und des γ-Tocopherols im Serum.[31] Gesundheitliche Aspekte einer möglichen erhöhten Blutungsneigung unter Komedikation mit Acetylsalicylsäurepräparaten werden in der Literatur diskutiert.[32] Auch zu Tocopheroloxidationsprodukten, wie z. B. dem Tocopherolchinon liegen Untersuchungsergebnisse aus Survey-Daten vor.[33]
Auch aus der Berliner Studie an Vegetariern liegen Daten zum Gehalt an Tocopherolen im Serum der Studienteilnehmer vor. Trotz höherer Aufnahme an Tocopherolen waren die Tocopherolgehalte im Serum der Vegetarier niedriger als bei den Vergleichspersonen.[34]
In einer großangelegten Studie an 35533 Männern[35] wurde untersucht, ob Vitamin E gegen Prostatakrebs schützt. Verwendet wurden 400 IE/d all rac-α-tocopheryl acetate (synthetisch hergestelltes dl-α-Tocopherylacetat). Im Ergebnis trat Prostatakrebs zu 17 Prozent häufiger im Vergleich zur Kontrollgruppe auf.[36] Dagegen wurde bei mehreren in vitro-Studien mit den gamma-Isomeren (gTP bzw. gTE) eine apoptotische Wirkung auf Prostatakrebszellen beobachtet.[37][38][39] Zu ähnlich positiven Ergebnissen hinsichtlich der Schutzwirkung der Tocopherole kommt eine Multizentrische Studie mit mehr als 2000 Studienteilnehmern unter Berücksichtigung ernährungsepidemiologischer Daten zur Tocopherolaufnahme mit der Nahrung.[40]
Mangelerscheinungen (Hypovitaminose)
Mangelerscheinungen beim Menschen sind heutzutage in Europa sehr selten, da Tocopherol sehr gut in der Leber und im Fettgewebe gespeichert werden kann. Nachgewiesene Mangelerscheinungen treten meist nur im Zusammenhang mit Krankheiten wie z. B. einer exokrinen Pankreasinsuffizienz[41] oder einer Verminderung des Gallenflusses[42] auf, bei denen gleichzeitig die Aufnahme von Fetten gestört ist.
Folgen einer Hypovitaminose sind:
- trockene, faltige Haut
- Konzentrationsstörungen
- Leistungsschwäche
- Müdigkeit
- Reizbarkeit
- schlecht heilende Wunden
- Begünstigung von Arteriosklerose
- Dystrophie
Überdosierung (Hypervitaminose)
| UL α-Tocopherol der EFSA für Kinder
und Jugendliche (Stand 2003)[43] | |
| Alter | UL (mg/Tag) |
|---|---|
| 1–3 | 100 |
| 4–6 | 120 |
| 7–10 | 160 |
| 11–14 | 220 |
| 15–17 | 260 |
Genauso wie die fettlöslichen Vitamine Vitamin A, Vitamin D und Vitamin K werden (RRR)-α-Tocopherol und die (2R)-Stereoisomere [(RSR)-, (RRS)- und (RSS)-α-Tocopherol] im Fettgewebe bzw. Blutplasma des Körpers angereichert. Die synthetisch hergestellten (2S)-Stereoisomere [(SRR)-, (SSR)-, (SRS)- und (SSS)-α-Tocopherol] werden hingegen nicht im Blutplasma gespeichert.[43][44]
2003 hatte die Europäische Behörde für Lebensmittelsicherheit (EFSA) 300 mg (~450 IE) pro Tag α-Tocopheroläquivalente als tolerierbare Höchstaufnahmemenge (Tolerable Upper Intake Level, UL) definiert und für Kinder altersabhängig eine UL von zwischen 100 bis 260 mg pro Tag abgeleitet.[43][45] In den nachfolgenden Jahren wurden gesundheitlich schädliche Effekte in Interventionsstudien bei der Supplementation von Vitamin E beobachtet, auch bei hohen Dosierungen nach Selbstmedikation. Daher hat das BfR auf Basis der sogenannten akzeptablen täglichen Aufnahmemenge (Acceptable Daily Intake, ADI) bei 0,15–2 mg/kg Körpergewicht neue Grenzen für eine akzeptable Tagesaufnahmemenge festgelegt. Bei einem Referenzkörpergewicht für Erwachsene von 70 kg entspricht diese 105–140 mg Vitamin E.[45] Jugendliche der Altersgruppe der 15- bis 17-Jährigen haben ein Referenzgewicht von 61,3 kg, wodurch die tägliche Aufnahme von 92–123 mg Vitamin E als akzeptabel bewertet wird.
In drei Meta-Analysen, die allerdings Gegenstimmen fanden,[46][47][48] wurde für Dosierungen > 400 IE eine erhöhte Sterblichkeit (alle Ursachen) gefunden.[49][50][51] Die mittlere letale Dosis (LD50) des α-Tocopherol liegt bei >2000 mg pro kg Körpergewicht; getestet an Mäusen, Ratten und Kaninchen.[43]
Das BfR schlägt für Nahrungsergänzungsmittel eine Höchstemenge von 30 mg pro Tag vor, warnen aber davor, dass bei Männern ab 55 Jahren bei einer unkontrollierten Supplementierung das Risiko für Prostatakrebs erhöhen werden kann.[45]
In hohen Dosen kann Vitamin E zu Blutungen führen.[52]
Verwendung
Tocopherole finden in der Lebensmittelindustrie als Antioxidationsmittel Verwendung. Sie sind in der EU als Lebensmittelzusatzstoffe der Nummern E 306 (Tocopherol-haltige Extrakte), E 307 (Alpha-), E 308 (Gamma-) und E 309 (Delta-Tocopherol) für alle für Zusatzstoffe zugelassenen Nahrungsmittel, zum Teil (in Form von tocopherolhaltigen Extrakten natürlichen Ursprungs) auch für „Bio“-Lebensmittel (E 306), zugelassen.
Neben Lebensmitteln wird Vitamin E auch Kosmetika (Sonnenschutzmitteln) und Anstrichmitteln zugesetzt sowie in künstlichen Gelenken zur höheren Beständigkeit gegen die Oxidation des verwendeten Kunststoffs[53]. Bei Kondomen soll eine Vitamin-E-Beschichtung u. a. die Reißfestigkeit erhöhen.
Auch im Adjuvans AS03 in COVID-19-Impfstoffen findet DL-α-Tocopherol Verwendung.[54]
Mit Sebacinsäure und Polyethylenglycol verestert erhält man das nichtionische Tensid Polyoxyethanyl-α-tocopherylsebacat (PTS), das als Hilfsmittel bei der Phasentransferkatalyse eingesetzt werden kann.[55]
Analytik
Die heute fast ausschließlich eingesetzten Methoden zur zuverlässigen qualitativen und quantitativen Bestimmung der einzelnen Tocopherole sind die HPLC, die Gaschromatographie und die Kopplungsverfahren der HPLC-MS[56] und der GC/MS.[57][58] Beide Verfahren werden sowohl in der lebensmittelchemischen Analytik als auch bei pharmazeutischen und physiologischen Fragestellungen verwandt. Das Massenspektrum des Tocopherols findet sich auch in der Spektrenbibliothek des NIST.[59] In Abhängigkeit von den zu untersuchenden Matrices empfehlen sich adäquate Probenvorbereitungsverfahren wie z. B. Extraktionsmethoden, auch unter Einsatz von Festphasenextraktionssäulen oder anderen Extraktionshilfsmitteln wie z. B. dem aus Diatomeenerde hergestellten Extrelut. Die früher häufig eingesetzten photometrischen Verfahren finden fast keine Verwendung mehr, da sie in der Regel keine Unterscheidung der einzelnen Tocopherole zulassen. Stereoisomere racemischen alpha-Tocopherols lassen sich sowohl durch HPLC als auch durch Gaschromatographie trennen.[60]
Literatur
- Carlo Agostoni et al.: Scientific Opinion on Dietary Reference Values for vitamin E as α-tocopherol. In: EFSA (Hrsg.): EFSA Journal. Band 13, Nr. 7, 2015, doi:10.2903/j.efsa.2015.4149 (englisch).
- Höchstmengenvorschläge für Vitamin E in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. 2021, abgerufen am 30. Dezember 2021.
- Anna Stahl, Helmut Heseker: Vitamin E: Physiologie, Funktionen, Vorkommen, Referenzwerte und Versorgung in Deutschland. (PDF) Ernährungs-Umschau, 9. November 2010, S. 608-615, abgerufen am 31. Dezember 2021.
- Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung. 1. Auflage. Urban&Fischer, Elsevier, München 2008, ISBN 978-3-437-55361-5, S. 290–364.
Siehe auch
Einzelnachweise
- Eintrag zu E 307: Alpha-tocopherol in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 7. August 2020.
- Eintrag zu TOCOPHEROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Datenblatt (±)-α-Tocopherol, synthetic, ≥96% (HPLC) bei Sigma-Aldrich, abgerufen am 29. Dezember 2019 (PDF).
- Anna Stahl, Helmut Heseker: Vitamin E: Physiologie, Funktionen, Vorkommen, Referenzwerte und Versorgung in Deutschland. (PDF) Ernährungs-Umschau, 9. November 2010, S. 608-615, abgerufen am 31. Dezember 2021.
- Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung. 1. Auflage. Urban&Fischer, Elsevier, München 2008, ISBN 978-3-437-55361-5, S. 290–364.
- „Vitamin der Fortpflanzung“. Quelle: Theodor Brugsch: Lehrbuch der inneren Medizin, 5. Auflage, 1. Band, Verlag Urban & Schwarzenberg, Berlin/ Wien 1940, S. 236.
- Max Bürger: Einführung in die innere Medizin, Sammelwerk "Der Kliniker", Verlag Walter de Gruyter, Berlin 1952, S. 307 und 317.
- H. M. Evans, K. S. Bishop: On the existence of a hitherto unrecognized dietary factor essential for reproduction. In: Science. Band 56, Nummer 1458, Dezember 1922, S. 650–651, doi:10.1126/science.56.1458.650, PMID 17838496.
- H. S. Olcott, O. H. Emerson: Antioxidants and the Autoxidation of Fats. IX. The Antioxidant Properties of the Tocopherols. In: Journal of the American Chemical Society. Band 59, Nr. 6, 1. Juni 1937, S. 1008–1009, doi:10.1021/ja01285a013.
- Merck-Index, 14th Ed. with CD-ROM, Merck, Whitehouse Station NJ, ISBN 978-0-911910-00-1.
- B. Nowicka, J. Gruszka, J. Kruk: Function of plastochromanol and other biological prenyllipids in the inhibition of lipid peroxidation-A comparative study in model systems. In: Biochimica et Biophysica Acta. Band 1828, Nummer 2, Februar 2013, S. 233–240, doi:10.1016/j.bbamem.2012.08.018, PMID 22959712.
- R. Szymańska, J. Kruk: Identification of hydroxy-plastochromanol in Arabidopsis leaves. In: Acta biochimica Polonica. Band 57, Nummer 1, 2010, S. 105–108, PMID 20234882.
- Carlo Agostoni et al.: Scientific Opinion on Dietary Reference Values for vitamin E as α-tocopherol. In: EFSA (Hrsg.): EFSA Journal. Band 13, Nr. 7, 2015, S. 8–9, doi:10.2903/j.efsa.2015.4149 (englisch).
- Verwendung von Vitaminen in Lebensmitteln. Toxikologische und ernährungsphysiologische Aspekte (PDF; 1,3 MB) Bundesinstitut für Risikobewertung, S. 88 ff.; abgerufen am 9. Juli 2009
- Vitamin and mineral requirements in human nutrition. (PDF) Vitamin E. FAO / WHO, 2005, S. 97, abgerufen am 31. Dezember 2021 (englisch).
- T. Bakır, I. Sönmezoğlu, F. Imer, R. Apak: Antioxidant/prooxidant effects of α-tocopherol, quercetin and isorhamnetin on linoleic acid peroxidation induced by Cu(II) and H2O2. In: International journal of food sciences and nutrition. Band 65, Nummer 2, März 2014, S. 226–234, doi:10.3109/09637486.2013.845654, PMID 24152374.
- H. Khor, T. Ng, R. Rajendran: Dose-dependent cholesterolemic activity of tocotrienols. In: Malaysian journal of nutrition. Band 8, Nummer 2, September 2002, S. 157–166, PMID 22692474.
- Vitamin-Umrechnungstabellen. (PDF) In: Gesellschaft Deutscher Chemiker. S. 2, abgerufen am 22. Januar 2022.
- Lester Packer, Stefan U. Weber, Gerald Rimbach: Molecular Aspects of α-Tocotrienol Antioxidant Action and Cell Signalling. In: The Journal of Nutrition. Band 131, Nr. 2, Februar 2001, S. 369S, doi:10.1093/jn/131.2.369s.
- Werner Kollath: Die Ordnung unserer Nahrung. 13. Auflage 1987, S. 171.
- Laurent Mène-Saffrané: Vitamin E Biosynthesis and Its Regulation in Plants. In: Antioxidants. Band 7, Nr. 1, 25. Dezember 2017, S. 2, doi:10.3390/antiox7010002, PMID 29295607, PMC 5789312 (freier Volltext).
- J. M. Zingg: Molecular and cellular activities of vitamin E analogues. In: Mini-Rev Med Chem. 7(5), 2007, S. 543–558, PMID 17504191, doi:10.2174/138955707780619608.
- Y. Yamamoto, A. Fujisawa, A. Hara, W. C. Dunlap: An unusual vitamin E constituent (alpha-tocomonoenol) provides enhanced antioxidant protection in marine organisms adapted to cold-water environments. In: Proc. Natl. Acad. Sci. USA. 98(23), 2001, S. 13144–13148, PMID 11687648, doi:10.1073/pnas.241024298.
- M. Carmen Dobarganes: Action of Natural Antioxidants during Frying (Memento vom 24. November 2016 im Internet Archive). AOCS Lipid Library doi:10.21748/lipidlibrary.39208.
- H. Kappus, A. T. Diplock: Tolerance and safety of vitamin E: a toxicological position report. In: Free Radic. Biol. Med. 13(1), 1992, S. 55–74, PMID 1628854.
- WC Willett, MJ Stampfer: Clinical practice. What vitamins should I be taking, doctor? In: N. Engl. J. Med. 345(25), 2001, S. 1819–1824, PMID 11752359.
- Karl-Heinz Bässler et al.: Vitamin-Lexikon. 3. Auflage, Urban und Fischer, München 2002, ISBN 978-3-437-21141-6.
- Forschungsverbund DHP (Hrsg.): Die Deutsche Herz-Kreislauf-Präventionsstudie, Hans Huber, Berlin, Göttingen, Toronto, Seattle 1998, ISBN 3-456-83011-4
- H. Knopf und H.-U. Melchert: Bundes-Gesundheitssurvey – Arzneimittelgebrauch – Konsumverhalten in Deutschland. Robert Koch-Institut, Berlin 2003, ISBN 3-89606-147-X.
- H. U. Melchert, H. Knopf, E. Pabel, M. Braemer-Hauth, Y. Du: Co- and multimedication in users of ASA and vitamin E drugs in the Federal Republic of Germany. Results of the Federal Health Surveys 1984–1999. In: Int. J. Clin. Pharmacol. Ther. 39(11), 2001, S. 488–491, PMID 11727969.
- H.-U. Melchert, E. Pabel: The Tocopherol Pattern in Human Serum Is Markedly Influenced by Intake of Vitamin E Drugs – Results of the German National Health Surveys. In: JAOCS. 75 (No. 2), 1998, S. 213–216, (PDF).
- Co-medication and multimedication in users of acetylsalicylic acid and vitamin E in Germany. Special review in: J.K. Aronson: Side Effects of Drugs Annual 26.Elsevier, Amsterdam / Boston / Heidelberg 2003, eingeschränkte Vorschau in der Google-Buchsuche.
- Dagmar Pollok: Bestimmung von Tocopheroloxidationsprodukten im Humanserum. Dissertation, TU Berlin, 2004, online
- H.-U. Melchert und J. Eichberg: α- und γ-Tocopherol-Status und Fettsäurespektren in Seren von Vegetariern und Nichtvegetariern, Fett Wissenschaft Technologie Vol. 92, No. 6, 236-240, 1990, doi:10.1002/lipi.19900920607
- Lippman et al.: Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). 2009, PMID 19066370.
- Klein et al.: Molecular and cellular activities of vitamin E analogues. 2011, PMID 21990298.
- Jiang et al.: Gamma-tocotrienol induces apoptosis and autophagy in prostate cancer cells by increasing intracellular dihydrosphingosine and dihydroceramide. 2011, PMID 21400505.
- Constantinou et al.: Induction of DNA Damage and Caspase-Independent Programmed Cell Death by Vitamin E. 2011, PMID 22172208.
- Jiang et al.: gamma-Tocopherol or combinations of vitamin E forms induce cell death in human prostate cancer cells by interrupting sphingolipid synthesis. 2004, PMID 15596715.
- S. O. Antwi, S. E. Steck, L. J. Su, J. R. Hébert, H. Zhang, E. T. Fontham, G. J. Smith, J. T. Bensen, J. L. Mohler, L. Arab: Dietary, supplement, and adipose tissue tocopherol levels in relation to prostate cancer aggressiveness among African and European Americans: The North Carolina-Louisiana Prostate Cancer Project (PCaP). In: Prostate. 2015 Jun 5. doi:10.1002/pros.23025. PMID 26053590.
- Katja M. Aue: DIE Pankreasdiät gibt es nicht: Ernährungstherapie bei Pankreaserkrankungen. In: Deutsche Apothekerzeitung, 2012, Nr. 35, S. 54.
- Claudia Borchard-Tuch: Gallenleiden: Von Entzündung bis Karzinom. In: Pharmazeutische Zeitung, Ausgabe 07/2015.
- Tolerable Upper Intake Levels for Vitamins and Minerals. Scientific Committee on Food / Scientific Panel on Dietetic Products, Nutrition and Allergies / European Food Safety Authority. 02/2006, ISBN 92-9199-014-0, S. 243–252.
- M. G. Traber: Vitamin E. In: M. E Shils, J. A Olson, M. Shike, A. C Ross: Modern Nutrition in Health and Disease. 9th Edition, Williams and Wilkins, Baltimore MD 1999.
- Höchstmengenvorschläge für Vitamin E in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. 2021, abgerufen am 30. Dezember 2021.
- Comments and Responses zu E. R. Miller et al.: Ann. Intern. Med. 2004.
- Hans Konrad Biesalski: Bjelakovic-Studie über Vitamin-Gefahr: „Angebliche Gefahr durch Vitamine ist nichts als Wissenschaftspopulismus“.
- Bell, Grochoski: How safe is vitamin E supplementation? In: Crit. Rev. Food Sci. Nutr., 48(8), 2008, S. 760–774, PMID 18756398.
- E. R. Miller, R. Pastor-Barriuso, D. Dalal, R. A. Riemersma, L. J. Appel, E. Guallar: Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. In: Ann. Intern. Med. Band 142, Nr. 1, Januar 2005, S. 37–46, PMID 15537682 (freier Volltext).
- G. Bjelakovic et al.: In: JAMA. 297, 2007, S. 842–857, Abstract.
- Yedidia Dotan, Dov Lichtenberg, Ilya Pinchuk: No evidence supports vitamin E indiscriminate supplementation. In: BioFactors. Band 35, Nr. 6, November 2009, S. 469, doi:10.1002/biof.61, PMID 19866453.
- Vitamin E zum Schutz vor Herzinfarkt und Krebs? In: Verbraucherzentrale. 22. März 2021, abgerufen am 26. April 2021.
- Deutsche Gesellschaft für Orthopädie und Unfallchirurgie e.V: Sportlich unterwegs mit neuer Hüftprothese. Abgerufen am 22. Juni 2019.
- Nathalie Garçon et al.: Development and evaluation of AS03, an Adjuvant System containing α-tocopherol and squalene in an oil-in-water emulsion. In: Expert Review of Vaccines. Band 11, Nr. 3, März 2012, S. 349–366, doi:10.1586/erv.11.192, PMID 22380826.
- Miriam Seßler, Jürgen Schatz: Organometall-Reaktionen in Wasser. In: Chemie in unserer Zeit. Band 46, 2012, S. 48–59.
- Kornél Nagy, Marie-Claude Courtet-Compondu, Birgit Holst, Martin Kussmann: Comprehensive analysis of vitamin E constituents in human plasma by liquid chromatography-mass spectrometry. In: Anal. Chem. 79(18), 2007, S. 7087–7096, PMID 17696496.
- W Wachs, HU Melchert: Eine neue Methode zur quantitativen Bestimmung von Tocopherolen in Pflanzenölen, Deutsche Lebensmittel-Rundschau 67(7), 221–225, Juli 1971.
- HU Melchert, E. Pabel: Quantitative determination of alpha-, beta-, gamma- and delta-tocopherols in human serum by high-performance liquid chromatography and gas chromatography-mass spectrometry as trimethylsilyl derivatives with a two-step sample preparation. In: J Chromatogr A. 896(1-2), 2000, S. 209–215, PMID 11093656.
- Eintrag zu Vitamin E (Mass spectrum, electron ionization). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- G. Kłaczkow, E. L. Anuszewska: Determination of the stereoisomers of racemic alpha-tocopherol in pharmaceutical preparations by high-performance liquid chromatography and gas chromatography. In: Acta Pol. Pharm. 65(6), 2008, S. 715–721, PMID 19172854.