Dipolmolekül
Dipolmolekül ist eine wenig gebräuchliche Bezeichnung für ein nach außen hin elektrisch neutrales Molekül, das ein permanentes elektrisches Dipolmoment besitzt, weil die Schwerpunkte seiner positiven und negativen Ladungen örtlich nicht zusammenfallen. Wenn diese Eigenschaft im Vordergrund steht, wird solch ein Molekül auch kurz Dipol genannt.[1]
Ursache für Dipolmoleküle

Polare Atombindungen können zu einem Dipolmoment des gesamten Moleküls führen. Das hängt vom Molekülbau ab, denn die Dipolmomente verschiedener Bindungen im Molekül addieren sich richtungsabhängig (vektoriell) und können sich daher gegenseitig aufheben oder verstärken. Fluorwasserstoff trägt als zweiatomige, heteronucleare Verbindung ein Dipolmoment. Kohlenstoffdioxid hat aus Symmetriegründen kein permanentes Dipolmoment, die Atome sind linear angeordnet und die entgegengesetzt ausgerichteten Bindungsdipole heben sich auf. Biegeschwingungen des Moleküls brechen allerdings die Symmetrie und führen zu Dipolmomenten und Wirkung von CO2 als Treibhausgas. Wasser hat ein größeres Gesamtdipolmoment als Fluorwasserstoff, obwohl die Polarität der Bindung zwischen Wasserstoff- und Sauerstoffatom (H–O) kleiner ist als die der Bindung zwischen Wasserstoff- und Fluoratom (H–F). Die Ursache liegt in der Addition der zwei H–O-Bindungsdipole, die in einem Bindungswinkel von ca. 105° zueinander stehen und dem kleineren Winkel der freien Elektronenpaare zur Symmetrieachse.
| Verbindung | Fluorwasserstoff (HF) | Wasser (H2O) | Kohlenstoffdioxid (CO2) |
| Struktureller Aufbau | 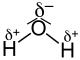 |
||
| Elektronegativitätsdifferenz | 1,9 | 1,4 | 1,0 |
| Dipolmoment μ in Debye | 1,82[2] | 1,85[2] | 0[2] |
Als Faustregel kann gesagt werden, dass Moleküle mit einem asymmetrischen Aufbau und einer Differenz der Elektronegativitäten (ΔEN) nach Pauling kleiner 1,7 aber größer als 0,5 als Dipol-Moleküle erscheinen, d. h., sie sind zwar nach außen elektrisch neutral, haben aber ein (messbares) Dipolmoment. Bei ΔEN größer 1,7 nimmt man ionischen Bindungscharakter an. Allerdings ist die Grenze ΔEN < 1,7 als Richtwert anzusehen, wie sich an den Beispielen Fluorwasserstoff und Aluminiumchlorid (ΔEN = 1,5) zeigt. Bei ΔEN kleiner 0,5 nimmt man unpolare Moleküle an.
Einzelnachweise
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 304–305.
- Eintrag zu Dipolmoment. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. April 2012.