Kettenreaktion (Chemie)
Eine chemische Kettenreaktion ist eine Reaktion, bei denen ein Startereignis eine Reaktion auslöst, deren Zwischenprodukt (häufig Radikale) insgesamt oder teilweise als Ausgangspunkt für ein oder mehrere nachfolgende Reaktionen dienen und die durch eine Abbruchreaktion beendet wird.[1]
Geschichte
Seit den Forschungen von Max Planck war bekannt, dass Licht aus diskreten Quanten besteht. Die Anregung einer einzelnen chemischen Reaktion durch ein Lichtquant konnte dadurch erklärt werden, jedoch nicht die extreme Lichtempfindlichkeit einiger Reaktionen, bei denen die Quantenausbeute in Größenordnungen von 104 bis 106 lag.[2]
Max Bodenstein, der bereits im Jahr 1899 über die Gasreaktionen in der chemischen Kinetik habilitiert hatte, hatte im Jahr 1913 die Idee, dass dies auf eine Kettenreaktion zurückzuführen sei. Das bedeutet, dass bei der Reaktion zweier Moleküle nicht nur das Endprodukt der Reaktion entstehen kann, sondern auch instabile Moleküle, die die Kette fortführen können.[3]
Der dänische Chemiker Jens Anton Christiansen und der niederländische Physiker Hendrik Anthony Kramers wiesen 1923 darauf hin, dass Kettenreaktionen auch durch die Kollision zweier Moleküle ausgelöst werden können. Auch auf die Möglichkeit der Verzweigung der Kettenreaktion mit der Möglichkeit der Explosion wurde von ihnen untersucht.[4][5]
Bei Untersuchungen der Phosphorverbrennung im Jahr 1926 fanden Juli Borissowitsch Chariton und Z. Valta, dass die Reaktion bei einem Sauerstoffgehalt oberhalb einer bestimmten Konzentration sich erstaunlicherweise verringert. Die Fortführung dieser Experimente durch Nikolai Nikolajewitsch Semjonow führte zur Entdeckung der Explosionsgrenzen und einer Bestätigung der Ideen von Kramers und Christiansen.[6]
Semjonow und Hinshelwood untersuchten vor allem auch die Knallgasreaktion, für die sie 1956 „für ihre Forschungen über die Mechanismen chemischer Reaktionen“ mit dem Nobelpreis für Chemie ausgezeichnet wurden.[7]
In der radikalischen und kationischen Polymerisation haben Kettenreaktionen eine große technische und ökonomische Bedeutung. Erhebliche Umweltrelevanz haben Chlorradikale, die als Kettenstarter etwa 100.000 Ozonmoleküle in einer Kettenreaktion abbauen und so zum Abbau der Ozonschicht beitragen.[8]
Unverzweigte Kettenreaktion
Wird bei radikalischen Kettenreaktionen pro Radikal jeweils nur ein weiteres erzeugt, spricht man von unverzweigten Kettenreaktionen.
Ein Beispiel hierfür ist die Chlorknallgasreaktion, bei der Wasserstoff und Chlor zu Chlorwasserstoff nach folgender Bruttogleichung reagieren:
Die Reaktion läuft bei Belichtung oder thermischer Aktivierung unter Beteiligung von Wasserstoff- und Chlor-Radikalen als Kettenträger ab.
Die einfache kinetische Beschreibung des Systems gelingt mittels des Bodenstein’schen Quasistationaritätsprinzips. Das Quasistationaritätsprinzip beruht auf der Annahme, dass die Konzentration der entstehenden Zwischenprodukte zeitlich konstant ist, also die Bildungsgeschwindigkeit gleich der Weiterreaktionsgeschwindigkeit ist.
Für die allgemeine Folgereaktion
mit den Reaktionsgeschwindigkeitskonstanten and ergeben sich die folgende Reaktionsraten:
Bei Anwendung der Bodensteinschen Quasistationärprinzips wird angenommen, dass die Konzentration von B unverändert bleibt.
- .
Damit ergibt sich:
und
- .
Kettenreaktionen mit polymeren Produkten
Eine Kettenreaktion von großer ökonomischer Bedeutung ist die radikalische Polymerisation von Olefinen. Zum Kettenstart wird ein sogenannter Radikalstarter wie Dibenzoylperoxid eingesetzt, also eine Verbindung, die leicht thermisch oder photolytisch in Radikale zerfällt. Diese lagert sich an ein Olefin an und erzeugt so ein Primärradikal, an das sich andere Olefine unter Bildung einer Kohlenstoff-Kohlenstoff-Bindung anlagern. Zum Abbruch der Reaktion kommt es entweder durch Disproportionierung (Eigeninhibition) oder die Zugabe von Radikalfängern (Fremdinhibition). Die mittlere Kettenlänge (mittlerer Polymerisationsgrad) lässt sich über das Verhältnis der Anfangskonzentrationen von Radikalstarter und Monomer steuern.[9]
Verzweigte Kettenreaktionen
Werden bei radikalischen Kettenreaktionen pro Radikal mehrere Radikale erzeugt, spricht man von verzweigten Kettenreaktionen.
Die Knallgasreaktion ist ein Beispiel für eine verzweigte Kettenreaktion, bei der Wasserstoff und Sauerstoff zu Wasser nach folgender Bruttogleichung reagieren:
Die Reaktion läuft unter Beteiligung von Wasserstoff-, Sauerstoff- und Hydroxyl-Radikalen als Kettenträger ab.
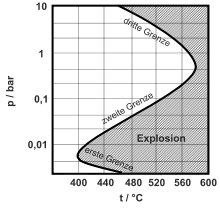
Je nach Druck, Temperatur und Zusammensetzung der Mischung kommt es zur Explosion, wenn die Kettenverzweigungsreaktionen wahrscheinlicher als die Kettenabbruchreaktionen sind. Bei niedrigem Druck oder bei zu hoher Sauerstoffkonzentration sind die Abbruchreaktionen wahrscheinlicher als die Kettenverzweigungen und das System befindet sich in einem Bereich unter der unteren Explosionsgrenze. Bei höherem Druck und im richtigen Mischungsverhältnis wird die untere Explosionsgrenze überschritten und die Mischung explodiert. Noch höherer Druck oder eine weitere Erhöhung der Wasserstoffkonzentration führt dazu, dass die Kettenabbruchreaktionen etwa durch Rekombination wieder überwiegen und die Bruttoreaktionsgeschwindigkeit verlangsamt wird.
Siehe auch
Literatur
- W. J. Moore, D. O. Hummel, G. Trafara, K. Holland-Moritz: Physikalische Chemie, 1236 Seiten, Verlag Gruyter (1986), ISBN 3-11-010979-4
- J. Bülle, A. Hüttermann: Das Basiswissen der organischen Chemie, Verlag Wiley-VCH, ISBN 3-527-30847-4 (eingeschränkte Vorschau in der Google-Buchsuche), S. 33.
Einzelnachweise
- Eintrag zu chain reaction. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00960.
- Handbuch der Abwasser- und Recyclingtechnik für die metallverarbeitende Industrie, von Ludwig Hartinger.
- M. Bodenstein: Zur Kinetik des Chlorknallgases. Z. phys. Chem. 85 (1913) 329.
- J. A Christiansen, H. A. Kramers: Z. Phys. Chem. 104(1923)451.
- Master of modern physics: the scientific contributions of H.A. Kramers, von D. ter Haar.
- Nikolai Nikolajewitsch Semjonow: Some problems relating to chain reactions and to the theory of combustion (PDF; 133 kB), Nobelpreisvortrag 1956.
- Cyril Norman Hinshelwood: Chemical kinetics in the past few decades (PDF; 54 kB), Nobelpreisvortrag 1956.
- Chlorine in the World: Good or Bad?, von David P. Gilkey und Holly A. Williams.
- Polystyrol von Hermann Gausepohl, D. Braun, Roland Gellert.
