Isobutan
Isobutan (systematischer Name nach IUPAC: 2-Methylpropan) ist eine organische chemische Verbindung aus der Gruppe der Alkane. Es ist ein Konstitutionsisomer des Butans und der einfachste verzweigte Kohlenwasserstoff.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
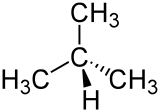 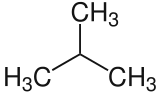 | |||||||||||||||||||
| Keilstrichformel (oben) und Skelettformel | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isobutan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H10 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit süßlichem Geruch[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
2,70 kg·m−3 (bei 0 °C, 1013 hPa) | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−11,7 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,3518 (−25 °C)[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
1000 ml·m−3[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Isobutan kommt in Erdgasen und Erdölen vor. Es wird auch daraus bei der Reinigung und Verarbeitung gewonnen.
Eigenschaften
Isobutan ist ein farbloses, fast geruchloses, brennbares Gas. Es ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend und erstickend. Der Flammpunkt liegt bei −83 °C, die Zündtemperatur bei 460 °C.[3] Der Stoff fällt somit in die Temperaturklasse T1. Für Isobutan liegt die untere Explosionsgrenze (UEG) bei 1,5 Vol.-% (37 g/m3) und die obere Explosionsgrenze (OEG) bei 9,4 Vol.-% (231 g/m3).[3] Diese Werte unterscheiden sich kaum von den Werten für das strukturisomere n-Butan. Die Sauerstoffgrenzkonzentration liegt bei 10,3 Vol.-%.[3]
Verwendung
Isobutan ist ein Grundstoff in der chemischen Industrie. Große Mengen werden zur Herstellung von Alkylat (Alkylierung, Isooktan) verwendet. Einige andere Chemikalien, wie Isobuten und tert-Butylhydroperoxid[3] werden aus Isobutan hergestellt. Zusammen mit Butan wird es als Treibgas in Sprühdosen eingesetzt (Lebensmittelzusatzstoff E 943b[8]). Da es wie andere Alkane brennbar ist, wird es als Brennstoff benutzt. Isobutan wird auch als Beimischung für Campinggas verwendet. Da Isobutan einen niedrigeren Siedepunkt als n-Butan (−0,5 °C) aufweist, wird Campinggas aus Propan und Isobutan gemischt. Dadurch eignet sich dieses Gasgemisch nicht nur für den Sommer, sondern auch für den Einsatz im Winter und auf Hochtouren.
Kältemittel
Isobutan weist einen sehr niedrigen Treibhauseffekt auf (GWP 3) und wird deswegen in Kühlschränken und Klimaanlagen als Kältemittel mit der Bezeichnung R-600a eingesetzt. Die Einsatzgrenze liegt aus Sicherheitsgründen derzeit bei 150 g pro Gerät. Seit 1992 Greenpeace das Projekt Greenfreeze mit Hilfe der Firma Foron vorgestellt hat, wird R-600a in Kühlschränken verwendet.[9] In Europa hat R-600a das zuvor als Kältemittel in Haushaltsgeräten verwendete R-134a fast vollständig verdrängt, da R-600a billiger ist, ein wesentlich niedrigeres Treibhauspotenzial hat, weniger chemische Verträglichkeitsprobleme hat und mit Mineralöl mischbar ist. Die meisten Geräte kommen mit weniger als 50 g Kältemittel aus. Bis 2011 sind schon 300 Millionen Geräte auf den Markt gekommen. Manche Solarkollektoren verwenden Methylpropan als Wärmeträger.
Einzelnachweise
- Eintrag zu E 943b: Isobutane in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- Eintrag zu ISOBUTANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Isobutan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Butane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-308.
- Eintrag zu Isobutane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Text der Zusatzstoff-Zulassungsverordnung.
- greenpeace.de: Greenfreeze: Der FCKW-freie Kühlschrank.

