Phenole
Als Phenole werden in der Chemie Verbindungen bezeichnet, die aus einem aromatischen Ring (Arene) und einer oder mehreren daran gebundenen Hydroxygruppen bestehen. Nach der chemischen Nomenklatur werden Phenole durch Anhängen der Nachsilbe -ol oder Voranstellen der Vorsilbe Hydroxy- bezeichnet.
| Phenole |
|---|
Phenol |
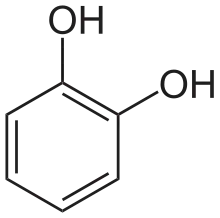 1,2-Dihydroxybenzol (Brenzcatechin) |
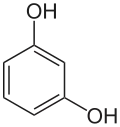 1,3-Dihydroxybenzol (Resorcin) |
1,4-Dihydroxybenzol (Hydrochinon) |
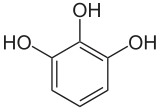 1,2,3-Trihydroxybenzol (Pyrogallol) |
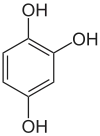 1,2,4-Trihydroxybenzol (Hydroxyhydrochinon) |
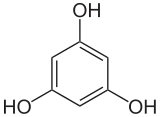 1,3,5-Trihydroxybenzol (Phloroglucin) |
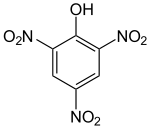 2,4,6-Trinitrophenol (Pikrinsäure) |
Phenole werden von Pflanzen und Mikroorganismen produziert und auch industriell synthetisiert.[1]
Eigenschaften
Phenole ähneln aufgrund der Hydroxygruppe den Alkoholen, reagieren jedoch in Wasser als schwache Säuren und führen zu leicht sauren Lösungen. Grund für den sauren Charakter der Hydroxygruppe ist die Stabilisierung des sich bildenden Phenolat-Anions durch Mesomerie. Mit Basen bilden Phenole daher Salze, die Phenolate. Trotz der Unterschiede gehen Phenole auch viele für Alkohole typische Reaktionen ein, etwa die Veresterung mit Säuren oder die Bildung von Phenolethern.
Phenole besitzen eine Keto-Enol-Tautomerie, die aber durch die energetische Begünstigung durch die Bildung des aromatischen Systems (vgl. Hückel-Regel) im Gegensatz zu den aliphatischen Ketonen stark auf der Enol-Seite liegt.
Vertreter
Einfache Phenole
Das Phenol ist das einfachste von Benzol abgeleitete Phenol mit nur einer Hydroxygruppe und der Summenformel C6H5OH.
Weitere Phenole mit einer Hydroxygruppe, sogenannte einwertige Phenole, sind die Toluol-Derivate: die Kresole (o-, m- und p-Kresol), sowie die Naphthole (α- und β-Naphthol) und Thymol.
Die bekanntesten Dihydroxybenzole (Diphenole oder zweiwertige Phenole), Phenole mit zwei Hydroxygruppen, sind Brenzcatechin, Resorcin, Hydrochinon und 1,4-Naphthohydrochinon.
Ein wichtiges Triphenol (dreiwertiges Phenol) ist das Phloroglucin (1,3,5-Trihydroxybenzol), das in salzsaurer Lösung als Nachweisreagenz für den Holzstoff Lignin verwendet wird. Pyrogallol (1,2,3-Trihydroxybenzol) wird in der chemischen Analytik zum Nachweis und zur Absorption von Sauerstoff eingesetzt. Der dritte Vertreter ist das Hydroxyhydrochinon (1,2,4-Trihydroxybenzol).
Substituierte Phenole
Die Pikrinsäure ist ein Beispiel für ein substituiertes Phenolderivat. Weitere chemisch bedeutsame Phenolderivate sind: Salicylsäure, o- und p-Nitrophenol, Gallussäure, Eugenol, Hexachlorophen, Chlorxylenol, Adrenalin und Noradrenalin. Zu den Phenolen zählen auch Tannine und viele Aromastoffe, die den Duft und Geschmack des Weines bestimmen. Andere bekannte Phenole sind beispielsweise das Vanillin, der wichtigste Aromabestandteil der Vanille sowie die Pflanzenfarbstoffe aus den Gruppen der Flavonoide. Das Butylhydroxytoluol ist ein vielseitig angewendetes Antioxidans, welches auch als Lebensmittelzusatzstoff E321 zugelassen ist.
Vorkommen und Darstellung
Einige Phenole werden durch Destillation aus dem Teer von Stein- und Braunkohle gewonnen,[3] andere können aus Naturprodukten isoliert werden. Die meisten Phenole werden heute – wie das Phenol selbst – nach dem Cumolhydroperoxid-Verfahren synthetisch dargestellt.
Aktuell wird an Möglichkeiten geforscht, Phenole aus nachwachsenden Rohstoffen und insbesondere aus Lignin herzustellen.[4] Dazu eignen sich beispielsweise verschiedene Pyrolyse- und Hydrolyseverfahren.[4]
Verwendung
Phenole sind die Grundlage zur Herstellung von Kunstharzen (Phenoplaste). Sie werden auch bei der Herstellung von Kunststoffen, Farbstoffen, Pharmazeutika und Pestiziden verwendet. Hydrochinon (1,4-Dihydroxybenzol) ist ein mildes Reduktionsmittel und wird deshalb auch als photographischer Entwickler eingesetzt.
Nachweis
Durch Eisen(III)-chlorid werden die meisten Phenole grün-blau gefärbt. Ein spezifischer Nachweis ist für viele Phenole über die Umsetzung mit Benzoylchlorid zu entsprechenden, gut kristallisierenden Estern möglich.[5]
Geschmacksträger
Zu den Phenolen zählen auch die Tannine und andere Aromen, die zum Beispiel für den Geschmack und Geruch von Wein von Bedeutung sind. Die Tannine kommen hauptsächlich in den Schalen und Kernen roter Weintrauben vor. Ein Derivat des Phenols, das 2,4,6-Trichloranisol, wird als Korkton von Weinen wahrgenommen, wobei schon Spuren im Bereich von wenigen Nanogramm pro Liter wahrnehmbar sind.
Phenole sind auch beim Whisky wichtige Geschmacksträger; hierzu gehören u. a. 4-Ethylphenol, 4-Ethylguajacol, Guajacol, Eugenol, Syringaaldehyd und Vanillin, von denen vor allem die drei Erstgenannten für die Rauchnote verantwortlich sind.[6]
Phenolische Vergilbung
Als phenolisches Vergilben wird eine Vergilbung von Materialien bezeichnet die durch Stickstoffoxide und phenolische Verbindungen hervorgerufen werden. Ob ein Material potenziell zu Vergilbung neigt kann mit einer Prüfung nach DIN EN ISO 105-X18 überprüft werden. Hierbei wird ein Probekörper mit 2,6-Di-tert-butyl-4-nitrophenol in Kontakt gebracht und eine eventuelle Vergilbung anhand eines Graumaßstab bewertet.[7]
Einzelnachweise
- Stephan Hättenschwiler, Peter M. Vitousek: The role of polyphenols in terrestrial ecosystem nutrient cycling. In: Trends in Ecology & Evolution. 15, Nr. 6, 2000, S. 238–243. doi:10.1016/S0169-5347(00)01861-9. PMID 10802549.
- Paula Yurkanis Bruice: Organic Chemistry, 4. Auflage, Pearson Education Inc., 2004, ISBN 0-13-121730-5, S. 854.
- Wissenschaft-Online-Lexika: Eintrag zu Phenole im Lexikon der Chemie, abgerufen am 17. Februar 2009.
- Joseph Zakzeski, Pieter C. A. Bruijnincx, Anna L. Jongerius & Bert M. Weckhuysen: The Catalytic Valorization of Lignin for the Production of Renewable Chemicals. In: Chemical Reviews. Band 110, Nr. 6, 2010, S. 3565–3567, doi:10.1021/cr900354u.
- H. P. Latscha, H. A. Klein, G. Linti, G. W. Linti: Analytische Chemie: Chemie-Basiswissen III., 4. Auflage, S. 127, Springer, 2004, ISBN 978-3-540-40291-6.
- Eintrag zu Whiskyaroma. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- DIN EN ISO 105-X18:2007.