Glutathiontransferase Omega
Glutathiontransferasen Omega (GSTO) sind Enzyme in Säugetieren, Insekten und Würmern, die Dehydroascorbinsäure und Monomethylarsenat mithilfe von Glutathion reduzieren können. Sie spielen daher eine wichtige Rolle bei der Recyclierung von Vitamin C und bei der Biotransformation von Arsenverbindungen. Im Menschen sind zwei Paraloge bekannt, die von den Genen GSTO1 und GSTO2 codiert werden. GSTO-1 kommt im Zytoplasma aller Gewebetypen vor, insbesondere aber in der Leber, den Skelettmuskeln und im Herz. GSTO-2 wird ebenso überall, aber besonders in den Hoden produziert.[1][2]
| Glutathiontransferase Omega | ||
|---|---|---|
|
Vorhandene Strukturdaten: 1eem | ||
| Masse/Länge Primärstruktur | 241/243 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name(n) | GSTO1, GSTO2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.5.1.18, Transferase | |
| Vorkommen | ||
| Übergeordnetes Taxon | Säugetiere, Insekten, Würmer | |
Die GSTO gehören zu den Glutathion-S-Transferasen und sind dadurch charakterisiert, dass als katalytisches Zentrum ein Cystein-Rest agiert, sowie durch ihre Dehydroascorbat-Reduktase-Aktivität.[2]
Weitere entdeckte Funktionen von GSTO-1 sind Modulierung des Ryanodin-Rezeptors und Interaktion mit Arzneistoffen, die die Freisetzung von Zytokinen hemmen.[2]
Es gibt möglicherweise Varianten von GSTO-1, die mit amyotropher Lateralsklerose assoziiert sind, andere erhöhen das Risiko für Brustkrebs, weitere gehen mit zerebraler Atherosklerose einher. GSTO-1 ist ein möglicher Kandidat als Ursache für das Phänomen der Platinresistenz.[3][4][5][6]
Katalysierte Reaktionen
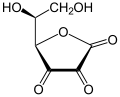 + 2GSH
+ 2GSH 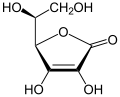 + GSSG
+ GSSG
Dehydroascorbinsäure wird zu Ascorbinsäure reduziert, während Glutathion zu Glutathiondisulfid oxidiert wird.[7]
Einzelnachweise
- UniProt P78417
- Whitbread AK, Masoumi A, Tetlow N, Schmuck E, Coggan M, Board PG: Characterization of the omega class of glutathione transferases. In: Meth. Enzymol.. 401, 2005, S. 78–99. doi:10.1016/S0076-6879(05)01005-0. PMID 16399380.
- van de Giessen E, Fogh I, Gopinath S, et al: Association study on glutathione S-transferase omega 1 and 2 and familial ALS. In: Amyotroph Lateral Scler. 9, Nr. 2, April 2008, S. 81–4. doi:10.1080/17482960701702553. PMID 18427999.
- Olsen A, Autrup H, Sørensen M, Overvad K, Tjønneland A: Polymorphisms of glutathione S-transferase A1 and O1 and breast cancer among postmenopausal Danish women. In: Eur J Cancer Prev. 17, Nr. 3, Juni 2008, S. 225–9. doi:10.1097/CEJ.0b013e3282b6fe1e. PMID 18414193.
- Kölsch H, Larionov S, Dedeck O, et al: Association of the glutathione S-transferase omega-1 Ala140Asp polymorphism with cerebrovascular atherosclerosis and plaque-associated interleukin-1 alpha expression. In: Stroke. 38, Nr. 10, Oktober 2007, S. 2847–50. doi:10.1161/STROKEAHA.107.484162. PMID 17717316.
- Yan XD, Pan LY, Yuan Y, Lang JH, Mao N: Identification of platinum-resistance associated proteins through proteomic analysis of human ovarian cancer cells and their platinum-resistant sublines. In: J. Proteome Res.. 6, Nr. 2, Februar 2007, S. 772–80. doi:10.1021/pr060402r. PMID 17269733.
- D'Eustachio/reactome.org: Reduction of dehydroascorbate to ascorbate.