Gustatorische Wahrnehmung
Als gustatorische Wahrnehmung (von lateinisch gustare „kosten, schmecken“) wird das subjektiv erfahrene Erlebnis von Empfindungen des Schmeckens bezeichnet, die durch Reizung spezifischer Sinnesorgane des Geschmacks (lateinisch gustus) wie den Geschmacksknospen hervorgerufen werden.
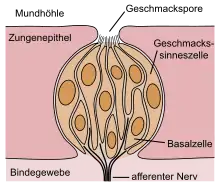
Der Geschmackssinn wird ebenso wie der Geruchssinn durch chemische Reize angesprochen, ist jedoch ein Nahsinn, mit dem aufgenommene Nahrung vor der eigentlichen Einnahme geprüft werden kann. Beim erwachsenen Menschen liegen die Sinneszellen des Geschmacksorgans in der Zungen- und Rachenschleimhaut und vermitteln fünf (oder sechs) Grundqualitäten. Saurer und bitterer Geschmack können auf unreife, vergorene oder giftige Nahrungsmittel hinweisen. Die Geschmacksqualitäten salzig, süß, umami (und fetthaltig) kennzeichnen eine Nahrung grob nach ihrem Gehalt an Mineralien und ernährungswichtigen Stoffen wie Kohlenhydraten, Eiweißen und Fetten.
Der Sinneseindruck, der alltagssprachlich als „Geschmack“ bezeichnet wird, ist ein Zusammenspiel des Geschmacks- und Geruchssinns gemeinsam mit Tast- und Temperaturempfindungen aus der Mundhöhle. Sinnesphysiologisch umfasst der menschliche Geschmackssinn hingegen nur die genannten grundlegenden Geschmacksqualitäten; sie werden mit Geschmacksrezeptoren wahrgenommen, die vorwiegend auf der Zunge liegen.
Als Dysgeusie werden Störungen der geschmacklichen Wahrnehmung bezeichnet. Ageusie heißt der Ausfall des Geschmackssinns.
Lage der Sinneszellen
Die Rezeptorzellen für verschiedene Geschmacksqualitäten sind bei Säugetieren in Geschmacksknospen (Caliculi gustatorii) angeordnet, die sich auf der Zunge in den Geschmackspapillen (Papillae gustatoriae), daneben auch in den Schleimhäuten von Mundhöhle, Rachen und Schlund befinden. Etwa 25 % der Geschmacksknospen sind auf den vorderen zwei Dritteln der Zunge angeordnet, weitere 50 % auf dem hinteren Drittel. Die übrigen verteilen sich auf Gaumensegel, Nasenrachen, Kehlkopf und die obere Speiseröhre.[1] Jede Geschmacksknospe kann 50 bis 150 Sinneszellen enthalten, abhängig auch von der Spezies eines Säugetieres, und eine Geschmackspapille dann einige bis zahlreiche Geschmacksknospen.[2]
Die Papillen der Zunge unterteilt man ihrer Form nach in Wall-, Blätter-, Pilz- und Fadenpapillen. Wallpapillen (Papillae vallatae) befinden sich im hinteren Drittel des Zungenrückens in V-förmiger Anordnung nahe dem Zungengrund. Jeder Mensch besitzt etwa sieben bis zwölf dieser Papillen, die jeweils mehrere Tausend Geschmacksknospen aufweisen. Auch die Blätterpapillen (Papillae foliatae) befinden sich im hinteren Drittel der Zunge, jedoch an deren Rand, und enthalten einige hundert Geschmacksknospen. Die bis zu vierhundert Pilzpapillen (Papillae fungiformes) finden sich über die gesamte Zungenoberfläche verteilt vornehmlich auf den vorderen zwei Dritteln der Zunge und enthalten beim Menschen je drei bis fünf Geschmacksknospen. Fadenpapillen (Papillae filiformes) enthalten keine Geschmacksknospen, sondern dienen der Beurteilung mechanischer Eigenschaften der aufgenommenen Lebensmittel.[1][2]
Menschliche Säuglinge und Kleinkinder haben nicht nur zahlenmäßig mehr Geschmacksknospen, sondern außerdem welche auf dem harten Gaumen, in der Zungenmitte sowie in der Lippen- und Wangenschleimhaut. Mit zunehmenden Lebensalter werden sie ihrer Anzahl nach ausgedünnt und auf bestimmte Lokalisationen konzentriert.
Die Geschmacksqualitäten
Aktuell wird von zumindest fünf – eventuell sechs – Grundqualitäten des Geschmacks ausgegangen:
- süß – ausgelöst durch Zucker und Zuckerderivate sowie einige Aminosäuren, Peptide oder Alkohole, siehe auch: Süßstoffe; aber auch durch einige Giftstoffe, z. B. Blei(II)-acetat
- salzig – ausgelöst durch Speisesalz sowie durch einige andere Mineralsalze
- sauer – ausgelöst durch saure Lösungen und organische Säuren
- bitter – ausgelöst durch eine Vielzahl verschiedener Stoffe, siehe auch: Bitterstoffe
- umami – ausgelöst durch die Aminosäuren Glutaminsäure und Asparaginsäure
- fett – ausgelöst durch freie Fettsäuren,[3] doch als Geschmacksqualität umstritten[4]
Umami (jap. 'wohlschmeckend, würzig') ist eine gemeinhin weniger bekannte Geschmacksqualität, die erstmals 1909 von dem japanischen Forscher Kikunae Ikeda beschrieben wurde. Ikeda war es gelungen, aus dem Seetang, der eine Hauptzutat des Dashi, eines japanischen Fischsudes, darstellt, Glutaminsäure zu isolieren und als den geschmacklich ausschlaggebenden Bestandteil von Dashi zu identifizieren.[5] Er gab dieser Qualität ihren Namen als Kompositum aus umai ('würzig') und mi ('Geschmack'). Ein starker umami-Geschmack zeigt eiweiß- und aminosäurereiche Nahrungsmittel an, kann aber auch allein durch eine hohe Konzentration an Glutaminsäure beziehungsweise durch den Geschmacksverstärker Mononatriumglutamat hervorgerufen werden. Rezeptoren aus der Gruppe CaSR binden Calciumionen und verstärken die Sinneseindrücke umami, süß und salzig.[6]
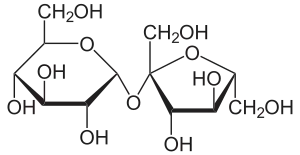 Saccharose – Kristallzucker
Saccharose – Kristallzucker Kristallstruktur von Natriumchlorid – Kochsalz
Kristallstruktur von Natriumchlorid – Kochsalz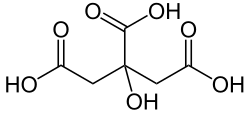
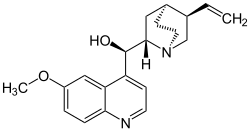 Chinin – Bitterstoff der Chinarindenbäume
Chinin – Bitterstoff der Chinarindenbäume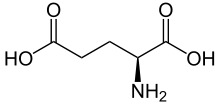 L-Glutaminsäure
L-Glutaminsäure Stearinsäure
Stearinsäure
Bereits seit Anfang des 20. Jahrhunderts ist bekannt, dass die genannten Geschmacksqualitäten wohl unterschiedlich stark in verschiedenen Regionen auf der Zunge auszulösen sind, doch grundsätzlich von allen geschmacksempfindlichen Bereichen wahrgenommen werden. Obgleich die Unterschiede zwischen den Zungenbereichen bezüglich der Sensitivität für einzelne Qualitäten beim Menschen eher gering sind, ist dennoch in vielen Lehrbüchern eine Einteilung der Zunge in „Geschmackszonen“ zu finden.[7]
Weitere Geschmacksqualitäten
Eine Gruppe von Wissenschaftlern um Philippe Besnard identifizierte Ende 2005 einen möglichen Geschmacksrezeptor für Fett: das Glycoprotein CD36, das in den Geschmackssinneszellen der Zunge nachgewiesen wurde und Fettsäuren mit hoher Affinität binden kann. Bis dahin war es strittig, ob es eine sechste Grundqualität gibt, die durch Fett in Nahrungsmitteln ausgelöst wird. Allgemein wurde angenommen, dass die Vorliebe für fetthaltige Speisen allein von deren Geruch und Konsistenz herrührt. Um die Frage nach einem möglichen weiteren Grundgeschmack für Fett zu klären, führten die Forscher Experimente mit normalen (Wildtyp) und mit gentechnisch veränderten Mäusen ohne den CD36-Rezeptor durch (Knockout-Mäuse). Den Mäusen wurde die Wahl zwischen zwei Futterangeboten gelassen, von denen eines Fett enthielt und das andere lediglich eine Substanz, die die Konsistenz des Fetts imitierte. Es zeigte sich, dass die normalen Mäuse mit CD36 eine starke Vorliebe für das fetthaltige Futter hatten, nicht aber die Knockout-Mäuse ohne CD36. Darüber hinaus reagierten nur die gewöhnlichen Mäuse auf fetthaltige Nahrung mit der Produktion von fettspezifischen Verdauungssäften. Aus diesen Ergebnissen lässt sich auf eine Beteiligung des CD36 bei der Wahrnehmung von Fett im Futter von Nagetieren schließen.[3]
Mittlerweile wurde von Wissenschaftlern aus derselben Gruppe auch nachgewiesen, dass die Stimulation von Geschmackssinneszellen der Maus, die CD36 exprimieren, mit Linolsäure zu einer Aktivierung intrazellulärer Signalkaskaden und der Freisetzung von Neurotransmittern führt.[8]
Linolsäure ist Bestandteil vieler pflanzlicher Fette, die in der Nahrung vorkommen, und wird in der Mundhöhle durch spezielle Enzyme (Lipasen) freigesetzt. Die Ausschüttung von Neurotransmittern durch Geschmackssinneszellen ist notwendig für eine Weiterleitung der Informationen ins Gehirn, wo sie verarbeitet werden.
Die Existenz einer solchen weiteren Geschmacksqualität wurde 2010 von einer kleineren Studie mit 30 Probanden gestützt. Die Probanden waren in der Lage, verschiedene Fettsäuren in ansonsten geschmacksneutralen Lösungen zu differenzieren. Ferner konnte ein Zusammenhang zwischen BMI und der Empfindlichkeit dieser Geschmacksqualität gezeigt werden. Demnach konsumierten Probanden mit einem empfindlicheren Geschmackssinn für Fettsäuren weniger Fett als solche mit einem weniger empfindlichen.[9]
Daneben werden immer wieder weitere Geschmacksqualitäten diskutiert, wie alkalisch, metallisch und wasserartig.
Eine wesentliche Rolle für komplexe Geschmackseindrücke spielt der Geruchssinn, der für alle anderen „Geschmackseindrücke“ verantwortlich ist. Deutlich wird dies bei schweren Erkältungen, wenn man mit verstopfter Nase keine Geschmackseindrücke jenseits der Grundkategorien mehr wahrnimmt. Auch gibt es bei vielen Tierarten keine Trennung zwischen Geschmacks- und Geruchswahrnehmung.
„Scharf“ wird zwar als Geschmacksempfindung qualifiziert, ist aber genau genommen ein Schmerzsignal der Nerven bei Speisen, die beispielsweise mit Chili gewürzt sind, dann hervorgerufen durch das Alkaloid Capsaicin.
Geschmacksrezeptoren
Die Geschmacksqualitäten bitter, süß und umami werden durch G-Protein-gekoppelte Rezeptoren vermittelt und die Signaltransduktion ist mittlerweile recht gut charakterisiert. Die Details der Wahrnehmung von sauer und salzig hingegen sind noch weitgehend ungeklärt. Aufgrund der chemischen Struktur der salzig und sauer schmeckenden Stoffe liegt die Vermutung nahe, dass Ionenkanäle eine entscheidende Rolle bei der Wahrnehmung spielen.
Süß, bitter und umami
Für die Wahrnehmung des süßen Geschmacks ist ein heterodimerer Rezeptor verantwortlich, der aus den beiden G-Protein-gekoppelten Rezeptoren T1R2 und T1R3 zusammengesetzt ist. Dieses Heterodimer vermittelt den süßen Geschmack aller für den Menschen süß schmeckender Stoffe, obwohl diese sehr unterschiedliche molekulare Strukturen aufweisen. Die Fähigkeit, eine Vielzahl unterschiedlicher Stoffe zu detektieren, wird durch den besonders langen extrazellulären N-Terminus der beiden Rezeptoruntereinheiten bewerkstelligt. Zur Bindung der einzelnen Stoffe sind verschiedene Teile des N-Terminus vonnöten. Sämtliche Arten der Familie der Katzen haben eine Mutation im T1R2-Gen, weswegen sie keine Süßwahrnehmung haben.[2] Der süße Geschmack kann mit bestimmten Stoffen (zum Beispiel Gymnemasäuren, Lactisol, Hodulcine, Gurmarin und Ziziphin) unterdrückt werden.[11]
Der Rezeptor für den Umami-Geschmack ist sehr ähnlich aufgebaut. Auch er ist ein Heterodimer, allerdings setzt er sich aus je einer T1R1- und T1R3-Untereinheit zusammen. Er ist in der Lage, verschiedene L-Aminosäuren zu erkennen, und zeigt beim Menschen eine hohe Spezifität für die Aminosäuren Glutamin- und Asparaginsäure. Die Anwesenheit von Purinnukleotiden, wie Inosinmonophosphat und Guanosinmonophosphat, führt zu einer Verstärkung der Rezeptoraktivierung und damit auch des Umami-Geschmacks.[2]
Im Gegensatz zu den anderen Geschmacksqualitäten ist für die Wahrnehmung des bitteren Geschmacks eine Vielzahl von Rezeptoren verantwortlich. Sie bilden die Genfamilie der T2Rs, die beim Menschen etwa 25–30 Mitglieder aufweist.[2][12] Die einzelnen T2R-Typen werden – in verschiedenen Kombinationen – in denselben Rezeptorzellen exprimiert. Das führt dazu, dass, obwohl die einzelnen Rezeptoren mitunter sehr spezifisch für einen oder wenige Bitterstoffe sind, Säugetiere verschiedene Bitterstoffe nicht am Geschmack unterscheiden können. Durch alle Bitterstoffe werden letztendlich dieselben Rezeptorzellen aktiviert und dieselben Informationen an das Gehirn weitergeleitet.[2] Einige Bitterstoffe sind auch in der Lage, die Signaltransduktion direkt zu beeinflussen, indem sie beteiligte Enzyme hemmen oder aktivieren.[7] Rezeptoren für Bitterstoffe wurden auch auf glatten Muskelzellen des Bronchialsystems gefunden. Dort verursacht ihre Aktivierung eine Bronchodilatation.[13]
Auch wenn die Rezeptoren für süß, umami und bitter verschieden sind, so ist die intrazelluläre Signalkaskade, die sie anstoßen, die gleiche: An die G-Protein-gekoppelten-Rezeptoren ist das heterotrimere G-Protein Gustducin gebunden, das strukturell eng verwandt mit dem Transducin aus den Stäbchen der Netzhaut ist. Die α-Untereinheit des Gustducins hat im Ruhezustand ein Guanosindiphosphatmolekül (GDP) gebunden. Die Bindung der Geschmacksstoffe an die G-Protein-gekoppelten-Rezeptoren führt zum Austausch des GDP durch ein Guanosintriphosphat (GTP) und zur Dissoziation des Gustducin in die α-Untereinheit und ein βγ-Dimer. Im Folgenden kommt es zur Aktivierung der Phospholipase Cβ2 (PLCβ2), die in der Membran befindliches Phosphatidylinositol-4,5-bisphosphat (PIP2) in die beiden Second Messenger Inositoltrisphosphat (IP3) und Diacylglycerin (DAG) spaltet. IP3 führt durch Öffnung von IP3-gesteuerten Calciumkanälen des Endoplasmatischen Reticulums (ER) zur Erhöhung der intrazellulären Ca2+-Konzentration. Das hat die Öffnung von TRPM5-Kanälen und die Depolarisation der Geschmackssinneszelle zur Folge.[2]
Salzig und sauer
Lange Zeit wurde der epitheliale Natriumkanal als der wichtigste Kandidat für den Rezeptor des Salzgeschmacks beim Menschen angesehen. Heute ist bekannt, dass er zwar bei Nagetieren an der Wahrnehmung salzigen Geschmacks stark beteiligt ist, beim Menschen aber nur eine untergeordnete Rolle spielt. Man vermutet, dass neben den Kationen, wie Na+, auch die Anionen der Salze, wie Cl−, einen Einfluss haben.[2]
Entgegen langjähriger Annahmen scheint bei der Detektion des sauren Geschmacks weniger der extrazelluläre als vielmehr der intrazelluläre pH-Wert in den Geschmacksrezeptorzellen die entscheidende Rolle zu spielen. Dies würde auch erklären, warum bei gleichem pH-Wert einer Lösung organische Säuren wie Essigsäure oder Citronensäure deutlich saurer schmecken als anorganische Säuren wie etwa Salzsäure. Die organischen Säuren sind in undissoziiertem Zustand wesentlich unpolarer als die anorganischen und somit eher in der Lage, die Zellmembran zu überwinden. In den Zellen dissoziieren sie dann in Protonen und anionische Säurereste und senken somit den pH-Wert intrazellulär. Die anorganischen Säuren hingegen können die Zellmembran nicht undissoziiert durchdringen. Erst bei entsprechend hohen Konzentrationen gelangen die durch extrazelluläre Dissoziation entstandenen Protonen (bzw. ihre hydratisierten Formen) über Ionenkanäle in die Rezeptorzellen. So führen erst deutlich höhere Konzentration anorganischer Säuren in der Mundhöhle zur gleichen Absenkung des pH-Werts in den Sinneszellen. Man vermutet, dass der niedrige pH-Wert zu Veränderungen an den intrazellulären Anteilen von Membranproteinen und darüber schließlich zur Aktivierung der Rezeptorzellen führt.[14]
Dennoch verläuft die Suche nach dem eigentlichen Rezeptor für die Geschmacksqualität „sauer“ schleppend. Nachdem in den letzten Jahrzehnten eine Reihe von Theorien verschiedene Ionenkanäle und -transporter als Sauerrezeptor vorgeschlagen hatten, wurde 2006 mit dem Transmembranprotein PKD2L1 (kurz für engl. „Polycystic kidney disease 2-like 1“) ein besonders interessanter Kandidat identifiziert. Es hat sich gezeigt, dass in Mäusen, bei denen selektiv die PKD2L1-exprimierenden Zellen abgetötet wurden, keine Aktivierung der entsprechenden Nerven durch Sauer-Stimuli mehr stattfand. Die übrigen Geschmacksqualitäten waren offenbar nicht beeinflusst.[2]
Durch eine Reihe von Experimenten weiß man heute, dass jede Geschmackssinneszelle nur Rezeptoren für eine bestimmte Geschmacksqualität enthält, die Detektion also auf Ebene der Sinneszellen getrennt stattfindet. Allerdings beherbergt eine Geschmacksknospe die Sinneszellen mehrerer Qualitäten. Und auch in den zugeordneten afferenten Nerven kodiert jede Faser für mehr als eine Geschmacksqualität.[2]
Calcium/Magnesium-Ionen
Die Ergebnisse von Untersuchungen am Monell Chemical Senses Center durch Tordoff legen nahe, dass es eine Geschmacksqualität für Calcium/Magnesium-Ionen geben könnte. In diesen Studien wurden auf der Zunge von Mäusen Rezeptoren gefunden, die spezifisch auf Calcium/Magnesium-Ionen reagieren.
Da ein Mäusestamm im Vergleichstest calciumhaltige Flüssigkeit (vermutlich wegen des Geschmacks) bevorzugte, wurde dessen Erbgut genauer untersucht. Dabei wurden zwei Gene identifiziert, die anscheinend an der Bildung von Calcium/Magnesium-spezifischen Geschmacksrezeptoren beteiligt sind. Eines der Gene ist auch am Süß- und Umami-Rezeptor beteiligt. Diese beiden Rezeptoren werden ebenfalls als Heterodimere durch die Kombination zweier verschiedener Genprodukte aufgebaut (siehe weiter oben). Neben dem Gen Tas1r3 soll für den Calcium/Magnesium-Geschmack bei Mäusen noch CaSR erforderlich sein. Die verantwortlichen Gene[15] sind auch im menschlichen Erbgut vorhanden, allerdings konnten Produkte des zweitgenannten Gens beim Menschen bisher nur Strukturen im Gehirn und im Verdauungssystem zugeordnet werden.[16][17]
Neuronale Verarbeitung
Die Übertragung der Informationen von den (sekundären) Geschmackssinneszellen auf die afferenten Neuronen, die für die Weiterleitung ins Gehirn zuständig sind, ist noch ungeklärt. Es ist bekannt, dass Geschmackssinneszellen eine Reihe von Neurotransmittern und Neuropeptiden, wie Serotonin, Noradrenalin, γ-Aminobuttersäure, Cholecystokinin und Neuropeptid Y, ausschütten können. Es existieren weiterhin Hinweise, dass Adenosintriphosphat eine wichtige Rolle in der Signalübertragung von der Sinneszelle auf die Nervenzelle spielt.[18]
Die Geschmacksinformationen werden bei Säugetieren über die drei Hirnnerven Nervus facialis (VII), Nervus glossopharyngeus (IX) und Nervus vagus (X) ins Gehirn geleitet. Dort findet die erste Verschaltung im rostralen Anteil des Nucleus tractus solitarii statt. Von dort gelangen die Geschmacksinformationen weiter in den Nucleus ventralis posteromedialis, Pars parvocellularis (VPMpc) des Thalamus. Bei Primaten geschieht dies durch eine direkte Projektion, bei Nagetieren hingegen gibt es mit dem Nucleus parabrachialis eine Zwischenstation auf dem Weg zum Thalamus. Der VPMpc des Thalamus projiziert seinerseits in den Inselcortex, in dem sich der primäre gustatorische Cortex befindet. Bereits hier findet eine Integration mit anderen Sinneseindrücken, vornehmlich Tast- und Temperaturinformationen, aus der Mundhöhle statt. Der sekundäre gustatorische Cortex, die nächsthöhere Station der Geschmacksverarbeitung, befindet sich im orbitofrontalen Cortex und überlappt teilweise mit dem sekundären olfaktorischen Cortex. Neben der hier geschilderten „Hauptroute“ existieren vielfache Abzweige auf jeder Ebene der Verarbeitung. Diese führen unter anderem zum Hypothalamus und zum limbischen System. Auch gibt es zahlreiche Verschaltungen von höheren zurück zu niedrigeren Ebenen.[1]
Sensorische Verarbeitung
Die Komplexität der gustatorischen Wahrnehmung wird durch ein kombinatorisches System von Repräsentationen im Gehirn erreicht, das eine detaillierte Analyse der Feinheiten eines Sinneseindrucks erlaubt. Dieses System unseres Nervensystems, die Vektorcodierung, kann als Darstellung in einem Merkmalsraum (bei sechs Grundgeschmacksarten ein sechsdimensionaler Raum) begriffen werden. Ein bestimmter Geschmack wird in diesem Raum durch ein Aktivierungsmuster aller sechs Rezeptortypen repräsentiert. Könnte die Zunge pro Grundgeschmack nur zehn Intensitätsstufen unterscheiden, so betrüge die Gesamtzahl an unterscheidbaren Aktivierungsmustern doch 106 = 1.000.000. Mit nur sechs verschiedenen Rezeptortypen könnte man also eine Million unterschiedliche Geschmacksrichtungen differenzieren. Aus einfachen Grundlagen erwächst kombinatorisch somit eine Vielzahl an Unterscheidungs- und Wahrnehmungsmöglichkeiten.
„schmecken“ als Wort im Sinne von „riechen“
Das Wort „schmecken“ stammt von mittelhochdeutsch smecken, in der Bedeutung von „riechen“ und „stinken“.[19] Das Deutsche Wörterbuch der Brüder Grimm gibt für die Bedeutung des Wortes schmecken eine im Althochdeutschen und Mittelhochdeutschen noch doppelte Beziehung an: „B.bedeutung.das verbum bezieht sich in älterer sprache sowol auf die geruchs- als die geschmacksempfindungen. die entwickelte nhd. schriftsprache hat die erste der beiden gebrauchsweisen aufgegeben, dagegen ist diese bewahrt in den oberdeutschen mundarten, zum theil sogar unter ausschlieszung der zweiten.“[20]
So kann mindestens im Sprachraum der alemannischen (Baden-Württemberg, Schweiz) und bairischen (Bayern, Österreich) Dialekte des Deutschen die Bezeichnung „schmecken“ gelegentlich zur Verwirrung führen, meinen die Sprecher dieser Dialekte mit „schmecken“ doch ein Begriffsfeld, das auch oder allein die Bedeutung ‚riechen‘ umfasst („durch die Nase schmecken“), im Unterschied zum Neuhochdeutschen. Ein älteres Beispiel für ein daraus resultierendes Missverständnis findet sich am Anfang des zweiten Teils des Romans Die Günderode der Bettina von Arnim (1840), wo von einem Herrn Arenswald erzählt wird, der eine Anzahl stinkender Schnecken gegessen habe, die man ihm als Schnecken angepriesen hatte, „die sehr schmecken“.
Bezüglich der Substantivform Geschmack und des mit diesem Wort bezeichneten semantischen Feldes bestehen – außerhalb der fachsprachlichen Verwendung – vergleichbare Verhältnisse,[21] die Missverständnisse möglich machen. Zu dem auch als „Geschmack“ bezeichneten komplexen Sinneseindruck bei der Nahrungsaufnahme trägt zumeist der Geruch einer Speise wesentlich bei.
Siehe auch
Literatur
- Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl: Physiologie. 7. Auflage, Thieme, Stuttgart 2014. ISBN 978-3-13-796007-2
- Stefano Mancuso, Carlo Petrini: Die Wurzeln des guten Geschmacks. Warum sich Köche und Bauern verbünden müssen. Übersetzung Christine Ammann. Antje Kunstmann, München, 2016. ISBN 978-3-95614-096-9
Weblinks
- Gustatorisches System und Geschmackssinn (PDF von anatomie.net; 1,2 MB)
Einzelnachweise
- D. V. Smith, J. D. Boughter jr: Neurochemistry of the Gustatory System. In: A. Lajtha and D. A. Johnson (Hrsg.): Handbook of Neurochemistry and Molecular Neurobiology. Springer US, 2007, S. 109–135, ISBN 978-0-387-30349-9.
- J. Chandrashekar et al.: The receptors and cells for mammalian taste. In: Nature. 444, Nr. 7117, 2006, ISSN 1476-4687, S. 288–294.
- F. Laugerette et al.: CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions. In: J Clin Invest. 115, Nr. 11, 2005, ISSN 0021-9738, S. 3177–3184 PMC 1265871 (freier Volltext).
- siehe Schmeckt uns Fett? Artikel in Spektrum der Wissenschaft, Abgerufen am 6. September 2016.
- B. Lindemann u. a.: The Discovery of Umami. In: Chemical Senses. Bd. 27, Nr. 9, 2002, ISSN 1464-3553, S. 834–844. (PDF; 50 kB). Abgerufen am 7. September 2016.
- T. Ohsu, Y. Amino, H. Nagasaki, T. Yamanaka, S. Takeshita, T. Hatanaka, Y. Maruyama, N. Miyamura, Y. Eto: Involvement of the calcium-sensing receptor in human taste perception. In: Journal of Biological Chemistry. Band 285, Nummer 2, Januar 2010, S. 1016–1022, doi:10.1074/jbc.M109.029165, PMID 19892707, PMC 2801228 (freier Volltext).
- B. Lindemann: Receptors and transduction in taste. In: Nature. Nr. 413, 2001, ISSN 0028-0836, S. 219–225, PMID 11557991.
- A. El-Yassimi et al.: Linoleic Acid Induces Calcium Signaling, Src Kinase Phosphorylation, and Neurotransmitter Release in Mouse CD36-positive Gustatory Cells. In: J Biol Chem. 283, Nr. 19, 2008, ISSN 1083-351X, S. 12949–12959, doi:10.1074/jbc.M707478200.
- Jessica E. Stewart, Christine Feinle-Bisset, Matthew Golding, Conor Delahunty, Peter M. Clifton, Russell S. J. Keast: Oral sensitivity to fatty acids, food consumption and BMI in human subjects. In: British Journal of Nutrition. 104, 2010, S. 145–152, doi:10.1017/S0007114510000267.
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg 2008, ISBN 978-3-540-73201-3, doi:10.1007/978-3-540-73202-0.
- Yoshie Kurihara: Characteristics of antisweet substances, sweet proteins, and sweetness‐inducing proteins. In: Critical Reviews in Food Science and Nutrition. Band 32, Nr. 3, 1992, S. 231–252, doi:10.1080/10408399209527598.
- M. Behrens, W. Meyerhof: Bitter taste receptors and human bitter taste perception. In: Cellular and molecular life sciences 63, 2006, S. 1501–1509. doi:10.1007/s00018-006-6113-8.
- Deepak A Deshpande, Wayne C H Wang, Elizabeth L McIlmoyle, Kathryn S Robinett et al.: Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction. In: Nature Medicine. 16, 2010, S. 1299, doi:10.1038/nm.2237.
- Stephen D. Roper: Signal transduction and information processing in mammalian taste buds. In: Pflügers Arch Bd. 454, Nr. 5, 2007, S. 759–776. doi:10.1007/s00424-007-0247-x. PMID 17468883.
- Vgl. etwa M. Max et al.: Tas1r3, encoding a new candidate taste receptor, is allelic to sweet resppnsiviness locus Sac. In: Nature Genetics. 1, 28. Mai 2001, S. 58–63, und J. Montmayeuer et al.: A candidate taste receptor gene near a sweet taste locus. In: Nature Neuroscience. Band 4, Nr. 5, 2001, S. 492–298.
- Michael G. Tordoff, Hongguang Shao, Laura K. Alarcón, Robert F. Margolskee, Bedrich Mosinger, Alexander A. Bachmanov, Danielle R. Reed, and Stuart McCaughey: Involvement of T1R3 in calcium-magnesium taste. In: Physiological Genomics. Band 34, 2008, S. 338–348, doi:10.1152/physiolgenomics.90200.2008, PMID 18593862 (physiology.org [abgerufen am 30. Dezember 2009]).
- C. E. Riera, H. Vogel u. a.: Sensory attributes of complex tasting divalent salts are mediated by TRPM5 and TRPV1 channels. In: The Journal of neuroscience : the official journal of the Society for Neuroscience. Band 29, Nummer 8, Februar 2009, S. 2654–2662, doi:10.1523/JNEUROSCI.4694-08.2009, PMID 19244541.
- Yi-Jen Huang et al.: The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds. In: PNAS Bd. 104, Nr. 15, 2007, ISSN 1091-6490, S. 6436–6441 (PDF; 2,3 MB) PMID 17389364
- Jürgen Martin: Die ‚Ulmer Wundarznei‘. Einleitung – Text – Glossar zu einem Denkmal deutscher Fachprosa des 15. Jahrhunderts. Königshausen & Neumann, Würzburg 1991 (= Würzburger medizinhistorische Forschungen. Band 52), ISBN 3-88479-801-4 (zugleich Medizinische Dissertation Würzburg 1990), S. 173.
- Brüder Grimm: Deutsches Wörterbuch, nach Das Deutsche Wörterbuch retrodigitalisiert von Uni Trier; Eintrag unter SCHMECKEN
- Grimm, nach Das Deutsche Wörterbuch retrodigitalisiert von Uni Trier; Eintrag unter GESCHMACK.