GLUT-1
GLUT-1, auch Erythrozyten/Hirn-Hexose-Facilitator (Gen: SLC2A1), ist ein Transportprotein in der Zellmembran der β-Zellen des Pankreas, Zellen der Blut-Hirn-Schranke von Säugetieren und vieler andere Gewebetypen, welches den Transport von Glucose, aber auch anderer Pentosen und Hexosen, sowie Vitamin C über die Zellmembran ermöglicht.[2]
| GLUT-1 | ||
|---|---|---|
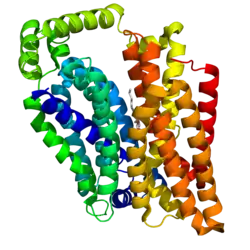 | ||
| Bändermodell vom menschlichen Glucosetransporter GLUT-1 mit β-Nonylglucosid als Ligand, nach PDB 4PYP | ||
|
Vorhandene Strukturdaten: 5EQI | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 492 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer; multipass (12 TMS) Membranprotein | |
| Bezeichner | ||
| Gen-Namen | SLC2A1 ; GLUT1 | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 2.A.1.1.28 | |
| Bezeichnung | Major-Facilitator-Superfamilie / Glucosetransporter | |
| Vorkommen | ||
| Übergeordnetes Taxon | Säugetiere[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 6513 | 20525 |
| Ensembl | ENSG00000117394 | ENSMUSG00000028645 |
| UniProt | P11166 | P17809 |
| Refseq (mRNA) | NM_006516 | NM_011400 |
| Refseq (Protein) | NP_006507 | NP_035530 |
| Genlocus | Chr 1: 42.93 – 42.96 Mb | Chr 4: 119.11 – 119.14 Mb |
| PubMed-Suche | 6513 | 20525 |
Mutationen im SLC2A1-Gen können das GLUT1-Defizit-Syndrom hervorrufen.[3][4]
Funktion
GLUT-1 kommt in den meisten Gewebetypen vor, es ermöglicht die Glucoseversorgung unabhängig von Insulin.
Im zentralen Nervensystem ist es unentbehrlich für die Glucoseaufnahme, ebenso transportiert es Glucose über die Membran von β-Zellen des humanen Pankreas.[5][6]
Die Transportgleichung lautet:[7]
- Solutaußen ⇔ Solutinnen
Es handelt sich also um einen Uniport. Bevorzugte Solute sind D-Glucose, Dehydroascorbinsäure, Quercetin. Über einen parallelen Kanal kann gleichzeitig Wasser diffundieren. Für den Glucosetransport wurde ein rutschender Prozess über mehrere Bindungsstellen hinweg vorgeschlagen. Das Umschalten auf Dehydroascorbat-Transport in Erythrozyten erfolgt mittels des Membranproteins Stomatin und dieser Prozess kommt nur in denjenigen Säugetieren vor, die nicht selbst Ascorbinsäure bilden können.[8][9]
Medizinische Bedeutung
In Tiermodellen von Diabetes mellitus ist die Expression von GLUT1 in Herzmuskelgewebe und in Gefäßen der Netzhaut (Retina) vermindert. Patienten mit Diabetes mellitus Typ 2 weisen in Skelettmuskelzellen eine verminderte Expression von GLUT1 und eine verminderte Glucoseaufnahme auf. Im Gegensatz dazu findet man bei Diabetikern in der Mesangiumzelle des Nierenkörperchens eine erhöhte Expression von GLUT1. Dies bewirkt in der Niere eine vermehrte Glucoseaufnahme und eine überschießende Aktivierung glucoseabhängiger Stoffwechselwege. Dies führt letztendlich zu einer erhöhten Bildung von TGF-β. Diese Hochregulation von TGF-β fördert die überschießende Produktion extrazellulärer Matrix, welche als eine mögliche Ursache der diabetischen Nierenschädigung angesehen wird. Zudem fördert TGF-β wiederum die Expression von GLUT1 und unterhält so den Pathomechanismus.
Ein erhöhter Druck in den Kapillaren des Nierenkörperchens oder ein Anstieg von Angiotensin II fördert ebenfalls die Expression von GLUT1 in der Niere. Möglicherweise ist dieser Mechanismus eine Ursache der durch Bluthochdruck oder Fettsucht verursachten Nierenschädigung (Nephrosklerose).[10]
Ein angeborener Defekt des SLC2A1-Gens kann zu GLUT1-Mangel führen (GLUT1-Defizit-Syndrom). Es führt aufgrund einer mangelnden Versorgung des Gehirns mit Glucose als einzigem Brennstoff zu einer deutlichen Verzögerung der körperlichen und geistigen Entwicklung, einer Epilepsie und einem im Wachstum zurückbleibendem Kopfumfang (erworbener Mikrozephalus), in etwa der Hälfte der betroffenen Kinder auch zu einer Gleichgewichtsstörung (Ataxie) und einer verminderten Muskelkraft (muskuläre Hypotonie).[11]
GLUT-1 ist eine Andockstelle für das HTLV.[12][13] Varianten von GLUT-1 sind assoziiert mit diabetischer Nephropathie bei Diabetes mellitus.[14] GLUT-1 wird in mehreren Krebszelllinien überexprimiert.[15][16]
Regulation
Bei der Regulation der Glucoseaufnahme sowie der Expression von GLUT-1 ist offensichtlich GSK-3 involviert, via Modulation durch TSC2 und mTOR.[17]
Weblinks
Einzelnachweise
- InterPro: IPR002439 Glucose transporter, type 1 (GLUT1) (Memento vom 25. Mai 2008 im Internet Archive)
- Löffler, Petrides: Biochemie und Pathobiochemie. Hrsg.: Lutz Graeve. 9. Auflage. Springer, 2014, ISBN 978-3-642-17972-3, S. 199–200.
- UniProt P11166
- Suls A, Dedeken P, Goffin K, et al: Paroxysmal exercise-induced dyskinesia and epilepsy is due to mutations in SLC2A1, encoding the glucose transporter GLUT1. In: Brain. 131, Nr. Pt 7, Juli 2008, S. 1831–44. doi:10.1093/brain/awn113. PMID 18577546. PMC 2442425 (freier Volltext).
- Löffler/Petrides "Biochemie und Pathobiochemie" 9.Auflage, S. 445
- K. T. Coppieters, A. Wiberg, N. Amirian, T. W. Kay, M. G. von Herrath: Persistent glucose transporter expression on pancreatic beta cells from longstanding type 1 diabetic individuals. In: Diabetes/metabolism research and reviews. Band 27, Nummer 8, November 2011, S. 746–754, doi:10.1002/dmrr.1246, PMID 22069254.
- TCDB: 2.A.1
- Cunningham P, Afzal-Ahmed I, Naftalin RJ: Docking studies show that D-glucose and quercetin slide through the transporter GLUT1. In: J. Biol. Chem.. 281, Nr. 9, März 2006, S. 5797–803. doi:10.1074/jbc.M509422200. PMID 16407180.
- Montel-Hagen A, Kinet S, Manel N, et al: Erythrocyte Glut1 triggers dehydroascorbic acid uptake in mammals unable to synthesize vitamin C. In: Cell. 132, Nr. 6, März 2008, S. 1039–48. doi:10.1016/j.cell.2008.01.042. PMID 18358815.
- Luigi Gnudi et al.: Mechanical Forces in Diabetic Kidney Disease: A Trigger for Impaired Glucose Metabolism. In: J Am Soc Nephrol. Nr. 18, 2007, S. 2226–2232 (Abstract).
- Kepler et al.: Angeborene Störungen des Glucosetransports. In: Monatsschrift Kinderheilkunde 2000 148:2–11
- Manel N, Kim FJ, Kinet S, Taylor N, Sitbon M, Battini JL: The ubiquitous glucose transporter GLUT-1 is a receptor for HTLV. In: Cell. 115, Nr. 4, November 2003, S. 449–59. PMID 14622599.
- Afonso PV, Ozden S, Cumont MC, et al: Alteration of blood-brain barrier integrity by retroviral infection. In: PLoS Pathog.. 4, Nr. 11, November 2008, S. e1000205. doi:10.1371/journal.ppat.1000205. PMID 19008946. PMC 2575404 (freier Volltext).
- Makni K, Jarraya F, Rebaï M, et al: Risk genotypes and haplotypes of the GLUT1 gene for type 2 diabetic nephropathy in the Tunisian population. In: Ann. Hum. Biol.. 35, Nr. 5, 2008, S. 490–8. doi:10.1080/03014460802247142. PMID 18821326.
- Ahrens WA, Ridenour RV, Caron BL, Miller DV, Folpe AL: GLUT-1 expression in mesenchymal tumors: an immunohistochemical study of 247 soft tissue and bone neoplasms. In: Hum. Pathol.. 39, Nr. 10, Oktober 2008, S. 1519–26. doi:10.1016/j.humpath.2008.03.002. PMID 18620729.
- Li J, Yang SJ, Zhao XL, et al: [Significant increase of glucose transport activity in breast cancer]. In: Zhonghua Bing Li Xue Za Zhi. 37, Nr. 2, Februar 2008, S. 103–8. PMID 18681321.
- Buller CL, Loberg RD, Fan MH, et al: A GSK-3/TSC2/mTOR pathway regulates glucose uptake and GLUT1 glucose transporter expression. In: Am. J. Physiol., Cell Physiol.. 295, Nr. 3, September 2008, S. C836–43. doi:10.1152/ajpcell.00554.2007. PMID 18650261.