Prolin
L-Prolin, abgekürzt Pro oder P, [systematischer Name: (S)-Pyrrolidin-2-carbonsäure] ist eine nichtessentielle proteinogene heterocyclische sekundäre α-Aminosäure und wird wegen seiner Biosynthese aus Pyrrolin-2-carbonsäure [genauer: (S)-3,4-Dihydro-2H-pyrrol-2-carbonsäure] manchmal fälschlich als Iminosäure (eine heute obsolete Klassifizierung) bezeichnet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
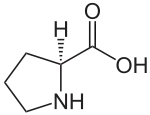 | ||||||||||||||||
| Strukturformel von natürlich vorkommendem L-Prolin | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Prolin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H9NO2 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit aminartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 115,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,35–1,38 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Stereoisomerie
In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Prolin [Synonym: (S)-Prolin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Prolin [Synonym: (R)-Prolin]. Racemisches DL-Prolin [Synonyme: (RS)-Prolin bzw. (±)-Prolin] hat nur geringe Bedeutung.
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Prolin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Prolin gemeint.
| Isomere von Prolin | ||
| Name | L-Prolin | D-Prolin |
| Andere Namen | (S)-Prolin | (R)-Prolin |
| Strukturformel |  | 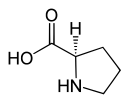 |
| CAS-Nummer | 147-85-3 | 344-25-2 |
| 609-36-9 (DL) | ||
| EG-Nummer | 205-702-2 | 206-452-7 |
| 210-189-3 (DL) | ||
| ECHA-Infocard | 100.005.185 | 100.005.866 |
| 100.009.264 (DL) | ||
| PubChem | 145742 | 8988 |
| 614 (DL) | ||
| DrugBank | DB00172 | – |
| – (DL) | ||
| Wikidata | Q20035886 | Q20035962 |
| Q484583 (DL) | ||
Geschichte
Der Name Prolin stammt von Emil Fischer und leitet sich vom Pyrrolidin ab.
Vorkommen
Innerhalb von Proteinen kommt es sowohl in cis- als auch in trans-gebundener Konfiguration vor. L-Prolin hat erheblichen Einfluss auf die Faltung von Proteinen, da es wie Glycin aufgrund der häufig vorkommenden cis-Peptidbindung α-Helices und β-Faltblätter unterbrechen kann. Es kann auch eigene Motive bilden, die häufig als Signalsequenz für andere Proteine wirken.
Biosynthese
Für die Biosynthese inklusive Strukturformeln siehe Abschnitt Weblinks
L-Prolin wird biochemisch aus L-Glutamat hergestellt. Hierfür werden insgesamt ein Molekül ATP sowie zwei Moleküle Reduktionsäquivalente in Form von NADPH benötigt.
L-Prolin ist die Vorstufe des L-Hydroxyprolins, das unter Beteiligung des Vitamins C nach Einbau in Kollagen entsteht und dessen mechanischen Eigenschaften bestimmt (Mangelerkrankung: Skorbut). Katalysiert durch eine Hydroxylase werden Prolylreste, je nach ihrer Position im Protein, entweder am β- oder am γ-Atom des Tetrahydropyrrolringes modifiziert.
Eigenschaften
Prolin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert. Die Zersetzungstemperatur liegt bei >185 °C.[1]
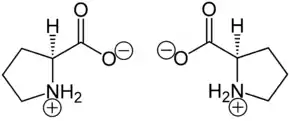
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (einem bestimmten pH-Wert) der Fall, bei dem das Prolin auch seine geringste Löslichkeit in Wasser hat.
Dadurch, dass das Stickstoffatom des Prolins in der Peptidgruppe nicht mit einem H-Atom verbunden ist, kann keine Wasserstoffbrückenbindung ausgebildet werden. An solchen Stellen einer Polypeptidkette tritt eine Störung der Sekundärstruktur (Knick oder Krümmung) auf.[3]
Weitere Eigenschaften:
- Seitenkette: hydrophob
- Isoelektrischer Punkt: pH = 6,30[4]
- Van-der-Waals-Volumen: 90 Å3 [5]
- Lipidlöslichkeit: LogP = −1,6[5]
Funktionen
L-Prolin wird im menschlichen Körper z. B. für die Bildung von Kollagen, dem Protein, aus dem Bindegewebe und Knochen bestehen, benötigt. Ferner wird es als „Helixbrecher“ bezeichnet und findet sich oft am Übergang einer Alpha-Helix zu einer anderen Sekundärstruktur (häufig Random Coil) wieder. Prolin ist nämlich die einzige Aminosäure, deren Peptidbindung kein Wasserstoffatom aufweist. Folglich kann es sich nicht an der Bindung von Wasserstoffbrückenbindungen beteiligen. L-Prolin wird in der Ökotoxikologie als Biomarker verwendet, z. B. für Trockenstress, Salzstress, da es von Pflanzen vermehrt produziert wird, wenn der Wasserhaushalt unter Stress gerät. L-Prolin als zyklische Aminosäure wirkt als Puffer gegen manche Ionen, die ansonsten die Enzymtätigkeiten im Cytoplasma einschränken könnten.
Chemische Verwendung
Enantiomerenreines Prolin ist als Element des chiralen Pools Ausgangssubstanz für die Synthese des Evans-Auxiliars, des CBS-Reagenz, des Enders-Reagenzes (RAMP/SAMP) und ist ein vielbenutzter Katalysator in der Organokatalyse. Die Literatur über die Verwendung von (S)- oder (R)-Prolin und deren Derivate in der stereoselektiven Synthese ist umfangreich.[6] Ein L-Prolin-Derivat dient als chiraler Selektor in der enantioselektiven Dünnschichtchromatographie.[7] Der therapeutisch und wirtschaftlich bedeutende Arzneistoff Captopril wird aus L-Prolin synthetisiert.
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2.
- Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2.
- Jesse Philip Greenstein und Milton Winitz: Chemistry of Amino Acids, John Wiley & Sons, 1962, Bände 1 bis 3, ISBN 0-471-32637-2.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Production and Utilization of Amino Acids, Angewandte Chemie International Edition in English, 17 (1978), S. 176–183.
- Karlheinz Drauz, Axel Kleemann und Jürgen Martens: Induktion von Asymmetrie durch Aminosäuren, Angewandte Chemie 94 (1982), S. 590–613; Angewandte Chemie – International Edition English 21 (1982), S. 584–608.
- Jürgen Martens: Asymmetric Syntheses with Amino Acids, Topics in Current Chemistry / Fortschritte der Chemischen Forschung 125 (1984), S. 165–246.
- Jürgen Martens: Induktion von Asymmetrie durch Iminosäuren, Chemiker-Zeitung 110 (1986), S. 169–183.
- Gary M. Coppola und Herbert F. Schuster: Asymmetric Synthesis − Construction of chiral Molecules using Amino Acids, Wiley, New York 1987, S. 267–345.
- Peter I. Dalko: Do We Need Asymmetric Organocatalysis?, Chimia 61 (2007), S. 213–218.
- Kurt Günther, Jürgen Martens und Maren Schickedanz: Dünnschichtchromatographische Enantiomerentrennung mittels Ligandenaustausch, Angewandte Chemie 96 (1984), S. 514–515; Angewandte Chemie – International Edition English 23 (1984), S. 506.
- Kurt Günther, Maren Schickedanz und Jürgen Martens: Thin-Layer Chromatographic Enantiomeric Resolution, Naturwissenschaften 72 (1985), S. 149–150.
- Kurt Günther, Jürgen Martens und Maren Schickedanz: Resolution of Optical Isomers by Thin-Layer Chromatography (TLC). Enantiomeric Purity of L-DOPA, Fresenius Zeitschrift für Analytische Chemie 322 (1985), S. 513–514.
- J. Behre, R. Voigt, I. Althöfer, S. Schuster: On the evolutionary significance of the size and planarity of the proline ring. Naturwissenschaften 99 (2012) 789–799.
Weblinks
Einzelnachweise
- Datenblatt Prolin (PDF) bei Merck, abgerufen am 23. Dezember 2019.
- F. A. Carey: Organic Chemistry, 5th edition, The McGraw Companies 2001, S. 1059, Link
- Nicolai Marroquin: Molekulargenetische Untersuchung des FGF8-Gens bei Patienten mit Erkrankungen aus dem Formenkreis der kongenitalen kranialen Dysinnervationsstörungen(CCDDs). GRIN Verlag, 2011, ISBN 978-3-656-01631-1. S. 36 (eingeschränkte Vorschau in der Google-Buchsuche).
- P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- Catherine H. Wu, Jerry Wayne McLarty: Neural Networks and Genome Informatics. Elsevier, 2000, ISBN 978-0-08-042800-0. S. 70 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ausgewählte Übersichtsartikel:
(a) Dieter Seebach, Albert K. Beck, D. Michael Badine, Michael Limbach, Albert Eschenmoser, Adi M. Treasurywala, Reinhard Hobi, Walter Prikoszovich und Bernhard Linder: Are Oxazolidinones really unproductive, parasitic species in proline catalysis? Thoughts and experiments pointing to an alternative view, In: Helvetica Chimica Acta 90 (2007), S. 425–471.
(b) Santanu Mukherjee, Jung Woon Yang, Sebastian Hoffmann und Benjamin List: Asymmetric enamine catalysis, In: Chemical Reviews 107 (2007), S. 5471–5569.
(c) Peter Diner, Anne Kjaersgaard, Mette Alstrup Lie und Karl Anker Jørgensen: On the origin of the stereoselectivity in organocatalysed reactions with trimethylsilyl-protected diarylprolinol, In: Chemistry – A European Journal 14, (2008), S. 122–127.
(d) Yujiro Hayashi, Hiroaki Gotoh, Ryouhei Masui und Hayato Ishikawa: Diphenylprolinol silyl ether as a catalyst in an enantioselective, catalytic, formal aza [3+3] cycloaddition reaction for the formation of enantioenriched piperidines, In: Angewandte Chemie-International Edition 47 (2008), S. 4012–4015.
(e) Hiyoshizo Kotsuki, Hideaki Ikishima und Atsushi Okuyama: Organocatalytic asymmetric synthesis using proline and related molecules. Part 1, In: Heterocycles 75 (2008), S. 493–529.
(f) Antonia Mielgo und Claudio Palomo: α,α-Diarylprolinol ethers: New tools for functionalization of carbonyl compounds, In: Chemistry – An Asian Journal 3 (2008), S. 922–948. - Kurt Günther, Peter Richter und Klaus Möller: Separation of Enantiomers by Thin-Layer Chromatography, Seiten 29–59 in Methods in Molecular Biology™– Chiral Separations, 243 (2004), Springer Verlag, ISBN 978-1-58829-150-9.