Tautomerie
Die Tautomerie (von gr. tautó „das Gleiche“ und meros „Anteil“) bezeichnet in der Chemie eine besondere Form der Isomerie. Sie wurde 1876 von Alexander Michailowitsch Butlerow (1828–1886) entdeckt und 1885 von Conrad Peter Laar als Begriff eingeführt.
| Übersicht | |||
|---|---|---|---|
| A–X–Y=Z mit A = H+ | X=Y–Z–A | Prototropie | |
| H–C–C=O | C=C–O–H | Keto-Enol | |
| H–C–N=O | C=N–O–H | Nitro-Acinitro | Nitroso-Oxim |
| H–C–N=N | C=N–N–H | Azo-Hydrazo | Hydrazo-Azo |
| H–N–C=O | N=C–O–H | Amid-Imidsäure | Lactam-Lactim |
| H–C–C=N | C=C–N–H | Imin-Enamin | |
| Ring-Ketten-Tautomerien | |||
| A–X–Y=Z mit A = OH− | Anionotropie | ||
| HO–C–C=C | C=C–C–OH | (siehe unten) | |
| A–X–Y | X–Y–H | dyadische Tautomerie | |
Wenn Moleküle zwar die gleiche Summenformel besitzen, aber die einzelnen Atome unterschiedlich verknüpft sind, spricht man von Konstitutionsisomeren. Als Tautomere bezeichnet man Isomere, die durch die Wanderung einzelner Atome oder Atomgruppen schnell ineinander übergehen, d. h. die beiden Isomere in einem dynamischen chemischen Gleichgewicht miteinander stehen.[1][2] Aufgrund des schnellen Gleichgewichts lassen sich die einzelnen Tautomere oft nicht isolieren; das Mengenverhältnis der Tautomere untereinander ist konstant.
Tautomere unterscheiden sich oft in der Stellung einer Gruppe und in der Stellung einer Doppelbindung:
Als wandernde Gruppe kommen einwertige Kationen wie das Proton oder einwertige Anionen wie Chlorid-, Hydroxid- oder Acetat-Ionen in Frage. Wird eine Doppelbindung durch eine Ringbildung aus Einfachbindungen ersetzt, spricht man von der Ring-Ketten-Tautomerie.[3]
Die Tautomerie darf dabei nicht mit der Mesomerie verwechselt werden, bei der lediglich dasselbe Molekül durch verschiedene Grenzformeln beschrieben wird.
Prototropie
Bei der Prototropie wechselt ein Proton seinen Platz im Molekül:[3]
Keto-Enol-Tautomerie
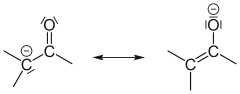
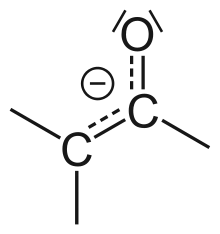
Die häufigste Form der Tautomerie ist die Keto-Enol-Tautomerie. Wegen der Polarisierung der C–O-Doppelbindung durch die große Elektronegativität des Sauerstoffs und der Möglichkeit, die negative Ladung nach der Deprotonierung über drei Atome zu delokalisieren, können Protonen am α-C-Atom der Carbonylgruppe leicht abgespalten werden. Eine Reprotonierung des Enolat-Ions am Sauerstoff führt zum Enol. Diese Tautomerisierung kann durch Basen, welche die Abspaltung des Protons unterstützen, oder durch Säuren, welche durch Protonierung des Carbonylsauerstoffs die Polarisierung der C–O-Bindung verstärken, katalysiert werden.
| Keto-Enol-Tautomerie | |||||
|---|---|---|---|---|---|
 |
  |
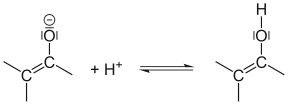 | |||
| Abspaltung eines Protons: Das α-C-Atom gibt in basischer Lösung ein Proton ab. | Dieses Carbanion ist mesomeriestabilisiert: Mesomeriestabilisierung des Enolat-Anions. | Bindet sich das Proton an den negativierten Sauerstoff, entsteht das Enol: Anlagerung des Protons an das Enolat-Anion. | |||
| Carbonylverbindung | Enolform in % |
|---|---|
| Propanon (Aceton) | 0,00025 |
| Butan-2,3-dion (Diacetyl) | 0,0056 |
| Cyclohexanon | 0,02 |
| Ethyl-3-oxobutyrat (Acetessigester) | 8 |
| Pentan-2,4-dion (Acetylaceton) | 80 |
| einwertige Phenole | 100 |
Das Gleichgewicht liegt in der Regel auf der Seite der Ketoform. So beträgt der Anteil der Enol-Form im Aceton nur 0,00025 %. Beim Pentan-2,4-dion (Trivialname Acetylaceton) dagegen überwiegt im Gleichgewicht die Enolform. Phenole liegen vorwiegend in der Enolform vor, da die Bildung der Ketoform (Beispiel: chinoide Struktur) das aromatische System aufhebt.
Beispiel: Ethanal und Ethenol befinden sich in Lösung in einem tautomeren Gleichgewicht, das Gleichgewicht liegt allerdings deutlich auf der Seite des Ethanals. Es liegt sowohl Bindungsisomerie (C=C / C=O) als auch funktionelle Isomerie (–CH=O / –C–OH) vor.
| Ethanal-Ethenol-Tautomerie |
|---|
 |
Aus der Lage des Gleichgewichts lässt sich nicht auf die Reaktivität schließen. Oft ist die Enol-Form erheblich reaktiver als die Keto-Form. Weil diese aber aufgrund des sich schnell einstellenden Gleichgewichtes ständig nachgebildet wird, beobachtet man makroskopisch ausschließlich die Reaktivität des Enols (siehe Prinzip von Le Chatelier).
Sehr schön lässt sich dies bei der Reaktion von Aceton mit Brom zeigen. Nach Zugabe eines Tropfens Brom verschwindet dessen Farbe zunächst langsam, dann immer schneller, da durch das entstandene HBr die Einstellung des Keto-Enol-Gleichgewichts stark beschleunigt wird. Bei weiterer Bromzugabe erfolgt die Entfärbung unter Bildung von Bromaceton fast augenblicklich.
Ketol-Endiol-Tautomerie
α-Hydroxy-Ketone (Acyloine) weisen eine besondere Form der Keto-Enol-Tautomerie auf.
1. Das 2-Hydroxy-propanal weist am α-C-Atom (dem 2. C-Atom) eine Hydroxygruppe auf. Diese polarisiert zusätzlich durch ihren negativen induktiven Effekt die C-H-Bindung am α-C-Atom und erleichtert damit die Abspaltung eines Protons. Es entsteht ein Endiol als ein Molekül mit einer Doppelbindung und zwei (-di-) benachbarten Hydroxygruppen. Durch Umlagerung eines Protons kann dieses wieder in ein Molekül mit einem Carbonylsauerstoff übergehen, in diesem Fall ein Keton.
| Hydroxypropanal-Propendiol-Hydroxypropanon-Tautomerie |
|---|
 Ketol-Endiol-Tautomerie |
Hier liegt zusätzlich Stellungsisomerie vor, da sich das 2-Hydroxy-propanal und das 1-Hydroxypropanon nur in den Positionen der Hydroxy- und der Carbonyl-Gruppe unterscheiden.
2. Wird im Beispiel des Propanals die Methylgruppe durch eine Kohlenwasserstoffkette mit vier C-Atomen und je vier Hydroxygruppen ersetzt, liegt eine Aldohexose vor, die über die Endiol-Form mit der Ketohexose in wässriger Lösung im Gleichgewicht vorliegt. So befinden sich in wässriger Lösung die epimere Glucose und Mannose als Aldohexosen mit der Ketohexose Fructose im Gleichgewicht (Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung). Die bisher angenommene Erklärung, dass die positive Fehling-Probe bei Fructose auch auf eine Keto-Enol-Tautomerie zurückzuführen ist, wurde mittlerweile widerlegt[4]. Doch stellen Endiole (bzw. deren Anionen, wie sie in der alkalischen Fehling-Lösung entstehen) selbst starke Reduktionsmittel dar, die zu 1,2-Diketonen dehydriert werden. Beispielsweise wirken auch Benzoin und Acetoin (3-Hydroxybutanon-2) stark reduzierend. In der Glycolyse wird die Umwandlung von Glucose-6-phosphat in Fructose-6-phosphat durch das Enzym Glucose-Phosphat-Isomerase, in einem späteren Schritt der Glycolyse die Reaktion des Glycerinaldehyd-3-phosphats zu Dihydroxyacetonphosphat durch das Enzym Triosephosphat-Isomerase katalysiert.
Weitere Beispiele: Ribose und Arabinose als Aldopentosen stehen mit der Ketopentose Ribulose im tautomeren Gleichgewicht.
3. Auch die Epimerisierung ist eine Tautomerisierung: In wässriger Lösung wandeln sich Epimere, das sind Aldosen, die sich nur durch die Stellung der Hydroxygruppe am 2. C-Atom unterschieden, ineinander um. Beispiele für Epimeren-Paare: Glucose / Mannose, Ribose / Arabinose, Erythrose / Threose, D-Glycerinaldehyd / L-Glycerinaldehyd
Siehe auch: Ketol-Endiol-Tautomerie bei Phloroglucin, Reduktone.
Nitro-aci-Nitro-Tautomerie
Verbindungen mit einer Nitro-Gruppe stehen in saurer Lösung mit ihrer aci-Form im Gleichgewicht. Dabei liegt das Gleichgewicht in der Regel auf der Seite der Nitroverbindung.
| Nitro-aci-Nitro-Tautomerie |
|---|
 |
| Nitroethan: Tautomerie der Nitrogruppe |
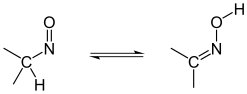
Nitroso-Oxim-Tautomerie
Verbindungen mit einer Nitroso-Gruppe stehen in saurer Lösung mit ihrer Oxim-Form im Gleichgewicht. Dabei liegt das Gleichgewicht in der Regel zu 100 % auf der Seite des Oxims.
| Nitroso-Oxim-Tautomerie |
|---|
 |
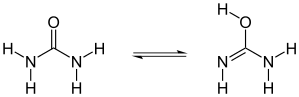
Amid-Imidsäure-Tautomerie
Die Imidsäuren sind Tautomere der Amide.[5]
| Amid-Imid-Tautomerie | ||
|---|---|---|
 |
 |
 |
| Tautomerie Amid / Imidsäure | Tautomerie des Harnstoffs | Tautomerie der Hydroxamsäure |
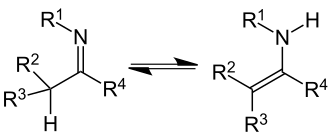
Imin-Enamin-Tautomerie
| Imin-Enamin-Tautomerie | |
|---|---|
 |
 |
| Imin-Enamin-Tautomerie | Ein Beispiel für eine cyclische und doppelte Imin-Enamin-Tautomerie stellt das Histidin dar. |
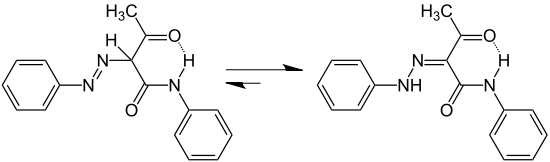
Azo-Hydrazo-Tautomerie
Azoverbindungen mit einem enolisierbaren Wasserstoffatom am α-Kohlenstoffatom neben der Azo-Gruppe stehen im Gleichgewicht mit der Hydrazo-Form. Dabei liegt das Gleichgewicht in der Regel vorwiegend auf der Seite der Hydrazo-Form.
| Azo-Hydrazo-Tautomerie |
|---|
 |
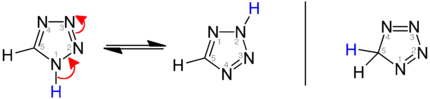
Tautomerie bei Tetrazolen
Tautomeres Gleichgewicht der heteroaromatischen 1H-Tetrazole und 2H-Tetrazole im Vergleich mit 5H-Tetrazol (rechts):
| Tetrazol-Tautomerie |
|---|
 |
Lactam-Lactim-Tautomerie
| Lactam-Lactim-Tautomerie | ||
|---|---|---|
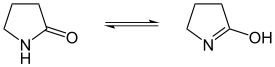 |
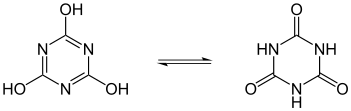 |
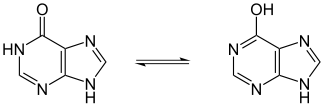 |
| Tautomerie eines Lactams | Tautomerie der Cyanursäure | Tautomerie des Hypoxanthins (ein Purin) |
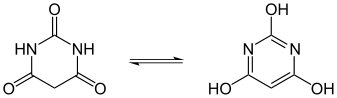 |
 |
Guanin hat in Position 2 zusätzlich eine NH2-Gruppe, Harnsäure in Position 2 und 8 jeweils ein OH-Gruppe |
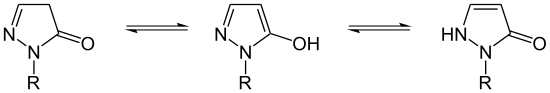
| Tautomerie der Barbitursäure (ein Pyrimidin) | Tautomerie von Dihydropyrazolonen | |
Thiolactam-Thiolactim-Tautomerie
| Thiolactam-Thiolactim-Tautomerie |
|---|
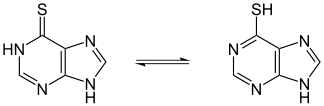 |
| Tautomerie des 6-Purinthiols: 6-Thioguanin hat in Position 2 zusätzlich eine NH2-Gruppe |
Oxy-Cyclo-Tautomerie
Bei langkettigen Oxo-Verbindungen könnte sich cyclo-Ether bilden. Beispiel ist die Halbacetal-Cyclo-Tautomerie. Halbacetale entstehen in einer Additionsreaktion von Alkoholen an Carbonylverbindungen. Enthält ein Molekül eine Hydroxygruppe, die weit genug von der Carbonyl-Gruppe entfernt ist, kann es durch eine Reaktion innerhalb des Moleküls zum Ringschluss kommen. Dabei erhält der Carbonylsauerstoff das Proton der Hydroxygruppe und wird dadurch selbst zur Hydroxygruppe. Der Ringschluss erfolgt durch die Bildung einer Bindung zwischen dem negativ polarisierten Sauerstoff der entfernten Hydroxygruppe und dem positiv polarisierten Kohlenstoff der Carbonylgruppe. Zwischen der offenkettigen Aldhehyd- oder Ketoform und der Ringform liegt in wässriger Lösung ein Gleichgewicht vor. Dies ist bei allen Aldo- und Keto-Pentosen und -Hexosen in wässriger Lösung der Fall.
| Oxy-Cyclo-Tautomerie | |
|---|---|
 |
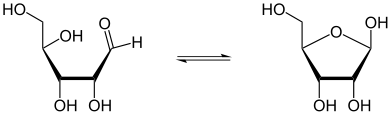 |
| Cyclo-Acetal-Gleichgewicht | Tautomerie der Ribose |
Tropanol-Cycloheptanon-Tautomerie
Das (1R)-1-Tropanol steht mit (R)-(Methylamino)cycloheptanon in einem tautomeren Gleichgewicht:
| Tropanol-Heptanon-Tautomerie |
|---|
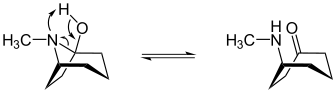 |
| Tautomerie des (1R)-1-Tropanols |
Anionotropie
| Anionotropie |
|---|
_m2.svg.png.webp) Anionotropie (Beispiel von 3-Hydroxy-1-buten) |
| Tautomerie der Butenole |
Beispiel Butenole: 3-Hydroxy-1-buten steht mit 1-Hydroxy-2-buten (Crotylalkohol) in einem tautomeren Gleichgewicht, wenn es mehrere Stunden mit verdünnter Schwefelsäure auf 100 °C erhitzt wird (Gleichgewichtsverhältnis 3 : 7). Diese Tautomerie entspricht nur formal einer Anionotropie, bei welcher ein Hydroxid-Anion seine Position ändert. Der eigentliche Reaktionsmechanismus besteht darin, dass zunächst die Hydroxygruppe protoniert und anschließend als Wassermolekül abgespalten wird. Zurück bleibt ein mesomeriestabilisiertes Carbeniumion, welches am 1. und 3. C-Atom positiv polarisiert ist. An einem der beiden C-Atome kann sich ein Wassermolekül binden, welches durch Abspaltung eines Protons wieder zur Hydroxygruppe wird.
Dyadische Tautomerie
Bei der dyadischen Tautomerie (von gr. dyas = Zweiheit) findet eine Protonenwanderung zwischen Nachbaratomen statt.
| Dyadische Tautomerie | |
|---|---|
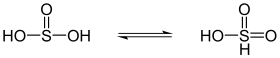 |
|
| Schweflige Säure steht im Gleichgewicht mit Sulfonsäure |
Cyanwasserstoff (Blausäure) steht im Gleichgewicht mit Isocyanwasserstoff, wobei das Gleichgewicht auf der Seite des Cyanwasserstoffs (links) liegt. |
Einzelnachweise
- Eintrag zu tautomerization. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.T06253 – Version: 2.3.3.
- L Antonov: Tautomerism: Methods and Theories, 1.. Auflage, Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33294-6.
- Eintrag zu tautomerism. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.T06252 – Version: 2.3.3.
- Holger Fleischer: Fehlinterpretation der Fehling-Probe auf reduzierende Zucker – Von der Beobachtung im Chemieunterricht zur Evidenz gegen die Oxidation der Aldehydgruppe. In: CHEMKON. Band 24, Nr. 1, 2017, ISSN 1521-3730, S. 27–30, doi:10.1002/ckon.201610283.
- Eintrag zu Imidsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Februar 2019.