Harnsäure
Harnsäure (klinisch geläufige Abkürzung: „HS“, jedoch nicht zu verwechseln mit Harnstoff) ist das Endprodukt des Nukleinsäureabbaus (hier: Abbau von Purinbasen) vieler Tierarten, zum Beispiel bei Reptilien, Vögeln, Affen und Menschen. Bei Reptilien und Vögeln werden auch Aminosäuren zu Harnsäure abgebaut. Die Salze der Harnsäure heißen Urate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
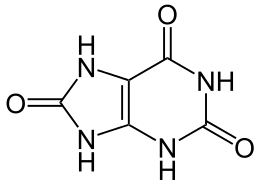 | ||||||||||||||||||||||
| Ketoform der Harnsäure | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Harnsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H4N4O3 | |||||||||||||||||||||
| Kurzbeschreibung |
geruchloser hellbeigefarbener Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 168,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,89 g·cm−3 [2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
5,75[3] | |||||||||||||||||||||
| Löslichkeit |
wenig in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Struktur
Für die Harnsäure lässt sich eine Lactam-Lactim-Tautomerie formulieren:

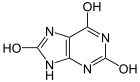
Die Ketoform ist gegenüber dem heteroaromatischen 2,6,8-Trihydroxypurin bevorzugt.[4]
Darstellung
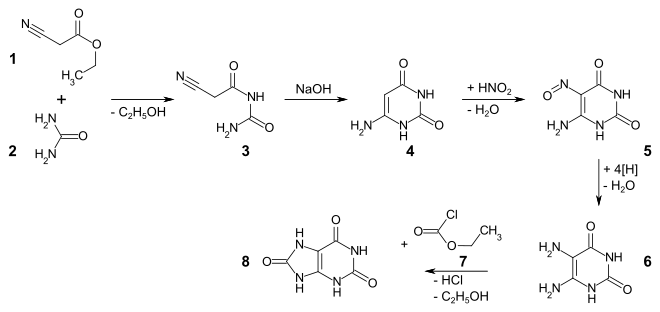
Harnsäure kann in einer Traube-Synthese dargestellt werden. Durch Kondensation von Cyanessigsäureethylester 1 mit Harnstoff 2 entsteht Cyanacetylharnstoff 3, der sich unter basischen Bedingungen zu 6-Aminouracil 4 cyclisieren lässt. Über die Nitrosoverbindung 5 ist 5,6-Diaminouracil 6 zugänglich, das mit Chlorameisensäureethylester 7 zur Harnsäure 8 reagiert.[5]
Eigenschaften
Harnsäure bildet weiße, geruchlose Kristalle, die ab 300 °C schmelzen, und tritt in zwei tautomeren Formen auf (siehe Strukturformel). Harnsäure ist als schwache Säure nur schlecht in protoniertem Zustand (beispielsweise in Wasser), dagegen gut in basischen Medien löslich. Auch die Alkalisalze (besonders das Lithiumsalz) haben eine bessere Wasserlöslichkeit.
Biologische Bedeutung
Physiologie
Im Organismus von Hominiden, also Menschen, Schimpansen, Gorillas und Orang-Utans, entsteht Harnsäure als Abbauprodukt der Purinbasen und ist damit das Endprodukt des Purinstoffwechsels. Sie entsteht aus Hypoxanthin oder Xanthin durch das Enzym Xanthinoxidase. Harnsäure ist das endgültige Abbauprodukt der Purinnukleotide und wird zu etwa 75 % renal, also über die Niere, ausgeschieden. Daneben erfolgt auch eine Elimination über Speichel, Schweiß oder die intestinale Sekretion, also über den Darm. Die tägliche Ausscheidung beträgt bis zu 1 g.
Bei anderen Säugetieren wird Harnsäure durch das Enzym Uricase in Allantoin umgewandelt.
Obwohl Hominiden Harnsäure nicht weiter abbauen können, besitzen sie in der Niere ein effektives Reabsorptionssystem in Form des Harnsäure/Anionentauschers URAT1. Aus diesem Grund haben sie fünf- bis zehnmal höhere Harnsäure-Spiegel im Serum als andere Säugetiere. Ein möglicher Grund für die hohen Harnsäurekonzentrationen im Blut könnte die antioxidative Wirkung sein.[6]
Eine – nur andere Tiere betreffende – überwiegende Ausscheidung von überschüssigem Stickstoff über Harnsäure bezeichnet man als Uricotelie.
Bei dem marinen Polychaeten Platynereis dumerilii tritt die Harnsäure als Pheromon auf, welches bei der Paarung der Tiere von den Weibchen ins Wasser abgegeben wird. Dort löst es die Spermienabgabe beim Männchen aus.[7]
Physikochemie
Harnsäure weist unterschiedliche Erscheinungsformen auf, reduzierte und oxidierte. Folglich kommt es auf das Milieu um die Harnsäure an, welcher Redox-Zustand vorliegt. Danach entscheidet sich auch, ob und wie lange mit einem Reaktionspartner eine Bindung eingegangen wird.
Pathophysiologie
Unter bestimmten Bedingungen kann es zum erhöhten Anfall von Harnsäure im Organismus kommen. Der häufigste Grund ist eine unzureichende Harnsäureausscheidung über die Nieren. Wird dabei das Löslichkeitsprodukt überschritten, kann die Harnsäure in den ableitenden Harnwegen, in der Blutbahn und in bradytrophen Geweben ausfallen und abgelagert werden. Hierbei spielt auch der pH-Wert eine Rolle: Während die Harnsäure im Blut bei einem pH von 7,4 weitgehend dissoziiert und damit löslich ist, kristallisiert sie bei einem saureren pH leicht aus. Dieser wird z. B. im Urin oder in Geweben mit geringer Sauerstoffversorgung (und dadurch vermehrter Lactatbildung) erreicht.
Folge dieser Hyperurikämie können Urolithe (Harnsteine bei der Harnsäurelithiasis), Gicht und Harnsäureinfarkte sein. Das Natriumsalz der Harnsäure, Natriumurat, spielt dabei eine wesentliche Rolle, weil es sich dann als Kristalle (Gicht) oder Steine (Nierensteine) absetzt.[8]
Bestimmte Faktoren erhöhen die Harnsäureproduktion oder die Harnsäuremenge im Organismus:
- Ernährung:
- Erhöhte Aufnahme Fructose-haltiger Lebensmittel (zuckerhaltige Getränke, Süßigkeiten, gezuckerte Frühstücksflocken etc.) assoziiert mit erhöhtem Risiko für Übergewicht, Gicht und Bluthochdruck
- Erhöhte Aufnahme purinreicher Lebensmittel
- Alkoholkonsum hemmt aufgrund des Ethanols die Harnsäureausscheidung
- Erkrankungen:
- Hämoblastosen
- Glykogenosen
- Lesch-Nyhan-Syndrom
- Idiopathische Hyperkalzämie
- Hypertriglyceridämie
- Chronisches Nierenversagen (Niereninsuffizienz)
- Akutes Tumorlyse-Syndrom
- Begleiterscheinung verschiedener Therapieformen:
- Medikamentengabe (beispielsweise Thiazid-Diuretika, Schleifendiuretika)
- Strahlentherapie
Die Bestimmung der Harnsäurekonzentration ist bei einer Tumortherapie mit Zytostatika oder ionisierenden Strahlen von großer Bedeutung. Werden größere Tumor- und Zellmassen zerstört, so steigt der Harnsäure-Gehalt im Blut rasch an, so dass es zu schweren Nierenschädigungen kommen kann. Durch regelmäßige Kontrolle muss die Tumortherapie so gesteuert werden, dass kritische Harnsäurespiegel nicht erreicht werden.
In einer großen epidemiologischen Untersuchung waren erhöhte Harnsäure-Spiegel in der Normalbevölkerung ein moderater Risikofaktor, im weiteren Verlauf an einer chronischen Nierenkrankheit zu erkranken.[9]
Metabolisches Syndrom
Der Begründer der Pathologie, Giovanni Battista Morgagni (1682–1771; Professor in Padua), erkannte bereits im 18. Jahrhundert den Zusammenhang zwischen Fettleibigkeit, Zuckerkrankheit, Bluthochdruck und Gicht. In der „Erstbeschreibung“ des Metabolischen Syndroms (MetS) durch den Schweden E. Kylin 1923 wird neben der Erhöhung von Körpergewicht, Blutfetten und Blutzucker noch die Hyperurikämie erwähnt. In den aktuell gültigen Definitionen z. B. der International Diabetes Foundation (IDF) fehlt die Hyperurikämie. Eine zunehmende Zahl von Wissenschaftlern nimmt sie aber wieder in ihre Definition des MetS auf.
Nachweisreaktionen
Der Harnsäuregehalt lässt sich im Enzymtest durch Photometrie unter Verwendung der Uratoxidase und einer Absorption im Bereich von 290 nm messen.
Ein weiterer gebräuchlicher Nachweis erfolgt über das Eindampfen der Harnsäure mit konzentrierter Salpetersäure und Versetzen mit Ammoniak-Lösung in der Murexid-Probe.
Weblinks
- Wissenschaft.de: Wie Harnsäure Lähmungen verhindern kann
- Ernährung.de: Harnsäuregehalt von Lebensmitteln (Tabelle; PDF, 77 kB)
Einzelnachweise
- Eintrag zu URIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. März 2020.
- Datenblatt Harnsäure (PDF) bei Carl Roth, abgerufen am 18. Dezember 2012.
- Shmuel Yannai: Dictionary of Food Compounds with CD-ROM, Second Edition. CRC Press, 2012, ISBN 978-1-4200-8352-1, S. 2025 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eberhard Breitmaier, Günther Jung: Organischen Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 642.
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 703.
- Deutsches Ärzteblatt: Harnsäure verlangsamt Progression bei Parkinson (Memento vom 13. August 2014 im Internet Archive).
- Erich Zeeck et al.: Uric acid: The sperm-release pheromone of the marine polychaete Platynereis dumerilii. In: J Chem Ecol. Nr. 24, 1998, S. 13–22, doi:10.1023/A:1022328610423.
- Ursula Gresser: Diagnose und Therapie der Gicht, in: Dtsch Arztebl 2003, 100(44): A-2862 / B-2379 / C-2235.
- Daniel E. Weiner et al.: Uric Acid and Incident Kidney Disease in the Community. In: J Am Soc Nephrol. Nr. 19, 2008, S. 1204–1211, doi:10.1681/ASN.2007101075.