Hydroxyprolin
Hydroxyprolin ist eine chirale α-Aminosäure, die chemisch gebunden im Kollagen vorkommt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
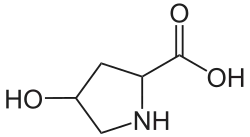 | |||||||||||||
| Struktur mit unspezifizierter Stereochemie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hydroxyprolin | ||||||||||||
| Andere Namen |
4-Hydroxypyrrolidin-2-carbonsäure | ||||||||||||
| Summenformel | C5H9NO3 | ||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 131,13 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Die exakte Bezeichnung der in der Natur vorkommenden Aminosäure lautet L-4-Hydroxyprolin oder (2S,4R)-4-Hydroxypyrrolidin-2-carbonsäure.
Stereoisomerie
4-Hydroxypyrrolidin-2-carbonsäure existiert in vier Stereoisomeren, in unserer Umwelt spielt nur das (2S,4R)-Isomere als proteinogene Aminosäure eine Rolle. Enantiomer zur natürlichen (2S,4R)-Form ist die (2R,4S)-Form. Die (2S,4S)-Form und die (2R,4R)-Form sind Diastereomere der proteinogenen (2S,4R)-4-Hydroxypyrrolidin-2-carbonsäure [Synonym: (2S,4R)-4-Hydroxyprolin].
Wenn in der Literatur und in diesem Artikel von Hydroxyprolin – ohne weitere Zusätze – die Rede ist, ist das natürliche (2S,4R)-Hydroxyprolin [Synonym: L-4-Hydroxyprolin] gemeint. Die anderen drei Isomere sind von geringer Bedeutung.
| Isomere von 4-Hydroxypyrrolidin-2-carbonsäure | ||||
| Name | (2S,4R)-4-Hydroxypyrrolidin-2-carbonsäure | (2R,4S)-4-Hydroxypyrrolidin-2-carbonsäure | (2S,4S)-4-Hydroxypyrrolidin-2-carbonsäure | (2R,4R)-4-Hydroxypyrrolidin-2-carbonsäure |
| Andere Namen | L-4-Hydroxyprolin | trans-4-Hydroxy-D-proline | ||
| Strukturformel | -4-Hydroxyprolin.svg.png.webp) |
-4-Hydroxyprolin_gespiegelt.svg.png.webp) |
-4-Hydroxyprolin.svg.png.webp) |
-4-Hydroxyprolin_gespiegelt.svg.png.webp) |
| CAS-Nummer | 51-35-4 | 3398-22-9 | 618-27-9 | 2584-71-6 |
| 6912-67-0 (unspez.) | ||||
| EG-Nummer | 200-091-9 | 625-221-5 | 210-542-1 | 219-963-5 |
| ? (unspez.) | ||||
| ECHA-Infocard | 100.000.084 | 100.153.738 | 100.009.585 | 100.018.149 |
| ? (unspez.) | ||||
| PubChem | 5810 | 440074 | 440015 | 440014 |
| 825 (unspez.) | ||||
| Wikidata | Q27089020 | Q72481402 | Q27103674 | Q27101809 |
| Q411237 (unspez.) | ||||
Herstellung und Gewinnung
Biosynthese
L-4-Hydroxyprolin entsteht durch Hydroxylierung in der 4-Stellung am Pyrrolidinring von L-Prolin, das in eine Polypeptidkette (Eiweiß) eines Kollagenmoleküls eingebaut ist. Das Enzym Prolylhydroxylase katalysiert dies unter Mitwirkung von Ascorbinsäure (Vitamin C). Hydroxyprolin stabilisiert im Kollagenmolekül den Zusammenhalt der Kollagen-Tripelhelix über einen gauche-Effekt. Die Theorie, dass von Hydroxyprolin ausgehende Wasserstoffbrücken die Tripelhelix stabilisieren, gilt als widerlegt.
Kommerzielle Herstellung
Die saure Hydrolyse von Kollagen ergibt nach der Neutralisation ein Proteinhydrolysat proteinogener α-Aminosäuren. Daraus gewinnt man bis heute durch Ionenaustausch L-Hydroxyprolin kommerziell.[3]
Eigenschaften
Hydroxyprolin in Reinform liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
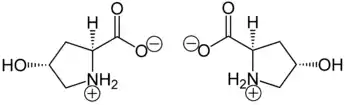
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (einem bestimmten pH-Wert) der Fall, bei dem Hydroxyprolin seine geringste Löslichkeit in Wasser hat. Die beiden anderen Stereoisomeren mit (2S,4S)- bzw. (2R,4R)-Konfiguration bilden also ebenso Zwitterionen.
Physiologische Funktion
Hydroxyprolin wird nicht direkt genetisch codiert, sondern entsteht als posttranslationale Modifikation. In Kollagen eingebautes L-Prolin wird durch das Enzym Prolyl-4-Hydroxylase und unter Beteiligung von Vitamin C zu L-Hydroxyprolin hydroxyliert. Hydroxyprolin ist erforderlich für dessen mechanische Eigenschaften als Strukturprotein. Die Mangelerkrankung Skorbut resultiert in einer Bindegewebsschwäche mit vermindertem oder fehlendem Gehalt von Hydroxyprolin und Hydroxylysin im Kollagen.
Pathophysiologie
Bei der Osteodystrophia deformans, einer chronischen Überaktivität der Osteoklasten, wird durch Knochenabbau vermehrt Hydroxyprolin freigesetzt. Das Hydroxyprolin kann im Urin zur Diagnostik bestimmt werden.[4]
Chemie und Verwendung
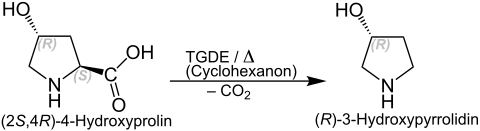
(2S,4R)-N-Acetyl-4-hydroxyprolin (INN: Oxaceprol) ist ein Arzneistoff gegen degenerative Gelenkerkrankungen. Für die vielstufige Synthese eines ACE-Hemmers wird (2S,4R)-4-Hydroxyprolin als Ausgangsstoff eingesetzt. Es decarboxyliert thermisch durch Erhitzen in Tetraethylenglykoldimethylether in Gegenwart katalytischer Mengen von Cyclohexen-3-on unter Bildung des cyclischen chiralen Aminoalkohols (R)-3-Hydroxypyrrolidin:[5]
Bestimmung des Hydroxyprolingehaltes
Die quantitative Analyse von Hydroxyprolin dient zur Bestimmung des Bindegewebsanteils in Fleischwaren. Die Qualität von Fleischwaren ist aufschlussreich, da Hydroxyprolin nur in Kollagen und damit maßgeblich in Bindegewebe (Sehnen-, Knochen-, Knorpel- und Hautteilen) vorkommt; ein hoher Gehalt von Hydroxyprolin gilt daher als Indiz für eine erhöhte Verwendung minderwertiger Rohstoffe. Nach Messung des Gesamtstickstoffs nach Kjeldahl kann der BEFFE-Wert berechnet werden.
Die Probe wird dazu mit Salzsäure aufgeschlossen und hydrolysiert, wobei Polypeptide in die Aminosäuren zerlegt werden. Das Fett wird abgetrennt und die Aminosäuren werden mit Chloramin T oxidiert. Das Oxidationsprodukt bildet mit p-Dimethylaminobenzaldehyd ein rotgefärbtes Kondensationsprodukt. Dieses wird fotometrisch bei 558 nm quantitativ nachgewiesen.[6]
Auch die Kopplung der HPLC und der Gaschromatographie mit der Massenspektrometrie eignet sich nach angemessener Probenvorbereitung zur sicheren Bestimmung von Hydroxyprolin, auch neben anderen Aminosäuren in unterschiedlichem Untersuchungsmaterial.[7][8][9]
Einzelnachweise
- Datenblatt trans-4-Hydroxy-L-proline, 99+% bei AlfaAesar, abgerufen am 26. Dezember 2019 (PDF) (JavaScript erforderlich).
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 839.
- Y. Izumi u. a.: Herstellung und Verwendung von Aminosäuren. In: Angewandte Chemie. 90(3), 1978, S. 187–194, doi:10.1002/ange.19780900307.
- Eintrag zu Morbus Paget im Flexikon, einem Wiki der Firma DocCheck, abgerufen am 15. September 2012.
- Sabine Wallbaum, Thomas Mehler, Jürgen Martens: Decarboxylation of α-Amino Acids containing two and three Stereogenic Centers: A Simple One-Step Procedure to Prepare Two Opticall Active β-Amino Alcohols and a Bicyclic Pyrrolidine Derivative. In: Synthetic Communications. 24(10), 1994, S. 1381–1387, doi:10.1080/00397919408011741.
- Reinhard Mattisek, Gabriele Steiner, Markus Fischer: Lebensmittelanalytik. 4. Auflage. Springer, Berlin 2010, ISBN 978-3-540-92205-6.
- S. Shin, H. M. Jeong, S. E. Chung, T. H. Kim, S. K. Thapa, D. Y. Lee, C. H. Song, J. Y. Lim, S. M. Cho, K. Y. Nam, W. H. Kang, Y. W. Choi, B. S. Shin: Simultaneous analysis of acetylcarnitine, proline, hydroxyproline, citrulline, and arginine as potential plasma biomarkers to evaluate NSAIDs-induced gastric injury by liquid chromatography-tandem mass spectrometry. In: J Pharm Biomed Anal. 165, 20. Feb 2019, S. 101–111. PMID 30522064
- L. Konieczna, M. Pyszka, M. Okońska, M. Niedźwiecki, T. Bączek: Bioanalysis of underivatized amino acids in non-invasive exhaled breath condensate samples using liquid chromatography coupled with tandem mass spectrometry. In: J Chromatogr A. 1542, 23. Mar 2018, S. 72–81. PMID 29477235
- M. Delport, S. Maas, S. W. van der Merwe, J. B. Laurens: Quantitation of hydroxyproline in bone by gas chromatography-mass spectrometry. In: J Chromatogr B Analyt Technol Biomed Life Sci. 804(2), 25. Mai 2004, S. 345–351. PMID 15081929