N-Methyl-2-pyrrolidon
N-Methyl-2-pyrrolidon (NMP) ist eine chemische Verbindung. Sie kann als Lactam der N-Methylaminobuttersäure gesehen werden und ist somit ein γ-Lactam.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
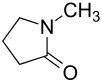 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | N-Methyl-2-pyrrolidon | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H9NO | |||||||||||||||||||||
| Kurzbeschreibung |
hygroskopische, photosensitive, farblose Flüssigkeit mit aminartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 99,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,03 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
203 °C[2] | |||||||||||||||||||||
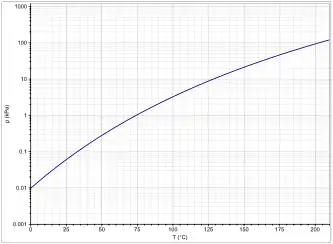
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser, Ethanol, Aceton, Diethylether, Essigsäureethylester, Chloroform, Benzol[3] | |||||||||||||||||||||
| Brechungsindex |
1,470 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | |||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
N-Methyl-2-pyrrolidon wird großtechnisch durch Reaktion von γ-Butyrolacton mit Methylamin bei Temperaturen von 250–400 °C und Drücken von 60–120 bar in adiabatisch betriebenen Rohrreaktoren hergestellt:[8]
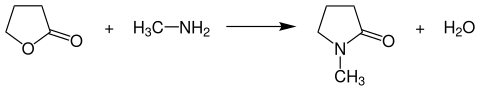
Die Reaktion verläuft exotherm. Das Produktgemisch wird im Anschluss entspannt und mittels Destillation aufgetrennt. Die Ausbeute an N-Methyl-2-pyrrolidon beträgt für gewöhnlich mehr als 97 %.[8]
Der Ausgangsstoff γ-Butyrolacton wird selbst praktisch ausschließlich aus 1,4-Butandiol produziert, welches wiederum durch zahlreiche Prozesse aus fossilen oder nachwachsenden Rohstoffen erzeugt werden kann.
Eigenschaften
Physikalische Eigenschaften
N-Methyl-2-pyrrolidon ist eine lichtempfindliche, hygroskopische, farblose bis gelbliche Flüssigkeit mit schwach aminartigem Geruch, welche mischbar mit Wasser ist.[2] Die Viskosität bei 25 °C beträgt 1,65 mPa·s, die Oberflächenspannung 40,7 mN/m.[3] Unter Normaldruck siedet die Verbindung bei 203 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 7,4, B = 2570 und C = 0 im Temperaturbereich von 361 K bis 477 K.[9]
Die Dichte von NMP sinkt mit steigender Temperatur. Die Funktion der Temperaturabhängigkeit kann mit einer quadratischen Gleichung nach ρ=α+β·T+γ·T2 mit α = 1,26202, β = −7,0026·10−4 , γ = −2,8771·10−7 und T = Temperatur in Kelvin beschrieben werden.[10]
Dichte von NMP[10] Temperatur in °C 25 32 40 60 80 100 Dichte in g·cm−3 1,0278 1,0215 1,0144 0,9968 0,9790 0,9606
Die spezifische Wärmekapazität steigt mit der Temperatur.[11]
Spezifische Wärmekapazität von NMP[11] Temperatur in °C 0 25 50 100 Spezifische Wärmekapazität in kJ·kg−1·K−1 1,70 1,78 1,86 2,03
Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−265,73 kJ·mol−1[12] −210,85 kJ·mol−1 [12] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −2988,05 kJ·mol−1[12] | als Flüssigkeit |
| Kritische Temperatur | Tc | 721,7 K[13][14] | |
| Kritischer Druck | pc | 45,2 bar[13] | |
| Kritische Dichte | ρc | 3,22 mol·l−1[14] | |
| Schmelzenthalpie | ΔfH | 18,1 kJ·mol−1[15] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 49,5 kJ·mol−1[16] | beim Normaldrucksiedepunkt |
NMP hat einen Brechungsindex, der dem von handelsüblichem Glas sehr nahekommt (1,4700). Folglich verschwinden Glasstäbe und Glaspipetten optisch nahezu in dieser Chemikalie.
Chemische Eigenschaften
NMP ist eine sehr schwache Base.[11] Bei Behandlung mit Chlorwasserstoff kann ein festes Hydrochlorid erhalten werden, welches bei 86–88 °C schmilzt.[17] Die wässrige Lösung reagiert alkalisch.[2] Eine 10%ige wässrige Lösung zeigt einen pH-Wert von 7,7 bis 8,0.[11] Die Verbindung ist chemisch sehr stabil. Der Lactam-Ring kann nur mittels starker Säuren und Basen geöffnet werden, wobei die 4-N-Methylaminobuttersäure resultiert.[11] NMP ist nur begrenzt gegenüber Sauerstoff stabil, wobei die Oxidation an der 5-Position ansetzt und über verschiedenen Zwischenstufen das N-Methylsuccinimid gebildet wird.[11] Dieses Produkt kann unter Verwendung von Rutheniumtetroxid als Oxidationsmittel gezielt aus NMP hergestellt werden.[18] Mit Halogenierungsmitteln, wie Phosgen oder Phosphorpentachlorid reagiert die Verbindung zum 2-Chlor-1-methylpyrrolidiniumchlorid, welches mit verschiedenen Nucleophilen, z. B. Aminen oder Alkoxiden weiter umgesetzt werden kann.[11][19][20]
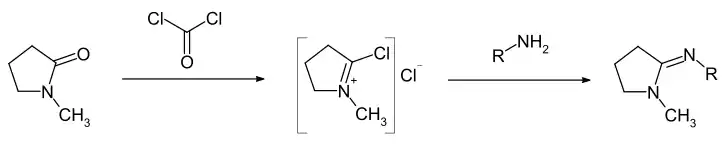
NMP wirkt bei der Synthese von Carbonsäurechloriden aus den Carbonsäuren als Katalysator.[19][20] Mit starken Basen wie Lithiumdiisopropylamid kann NMP in der 3-Stellung deprotoniert werden, wobei eine Amidenolatstruktur gebildet wird, die mit Alkylhalogeniden[21] oder Arylbromiden[22] umgesetzt werden kann.
Sicherheitstechnische Kenngrößen
NMP bildet oberhalb des Flammpunktes von 86 °C entzündliche Dampf-Luft-Gemische.[2] Der Explosionsbereich liegt zwischen 1,52 Vol.-% (63 g/m3) als untere Explosionsgrenze (UEG) und 9,5 Vol.-% (392 g/m3) als obere Explosionsgrenze (OEG).[2] Eine Korrelation der unteren Explosionsgrenze mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 79 °C.[2] Die Sauerstoffgrenzkonzentration liegt bei 200 °C bei 8,1 Vol.-%.[23] Die Grenzspaltweite wurde mit 0,93 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 265 °C.[2][9] Der Stoff fällt somit in die Temperaturklasse T3. NMP zersetzt sich bei einer Temperatur über 300 °C, wobei Kohlenstoffmonoxid, Kohlenstoffdioxid, nitrose Gase und Cyanwasserstoff entstehen. Die Leitfähigkeit liegt bei 2·10−6 S/m bei 25 °C.[2]
Verwendung
NMP wird wegen seiner thermischen Stabilität und hohen Polarität oft als Lösungsmittel verwendet. Es eignet sich als Lösungsmittel für Polymere wie Acrylate, Epoxide, Polyurethane, Polyvinylchlorid, Polyimide, Polyamidimid und für zahlreiche organische Synthesen.[17] Weitere wichtige Anwendungen umfassen die Lackentfernung und die Herstellung von Polyurethan-Schaum (PU-Schaum). Eine wichtige technische Anwendung stellt die Extraktion von 1,3-Butadien aus C4-Kohlenwasserstoffströmen dar. Außerdem wird es zur Absorption saurer Bestandteile bei der Gaswäsche verwendet.
Einzelnachweise
- Eintrag zu METHYL PYRROLIDONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- Eintrag zu N-Methyl-2-pyrrolidon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. November 2021. (JavaScript erforderlich)
- Datenblatt 1-Methyl-2-pyrrolidinone bei Sigma-Aldrich, abgerufen am 16. Juni 2011 (PDF).
- Eintrag zu 1-methyl-2-pyrrolidone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 6. Januar 2015.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 872-50-4 bzw. N-Methyl-2-pyrrolidon), abgerufen am 19. September 2019.
- Eintrag zu Methylpyrrolidone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Albrecht Ludwig Harreus, R. Backes, J.‐O. Eichler, R. Feuerhake, C. Jäkel, U. Mahn, R. Pinkos, R. Vogelsang: 2‐Pyrrolidone. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. Oktober 2011, S. 3, doi:10.1002/14356007.a22_457.pub2.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- P. Kneisl, J. W. Zondlo: Vapor pressure, liquid density, and the latent heat of vaporization as functions of temperature for four dipolar aprotic solvents. In: Journal of Chemical & Engineering Data. 32, 1987, S. 11–13, doi:10.1021/je00047a003.
- R.B.; Harreus, R. Backes, J.-O. Eichler, R. Feuerhake, C. Jäckel, U. Mahn, R. Pinkos, R. Vogelsang: 2-Pyrrolidone, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011; doi:10.1002/14356007.pub2.
- Steele, W.V.; Chirico, R.D.; Nguyen, A.; Hossenlopp, I.A.; Smith, N.K.: Determination of ideal-gas enthalpies of formation for key compounds in Am. Inst. Chem. Eng. Symp. Ser. (AIChE Symp. Ser.), 1990, 138–154.
- Gude, M.T.; Teja, A.S.: The Critical Properties of Several n-Alkanals, Tetralin and NMP in Experimental Results for DIPPR 1990-91 Projects on Phase Equilibria and Pure Component Properties, 1994, 1994, DIPPR Data Series No. 2, p. 174–83.
- Teja, A.S.; Anselme, M.J., The critical properties of thermally stable and unstable fluids. II. 1986 results, AIChE Symp. Ser., 1990, 86, 279, 122–127.
- Lisicki, Z.; Jamróz, M.E.: (Solid + liquid) equilibria in (polynuclear aromatic+ tertiary amide) systems in J. Chem. Thermodyn. 32 (2000) 1335–1353, doi:10.1006/jcht.2000.0685.
- Palczewska-Tulinska, M.; Oracz, P.: Vapor Pressures of 1-Methyl-2-pyrrolidone, 1-Methyl-azepan-2-one, and 1,2-Epoxy-3-chloropropane in J. Chem. Eng. Data 52 (2007) 2468–2471, doi:10.1021/je700398k.
- Eintrag zu N-Methyl-2-pyrrolidon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Februar 2012.
- S. Yoshifuji, Y. Arakawa, Y. Nitta: Ruthenium Tetroxide Oxidation of N-Alkyllactams in Chem. Pharm. Bull. 35 (1987) 357–363, doi:10.1248/cpb.35.357, pdf.
- Eilingsfeld, H.; Seefelder, M.; Weidinger, H.: Amidchloride und Carbamidchloride in Angew. Chem. 72 (1960) 836–845, doi:10.1002/ange.19600722208.
- Eilingsfeld, H.; Seefelder, M.; Weidinger, H.: Synthesen mit Amidchoriden, I. Reaktionen an der funktionellen Gruppe N.N-disubstituierter Carbonsäureamidchloride in Chem. Ber. 96 (1963) 2671–2690, doi:10.1002/cber.19630961023.
- Hullot, P.; Cuvigny, T.; Larcheveque, M.; Normant, H.: Milieux hyperbasiques: préparation et alkylation de carbanions en α d'amides N,N-disubstitués. Application à la synthèse de la d,l-pipéritone in Can. J. Chem. 54 (1976) 1098–1104, doi:10.1139/v76-157, pdf.
- Stewart, J.D.; Fields, S.C.; Kochhar, K.S.; Pinnick, H.W.: α-Arylation of pyrrolidinones in J. Org. Chem. 52 (1987) 2110–2113, doi:10.1021/jo00386a045.
- Osterberg, P.M.; Niemeier J.K.; Welch,C.J.; Hawkins, J.M.; Martinelli, J.R.; Johnson, T.E.; Root, T.W.; Stahl, S.S.: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry in Org. Process Res. Dev. 19 (2015) 1537–1542, doi:10.1021/op500328f.

