Nitrobenzol
Nitrobenzol ist die einfachste aromatische organische Nitroverbindung. Es wurde erstmals im Jahr 1834 durch Eilhard Mitscherlich dargestellt. Nitrobenzol ist bei Raumtemperatur flüssig und in saurem und überwiegend auch in alkalischem Milieu beständig. Es ist giftig und steht im Verdacht, Krebs zu erzeugen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
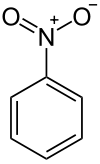 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nitrobenzol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H5NO2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis blassgelbe, stark lichtbrechende Flüssigkeit mit bittermandelölartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 123,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,20 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
211 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,5530[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
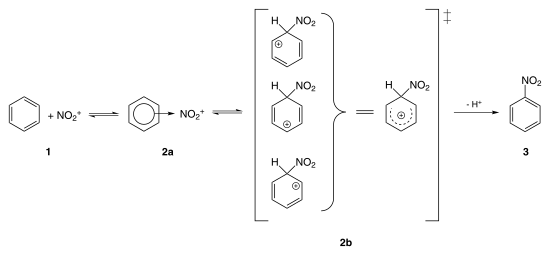
Nitrobenzol wird technisch durch Nitrierung von Benzol unter Einsatz von Nitriersäure hergestellt.[6] Sie bildet durch Dehydratisierung von Salpetersäure mit konzentrierter Schwefelsäure zunächst reaktive Nitroniumionen.
Das entstandene Nitroniumion (auch Nitrylkation) reagiert mit dem Benzol:
Nitrobenzol ist entstanden, das freie Proton lagert sich wieder an ein Wassermolekül an (Oxonium), und verbleibt mit dem Hydrogensulfation in Lösung und muss ggf. neutralisiert werden.
Eigenschaften
Physikalische Eigenschaften

Nitrobenzol ist eine farblose, bisweilen aufgrund von Verunreinigungen blassgelbe Flüssigkeit. Es riecht bittermandelölartig (nach „Marzipan“), wobei jedoch eine leicht stechende Note zu verzeichnen ist, und schmeckt in wässriger Lösung angenehm süßlich marzipanartig. Es ist giftig und brennbar. Nitrobenzol weist einen hohen Brechungsindex auf. Unter Normbedingungen hat es eine Dichte von 1,20 g/cm3, schmilzt bei 5,7 °C und siedet bei 210,85 °C; der Flammpunkt liegt bei 88 °C. Nitrobenzol ist in Wasser nur in Spuren löslich, dafür kann man es gut mit Alkoholen, Ether und Benzol mischen. In verdünnter Schwefelsäure löst sich Nitrobenzol schlecht, ab einer Konzentration von 80 % jedoch vollständig. Die Löslichkeit ist wenig temperaturabhängig.
Chemische Eigenschaften
Die Nitrogruppe ist gegenüber Säuren, elektrophilen Reagenzien und den meisten Oxidationsmitteln inert. Sie reagiert aber mit Grignard-Reagenzien und starken Basen. Durch die starken −I- und −M-Effekte der Nitrogruppe ist die Elektronendichte des aromatischen π-Systems stark verringert, was zwar elektrophile aromatische Substitutionen erschwert, aber nucleophile aromatische Substitutionen begünstigt. Die mittels DSC bestimmte Zersetzungswärme beträgt −214 kJ·mol−1 bzw. −1740 kJ·kg−1.[7]
Reaktionen
Nitrobenzol kann mit Wasserstoff über Nickelkontakten bei erhöhter Temperatur und Druck zu Anilin hydriert werden.
Die auch technisch durchgeführte Reduktion mittels Eisenpulver in einer alkoholischen Salzsäurelösung ergibt ebenfalls Anilin. Liegt ein Nitrobenzolderivat vor, das andere reduzierbare Gruppen enthält, ist die Nitro-Reduktion selektiv mit Zinn(II)-chlorid in konzentrierter Salzsäure möglich. Die Reduktion einer Nitrogruppe von zweifach nitrierten Aromaten kann mit Natrium- oder Ammoniumsulfid durchgeführt werden.
Führt man die chemische Reduktion in neutralem Medium durch, so erhält man Phenylhydroxylamin. Wählt man ein basisches Reaktionsmedium, so erhält man je nach Reduktionsmittel verschiedene gekuppelte Verbindungen: mit As2O3 in wässriger Natronlauge erhält man Azoxybenzol, mit Zinkpulver in alkoholischer Natronlauge erhält man Azobenzol und mit Hydrazin in alkoholischer Natronlauge mit Übergangsmetallkatalysatoren erhält man Hydrazobenzol.
Verwendung
| Nitrobenzol als Kraftstoff | |
|---|---|
| Kurzbeschreibung | Bestandteil ehemaliger Rennkraftstoffe, Zündbeschleuniger für Dieselkraftstoffe, Lösungsmittel |
| Eigenschaften | |
| Aggregatzustand | flüssig |
| Flammpunkt |
88 °C[2] |
| Zündtemperatur | 480 °C[2] |
| Explosionsgrenze | 1,8–40 Vol.-%[2] |
| Temperaturklasse | T1[2] |
| Explosionsklasse | IIB[2] |
| Sicherheitshinweise | |
| UN-Nummer |
1662[2] |
| Gefahrnummer |
60[2] |
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |
Nitrobenzol ist ein wichtiges, in großem Maßstab hergestelltes Zwischenprodukt bei der Herstellung verschiedener Chemikalien, wie zum Beispiel Anilin, Benzidin, Dinitrobenzol, Trinitrobenzol, Nitrobenzolsulfonsäure, Fuchsin oder Chinolin.
In geringem Ausmaß dient Nitrobenzol auch als Lösungsmittel, Schmierölbestandteil, chemisches Reagenz und als Zusatz bei Sprengstoffen. Ferner ist es als Zündbeschleuniger für Dieselkraftstoffe verwendbar.
Früher wurde Nitrobenzol zudem auch unter dem Namen „Mirbanöl“ zur Parfümierung von Seifen verwendet.[8] Die Verwendung in kosmetischen Mitteln ist aber mittlerweile verboten. „Mirbanöl“ verwendete man auch zur Desinfektion von Insektensammlungen.[9]
Aufgrund des bei Nitrobenzol sehr ausgeprägten magnetooptischen Effekts, unter angelegter Hochspannung Polarisationsdrehungen des Lichts zu verursachen, wird der Stoff in der Kerr-Zelle dazu verwendet, Lichtstrahlen zu modulieren. Eine wesentliche Anwendung der mit Nitrobenzol gefüllten Kerr-Zellen bestand in der Vergangenheit darin, den Ton optisch auf Filmmaterial zu belichten. In diesem Zusammenhang wird statt Kerr-Zellen auch von Karolus-Zellen gesprochen.
Biologische Bedeutung
Nitrobenzol ist umweltgefährdend. Es hat die Wassergefährdungsklasse 2 (wassergefährdend).
Vergiftung
Nitrobenzol kann durch die Haut, die Atmungs- und die Verdauungsorgane in den menschlichen Körper gelangen. Dort kann es schwere Vergiftungen hervorrufen. Dabei wird das Blut des Menschen dunkelbraun, es verliert die Fähigkeit, Sauerstoff aufzunehmen, da sich Methämoglobin bildet.
Infolgedessen färbt sich die Haut bläulich und es tritt eine Zyanose auf. Zudem kommt es zu einer starken Schädigung des zentralen Nervensystems und es treten Schwächegefühl, Kopfschmerzen und Erbrechen auf. Bei stärkeren Vergiftungen kommen Bewusstseinstrübung, Herzklopfen, Krämpfe und schließlich Bewusstlosigkeit hinzu. Eine schwere Vergiftung kann innerhalb weniger Stunden zum Tod führen. Alkohol verstärkt die giftige Wirkung des Nitrobenzols.
Insbesondere kleine Kinder und Säuglinge sind anfällig für Vergiftungen mit Methämoglobinbildnern wie Nitrobenzol, da die entsprechenden Enzyme zum Abbau des Methämoglobins noch fehlen.
Als Gegengift kommen bei leichten Fällen Ascorbinsäure und bei schwereren Fällen Toluidinblau in Frage. Beide Medikamente beschleunigen die Reduktion des Methämoglobins. Toluidinblau führt zu einer vorübergehenden, ungefährlichen Blaufärbung des Patienten. In lebensbedrohlichen Situationen kann eine Austauschtransfusion durchgeführt werden.[10]
Einzelnachweise
- Eintrag zu Nitrobenzol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Eintrag zu Nitrobenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. April 2018. (JavaScript erforderlich)
- Eintrag zu Nitrobenzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. August 2016.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 98-95-3 bzw. Nitrobenzol), abgerufen am 27. September 2019.
- Joachim Buddrus: Grundlagen der Organischen Chemie. 4. Auflage. Walter de Gruyter Verlag, Berlin 2011, ISBN 978-3-11-024894-4, S. 374–375.
- T. Grewer, O. Klais: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften. (= Humanisierung des Arbeitslebens. Band 84). VDI-Verlag, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- Riechstoffe [1]. In: Lueger, Otto: Lexikon der gesamten Technik und ihrer Hilfswissenschaften, Bd. 7 Stuttgart, Leipzig 1909, S. 425-426, auf http://www.zeno.org. Contumax GmbH & Co. KG; Otto Lueger, 1909, abgerufen am 17. Mai 2019: „zum Parfümieren billiger Toiletteseifen“
- Gerfried Deschka: Die Desinfektion kleiner Insektensammlungen nach neueren Gesichtspunkten. In: Steyrer Entomologenrunde. 21, Steyr 1987, S. 57–61.
- Heinz Lüllmann, Hein Lutz, Klaus Mohr, Martin Wehling: Pharmakologie und Toxikologie. Thieme, 2006, ISBN 3-13-368516-3, S. 507–508.