Solvatochromie
Unter Solvatochromie versteht man allgemein die Beeinflussung der Farbe eines Farbstoffes durch Lösungsmittel (Solvens). Die erkennbare Farbe der Lösung beruht auf Wechselwirkungen des Farbstoffes einerseits mit den Solvensmolekülen und auf den gegenseitigen Wechselwirkungen der Solvensmoleküle andererseits. Man unterscheidet zwischen der negativen Solvatochromie, die eine hypsochrome (farbaufhellende) Verschiebung bewirkt, und der positiven Solvatochromie, die eine bathochrome (farbvertiefende) Wirkung nach sich zieht.
Einige Farbstoffe interagieren in Lösung mit ihrer Umgebung und fungieren dabei als Indikator für zwischenmolekulare Wechselwirkungen. Lösungen dieser solvatochromen Farbstoffe ändern ihre Farbe mit der Temperatur, das heißt, sie sind auch thermochrom.
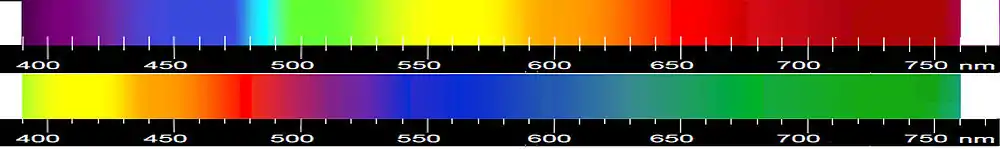
.
Negative Solvatochromie

Bei der negativen Solvatochromie überwiegt im Grundzustand des Farbmoleküls ein polarer mesomerer Zustand (Grenzformeln mit Partialladungen). Deshalb wird das Energieniveau des Stoffes umso stärker abgesenkt, je polarer das Lösungsmittel ist. Das Niveau des angeregten Zustandes des Moleküls bleibt annähernd gleich.
Somit werden die Wellenlängen des Absorptionsmaximums umso kleiner (und damit energiereicher), je polarer das Lösungsmittel ist. Es wird also mehr Energie für die Absorption notwendig, eine hypsochrome Verschiebung findet statt. Die Farbe des Farbstoffs verändert sich in stärker wechselwirkenden Solventien von Grün über Blau und Rot nach Gelb.
Substanzen mit negativer Solvatochromie lösen sich auch besser in stark wechselwirksamen Lösungsmittel (Wasser und Alkohole) als in Kohlenwasserstoffen, die als schwach wechselwirkend gelten.
Positive Solvatochromie
Bei der positiven Solvatochromie überwiegt im Grundzustand des Farbmoleküls hingegen eine unpolare Grenzstruktur. Durch zunehmend polare Lösungsmittel wird der Grundzustand destabilisiert, das Energieniveau erhöht und die Wellenlänge des Absorptionsmaximums immer länger. Es wird weniger Energie für die Absorption benötigt, eine bathochrome Verschiebung findet statt, die Farbe des Farbstoffes verschiebt sich vom roten über den blauen zum dunkelgrünen Teil des sichtbaren Spektrums.
Charakterisierung der Lösemittelpolarität
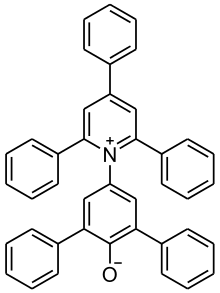
Besonders stark ist die Farbe eines gelösten Stoffes von polaren Wechselwirkungen mit dem Lösungsmittel abhängig. Oft wird die „Polarität“ eines Lösungsmittels als Begründung dafür herangezogen, wie stark es die Färbung eines gelösten Stoffes beeinflusst. Diese Sichtweise ist jedoch keineswegs unproblematisch, da mit der Zeit diverse Polaritätsskalen (neben Stoffkonstanten wie Dielektrizitätskonstante, Brechungsindex, Säure- und Basenkonstanten auch empirische Werte wie die Taft’sche π*-Polaritätsskala, ET(30)-Werte) entdeckt und entwickelt wurden, die teilweise widersprüchliche Aussagen liefern und alle nur begrenzt anwendbar sind.[1][2]
Wenn die Wechselwirkungen der Solvensmoleküle untereinander beträchtlich sind, dann werden sie auch beträchtliche Auswirkungen auf die gelösten Moleküle ausüben. Es gibt verschiedene Indikatoren für die zwischenmolekularen Wechselwirkungen in Flüssigkeiten und Gasen: Bei vergleichbaren Substanzen werden die Wechselwirkungen mit steigender molarer Masse größer und das erhöht die Siedetemperatur. Mit der Molmasse nimmt auch die „Oberfläche“ von Teilchen zu und an der Oberfläche greifen die zwischenmolekularen Wechselwirkungen an. Dabei sind neben elektromagnetischen Kräften auch „unpolare“ Massen wirksam. Bei Isomeren geben Messwerte für Dichte, Viskosität und Oberflächenspannung Hinweise auf unterschiedlich stark ausgeprägte strukturabhängige Wechselwirkungen.[3] Mit zunehmender Temperatur nehmen die vorhandenen Wechselwirkungen zwischen Solvensmolekülen ab. Dadurch verringern sich auch die Wechselwirkungen mit gelösten Teilchen.
Weblinks
- Christian Reichardt – Demonstration und Erklärung von Solvatochromie (Video)
- Christian Reichardt – Angewandte Solvatochromie (Video)
Einzelnachweise
- Mortimer J. Kamlet, Jose Luis Abboud, R. W. Taft: The solvatochromic comparison method. 6. The π* scale of solvent polarities. In: J. Am. Chem. Soc. 99 (18), 1977, S. 6027–6038, doi:10.1021/ja00460a031.
- Karl Dimroth, Christian Reichardt, Theodor Siepmann, Ferdinand Bohlmann: Über Pyridinium-N-phenol-betaine und ihre Verwendung zur Charakterisierung der Polarität von Lösungsmitteln. In: Justus Liebigs Annalen der Chemie. 661, 1963, S. 1–37, doi:10.1002/jlac.19636610102.
- Ralf Lemke: Zwischenmolekulare Wechselwirkungen. In: Ursachenforschung in Praxis der Naturwissenschaften Chemie in der Schule. 54/6, 2005, S. 39–43.