Tetramethylharnstoff
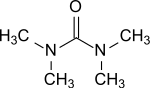
Tetramethylharnstoff (TMU, von engl. tetramethylurea) ist ein Lösungsmittel für organische Verbindungen, insbesondere für Aromaten, und eignet sich als aprotisch-dipolares Reaktionsmedium, z. B. für Grignard-Verbindungen.[6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetramethylharnstoff | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H12N2O | |||||||||||||||
| Kurzbeschreibung |
klare farblose[1] Flüssigkeit | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 116,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−1 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
13,3 hPa bei 61 °C[3] | |||||||||||||||
| Löslichkeit |
vollkommen mischbar mit Wasser (1000 g·l−1 bei 20 °C) und in den meisten organischen Lösungsmitteln[5][6] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Die akute Toxizität von TMU ist mäßig. Allerdings erwies es sich an mehreren Tierarten als embryotoxisch und teratogen[8] und sollte daher unter angemessenen Sicherheitsvorkehrungen verwendet werden.
Vorkommen und Darstellung
Die Synthese und Eigenschaften von Tetramethylharnstoff wurden von Arthur Lüttringhaus 1963 umfassend beschrieben.[6]
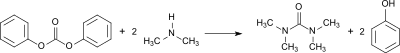
Die von den Autoren bevorzugte Synthesevariante geht aus von dem für die Herstellung von Polycarbonaten verwendeten Diphenylcarbonat, das mit gasförmigem Dimethylamin im Autoklaven zur Reaktion gebracht wird und eine Ausbeute an Tetramethylharnstoff von 74 % liefert.
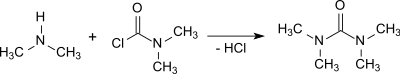
Bei der Reaktion von Dimethylcarbamoylchlorid mit wasserfreiem Natriumcarbonat fällt TMU in einer Ausbeute von 96,5 % an.[9] Diese Reaktion wurde bereits 1879 von Wilhelm Michler und Mitarbeiter beschrieben.[10]
Dimethylcarbamoylchlorid reagiert auch mit überschüssigem Dimethylamin zu (verunreinigtem und übelriechendem) Tetramethylharnstoff, der durch Zugabe von Calciumoxid und anschließende fraktionierte Destillation gereinigt werden kann.[11]
Die Umsetzung von Dimethylamin mit Phosgen in Gegenwart von z. B. 50%iger Natronlauge und anschließende Extraktion mit 1,2-Dichlorethan liefert TMU in 95%iger Ausbeute.[4]
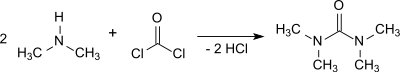
Die Reaktionen mit Dimethylcarbamoylchlorid und Phosgen sind stark exotherm und die Entfernung des anfallenden Dimethylamin-Hydrochlorids erfordert einigen Aufwand.[6]
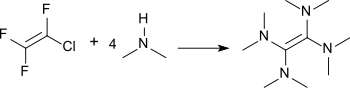
Tetramethylharnstoff entsteht auch bei der Oxidation von Tetrakis(dimethylamino)ethylen (TDAE), einem sehr elektronenreichen Alken[12] und starkem Reduktionsmittel, zugänglich aus Tris(dimethylamino)methan durch Pyrolyse[13] oder aus Chlortrifluorethen und Dimethylamin.[14]
TDAE reagiert mit Sauerstoff in einer (2+2)-Cycloaddition zu einem 1,2-Dioxetan, welches zu elektronisch angeregtem Tetramethylharnstoff zerfällt. Dieser kehrt unter Abgabe von grünem Licht mit einem Emissionsmaximum bei 515 nm[15] in den Grundzustand zurück.[16]

Eigenschaften
Tetramethylharnstoff ist eine klare, farblose Flüssigkeit mit schwachem aromatischem Geruch, die sich mit Wasser und vielen organischen Lösungsmitteln mischt.[5] Ungewöhnlich für Harnstoffe ist der flüssige Zustand von TMU und sein weiter Flüssigkeitsbereich von > 170 °C.
Anwendungen
Tetramethylharnstoff ist mit einer Vielzahl organischer Verbindungen mischbar, darunter auch Säuren, wie z. B. Essigsäure oder Basen, wie z. B. Pyridin und ein ausgezeichnetes Lösungsmittel für organische Substanzen, wie z. B. ε-Caprolactam oder Benzoesäure und löst selbst einige anorganische Salze, wie z. B. Silbernitrat oder Natriumiodid.[17][18] TMU wird wegen seiner ausgeprägten Lösungsmitteleigenschaften oft als Ersatz für das karzinogene Hexamethylphosphorsäuretriamid (HMPT) eingesetzt.[19]
Tetramethylharnstoff eignet sich als Reaktionsmedium für die Polymerisation von aromatischen Disäurechloriden, wie z. B. Isophthalsäuredichlorid und aromatischen Diaminen, wie z. B. 1,3-Diaminobenzol (m-Phenylendiamin) zu Aramiden wie z. B. Poly(m-phenylenisophthalamid) (Nomex®).[20][21]
Die Polymerisation von 4-Aminobenzoesäurechlorid-hydrochlorid in TMU liefert isotrope, viskose Lösungen von Poly(p-benzamid) (PPB), die direkt zu Fasern versponnen werden können.[22]
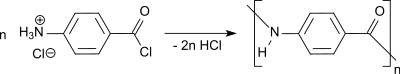
In einem Gemisch TMU-LiCl können stabile isotrope Lösungen bis zu einer PPB-Polymerkonzentration von 14 % erhalten werden.[23]
TMU löst auch Celluloseester und quillt andere Polymere, wie z. B. Polycarbonate, Polyvinylchlorid oder aliphatische Polyamide, meist bei erhöhter Temperatur, an.[6]
Aus Tetramethylharnstoff sind auf einfachem Weg starke gehinderte und nicht-nucleophile Guanidin-Basen zugänglich,[24][25]
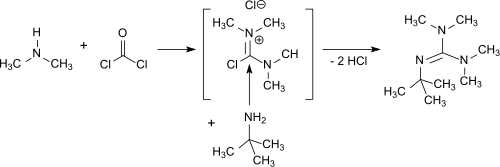
die im Gegensatz zu den anellierten Amidinbasen DBN oder DBU nicht alkyliert werden.
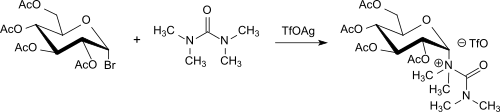
Eine Abwandlung der Koenigs-Knorr-Methode zum Aufbau von Glycosiden aus 2,3,4,6-Tetra-O-acetyl-α-D-glucopyranosylbromid (Acetobromglucose) stammt von S. Hanessian, der als Silbersalz Silbertrifluormethansulfonat (Ag-triflat, TfOAg) und als Protonenacceptor Tetramethylharnstoff einsetzte.[26] Diese Verfahrensvariante zeichnet sich durch eine vereinfachte Prozessführung, sowie hohe Anomerenreinheit und Ausbeuten der Produkte aus.
Führt man die Reaktion mit Acetobromglucose und Silbertriflat/TMU bei Raumtemperatur durch, dann reagiert TMU nicht nur als Base, sondern auch mit dem Glycosylhalogenid unter Bildung eines gut isolierbaren Uroniumtriflats in 56%iger Ausbeute.[27]
Einzelnachweise
- Datenblatt Tetramethylharnstoff bei Sigma-Aldrich, abgerufen am 15. August 2016 (PDF).
- Eintrag zu Tetramethylharnstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Datenblatt Tetramethylurea bei AlfaAesar, abgerufen am 15. August 2016 (PDF) (JavaScript erforderlich).
- Patent US3681457: Method of making tetramethylurea. Angemeldet am 26. Februar 1969, veröffentlicht am 1. August 1972, Anmelder: The Ott Chemical Co., Erfinder: H. Babad.
- R.M. Giuliano: Tetramethylurea. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2004, doi:10.1002/047084289X.rn00399.
- A. Lüttringhaus, H.-W. Dirksen: Tetramethylharnstoff als Lösungsmittel und Reaktionspartner. In: Angew. Chem. Band 75, Nr. 22, 1963, S. 1059–1068, doi:10.1002/ange.19630752204.
- Datenblatt Tetramethylharnstoff (PDF) bei Merck, abgerufen am 15. August 2016.
- The MAK Collection for Occupational Health and Safety: Tetramethylharnstoff [MAK Value Documentation in German language, 1979], Documentations and Methods. Wiley-VCH, Weinheim 2012, doi:10.1002/3527600418.mb63222d0007.
- J.K. Lawson, Jr., J.A.T. Croom: Dimethylamides from alkali carboxylates and dimethylcarbamoyl chloride. In: J. Org. Chem. Band 28, Nr. 1, 1963, S. 232–235, doi:10.1021/jo1036a513.
- W. Michler, C. Escherich: Ueber mehrfach substituirte Harnstoffe. In: Ber. Dtsch. Chem. Ges. Band 12, Nr. 1, 1879, S. 1162–1164, doi:10.1002/cber.187901201303.
- Patent US3597478: Preparation of tetramethylurea. Angemeldet am 14. September 1967, veröffentlicht am 3. August 1971, Anmelder: Nipak, Inc., Erfinder: M.L. Weakly.
- H. Bock, H. Borrmann, Z. Havlas, H. Oberhammer, K. Ruppert, A. Simon: Tetrakis(dimethylamino)ethen: Ein extrem elektronenreiches Molekül mit ungewöhnlicher Struktur sowohl im Festkörper als auch in der Gasphase. In: Angew. Chem. Band 103, Nr. 12, 1991, S. 1733–1735, doi:10.1002/ange.19911031246.
- H. Weingarten, W.A. White: Synthesis of Tetrakis(dimethylamino)ethylene. In: J. Org. Chem. Band 31, Nr. 10, 1966, S. 3427–3428, doi:10.1021/jo01348a520.
- Patent US3293299: Process for making tetrakis(dimethylamino)ethylene. Angemeldet am 4. Oktober 1965, veröffentlicht am 20. Dezember 1966, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: H. Boden.
- H.E. Winberg, J.R. Downing, D.D. Coffman: The chemiluminescence of tetrakis(dimethylamino)ethylene. In: J. Am. Chem. Soc. Band 87, Nr. 9, 1965, S. 2054–2055, doi:10.1021/ja01087a039.
- Chemilumineszenz von TDAE. illumina-chemie.de, 8. August 2014, abgerufen am 22. August 2016.
- B.J. Barker, J.A. Caruso: The Chemistry of Nonaqueous Solvents, IV. Solution Phenomena and Aprotic Solvents. Academic Press, New York 1976, ISBN 0-12-433804-6, S. 110–127.
- B.J. Barker, J. Rosenfarb, J.A. Caruso: Harnstoffe als Lösungsmittel in der chemischen Forschung. In: Angew. Chem. Band 91, Nr. 7, 1979, S. 560–564, doi:10.1002/ange.19790910707.
- A.J. Chalk: The use of sodium hydride as a reducing agent in nitrogen-containing solvents I. The reduction of chlorosilanes in Hexaalkylphosphoric triamides and tetraalkylureas. In: J. Organomet. Chem. Band 21, Nr. 1, 1970, S. 95–101, doi:10.1016/S0022-328X(00)90598-9.
- G. Odian: Principles of Polymerization, 4th Edition. Wiley-Interscience, Hoboken, NJ 2004, ISBN 0-471-27400-3, S. 100.
- H.G. Rodgers, R.A. Gaudiana, W.C. Hollinsed, P.S. Kalyanaraman, J.S. Manello, C. McGovern, R.A. Minns, R. Sahatjian: Highly amorphous, birefringent, para-linked aromatic polyamides. In: Macromolecules. Band 18, Nr. 6, 1985, S. 1058–1068, doi:10.1021/ma00148a003.
- J. Preston: Synthesis and Properties of Rodlike Condensation Polymers, in Liquid Crystalline Order in Polymers. Hrsg.: A. Blumstein. Academic Press, New York 1978, ISBN 0-12-108650-X, S. 141–166.
- S.L. Kwolek, P.W. Morgan, J.R. Schaefgen, L.W. Gulrich: Synthesis, Anisotropic Solutions, and Fibers of Poly(1,4-benzamide). In: Macromolecules. Band 10, Nr. 6, 1977, S. 1390–1396, doi:10.1021/ma60060a041.
- D.H.R. Barton, M. Chen, J.C. Jászbérenyi, D.K. Taylor: PREPARATION AND REACTIONS OF 2-tert-BUTYL-1,1,3,3-TETRAMETHYLGUANIDINE: 2,2,6-TRIMETHYLCYCLOHEXEN-1-YL IODIDE In: Organic Syntheses. 74, 1997, S. 101, doi:10.15227/orgsyn.074.0101; Coll. Vol. 9, 1998, S. 147 (PDF).
- D.H.R. Barton, J.D. Elliott, S.D. Géro: The synthesis and properties of a series of strong but hindered organic bases. In: J. Chem. Soc., Chem. Commun. 1981, S. 1136–1137, doi:10.1039/C39810001136.
- S. Hanessian, J. Banoub: Chemistry of the glycosidic linkage. An efficient synthesis of 1,2-trans-disaccharides. In: Carbohydr. Res. Band 53, 1977, S. C13–C16, doi:10.1016/S0008-6215(00)85468-3.
- K. Bock, J. Fernández-Bolanos Guzmán, S. Refn: Synthesis and properties of 1,1,3,3-tetramethyl-2-(2,3,4,6-tetra-O-acetyl-α-D-glucopyranosyl)uronium triflate. In: Carbohydr. Res. Band 232, 1992, S. 353–357, doi:10.1016/0008-6215(92)80067-B.

