Nitroverbindungen
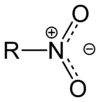
Nitroverbindungen sind organische Verbindungen, bei denen eine oder mehrere Nitrogruppen (–NO2) an jeweils ein Kohlenstoffatom eines organischen Restes gebunden sind. Man kann zwischen aliphatischen und aromatischen Nitroverbindungen unterscheiden. Die aromatischen Nitroverbindungen sind in der Regel stabiler. Organische Verbindungen, in denen die Nitrogruppe an ein weiteres Stickstoffatom gebunden ist (sog. N-Nitroverbindungen), gehören einer eigenen Verbindungsklasse an und werden Nitramine genannt.
Aromatische Nitroverbindungen
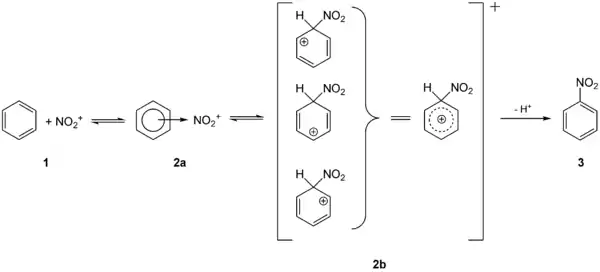
Die aromatischen Nitroverbindungen (oft auch Nitroaromaten) lassen sich durch elektrophile aromatische Substitution mit Nitriersäure direkt herstellen. Die Nitrierung von Benzol liefert über die Zwischenstufen 2a und 2b den einfachsten Nitroaromat, Nitrobenzol 3:
Zu den bekanntesten Vertretern gehören die Sprengstoffe Trinitrotoluol, Pikrin- und Styphninsäure. Neben Sprengstoffen umfasst die Gruppe der Nitroaromaten auch Farbstoffe, Pharmazeutika, Herbizide, Ausgangsstoffe für die Kunststoffindustrie und synthetische Duftstoffe, (z. B. Nitromoschus-Duftstoffe, mittlerweile in Verruf gekommen). In der chemischen Industrie sind Nitroaromaten bedeutende Zwischenprodukte, da sie zur Herstellung von aromatischen Aminen benötigt werden (z. B. Anilin, das aus Nitrobenzol synthetisiert wird) – siehe auch BASF.
Nitroaromaten als Umweltgifte
Viele Nitroaromaten sind Umweltgifte und stellen als solche ein (Abfall-)Problem dar. So sind z. B. in Deutschland die Böden und das Grundwasser in der Umgebung ehemaliger Sprengstofffabriken noch heute mit Nitroaromaten kontaminiert.[1]
Aliphatische Nitroverbindungen
Aliphatische Nitroverbindungen lassen sich u. a. durch nucleophile Substitution von Alkylhalogeniden mit anorganischen Nitriten, z. B. Silbernitrit, AgNO2 oder Natriumnitrit, NaNO2 herstellen.

- Synthese von Nitromethan aus Chloressigsäure und Natriumnitrit.
Sie sind präparativ vielseitig einsetzbar. So können sie beispielsweise in einer Henry-Reaktion (Nitro-Aldolreaktion) eingesetzt werden. Die so erhaltenen Nitroverbindungen können in weiteren Reaktionsschritten auch durch Reduktion zu aliphatischen Aminen oder in einer Nef-Reaktion zu Ketonen umgesetzt werden. Bedeutung besitzen sie als Zwischenprodukte in der chemischen Industrie, als Lösungsmittel oder Treibstoff.
Unterscheidung von Nitro- und Nitritgruppen
Bei der Herstellung von Nitroverbindungen entsteht in einer Nebenreaktion auch der Ester der Salpetrigen Säure (Nitrite) immer als Nebenprodukt. Der prozentuale Anteil ist jedoch vom Reaktionsweg abhängig. Der Unterschied besteht in der Wertigkeit des Stickstoffs. Die Nitrogruppe ist über das Stickstoffatom am Kohlenstoffatom gebunden. In der isomeren Nitritgruppe ist der Stickstoff dreiwertig und über ein Sauerstoffatom am Kohlenstoff gebunden. Nitroalkane sind temperaturstabiler als Nitritester.
Einzelnachweise
- Bayerisches Landesamt für Umweltschutz: Rüstungsaltlasten - Fachinformation und Erfahrungsaustausch (PDF; 2,8 MB), Fachtagung vom 14. Oktober 2004.