Propylencarbonat
Propylencarbonat (4-Methyl-1,3-dioxolan-2-on) ist eine klare, farblose, leicht bewegliche, fast geruchlose Flüssigkeit. Als Carbonat ist es ein Ester der zweiwertigen Kohlensäure, hier mit dem zweiwertigen Alkohol 1,2-Propandiol. Es wird unter anderem als polares Lösungsmittel verwendet, hat aber weitaus mehr Anwendungsmöglichkeiten.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
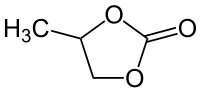 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propylencarbonat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit fruchtigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 102,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,21 g·ml−1[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
242 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (240 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,4189 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Es ersetzt zunehmend die ökologisch und vom Arbeitsschutz her bedenklicheren Kresole.
Herstellung
Propylencarbonat entsteht als Nebenprodukt bei der Polypropylencarbonatsynthese aus Propylenoxid und Kohlendioxid. Es kann auch aus Propylenglycol und Harnstoff mit Zinkeisenmischoxid-Katalysator hergestellt werden.
Eigenschaften
Propylencarbonat weist ein sehr hohes Dipolmoment auf, was zur Eignung als Lösungsmittel führt.
-_%2526_(S)-Propylene_Carbonate_V.1.svg.png.webp)
Stereoisomerie
Propylencarbonat besitzt ein stereogenes Zentrum. Folglich gibt es zwei Stereoisomere, (R)- und (S)-4-Methyl-1,3-dioxolan-2-on. Gewöhnlich wird Propylencarbonat in der Technik als 1:1-Gemisch (Racemat) von (R)- und (S)-4-Methyl-1,3-dioxolan-2-on eingesetzt. In der enantioselektiven Synthese werden bisweilen jedoch die reinen Enantiomeren (R)- oder (S)-4-Methyl-1,3-dioxolan-2-on genutzt.
Sicherheitstechnische Kenngrößen
Propylencarbonat bildet bei höherer Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 135 °C.[2] Die untere Explosionsgrenze liegt bei 2,3 Vol.‑% (98 g/m3).[2] Die Zündtemperatur beträgt 430 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
- Lösungsmittel zum Beispiel in Tinten, Farben, Universalreinigern, Teerentfernern, Nagellackentferner
- Kosmetik- und Hautpflegeprodukte, beispielsweise Lippenstift oder Mascara. Es dient üblicherweise als Lösungsmittel für einige der Zutaten, um eine gleichmäßige Durchmischung zu gewährleisten. Außerdem verringert es die Viskosität des Produkts. Übliche Konzentrationen sind von kleiner 0,1 % bis maximal 5 %.[8]
- In medizinischen Salben erleichtert es das Lösen oder Dispergieren der Wirkstoffe.[9]
- Entfettung von Metallen, Reinigung[10]
- Extraktionsmittel für aromatische Kohlenwasserstoffe
- Lösungsmittel für die Elektrolyte in Lithiumionenakkumulatoren
- Elektrolytsysteme für elektrochemische Untersuchungen und galvanische Abscheidung stark elektropositiver Metalle (z. B. Alkalimetalle, Lanthanoide) und leitfähiger Kunststoffe wie Polymethylthiophen (Elektropolymerisation)
- Kernsandbindemittel in der Gießerei-Industrie und als Quellmittel für spezielle Tonminerale z. B. bei Farben, Kosmetika oder Schmiermitteln
- Zwischenprodukt in der chemisch-organische Synthese / Reaktant
- Weichmacher für Kunststoffe
- Flüssigkeit in Flüssigkeitsthermometern[11]
Literatur
- N. Holstein, Elektrochemische Abscheidung von Sm-Co-Legierungen aus aprotischen Elektrolyten, Shaker Verlag, 2000, ISBN 3-8265-7748-5.
- R. Schmitz, Electronic and ionic conductivity of poly(3-methylthophene) films, Shaker Verlag, 1999, ISBN 90-423-0085-X.
- B. Schäffner, S. P. Verevkin, A. Börner: Organische Carbonate. Grüne Lösungsmittel für Synthese und Katalyse, Chemie in Unserer Zeit, 2009, 43, S. 12–21; doi:10.1002/ciuz.200900468.
- B. Schäffner, F. Schäffner, S. P. Verevkin, A. Börner: Organic Carbonates as Solvents in Synthesis and Catalysis, Chemical Reviews, 2010, 110, S. 4554–4581; doi:10.1021/cr900393d.
Einzelnachweise
- Eintrag zu PROPYLENE CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- Eintrag zu Propylencarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. März 2019. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-444.
- Eintrag zu Propylene carbonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Buysch, H.-J.: Carbonic Esters in Ullmann’s Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a05_197.
- CRC-Handbook "Standard Thermodynamic Properties of Chemical Substances" 90. Aufl. (2009–2010), S. 5–26 (Memento vom 26. April 2015 im Internet Archive).
- Eintrag zu Propylencarbonat. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 22. März 2010.
- Why Is Propylene Carbonate Used In Skincare? In: The Dermatology Review. 2. Oktober 2020, abgerufen am 30. Oktober 2020 (amerikanisches Englisch).
- Pahala Simamora: In Vitro Bioequivalence Data for a Topical Product: Chemistry Review Perspective. Food and Drug Administration FDA, 20. Oktober 2017, abgerufen am 30. Oktober 2020 (englisch).
- J. R. H. Co: Propylene Carbonate in Cleaning & Degreasing Applications. In: https://www.jrhessco.com/. J R Hess & Co., abgerufen am 30. Oktober 2020 (amerikanisches Englisch).
- Amarell Präzisions-Thermometer und Aräometer abgerufen am 21. August 2020.
