Carbanion
Als ein Carbanion (lies: Carb-anion) wird in der organischen Chemie ein negativ geladenes Kohlenstoffatom, an das meist ein oder mehrere elektronenziehende Substituenten (Carbonylgruppe in Aldehyden, Estern oder Ketonen sowie auch ein Nitril-Rest etc.) gebunden sind, bezeichnet.
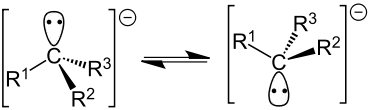
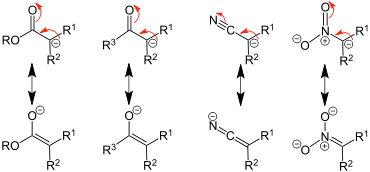
Im Gegensatz zum Carbeniumion sind primäre Carbanionen stabiler als sekundäre Carbanionen und diese stabiler als tertiäre Carbanionen.[3]
Das chemische Verhalten von Grignard-Verbindungen (RMgBr oder RMgCl) und Alkyllithiumverbindungen (RLi) entspricht dem eines negativ geladenen Alkylrestes (R−), eines Carbanions. Isonitrile (R–NC) reagieren ebenfalls wie Carbanionen, z. B. in der Passerini-Reaktion oder der Ugi-Reaktion.
Carbanionen treten häufig als reaktive Zwischenprodukte auf, die oft durch Mesomerie stabilisiert sind. Beispiele:
Carbanionen wurden als reaktive Zwischenprodukte bei der Kondensation von Benzoinen 1907 von R. W. L. Clarke und A. Lapworth[4] vorgeschlagen, von W. Schlenk und E. Marcus 1914[5] beim Studium der Umsetzung von Triphenylmethylchlorid mit Natrium nachgewiesen (sie untersuchten die Ionenstruktur der Verbindung über die elektrische Leitfähigkeit) und der Name 1933 von E. S. Wallis und F. H. Adams geprägt.[6]
Siehe auch
Positiv geladene Alkylreste werden Carbokation genannt. Ein Beispiel für ein Carbokation ist das Carbeniumion.
Einzelnachweise
- Ulrich Lüning: Organische Reaktionen, 2. Auflage, Elsevier GmbH, München, 2007, S. 108–111, ISBN 978-3-8274-1834-0.
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 128, ISBN 3-211-81060-9.
- Paula Yurkanis Bruice: Organische Chemie, Pearson Education Inc., 2007, 5. Auflage, S. 1081, ISBN 978-3-8273-7190-4.
- Clarke, Lapworth, J. Chem. Soc., Band 91, 1907, S. 694–705.
- Schlenk, Marcus, Berichte Deutschen Chem. Ges., Band 47, 1914, S. 164–1687.
- Wallis, Adams, J. Am. Chem. Soc., Band 55, 1933, S. 3838–3851. Nach Thomas T. Tidwell, The first century of Ketenes (1905–2005): the birth of a family of reactive intermediates, Angewandte Chemie, Int. Edition, Band 44, 2005, S. 5778.