Lactame
Lactame (Singular: das Lactam; Synonym: intramolekulares Amid, Kunstwort aus Lacton und Amid) nennt man cyclische organisch-chemische Verbindungen, die eine Amid-Bindung im Ring enthalten.

In der Nomenklatur werden den Namen von Lactamen griechische Buchstaben vorangestellt, die anzeigen, wie viele Kohlenstoffatome im Ring neben dem Carbonylkohlenstoff vorhanden sind. Sie geben auch die ursprüngliche Ständigkeit der Carboxy- zur Aminogruppe in der entsprechenden Aminocarbonsäure an. So besitzt z. B. ein δ-Lactam vier Kohlenstoffatome, den Carbonylkohlenstoff und den Stickstoff, sodass ein Sechsring vorliegt; in der Ausgangsaminocarbonsäure ist die Aminogruppe δ-ständig zur Carboxygruppe. Halbwegs stabil sind allerdings nur γ- und δ-Lactame. Aber auch sie werden durch Alkalien und Säuren in der Wärme in die entsprechenden Aminocarbonsäuren gespalten. Bei noch größerem Abstand zwischen Amino- und Carboxygruppe werden die Lactame unbeständiger und spalten sich in Gegenwart von wenig Wasser in ω-Aminosäuren, die leicht zu Makromolekülen kondensieren.
Eigenschaften
Lactame mit einem geeigneten Substitutionsmuster unterliegen der Lactam-Lactim-Tautomerie. Beispiel:
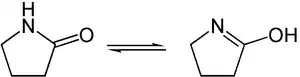
Herstellung
Beispiel einer Lactambildung der γ-Aminobuttersäure (GABA) zum γ-Butyrolactam:
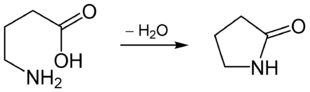
Analog werden andere Lactame meist aus ω-Aminocarbonsäuren durch Ringschluss unter Abspaltung von Wasser hergestellt. Aus offenkettigen Amiden mit mindestens je einer Kohlenstoff-Kohlenstoff-Doppelbindung an beiden Enden des Moleküls kann man durch Ringschluss-Metathese ebenfalls Lactame synthetisieren.[1]
β-Lactame lassen sich mit der Kinugasa-Reaktion[2] oder aus Iminen und Ketenen durch die sog. Staudinger Synthese herstellen.[3]
ε-Caprolactam kann über die sauer katalysierte Beckmann-Umlagerung aus dem Oxim des Cyclohexanons hergestellt werden. Jährlich werden über 2 Mio. t ε-Caprolactam produziert.[4]
Verwendung
ε-Caprolactam bildet kettenförmige Makromoleküle, die als Kunststoff unter der Bezeichnung Polyamid bekannt sind und im industriellen Maßstab erzeugt werden. Thiolactame werden aus Lactamen durch die Umsetzung mit Lawesson-Reagenz oder Phosphorpentasulfid hergestellt.[5]
Einzelnachweise
- Martin Watzke, Knut Schulz, Katharina Johannes, Pascal Ulrich und Jürgen Martens: First Synthesis of Bi- and Tricyclic α,β,-Unsaturated δ-Oxacaprolactams from Cyclic Imines via Ring-Closing Metathesis, European Journal of Organic Chemistry 2008, 3859–3867.
- M. Kinugasa, S. Hashimoto: J. Chem. Soc. Chem. Commun. 1972, 466–467.
- Hermann Staudinger: Zur Kenntnis der Ketene. Diphenylketen. In: Justus Liebigs Annalen der Chemie. Band 356, Nr. 1–2. John Wiley & Sons, Inc., 1907, S. 51–123, doi:10.1002/jlac.19073560106.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 2304.
- A. Kleemann, J. Martens, K. Drauz: Synthese von Prolin aus Glutaminsäure, Chem.-Ztg. 105 (1981) 266.
