Cyclohexanol
Cyclohexanol ist ein sekundärer Alkohol der sich vom Cyclohexan ableitet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
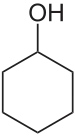 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cyclohexanol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H12O | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses, kristallines Pulver mit campherartigem Geruch[4] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 100,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[4] | |||||||||||||||||||||
| Dichte |
0,95 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
161 °C[4] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (40 g·l−1 bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
Cyclohexanol kommt natürlich in Okra (Abelmoschus esculentus), Tomaten (Lycopersicon esculentum) und Basilikum (Ocimum basilicum) vor.[8]
 Okra
Okra Tomate
Tomate Basilikum
Basilikum
Gewinnung und Darstellung
Cyclohexanol fällt gemeinsam mit Cyclohexanon bei der katalytischen Oxidation von Cyclohexan mit Luftsauerstoff an. Diese radikalische Reaktion verläuft über ein instabiles Zwischenprodukt, das Cyclohexanhydroperoxid, welches spontan zu den beiden Produkten zerfällt. Das Produktgemisch kann durch Destillation getrennt werden.
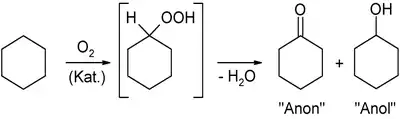
Alternativ kann Cyclohexanol durch katalytische Hydrierung von Phenol erhalten werden:
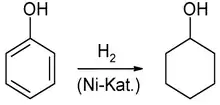
Eigenschaften
Cyclohexanol schmilzt bei 24 °C und siedet bei 161 °C. Cyclohexanol löst sich gut in Ethanol. In Wasser lösen sich bei 20 °C 56,7 g Cyclohexanol je Liter. Die farblosen Kristalle riechen campherartig.[4] Der Flammpunkt liegt bei 68 °C, die Zündtemperatur bei 290 °C. Mit einer Dichte von 0,95 g/cm3 ist es leichter als Wasser. Cyclohexanol ist bei Raumtemperatur leicht viskos, meistens allerdings gefroren.
Reaktionen
Cyclohexanol reagiert mit elementarem Chlor im Sonnenlicht zu Tetrachlorcyclohexanon. Dieses kann mit Aluminiumtriisopropylat zu Tetrachlorcyclohexanol umgesetzt werden, ein Beispiel für die Meerwein-Ponndorf-Verley-Reduktion. Durch Erhitzen wird 2,6-Dichlorphenol erhalten.[9]
Verwendung
Extraktions- und Lösungsmittel zur Herstellung von Lacken und Kunststoffen, Zwischenprodukt für chemische Synthesen, Standardbezugssubstanz in der Gaschromatographie. Bis in die 1980er-Jahre auch als Verdunsterflüssigkeit für Heizkostenverteiler verwendet.
Sicherheitshinweise
Cyclohexanol ist gesundheitsschädlich und schwach wassergefährdend.
Weblink
Einzelnachweise
- CYCLOHEXANOL – Occupational Safety and Health Administration. In: osha.gov. Abgerufen am 24. Oktober 2021 (englisch).
- Cyclohexanol. In: webbook.nist.gov. Abgerufen am 24. Oktober 2021 (englisch).
- Eintrag zu CYCLOHEXANOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu Cyclohexanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Cyclohexanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- The MAK Collection for Occupational Health and Safety: Cyclohexanol, 2010, doi:10.1002/3527600418.mb10893d0048.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 108-93-0 bzw. Cyclohexanol), abgerufen am 2. November 2015.
- CYCLOHEXANOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 29. August 2021.
- O. Hassel, K. Lunde: Tetrachloro-Cyclohexanone and Tetrachloro-Cyclohexanol Obtained from Cyclohexanol. In: Acta Chem. Scand. 1950, 4, S. 200–204, doi:10.3891/acta.chem.scand.04-0200.
