γ-Butyrolacton
γ-Butyrolacton (nach IUPAC-Nomenklatur: Oxolan-2-on, abgekürzt oft auch als GBL bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Lactone, genauer gesagt ist es das Lacton der γ-Hydroxybuttersäure (GHB). Es wird hauptsächlich als Lösungsmittel in der Industrie und als Ausgangsstoff zur Herstellung von Pharmazeutika und Chemikalien eingesetzt. Daneben dient es als Vorläuferstoff des Betäubungsmittels GHB; in Europa und den USA wird die Abgabe von GBL daher durch das sogenannte Monitoring (Name für freiwillige Selbstkontrolle der Händler und Hersteller) überwacht.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
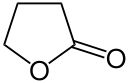 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | γ-Butyrolacton | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit schwachem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,13 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
204–206 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser und Ethanol[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
In der Natur kommt GBL in Spuren z. B. als Umbauprodukt der natürlichen 4-Hydroxybutansäure und auch in Wein vor.[6] Es wird industriell aus Bernsteinsäure oder 1,4-Butandiol synthetisiert.
Gewinnung und Darstellung
γ-Butyrolacton wird großtechnisch durch Dehydrierung und gleichzeitiger Cyclisierung von 1,4-Butandiol bei Temperaturen von 180–300 °C unter Normaldruck an Kupferkontakten als Katalysator hergestellt.[7]
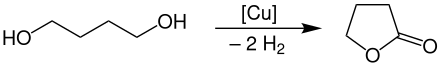
Die Ausbeute bei diesem Verfahren beträgt ungefähr 95 %. Das Produkt kann durch Abtrennung aus der Wasserstoff-Gasphase relativ einfach gewonnen werden.[7]
Dieses Verfahren wird hauptsächlich von BASF, Ashland und LyondellBasell durchgeführt.[7]
Darüber hinaus kann GBL auch durch eine innere Veresterung von γ-Hydroxybuttersäure in saurem Milieu synthetisiert werden. Umgekehrt wird γ-Hydroxybuttersäure durch die Verseifung von GBL in basischem Milieu hergestellt.
Eigenschaften
Physikalische Eigenschaften
GBL ist eine bei Raumtemperatur farblose Flüssigkeit mit schwachem Geruch.
Die Schmelztemperatur von γ-Butyrolacton liegt bei −43,5 °C, der Siedepunkt bei 206 °C. Zusammen mit Wasserdampf ist GBL flüchtig bei Temperaturen, die unter dem eigentlichen Siedepunkt von GBL liegen. Der Flammpunkt und die Zündtemperatur liegen bei 100 beziehungsweise 455 °C. Die Dichte von GBL beträgt 1,128 g/cm3.
Löslich ist γ-Butyrolacton in jedem Verhältnis mit Wasser, Methanol, Ethanol, Aceton, Ether, Dichlormethan, Toluol und Propylenglycol. Allerdings ist die Löslichkeit von GBL in aliphatischen Kohlenwasserstoffen stark begrenzt.
Die Viskosität von GBL ist relativ gering und mit der von Wasser vergleichbar.
Chemische Eigenschaften
GBL reagiert durch partielle Hydrolyse zu γ-Hydroxybuttersäure in Wasser leicht sauer. Die Substanz wird durch wässrige Alkalien quantitativ hydrolysiert. Wasserfreie Basen können ein Proton am C2-Atom abstrahieren (C-H-acide Verbindung, Bildung des Enolats), das dadurch einem nukleophilen Angriff zugänglich wird.
GBL ist wie Essigsäureethylester oder Aceton ein polar aprotisches Lösungsmittel und löst viele Kunststoffe wie Polyester oder PMMA.
Pharmakokinetik
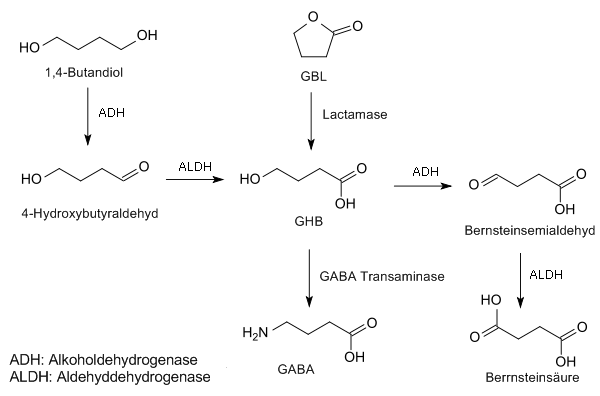
GBL wird im menschlichen Blut durch die 1,4-Lactonase zu GHB hydrolysiert. Die Resorbierung von GBL erfolgt bei oraler Aufnahme schneller als von GHB, so dass der Plasmaspiegel von GHB bei der Einnahme von GBL schneller ansteigt als bei Einnahme von GHB selbst. Die Plasmahalbwertszeit von GBL beträgt auf Grund rascher Metabolisierung zu GHB weniger als 60 s, das heißt, fünf Minuten nach der Einnahme von GBL sind im Körper noch etwa 3 % des γ-Butyrolactons vorhanden. Primär wird GHB durch Alkoholdehydrogenase (ADH)/Aldehyddehydrogenasen (ALDH) im Körper zu Bernsteinsäure metabolisiert, die ihrerseits in den Citratzyklus übergeht. Als Abbauprodukte bleiben letztlich nur Kohlenstoffdioxid und Wasser übrig. Zu geringen Teilen entstehen auch Metabolite durch β-Oxidation, die renal ausgeschieden werden.
Verwendung
Industrie
GBL ist ein weit verbreitetes Lösungsmittel in der Industrie und wird auch als Farbentferner, Graffitientferner, Reinigungsmittel und Nagellackentferner verwendet. Es ist als Weichmacher in Weich-PVC-Folien enthalten und als Elektrolytbestandteil in Elektrolytkondensatoren.
Darüber hinaus dient GBL auch als Ausgangsstoff zur Herstellung von Pharmazeutika und Chemikalien für die Landwirtschaft.
Für die chemische Industrie ist GBL unersetzlich, was der wesentliche Grund dafür ist, dass es im Gegensatz zu GHB nicht als illegales Betäubungsmittel eingestuft wird. GBL findet seit dem Verbot von GHB (Liquid Ecstasy) auch als Droge Verwendung und dient zudem als Grundstoff für die Herstellung von GHB.
Im November 2007 machte GBL Schlagzeilen als Bestandteil einer Knetmasse für Kinder. Durch Verschlucken der Knetmasse sind einzelne Kinder angeblich „in einen narkotischen Zustand“ gefallen, d. h., sie bekamen die Wirkung von GBL als Schlafmittel zu spüren.
Droge
GBL ist auch als Partydroge bekannt, da es innerhalb weniger Sekunden im menschlichen Körper zu GHB umgewandelt wird, das ebenfalls als Droge bekannt ist. Ersteres insbesondere, nachdem der Erwerb von GHB – beispielsweise in Deutschland ab 2002 – rechtlich erschwert wurde. Während ursprünglich GHB die Szenenamen Liquid Ecstasy, Liquid E oder schlicht G (englisch ausgesprochen) trug, wird mittlerweile auch GBL so bezeichnet, da meist diese Substanz effektiv konsumiert wird. Im Drogen- und Suchtbericht der Bundesregierung wird GBL stets nur zusammengefasst mit GHB unter der Begrifflichkeit „GHB/GBL“ erwähnt[8].
GBL erzielt annähernd dieselbe Wirkung wie GHB, allerdings gibt es aus Sicht der Konsumenten bis zum Wirkungseintritt einige Unterschiede:
- GBL muss im Vergleich zu GHB deutlich niedriger (etwa mit dem Faktor 0,5) dosiert werden, um dieselbe (GHB-)Wirkung zu entfalten. Eine typische (Party-)Dosis liegt daher bei GBL meist bei 1,0 bis maximal 2,0 ml.
- GBL bewirkt einen schnelleren Wirkungseintritt im Vergleich zu GHB (s. obiger Abschnitt Pharmakokinetik).
- GBL muss stärker verdünnt werden (s. Abschnitt Schäden durch Dauerkonsum).
- GBL hat einen stärkeren Eigengeschmack, der oft als sauer beschrieben wird, während GHB einen eher geringen Eigengeschmack hat.[9]
Für weitere Informationen zur Wirkung und zum Nachweis als Droge siehe Hauptartikel GHB.
Risiken
Schäden durch Dauerkonsum
Bei unverdünntem GBL-Konsum durch den Menschen wird die Speiseröhre, Magenschleimhaut, Dick- und Dünndarmzellen angegriffen, auch kann die Wundheilung verzögert werden. Unverdünntes GBL löst zudem Calcium aus dem Zahnschmelz. Drogenberatungsstellen und Safer-Use-Initiativen empfehlen daher meist eine Verdünnung von 1:100 bis 1:300 (1 ml GBL auf 100–300 ml alkoholfreie Flüssigkeit).[10] Eine weitere Gefahr stellen in diesem Zusammenhang Verunreinigungen dar, die in dem nicht analysenreinen Industrie-GBL enthalten sein können.
Mischkonsum und Überdosierung
Da GBL im menschlichen Körper innerhalb von Sekunden zu GHB verstoffwechselt wird, gelten alle Risiken für den Konsum von GHB im Prinzip auch für den Konsum von GBL, zusätzlich zu den Eigenrisiken von GBL (s. vorherigen Abschnitt Schäden durch Dauerkonsum). Eine Überdosierung kann bei GBL zudem schneller herbeigeführt werden, da GBL nur etwa halb so stark dosiert werden darf wie GHB, wenn man denselben (GHB-)Effekt erzielen will.
Für weitere Informationen zu den Risiken als Droge siehe im Hauptartikel GHB den dortigen gleichnamigen Abschnitt.
Toxizität
Die Toxizität von GBL wurde auf Grund seiner vielfältigen Verwendung in der chemischen Industrie, unter anderem auch bei der Produktion von Lebensmitteln, recht eingehend erforscht. Tierversuche haben ergeben, dass GBL innerhalb weniger Minuten zu GHB metabolisiert wird und binnen zwei bis drei Stunden als CO2 mit der Atemluft wieder ausgeschieden wird. Für Mäuse liegt die mittlere letale Dosis bei einmaliger Verabreichung von GBL im Bereich zwischen 0,5 und 1,8 g pro Kilogramm Körpergewicht. Mehrmonatige Verabreichungen an Tiere in kleineren Dosierungen sind ohne Schäden überstanden worden.[11] GBL ist weder gentoxisch noch krebserregend. Bei Überdosierung kann GBL jedoch tödlich sein (s. o.).
Sicherheitshinweise
GBL ist eine schleimhautreizende, gesundheitsschädliche Substanz. Daher müssen beim Arbeiten mit GBL eine Schutzbrille und Schutzhandschuhe getragen werden. Mit GBL verunreinigte Kleidung muss sofort entfernt werden. Zudem muss beim Arbeiten mit GBL für eine gute Belüftung gesorgt werden. Nach Hautkontakt müssen betroffene Stellen mit Seife und Wasser gründlich abgewaschen werden, Haut jedoch nicht schrubben. Nach Augenkontakt muss das betroffene Auge mindestens 15 Minuten mit fließendem Wasser gespült werden und anschließend ein Augenarzt aufgesucht werden. Wird GBL versehentlich verschluckt, muss der Mund sofort mit Wasser gespült und reichlich Wasser nachgetrunken werden.
Brennendes GBL kann mit Wasser, Trockenlöschmitteln, Schaum und Kohlenstoffdioxid gelöscht werden, wobei Chemikalienschutzkleidung getragen werden muss. Kontaminiertes Löschwasser muss getrennt gesammelt werden und darf nicht in die Kanalisation gelangen.
GBL muss an einem gut belüfteten Ort und getrennt von Alkalien und basenbildenden Substanzen gelagert werden.
Rechtliche Situation
Deutschland
GBL ist nicht im Betäubungsmittelgesetz aufgeführt, doch wird in Europa auf eine freiwillige Kontrolle der Abgabe durch die Vertreiber vertraut (Monitoring). Der Besitz ist nicht strafbar, ist aber durch das Chemikaliengesetz und die GefStoffV geregelt. Strafbar ist der Missbrauch von GBL zur Synthese (Herstellung) von GHB.[12] In den letzten Jahren war auf Grund des Verbotes von GHB ein Anstieg des GBL-Konsums zu beobachten.
GBL fällt unter Umständen unter die Legaldefinition des § 2 Abs. 1 AMG. Dann sind Herstellung und Verkauf nach dem AMG reguliert, unabhängig davon, in welcher Form es vorliegt,[13][14] und bedürfen einer Genehmigung. Dies wurde in einem Urteil des Bundesgerichtshofs bestätigt.[12][15]
Inwieweit diese Entscheidung nach dem Urteil vom 10. Juli 2014 des Europäischen Gerichtshofs[16] noch haltbar ist, ist rechtlich umstritten. Der EuGH hatte sinngemäß geurteilt, dass das AMG nur angewendet werden kann, wenn es sich bei der entsprechenden Substanz um ein Arzneimittel handle und nicht bei Stoffen, „die nur konsumiert werden, um einen Rauschzustand hervorzurufen, und die dabei gesundheitsschädlich sind“.[15] Aktuelle Kommentare zum Arzneimittelgesetz spiegeln diese Rechtslage wider.[17] Es gibt jedoch zur Zeit keine neuere Entscheidung deutscher Bundesgerichte im Bezug auf GBL.
Australien
In Australien ist GBL eine border controlled substance und die Einfuhr ohne Erlaubnis illegal.[18]
Kanada
GBL ist in Kanada eine Controlled Substance nach Schedule VI des Controlled Drugs and Substances Act.[19]
Hongkong
In Hongkong wird GBL als dangerous drug controlled under Schedule 1 nach der Dangerous Drugs Ordinance, Cap.134 mit Ausnahmen nach Paragraph 16D behandelt.
Israel
GBL ist in Israel seit 2007 als verschreibungspflichtig klassifiziert.[20]
Niederlande
In den Niederlanden ist GBL als Reinigungsmittel frei erhältlich.[21]
Schweden
GBL ist in Schweden als gesundheitsgefährdender Stoff eingestuft, seit 2011 als controlled substance.[22]
Schweiz
GBL ist in der Schweiz ein Betäubungsmittel, soweit der Stoff nicht industriell eingesetzt wird. Der private Umgang ist damit wie bei jedem anderen Betäubungsmittel strafbar.[23]
Vereinigtes Königreich
Nach regulation 4B von 2001 ist die Einfuhr, Ausfuhr, Herstellung, Vertrieb und Besitz von GBL und 1,4-BD gestattet, sofern es nicht zum menschlichen Konsum beabsichtigt ist.[24][25]
USA
GBL ist in den USA als List 1 controlled chemical klassifiziert. Als Analogon von GHB ist es eine Schedule I controlled substance nach dem Controlled Substances Act, wenn es für den menschlichen Konsum verwendet wird.[26]
Weblinks
- The Emergence of GHB Alternatives(GBL als GHB Alternative-engl.)
- The Commercial Chemistry of GHB (Zusammenhang GHB/GBL chemisch-engl.)
- Toxikologische Bewertung von γ-Butyrolacton (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.
- Anfragen über GBL- u. GHB-Vergiftungen an das Toxzentrum der Schweiz
Einzelnachweise
- Eintrag zu BUTYROLACTONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu gamma-Butyrolacton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt γ-Butyrolacton (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu gamma-Butyrolactone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 23. April 2016.
- CRC-Handbook 90. Auflage (2009–2010), S. 5–26 (Memento vom 26. April 2015 im Internet Archive). – Siehe auch Eintrag zu Butyrolactone. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 1. März 2016.
- J. Vose, T. Tighe, M. Schwartz, E. Buel: Detection of gamma-butyrolactone (GBL) as a natural component in wine. In: Journal of Forensic Sciences. Band 46, Nr. 5, 2001, S. 1164–1167, PMID 11569560.
- Wolfgang Schwarz, Jürgen Schossig, Roland Rossbacher, Rolf Pinkos, Hartmut Höke: Butyrolactone. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 17. Mai 2019, S. 2f., doi:10.1002/14356007.a04_495.pub2.
- Die Drogenbeauftragte der Bundesregierung: Drogen- und Suchtbericht Mai 2015. Online unter Archivierte Kopie (Memento vom 22. Juli 2015 im Internet Archive), abgerufen am 15. September 2015
- http://www.drogen-info-berlin.de/htm/ghb.htm
- https://drugscouts.de/de/lexikon/gbl
- NTP Study Reports TR-406: Toxicology and Carcinogenesis Studies of γ-Butyrolactone (CAS No. 96-48-0) in F344/N Rats and B6C3F1 Mice (Gavage Studies) oder Cognitive Enhancement Research Institute Discussion.
- BGH, Urteil vom 8. Dezember 2009, Az. 1 StR 277/09, Volltext.
- Erwin Deutsch, Hans-Dieter Lippert (Hrsg.): Kommentar zum Arzneimittelgesetz (AMG). Springer, 2010, S. 64–66 (eingeschränkte Vorschau in der Google-Buchsuche).
- § 2 Abs. 1 Nr. 5 a.F., § 2 Abs. 1 Nr. 2a n.F., § 5, § 95 Abs. 1 Nr. 1.
- Strafrecht: Handel mit Gamma-Butyrolacton (GBL; liquid ecstasy) zu Konsumzwecken
- EuGH, Urteil vom 10. Juli 2014, Az. C-358/13, C-181/14, C-358/13, C-181/144, Volltext.
- Kügel, Müller, Blattner: Arzneimittelgesetz, Kommentar; 2. Auflage, 2016; C.H. Beck Verlag; Rn. 86, Rn. 99.
- LAW AND JUSTICE LEGISLATION AMENDMENT (SERIOUS DRUG OFFENCES AND OTHER MEASURES) ACT 2005 NO. 129, 2005 – SCHEDULE 1.
- Controlled Drugs and Substances Act (S.C. 1996, c. 19).
- section 7c of chapter B of part A of the 1st appendix of the Dangerous Drugs Act 1973.
- Verkopers schoonmaakmiddel verdienen fors aan partydrug GHB (Dutch) In: Trouw. 11. April 2012. Abgerufen am 11. April 2012.
- Socialutskottets betänkande 2010/11:SoU5 – Riksdagen.
- Entscheid des Schweizerischen Bundesgerichts vom 15. Juli 2014 (6B_1067/2013) E. 1.5
- A Change to the Misuse of Drugs Act 1971: Control of GBL, 1,4-BD, BZP and related piperazine compounds, a further group of anabolic steroids and 2 non-steroidal agents, synthetic cannabinoid receptor agonists and oripavine
- UK Statutory Instrument 2011 No. 448. 18. Februar 2011. Abgerufen am 16. Januar 2015.
- Information Bulletin: GHB Analogs; GBL, BD, GHV, and GVL.

