Wasserstoffspeicherung
Die Wasserstoffspeicherung ist die umkehrbare Aufbewahrung von Wasserstoff, mit dem Ziel, dessen chemische und physikalische Eigenschaften für eine weitere Verwendung zu erhalten. Die Speicherung umfasst die Vorgänge der Einspeicherung oder Speicherbeladung, der zeitlich befristeten Lagerung und der Ausspeicherung oder Speicherentladung. Konventionelle Methoden der Speicherung von Wasserstoff sind:
- Druckgasspeicherung (Speicherung in Druckbehältern durch Verdichten mit Kompressoren)
- Flüssiggasspeicherung (Speicherung in verflüssigter Form durch Kühlung und Verdichten)
Alternative Formen der Speicherung von Wasserstoff nutzen die physikalische oder chemische Bindung an einen anderen Stoff:
- Absorption im Metallhydridspeicher (Speicherung als chemische Verbindung zwischen Wasserstoff und einem Metall bzw. einer Legierung)
- Adsorptionsspeicherung (adsorptive Speicherung von Wasserstoff in hochporösen Materialien)
- chemische Bindung, bei der der Wasserstoff durch eine chemische Reaktion in einen anderen Stoff überführt wird, der z. B. drucklos und bei Raumtemperatur gelagert und transportiert werden kann („Chemisch gebundener Wasserstoff“). Bei der Ausspeicherung erfolgt dann die Umkehrreaktion. Beispiele sind Hydrierung organischer Substanzen oder Bildung von Alkoholen mit CO.
Problemstellung
Wegen seiner chemischen und physikalischen Eigenschaften unterscheidet sich der Umgang mit Wasserstoff von den bisher genutzten Energieträgern.
- Wasserstoff bildet beim Austreten ein entzündliches Gemisch mit der Umgebungsluft, bei einem Anteil von 4 % bis 75 %. Ein explosives Gemisch (Knallgas) bildet Wasserstoff erst bei einem Anteil von 18 %. Weil Wasserstoff eine hohe Diffusionsneigung hat und Gemischwolken aus Wasserstoff und Luft eine geringere Dichte als gewöhnliche Luft haben, verflüchtigt es sich in offener Umgebung in der Regel, bevor es ein explosives Gemisch bilden kann, oder es brennt in heißen Umgebungen bereits bei der Konzentration von 4 % ab.
- Wasserstoff hat im Vergleich zu vielen Kohlenwasserstoffen eine niedrige Verbrennungsenthalpie und damit eine niedrige volumenbezogene Energiedichte (ca. 1/3 von Erdgas). Das erfordert zum Speichern äquivalenter Energiemengen einen dreimal so großen Tank oder einen dreimal so hohen Druck wie für Erdgas. Auf Grund der geringen molaren Masse ergibt sich jedoch eine vergleichsweise hohe massenbezogene Energiedichte (z. B. mehr als die doppelte massenbezogene Energiedichte von Erdgas).
- Durch seine geringe Molekülgröße diffundiert Wasserstoff relativ gut durch eine Vielzahl von Materialien, sodass viele Materialien für die Tankhülle ungeeignet sind. Durch hohe Temperaturen und hohen Innendruck wird der Diffusionsprozess verstärkt. Durch Wasserstoffversprödung werden metallische Tankhüllen zusätzlich belastet. Bei Hüllen aus Kunststoff tritt dieser Effekt nicht auf.
- Bei der kryogenen Wasserstoffverflüssigung kommt es durch unvermeidbare thermische Isolationsverluste zum Verdampfen/Ausgasen. Damit der Druck in den Behältern nicht zu hoch steigt, wird das Wasserstoffgas mittels eines Überdruckventils abgelassen. Kann dieses entstehende Wasserstoffgas nicht genutzt werden, entstehen erhebliche Verluste. Beispielsweise leert sich der halbvolle Flüssigwasserstofftank des BMW Hydrogen7 bei Nichtbenutzung in 9 Tagen.[1]
- Nicht nur zur Herstellung von Wasserstoff, sondern auch zur Speicherung werden große Energiemengen benötigt (Kompression ca. 12 %, Verflüssigung ca. 20 %). Daher ist die Wasserstoffspeicherung trotz vieler Vorteile derzeit (2021) oftmals unwirtschaftlich.
Arten der Wasserstoffspeicherung
Druckwasserstoffspeicherung
Die Probleme der Speicherung in Druckbehältern gelten heute als gelöst. Waren für den Kfz-Bereich um das Jahr 2000 noch Drucktanks mit 200 bis 350 bar üblich, so sind es 2011 schon 700- und 800-bar-Tanks mit höherer Kapazität. Das komplette Wasserstoff-Tanksystem für einen Pkw soll nur noch 125 kg wiegen.[2] Der Energieaufwand für die Komprimierung auf 700 bar beträgt ca. 12 % des Energieinhaltes des Wasserstoffs[3]. Die heute im kommerziellen Einsatz befindlichen Drucktanks entsprechen allen Sicherheitsanforderungen der Fahrzeughersteller[4] und sind vom TÜV abgenommen.[5] Der immer wieder genannte Schwund durch Diffusion ist und war noch nie ein tatsächliches Problem, da die relative Verlustmenge theoretisch zwar höher ist als bei anderen Gasen, jedoch praktisch keinerlei Relevanz hat, da die Mengen extrem gering sind.[6][7]
Ein Sonderfall der Druckwasserstoffspeicherung mit sehr hoher Speicherkapazität ist die Speicherung in unterirdischen Gasspeichern (z. B. Salzkavernen-Speicher) ähnlich den Speichern im Erdgasnetz. Ebenso können speziell erstellte Rohrleitungen als Speicher dienen. → Siehe : Wasserstoffrohrleitung
Flüssigwasserstoffspeicherung

Für große Mengen werden Flüssiggasspeicher eingesetzt. Weil oberhalb des kritischen Punktes (−240 °C, 1,3 MPa = 13,0 bar) keine Druckverflüssigung mehr möglich ist, wird der Wasserstoff zur Verflüssigung stark gekühlt und verdichtet (LH2).
Der Energieaufwand dazu lässt sich in folgende Anteile gliedern[3], jeweils bezogen auf den gespeicherten Energieinhalt:
- 28…46 % für die Verflüssigung je nach Menge und angewandter Methode[8]
- 6 % Transport zwischen Verflüssigungsstation und Tankstelle (Diesel- und Ottokraftstoffe 0,2 %)
- Bis zu 3 % je Tag durch boil-off Verluste (s. u.)
- Verdampfungsverluste beim Umfüllen
Der Druck stellt dann für die Gestaltung des Tanks kein Problem mehr dar. Ein großer Aufwand muss aber bei der Wärmedämmung des Tanks und der Leitungen betrieben werden. Vorteilhaft ist die geringere Reaktivität bei tiefen Temperaturen und die um den Faktor 800 höhere Dichte des flüssigen Wasserstoffs im Vergleich zu gasförmigem Wasserstoff bei Umgebungsdruck. Trotzdem benötigt flüssiger Wasserstoff je Gewichtseinheit viel Platz. Er hat mit 71 kg/m³ eine nur minimal höhere Dichte als kleinporig geschäumtes Polystyrol (in einen 20-Liter-Eimer passen nur 1,42 kg Flüssigwasserstoff, das entspricht etwa einem Zehntel dessen von Benzin). Nachteilig ist, dass durch die sehr niedrige Temperatur im Inneren des Tanks auch bei guter Wärmedämmung ein Wärmestrom aus der Umgebung nicht zu vermeiden ist. Dieser führt zu einer teilweisen Verdampfung des Wasserstoffs. Um einen Druckaufbau zu vermeiden, muss dieser Wasserstoff, bei unstetiger oder Nicht-Abnahme des entstehenden Wasserstoffgases, abgelassen werden (sogenannte Boil-Off-Verluste). Durch weitere Maßnahmen (boil off management) lassen sich die Verluste durch Verdunstung minimieren, bei stationären Anwendungen z. B. durch Kopplung mit einem Blockheizkraftwerk (BHKW).
Für den Einsatz in Automobilen wurden Tankroboter entwickelt, die die Kopplung und das Betanken übernehmen. Der Energieaufwand zur Verflüssigung fällt nur einmalig an, späteres Umfüllen benötigt relativ wenig Energie, erzeugt aber zusätzliche Ausgasungsverluste. Auch der Transport von der Fabrik mit Tanklastzügen zu Tankstellen/Lagertanks kostet durch das große Volumen und die geringe Energiedichte bis 6 % der eingesetzten Energie – ein Vielfaches gegenüber der Verteilung von flüssigen Kraftstoffen (0,2 %).[8]
Transkritische Speicherung (cryo compressed)
Bei beengten Platzverhältnissen ermöglicht die Kombination der oben genannten Varianten wesentlich höhere Speicherdichten von bis zu 100 kg/m³. Dabei erfolgt die Speicherung wie bei der Druckgasspeicherung oberhalb der kritischen Temperatur und des kritischen Druckes bei bis zu 1000 bar. Damit entspricht der Speicherdruck der Druckgasspeicherung, die Speichertemperatur liegt jedoch mit −220 °C (53 K) über der von Flüssigwasserstoff. Dem Vorteil der hohen Speicherdichte steht der notwendige Aufwand für den Drucktank und die thermische Dämmung gegenüber.
Metallhydridspeicher
Eine andere Möglichkeit zur Druckverringerung des molekularen Wasserstoffes ist die Lösung in anderen Speichermitteln. Wegen seiner weitgehend elektrisch und magnetisch neutralen Eigenschaften verwendet man kein flüssiges Lösungsmittel, sondern feste Speicherstoffe wie Metallhydride. Der Wasserstoff wird in den Lücken des Metallgitters eingelagert. Dieser Vorgang ist temperaturabhängig, die Speicherfähigkeit sinkt bei hohen Temperaturen, so dass der Wasserstoff bei Erwärmung des Speichers wieder abgegeben/ausgespeichert wird. Ein Kubikmeter Metallhydrid enthält mehr Wasserstoffatome als ein Kubikmeter verflüssigter Wasserstoff. In Metallhydridspeichern kann fünfmal so viel Energie gespeichert werden als elektrische Energie in Bleiakkumulatoren gleichen Gewichts. Sie erwiesen sich aber für eine breite Anwendung als zu teuer, so dass sie nur in U-Booten verwendet werden, wo der Preis keine Rolle spielt.[9] Kritisch für die Auswahl der Materialien sind Absorptions- und Desorptionstemperatur und -druck, bei welchen Wasserstoff gespeichert und wieder abgegeben wird, und das hohe Gewicht des Tanks.
Forscher der Université Catholique de Louvain (Katholische Universität Löwen) in Belgien und der Universität Aarhus in Dänemark stellten 2011 eine neue hochporöse Form von Magnesiumborhydrid vor, die Wasserstoff chemisch gebunden und physikalisch adsorbiert speichern kann. Magnesiumborhydrid (Mg(BH4)2) gibt Wasserstoff bereits bei relativ niedrigen Temperaturen ab und speichert einen hohen Gewichtsanteil Wasserstoff (ca. 15 %).[10]
Im Februar 2021 veröffentlichte das Fraunhofer-Institut für Fertigungstechnik und Angewandte Materialforschung IFAM in Dresden eine Variante dieser Speicherform, die „Powerpaste“ genannt wird. Hierbei wird Magnesiumhydrid verwendet, um den Wasserstoff bei Raumtemperatur und Umgebungsdruck in Kartuschen zu speichern und bedarfsgerecht wieder freizusetzen. Das Material ist bis zu 250 °C stabil. Weitere Bestandteile sind Ester und Metallsalze. In dieser Form eignet sich die Speicherung besonders für Kleinfahrzeuge wie z. B. Roller, aber auch der Einsatz in Brennstoffzellen-PKW und Hybridfahrzeugen oder Drohnen ist möglich. Dabei wird nur die Hälfte des benötigten Wasserstoffs aus der Powerpaste zur Verfügung gestellt – die andere Hälfte stammt aus einem weiteren Wassertank. In der Kombination entsteht gasförmiger Wasserstoff. Das Institut verspricht eine deutlich höhere Energiedichte als bei herkömmlichen 700 bar-Drucktanks und die zehnfache Energiespeicherdichte als bei Batterien. Des Weiteren werden Vorteile bei der Infrastruktur hervorgehoben: die Paste ist fließfähig und pumpbar, kann jedoch auch an jeder beliebigen Tankstelle in Kartuschen angeboten werden. Derzeit wird eine Produktionsanlage im Fraunhofer-Projektzentrum für Energiespeicher und Systeme ZESS aufgebaut, die Ende 2021 für ein Pilotprojekt in Betrieb gehen und bis zu vier Tonnen pro Jahr produzieren soll.[11] Nicht betrachtet wurden dabei die Entsorgung des beim Entladungsprozess anfallenden Magnesiumhydroxids bzw. dessen Recyclings. Auch zu Kosten-, Umwelt- und Energiebilanz macht das Institut noch keine Angaben.[12]
Adsorptive Speicherung
Durch Anlagerung an die Oberfläche eines hochporösen Materials lässt sich prinzipiell die volumenbezogene Speicherdichte gegenüber Druckwasserstoff bei gleicher Temperatur und gleichem Druck erhöhen. Mögliche Materialien für die adsorptive Wasserstoffspeicherung sind beispielsweise Zeolithe, Metal Organic Frameworks, Carbon Nanotubes oder Aktivkohle. Da bei Raumtemperatur nur sehr wenig Wasserstoff adsorbiert, ist es aus thermodynamischen Gründen erforderlich, Adsorptionsspeicher bei niedrigeren Temperaturen zu betreiben. In einem Großteil der aktuellen Arbeiten zu diesem Thema wird die Aufnahmefähigkeit bei −196 °C (der Temperatur von Flüssigstickstoff) untersucht.[13] Die Abkühlung auf −196 °C zieht einen erheblichen Energiebedarf nach sich. Infolge der sehr niedrigen Temperaturen kommt es darüber hinaus wie bei Flüssigwasserstoff zu einem permanenten Wärmestrom ins Innere des Behälters, was zu Verlusten während der Lagerung führt. Infolgedessen weist Wasserstoffspeicherung durch Adsorption bei niedrigen Temperaturen nur eine sehr geringe Energieeffizienz auf.[14] Um die Verluste zu reduzieren wird gegenwärtig auch nach Materialien gesucht, die bei höheren Temperaturen (z. B. −78 °C; der Temperatur von Trockeneis) eingesetzt werden können. Die Energiedichten sind in diesen Fällen jedoch deutlich geringer und auch wenn höhere Wirkungsgrade erzielt werden können, sind die Verluste immer noch erheblich.[15]
Metal Organic Framework
Metall-organische Gerüste (engl. metal-organic frameworks, MOF) sind poröse Materialien mit wohlgeordneter kristalliner Struktur. Sie bestehen aus Komplexen mit Übergangsmetallen (meist Cu-, Zn-, Ni- oder Co) als „Knoten“ und organischen Molekülen (Liganden) als Verbindung („Linker“) zwischen den Knoten. Durch Verwendung geeigneter Knoten und Linker sowie durch Imprägnierung mit anderen Gastspezies können die MOF für die Wasserstoffspeicherung optimiert werden. Die MOF bilden ein aktives Forschungsfeld und werden als eine der vielversprechendsten Technologien zur Wasserstoffspeicherung angesehen.
Zeolithe
Zeolithe sind eine weitere Klasse von potentiellen Trägerstoffen, die für die adsorptive Wasserstoffspeicherung vorgeschlagen wurden.[16] Dabei handelt es sich um Alumosilikate mit definierten Porenstrukturen, die eine große innere Oberfläche aufweisen an der Stoffe wie Wasserstoff adsorbieren könnten.
Kohlenstoffträger
Verschiedene Hochoberflächenformen von Kohlenstoff wurden ebenfalls als Träger untersucht. Die mit Aktivkohle erzielbaren Speicherdichten sind jedoch sehr gering, so dass verstärkt an Kohlenstoffnanoröhren gearbeitet wurde.[17] Auch auf Kohlenstoffnanoröhren ist die Aufnahmekapazität aber wohl noch so gering, dass die Energiedichte für eine technisch sinnvolle Umsetzung nicht ausreicht.[18]
Andere adsorptive Trägermaterialien
Weitere Trägermaterialien wie TiO2-Nanoröhren[19] oder SiC-Nanoröhren[20] werden in der Fachliteratur auf ihre Eignung als Wasserstoffträger untersucht. Die Aufnahmefähigkeit ist dabei wohl etwas höher als bei kohlenstoffbasierten Trägern. Es werden Werte von etwa 2 Gew.-% Wasserstoff bei 60 bar angegeben.
Chemisch gebundener Wasserstoff
- Hauptartikel: Chemische Wasserstoffspeicher
Neben den Möglichkeiten der Speicherung von molekularem Wasserstoff gibt es eine ganze Reihe von Möglichkeiten des Transports und der Lagerung in chemisch gebundener Form. Diese Möglichkeiten zählen nicht zur Wasserstoffspeicherung im engeren Sinne, die sich auf den technischen Prozess der Lagerung von molekularem Wasserstoff bezieht. Im Rahmen einer Wasserstoffwirtschaft wird diese Möglichkeit jedoch dazu gezählt, da hier Speicherung und Entnahme von Wasserstoff der Gegenstand des produktiven Prozesses ist.
Da es sich bei den Wasserstoffträgern meist um organische Substanzen handelt, werden sie auch „Liquid Organic Hydrogen Carriers“ (LOHC, flüssige organische Wasserstoffträger) genannt.[21]
Methanol
Geeignet als Wasserstoffträger sind insbesondere Alkohole, z. B. Methanol. Methanol kann durch Reaktion von Wasserstoff mit CO bzw. CO2 hergestellt werden. Mittels Methanol-Reformierung kann man daraus wieder ein wasserstoffreiches Gasgemisch erzeugen. Dieses enthält allerdings erhebliche Anteile von Kohlenstoffmonoxid bzw. -dioxid. Insbesondere Kohlenstoffmonoxid kann bei der Verwendung in der Niedertemperatur-Brennstoffzelle jedoch Probleme verursachen, weshalb bei Brennstoffzellen-Anwendung von Methanol-Reformatgas beispielsweise die gegenüber Kohlenstoffmonoxid tolerantere Hochtemperatur-Polymerelektrolytmembran-Brennstoffzelle (HT-PEMFC) verwendet wird. Vorteile von Methanol sind die leichte Lagerung und Transport, für die keine Kühlung nötig ist, sowie die hohe Energiedichte. Es könnte in vielen Bereichen z. B. im Chemie- oder Verkehrssektor eingesetzt werden. Verglichen mit Methan als Speichermedium entfällt außerdem auch das Risiko von sehr klimaschädlichen Leckagen.
Liquid Organic Hydrogen Carrier (LOHC)
In Flüssigen Organischen Wasserstoffträgern (LOHC) wird Wasserstoff durch chemische Reaktion mit einer ungesättigten Verbindung (Hydrierung) chemisch an diese gebunden. Zur Freisetzung wird die bei der Einspeicherung entstandene gesättigte Verbindung wieder dehydriert, wobei die ungesättigte Verbindung zurückgebildet wird und gasförmiger Wasserstoff entsteht. Eine große Zahl von Stoffen kommt hierfür prinzipiell in Frage. Lediglich aromatische Verbindungen eignen sich jedoch für die technische Anwendung.
Toluol
Das älteste erforschte LOHC-System basiert auf der Hydrierung von Toluol zu Methylcyclohexan (bzw. der entsprechenden Rückreaktion). Dieses System wurde in einer Demonstrationsanlage gezeigt.[22] Aufgrund teilweise ungünstiger Eigenschaften werden jedoch seit einigen Jahren verstärkt andere Stoffe untersucht.
N-Ethylcarbazol
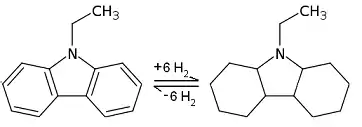
N-Ethylcarbazol gilt als vielversprechendster Kandidat unter den hydrierbaren organischen Substanzen. Für die Rückgewinnung des Wasserstoffs zum Betrieb eines Wasserstoffverbrennungsmotors oder einer Brennstoffzelle ist die relativ niedrige zur Freisetzung benötigte Temperatur von Vorteil. Das „entladene“ Carbazol kann an einer Tankstelle wieder gegen mit Wasserstoff „aufgeladenes“ Perhydro-N-Ethylcarbazol (auch Perhydro-Carbazol) ausgetauscht werden; die derzeitige Tankstellen-Infrastruktur könnte mit geringen Änderungen erhalten bleiben. Das Verfahren ist aber zurzeit (2011) noch im Entwicklungsstadium.[23]
Dibenzyltoluol
Nachdem die Forschung die reversible Hydrierung von Dibenzyltoluol als besonders vielversprechend für die Wasserstoffspeicherung nachgewiesen hatte, wurde 2016 die weltweit erste kommerzielle LOHC-Anlage zur Speicherung von Wasserstoff in Dibenzyltoluol eingeweiht. Sie wurde von der Hydrogenious Technologies GmbH entwickelt und erstellt. Mit Hilfe von Solarstrom aus einer 98 kWp-Photovoltaikanlage wird mittels PEM-Elektrolyse Wasserstoff erzeugt. Dieser wird in Dibenzyltoluol gespeichert. Das beladene Dibenzyltoluol kann dann unter Umgebungsbedingungen in konventionellen Tanks gelagert oder über weite Strecken transportiert werden. Bei Bedarf wird der gespeicherte Wasserstoff wieder freigesetzt. Durch Anbindung einer Brennstoffzelle oder eines Blockheizkraftwerks kann der freigesetzte Wasserstoff in Elektrizität oder nutzbare Wärme gewandelt werden. Ein Liter Dibenzyltoluol (LOHC) nimmt etwa 660 l Wasserstoff auf[24][25], was aber bei Normaldruck gravimetrisch nur ca. 60 Gramm Wasserstoff entspricht. Damit liegt die Energiedichte bei nur einem Zehntel von Diesel.
Einsatz

Bei den Verfahren zur technischen Speicherung von Wasserstoff in elementarer Form sind Druckbehälter erforderlich, wofür oft eine metallische Außenhülle verwendet wird. Das gilt auch für Flüssiggasspeicher und Metallhydridspeicher, die einen temperaturabhängigen Innendruck aufweisen. Für die Hochdruckspeicherung bei 700 bar finden auch kohlenstofffaserverstärkte Kunststoffe Verwendung, um das Gewicht des Tanks niedrig zu halten.
Für große Mengen in stationären Systemen sind derzeit Flüssiggasspeicher in Verwendung. Für kleine Mengen werden Druckspeicher bis 700 bar eingesetzt. Metallhydridspeicher werden dort verwendet wo das Speichergewicht keine große Rolle spielt, etwa auf Schiffen. Für Fahrzeuge und Flugzeuge werden wegen des geringen Gewichtes heute ausschließlich Drucktanks verwendet:
Toyota setzt ihn in seinem Brennstoffzellen-Fahrzeug FCHV-adv ein und erreicht damit eine Reichweite von 830 km.[26][27] Das Fahrzeug befindet sich bereits im kommerziellen Einsatz und kann geleast werden.[28]
Volkswagen baut einen 700-bar-Wasserstofftank im Tiguan HyMotion ein,[29] Mercedes im A-Klasse F-Cell „plus“ und Opel im HydroGen4.[30]
Bei Bussen werden inzwischen auch Drucktanks verwendet, wie z. B. im Citaro Fuel Cell Hybrid von Mercedes.[31]
Firmen, die in die Forschung und Produktion von Wasserstoffspeichern involviert sind, sind z. B. in Deutschland die Linde AG, in Norwegen und Island StatoilHydro[32] und in den USA Quantum Fuel Technologies Worldwide.[33]
Brennstoffzellen-Schienenfahrzeuge
Flugzeuge
Unfallgefahr
Die heute industriell eingesetzte Technik berücksichtigt die Hochentzündlichkeit des Wasserstoffes sowie seine Eigenschaft, explosives Knallgas zu bilden. Leitungen und Tanks sind entsprechend ausgelegt,[4][5] so dass im täglichen Gebrauch keine größeren Risiken entstehen als z. B. durch die Verwendung von Benzin.[34][35][36]
Wasserstofffahrzeuge mit Drucktanks können problemlos in Parkhäusern und Tiefgaragen geparkt werden. Es existiert keine gesetzliche Bestimmung, die das einschränkt. Fahrzeuge mit Flüssigwasserstoffspeichern dürfen wegen der unvermeidlichen Ausgasung nicht in geschlossenen Räumen abgestellt werden.
Energiedichten im Vergleich
Auf die Masse bezogen (in kWh/kg):[37][38]
- Wasserstoff: 33,3
- Wasserstoff-Speicher mit Perhydro-N-Ethylcarbazol: 1,9
- Erdgas: 13,9
- Benzin: 11,1–11,6 (40,1–41,8 MJ/kg)[39][Anmerkung 1]
- Diesel: 11,8–11,9 (42,8–43.1 MJ/kg)[39][Anmerkung 1]
- Methanol: 6,2
- LOHC (N-Ethylcarbazol): 1,93[40]
- Li-Ionen-Batterie: 0,2 (ca., abhängig vom Typ)
Auf das Volumen bezogen (in kWh/l)
- Wasserstoffgas (Normaldruck): 0,003
- Wasserstoffgas (20 MPa / 200 bar): 0,53
- Wasserstoffgas (70 MPa / 700 bar): 1,855
- Wasserstoffspeicherung mit Perhydro-N-Ethylcarbazol: 2,0
- Wasserstoff (flüssig, −253 °C): 2,36
- Erdgas (unter Druck bei 20 MPa): 2,58
- Methanol: 4,99
- Benzin: 8,2–8,6[39][Anmerkung 2]
- Diesel: 9,7[39][Anmerkung 2]
- LOHC (N-Ethylcarbazol): 1,89[40]
- Li-Ionen-Batterie: 0,25–0,675
Siehe auch
Weblinks
- Hydrogeit – der Wasserstoff-Guide
- Deutscher Wasserstoff und Brennstoffzellen-Verband e.V.
- Ingrid Rieck: Neuartiges Verfahren zur Erzeugung von Wasserstoff. Universität Rostock, Pressemitteilung vom 23. September 2011 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- "Power to Methanol – als Langzeitspeicher unverzichtbar für den Klimaschutz", Solarenergie Förderverein Deutschland e.V., Aachen
Einzelnachweise und Anmerkungen
- Unterwegs im Wasserstoff-7er. In: heise online, 22. November 2006, abgerufen am 8. Februar 2012
- Opel setzt auf Wasserstoff (Stand: 6. April 2011) (Memento vom 22. Februar 2012 im Internet Archive)
- Peter Kurzweil, Otto K. Dietlmeier: Elektrochemische Speicher. 2. Auflage. Springer Fachmedien, Wiesbaden 2018, ISBN 978-3-658-21828-7, 8.2 Wasserstoffspeicherung.
- (Seite nicht mehr abrufbar, Suche in Webarchiven: Anforderungen an Kunststoffe für Wasserstoff-Hochdrucktanks) (Quelle: Adam Opel GmbH, Stand: 30. Juni 2002)
- Hochleistungs-Wasserstofftank erhält TÜV-Zertifikat (Memento vom 26. Juni 2012 im Internet Archive) (Quelle: Motor-Talk, Stand: 30. Juni 2002)
- DWV: Wasserstoff-Sicherheits-Kompendium. In: https://www.dwv-info.de/. Deutscher Wasserstoff- und Brennstoffzellen-Verband (DWV), 26. November 2011, abgerufen am 9. Dezember 2021.
- Wasserstofftransport. In: Nationaler Wasserstoffrat. Nationaler Wasserstoffrat, 16. Juli 2021, abgerufen am 16. Dezember 2021.
- Ulf Bossel: Wasserstoff löst keine Energieprobleme. In: Technikfolgenabschätzung – Theorie und Praxis. Karlsruher Institut für Technologie, 1. April 2006, abgerufen am 3. Februar 2019.
- nano-Bericht von der HGW-Werft der U-Boote mit Brennstoffzellenantrieb aus Metallhydridspeicher (Memento vom 8. Dezember 2007 im Internet Archive)
- Renate Hoer: Randvoll mit Wasserstoff. Gesellschaft Deutscher Chemiker, Pressemitteilung vom 29. September 2011 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- Energiespeicher für Kleinfahrzeuge – Wasserstoffantriebe für E-Scooter und Co. In: Fraunhofer Institut. Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e. V., 1. Februar 2021, abgerufen am 7. Februar 2021.
- Forschung: Powerpaste soll Wasserstoff speichern. Transport online, 4. Februar 2021, abgerufen am 21. Februar 2021.
- K. Müller, W. Arlt: Status and Development in Hydrogen Transport and Storage for Energy Applications, Energy Technology, 2013, 1, 9, 501–511, doi:10.1002/ente.201300055
- P. Adametz, K. Müller, W. Arlt: Efficiency of low-temperature adsorptive hydrogen storage systems, International Journal of Hydrogen Energy, 2014, 39, 28, 15604–15613, doi:10.1016/j.ijhydene.2014.07.157
- P. Adametz, K. Müller, W. Arlt: Energetische Bewertung von adsorptiven Wasserstoffspeichern, Chemie Ingenieur Technik, 2014, 86, 9, 1427, doi:10.1002/cite.201450249
- J. Weitkamp, M. Fritz, S. Ernst: Zeolites as media for hydrogen storage, International Journal of Hydrogen Energy, 1995, 20, 12, 967–970, doi:10.1016/0360-3199(95)00058-L
- A.C. Dillon, M.J. Heben: Hydrogen storage using carbon adsorbents: past, present and future, Applied Physics A, 2001, 72, 2, 133–142, doi:10.1007/s003390100788
- C. Liu, Y. Chen, C.-Z. Wu, S.-T. Xu, H.-M. Cheng: Hydrogen storage in carbon nanotubes revisited, Carbon, 2010, 48, 2, 452–455, doi:10.1016/j.carbon.2009.09.060
- S.H. Lim, J. Luo, Z. Zhong, W. Ji, J. Li: Room-Temperature Hydrogen Uptake by TiO2- Nanotubes, Inorganic Chemistry, 2005, 44, 12, 4124–4126, doi:10.1021/ic0501723
- G. Mpourmpakis, G. Froudakis, G.P. Lithoxoos, J. Samios: SiC Nanotubes: A Novel Material for Hydrogen Storage, Nano Letters, 2006, 6, 8, 1581–1583, doi:10.1021/nl0603911
- Daniel Teichmann, Wolfgang Arlt, Peter Wasserscheid und Raymond Freymann: A future energy supply based on Liquid Organic Hydrogen Carriers (LOHC). Energy Environ. Sci., 2011, 4, 2767–2773, 8. Juli 2011; doi:10.1039/C1EE01454D.
- Quelle: Chiyoda Pressemitteilung Stand: 10. Februar 2014
- Elektrisches Benzin Carbazol weckt Hoffnungen. (Memento vom 5. Juli 2011 im Internet Archive) In: Automobil Produktion, Stand: 30. Juni 2011
- VDI-Nachrichten, 14. April 2014: Wasserstoff sicher transportieren und lagern, abgerufen am 15. Mai 2019
- Brennstoffzelle: Wasserstoff in Dieselform, Bericht in Die Zeit vom 31. Mai 2019
- Der Toyota FCHV-adv. (Memento vom 10. August 2009 im Internet Archive) In: Toyota.de
- Toyota optimiert Brennstoffzellen Fahrzeug. (Memento vom 21. Juli 2012 im Webarchiv archive.today) In: atzonline.de, 16. Juni 2008
- Japanisches Umweltministerium least FCHV-adv. (Memento vom 16. September 2009 im Internet Archive) In: auto.de, 1. September 2008
- Volkswagen-Forschung: Weltpremiere der VW-Hochtemperatur-Brennstoffzelle. In: innovations-report.de, 1. November 2006
- Opel HydroGen4 beweist Alltagstauglichkeit. In: auto.de, 14. Mai 2009
- Mercedes’ neuer Brennstoffzellen-Bus. In: heise.de, 17. November 2009
- Hydrogen. (Memento vom 2. März 2010 im Internet Archive) In: statoil.com, 23. September 2008
- Hydrogen Refueling. (Memento vom 16. September 2008 im Internet Archive) In: quantum-technologies.com
- Spektakulärer Test zeigt: Wasserstoff im Auto muss nicht gefährlicher sein als Benzin. In: wissenschaft.de. 3. Februar 2003, abgerufen am 8. September 2019.
- Sicherheitsaspekte bei der Verwendung von Wasserstoff. (Memento vom 6. März 2012 im Internet Archive) In: Hycar.de
- Video: Crashversuch der University of Miami
- Energieinhalte im Vergleich. In: Hydox.de, abgerufen am 11. März 2012
- Wolfgang Arlt: Carbazol: Das elektrische Benzin? (Memento vom 30. März 2012 im Internet Archive), Elektor, 30. Juni 2011.
- Welchen Heizwert haben Kraftstoffe? In: aral.de, abgerufen am 11. März 2012
- Benjamin Müller, Karsten Müller, Daniel Teichmann, Wolfgang Arlt: Energiespeicherung mittels Methan und energietragenden Stoffen – ein thermodynamischer Vergleich. Chemie Ingenieur Technik, 2011, 83, 2002–2013; doi:10.1002/cite.201100113.
Anmerkungen
- Der massebezogene Energiegehalt schwankt je nach Zusammensetzung und ist von Benzin und Diesel wegen der unterschiedlichen Dichten annähernd gleich
- Die volumenbezogenen Energiegehalte schwanken recht stark durch Abhängigkeit von Temperatur (ARAL: 15 °C) und Mischungsverhältnissen der Bestandteile