Hexafluorbenzol
Hexafluorbenzol (C6F6) ist eine aromatische Verbindung. Das Molekül ist wie das Benzol aufgebaut, nur dass alle Wasserstoff-Atome durch Fluor-Atome ersetzt wurden. Es ist eine farblose, entzündliche Flüssigkeit. Aufgrund seines unpolaren Charakters mischt es sich nicht mit Wasser. Hexafluorbenzol besitzt mit seinem Schmelzpunkt bei 3,7–4,1 °C und seinem Siedepunkt bei 80–82 °C kaum Unterschiede zu seinem Substitutionsinversen, dem reinen Benzol. Es wird u. a. in der 19F-NMR-Spektroskopie verwendet.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
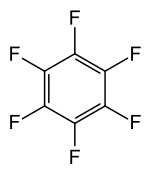 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexafluorbenzol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6F6 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 186,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,612 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
80–82 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,377 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−937,9 ± 8,34 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung
Eine direkte Synthese von Hexafluorbenzol aus Benzol und Fluor ist nicht möglich. Der Syntheseweg verläuft beispielsweise über die Reaktion von wasserfreiem Kaliumfluorid mit Hexachlorbenzol im Autoklaven bei 450–500 °C:[5]
Die erste Synthese der Verbindung wurde zwischen 1934 und 1936 durch Pyrolyse von Tribromfluormethan über Platin bei etwa 630 °C durch Yvonne Désirant entwickelt.[6]
Einzelnachweise
- Datenblatt Hexafluorobenzene bei Sigma-Aldrich, abgerufen am 3. Oktober 2016 (PDF).
- Datenblatt Hexafluorobenzene, 99% (PDF) bei Fisher Scientific, abgerufen am 1. Oktober 2014.
- M. Krech, S. J. W. Price, W. F. Yared: Determination of the Heat of Formation of Hexafluorobenzene. In: Canadian Journal of Chemistry. 50 (18), 1972, S. 9235–9238, doi:10.1139/v72-471.
- R. P. Mason, W. Rodbumrung, P. P. Antich: Hexafluorobenzene: a Sensitive 19F NMR Indicator of Tumor Oxygenation, in: NMR in Biomedicine, 1996, 9 (3), S. 125–134 (doi:10.1002/(SICI)1099-1492(199605)9:3<125::AID-NBM405>3.0.CO;2-F).
- N. N. Vorozhtsov, V. E. Platonov and G. G. Yakobson: Preparation of hexafluorobenzene from hexachlorobenzene, in: Russian Chemical Bulletin, 1963, 12 (8), S. 1389 (doi:10.1007/BF00847820).
- R.E. Banks: Fluorine Chemistry at the Millennium Fascinated by Fluorine. Elsevier, 2000, ISBN 978-0-08-053179-3, S. 491 (eingeschränkte Vorschau in der Google-Buchsuche).
Literatur
- Walter J. Pummer, Leo A. Wall: Reactions of Hexafluorobenzene, in: Science, 1958, Vol. 127, Nr. 3299, S. 643–644 (doi:10.1126/science.127.3299.643).
- Patent DE1226553B: Verfahren zur Herstellung von Hexafluorbenzol und Fluorchlorbenzolen. Angemeldet am 17. Dezember 1963, veröffentlicht am 13. Oktober 1966, Anmelder: ICI Ltd, Erfinder: Harold Crosbie Fielding.
- M. D. Bertolucci, R. E. Marsh: Lattice parameters of hexafluorobenzene and 1,3,5-trifluorobenzene at −17 °C, in: J. Appl. Cryst., 1974, 7, S. 87–88 (doi:10.1107/S0021889874008764).
