Nervenfaser
Als Nervenfaser bezeichnet man den von Gliazellen umhüllten Fortsatz einer Nervenzelle, beispielsweise das Axon einer Nervenzelle mitsamt seiner Myelinscheide. Im peripheren Nervensystem sind mehrere Nervenfasern zumeist durch zusätzliche bindegewebige Hüllen zu Nerven zusammengefasst.
Myelinisierung (Myelinisation)
Entwicklung
Myelinisierung wird die mehrfache Umwicklung des Neuriten einer Nervenzelle durch umhüllende Gliazellen genannt, wodurch das Axon elektrisch derart isoliert wird, dass mit Umbau seiner Internodien eine schnellere Erregungsleitung möglich wird. Fortsätze von Nervenzellen werden zunächst einfach von Gliazellen umhüllt, und erst später manche mehrfach und so zu myelinisierten (markhaltigen) Nervenfasern. Dieser Vorgang läuft ontogenetisch mit einer bestimmten Reihenfolge ab, in der sich oft auch eine Abfolge von Schritten der Entwicklungsgeschichte des Nervensystems und des Gehirns widerspiegelt – worauf bereits Paul Flechsig (1847–1929) hinwies.[1] So werden beispielsweise motorische vor sensiblen myelinisiert, und grundlegende Verknüpfungen vor zusätzlichen. Denn manche Verbindungen können erst dann funktional werden, wenn andere dies schon sind.
Doch ist die Ausbildung einer Markscheide keine Voraussetzung für funktionstüchtige Nervenzellen. Zahlreiche Nervenfasern bleiben lebenslang ohne Markscheide (marklos) und sind doch funktionsfähig – etwa im vegetativen Nervensystem, im Eigenapparat des Rückenmarks, in der Formatio reticularis des Markhirns –, selbst in der Retina und im Gehirn. Die aufwändige Markscheide erhöht die Leitungsgeschwindigkeit, was jedoch erst über längere Distanzen deutliche Unterschiede macht.
Myelinisiert werden längere Axone, vornehmlich solche von neuronalen Verbindungen, die sensorische oder motorische Beziehungen des Körpers in seiner Umwelt tragen (oikotroper Bezug somatischer Fasern). Denn im Verhältnis zu anderen Lebewesen spielt die Geschwindigkeit der Reaktion auf einen Reiz eine – in Konkurrenz beschleunigt zunehmende – Rolle. Signalleitungen dagegen, die Beziehungen des Körpers als eigene Inwelt vermitteln (idiotroper Bezug viszeraler Fasern) und auf Funktionen seiner Eingeweide Einfluss nehmen, bedürfen dieser Beschleunigung in der Regel nicht.
Aussprossende Nervenzellfortsätze werden von Gliazellen umgeben, beständige erhalten eine gliäre Umhüllung, viele dann später während bestimmter Phasen der Entwicklung auch eine regelrechte Myelinscheide oder Markscheide. Innerhalb des ZNS wird sie von Oligodendrogliazellen gebildet, die aus Neuroepithelzellen des Neuralrohrs hervorgehen. Außerhalb, bei den Nervenfasern des peripheren Nervensystems wird diese Aufgabe von Schwann-Zellen übernommen, Gliazellen, die aus neuroektodermalen Zellen der Neuralleisten hervorgehen.
Histologie
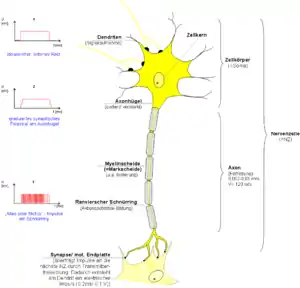
Die Schwann-Zellen wachsen während der Entwicklung der Myelinscheiden (Myelogenese oder Markreifung) je nach Typ der Nervenzelle bis etwa 50-mal um deren Nervenzellfortsatz herum und wickeln ihn dabei mit Doppellagen ihrer Zellmembran mehrfach ein. Eine einzelne Schwann-Zelle umwickelt dabei immer nur einen bis 2 mm langen Teilabschnitt eines Axons, das Internodium, viele Schwann-Zellen liegen daher nebeneinander aufgereiht längs dem gemeinsamen Achsenzylinder um das Axon herum.[2]
Mit zunehmender Anzahl der Wicklungen nimmt der Durchmesser einer Nervenfaser bei gleichem Axondurchmesser zu. Je nach Dicke der Myelinscheide bzw. Anzahl der Markscheidenlamellen unterscheidet man die markhaltigen Nervenfasern in markreiche (stark myelinisierte) und markarme Nervenfasern. Sogenannte marklose Nervenfasern (besser: markscheidenlose) haben keine Markscheide, doch im PNS ebenfalls eine Umhüllung durch Gliazellen, in deren Seitenfalten sie verlaufen. Diese einschichtige Hülle isoliert allerdings so wenig, dass Aktionspotentiale kontinuierlich weitergeleitet werden müssen, weshalb die Erregungsleitung deutlich langsamer ist als bei Axonen in einer Myelinscheide.
Bei somatischen Nervenfasern, die afferent oder efferent die Leibeswand beziehen – und so rasche Reaktionen auf Veränderungen der Umgebung vermitteln können – stellen die markhaltigen Nervenfasern den größten Anteil. Deren Axondurchmesser macht nur noch etwa die Hälfte des Nervenfaserquerschnitts aus, wegen der dicken Isolierungsschicht. Diese erst ermöglicht die sogenannte saltatorische Erregungsleitung mit einer mehrfach erhöhten Nervenleitgeschwindigkeit. Hierfür bleibt zwischen zwei Schwann-Zellen eine kleine Lücke, Ranvierscher Schnürring oder Knoten (lateinisch nodus) genannt, und nur noch in diesem (nodalen) Bereich liegt das Axon so frei, dass hier ein Aktionspotential aufgebaut werden kann – was je eine gewisse Zeit beansprucht. Dagegen wird die stark isolierte (internodale) Spanne zwischen zwei Schnürringen nun allein durch schnelle elektrotonische Fortleitung überbrückt, sodass die Aktionspotentiale nur mehr sprunghaft auftretend weitergeleitet werden. Bei demyelinisierenden Erkrankungen, beispielsweise einer Multiplen Sklerose, geht abschnittsweise die Myelinscheide um Axone von zentralen Neuronen verloren, wodurch diese Erregungsleitung gestört wird, was sich unter anderem in Gefühlsstörungen oder Lähmungen äußern kann.
Topographie
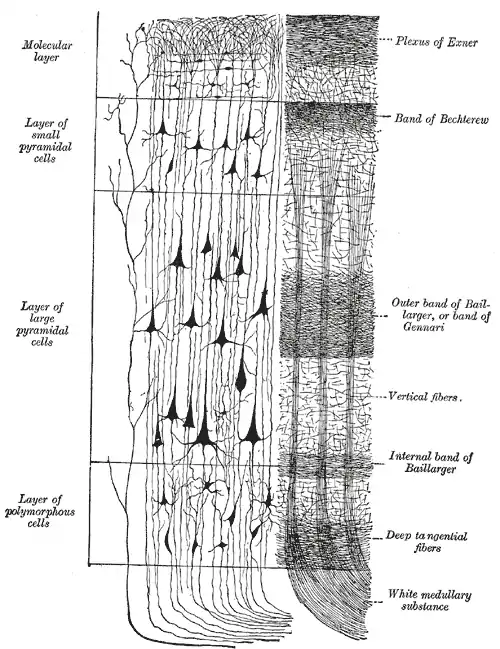
Die Laminae II und III sowie die Laminae IV und V wurden auf dieser Illustration zusammengefasst.
Wie aus Abb. 1 hervorgeht, ermöglicht die Kenntnis der Reifungsstadien des Gehirns bis hin zur Pubertät eine topographische Beschreibung und Systematisierung des Gehirns im Sinne einer funktionellen Anatomie. Eine solche Systematisierung betrifft die Unterteilung in Projektionszentren und Assoziationszentren im Gehirn. Es wird auf die entsprechenden Artikel verwiesen.
Vom zyto- und myeloarchitektonischen Aufbau der Hirnrinde wird gesprochen, wenn man das Verhältnis von Zellen und Markfasern in einem bestimmten Hirnabschnitt beschreiben will (z. B. in der Hirnrinde, siehe Abb. 3). Die Erstellung entsprechender Karten der Hirnrinde, in der Strukturen und Funktionen miteinander in Verbindung gesetzt wurden, geht auf Karl Kleist (1879–1960), Korbinian Brodmann (1868–1918), Cécile Vogt (1875–1962) und Oskar Vogt (1870–1959) sowie auf Constantin von Economo (1876–1931) zurück.[3]
Nervenfaserbündel (periphere Nerven)
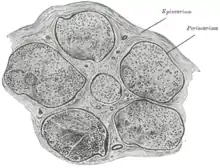
Die einzelnen ummarkten Nervenfasern werden durch sehr feine Bindegewebslamellen, das sogenannte Endoneurium, voneinander getrennt. Es besteht aus retikulären Fasern und einer Basalmembran.
Mehrere solcher Fasern werden durch das sogenannte Perineurium zu Faserbündeln (Faszikeln) zusammengefasst, das aus kollagenem Bindegewebe besteht.
Das Epineurium umhüllt schließlich den gesamten peripheren Nerv (d. h. mehrere Nervenfaserbündel) und fixiert diesen im umgebenden Gewebe.
Diese Bindegewebsumhüllung gibt den Nerven eine höhere Elastizität (durch elastische Fasern), schützt vor Druck und sie dient den Schwann-Zellen zur Ernährung, da in diesen Bindegewebslamellen die Blutgefäße verlaufen.
Faserqualitäten
Die Versorgung von Organen oder Körperteilen mit Nervenfasern und deren Reizübertragung bezeichnet man als Innervation. Nervenfasern oder ganze Nerven können nach verschiedenen Kriterien eingeteilt werden:
- nach der Richtung der Erregungsleitung: afferent (zum ZNS hin) und efferent (vom ZNS weg)
- nach dem Grad der Myelinisierung und damit auch der Leitungsgeschwindigkeit
- nach ihrer Wirkung
Nach ihrer primären Wirkung unterscheidet man drei verschiedene Faserqualitäten: sensibel, motorisch, vegetativ.
Sensible Nervenfasern
Sensible Fasern leiten Signale von Rezeptorzellen im Körper zum Zentralnervensystem und tragen so zu Empfindungen bei. Hinsichtlich der Richtung der Erregungsleitung spricht man auch von afferenten Fasern, wobei grob zwischen somatischen Afferenzen – von der Leibeswand – und viszeralen Afferenzen – von den Eingeweiden – unterschieden wird.
Im deutschen Sprachraum werden von den sensiblen häufig sensorische Fasern abgegrenzt. Sensorische Fasern leiten Erregungen von spezifischen Sinnesorganen wie der Netzhaut des Auges, dem Corti-Organ des Innenohrs, der Riechschleimhaut der Nase oder den Geschmacksknospen der Zunge. Allerdings können auch sensible Fasern spezialisierte Nervenendigungen haben, wie z. B. verschiedene Mechanorezeptoren der Haut. Im Englischen wird diese Differenzierung nicht gemacht, sowohl sensibel als auch sensorisch werden unter dem Begriff sensory zusammengefasst.
Dem Sensorium zugehörige Fasern werden nochmals unterteilt in speziell-somatosensible Fasern (Sehen, Hören) sowie speziell-viszerosensible Fasern (Riechen, Geschmack). Neben den allgemein-somatosensiblen Fasern (Hautsinne, Bewegungssinn, Kraftsinn) gibt es allgemein-viszerosensible Fasern, die Signale aus inneren Organen zum ZNS leiten und meist zu den vegetativen Fasern gezählt werden.
Motorische Nervenfasern
Motorische Fasern innervieren die Skelettmuskeln. Dort wird die Erregung über eine motorische Endplatte auf die Muskelfaser übertragen und diese zu einer Kontraktion angeregt. Gelegentlich werden von den motorischen Nerven die branchomotorischen Nerven abgegrenzt. Diese innervieren Skelettmuskeln, die aus den Kiemenbogen hervorgehen. Nach der Richtung der Erregungsleitung handelt es sich um efferente Fasern. Rein motorische Nerven gibt es nicht, in als „motorisch“ klassifizierten Nerven laufen stets auch afferente Fasern von den Rezeptoren in den Muskeln (Muskelspindel, Golgi-Sehnenorgan), die den aktuellen Tonus des Muskels registrieren.
Viszeromotorische Nerven innervieren die glatte Muskulatur der Eingeweide und Blutgefäße und gehören zu den vegetativen Fasern.
Vegetative Nervenfasern
Als vegetative Fasern bezeichnet man die Nervenbahnen des autonomen (vegetativen) Nervensystems. Sie können nach Zugehörigkeit zum jeweiligen System auch als parasympathisch oder sympathisch und auch als enterisch klassifiziert werden. Nach ihrer primären Funktion oder Leitungsrichtung unterscheidet man
- viszeroafferent oder viszerosensibel
- viszeroefferent: viszeromotorisch (an glatte Muskulatur) oder sekretorisch (an Drüsen)
Einteilung nach Leitungsgeschwindigkeit nach Erlanger/Gasser
| Fasertyp/-klasse (nach Erlanger/Gasser)[4] | Leitungsgeschwindigkeit | Durchmesser | efferent zu: | afferent von / (Einteilung nach Lloyd/Hunt): |
|---|---|---|---|---|
| Aα | 70–120 m/s | 10–20 µm | Skelettmuskel (extrafusal) | Skelettmuskel: Muskelspindel (Ia), Golgi-Sehnenorgan (Ib) |
| Aβ | 30–70 m/s | 7–15 µm | Hautrezeptoren (Berührung, Druck, Vibration) (II) | |
| Aγ | 15–30 m/s | 4–8 µm | Skelettmuskel (intrafusal) | |
| Aδ | 12–30 m/s | 2–5 µm | Hautrezeptoren (Temperatur, schneller Schmerz) (III) | |
| B | 3–15 m/s | 1–3 µm | präganglionäre Viszeroefferenzen | |
| C | 0,5–2 m/s | 0,1–1,5 µm | postganglionäre Viszeroefferenzen | langsamer Schmerz, Thermorezeptoren (IV) |
Siehe auch
Einzelnachweise
- Paul Flechsig: Anatomie des menschlichen Gehirns und Rückenmarks auf myelogenetischer Grundlage. Thieme, Leipzig 1920.
- Ulrich Welsch: Sobotta Lehrbuch Histologie. Zytologie, Histologie, mikroskopische Anatomie. 2., völlig überarbeitete Auflage. Elsevier, Urban & Fischer, München u. a. 2006, ISBN 3-437-44430-1, S. 186–188.
- Alfred Benninghoff u. a.: Lehrbuch der Anatomie des Menschen. Band 3: Nervensystem, Haut und Sinnesorgane. Urban & Schwarzenberg, München 1964, S. 234: Der Feinbau der Großhirnrinde und seine funktionelle Bedeutung.
- Robert F. Schmidt, Florian Lang, Manfred Heckmann: Physiologie des Menschen. mit Pathophysiologie. 31., überarbeitete und aktualisierte Auflage. SpringerMedizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9, S. 72.