Rüsselspringer
Die Rüsselspringer (Macroscelidea) sind eine Ordnung der Säugetiere, die mit den Macroscelididae und den Rhynchocyonidae zwei heute noch bestehende Familien enthält. Sie bewohnen den zentralen, östlichen und südlichen und mit einem Vertreter auch den nördlichen Bereich von Afrika. Gegenwärtig umfasst die Gruppe 20 Arten in sechs Gattungen. Die Tiere sind kleine Bodenbewohner, die durch einen großen Kopf mit rüsselartig verlängerter Nase sowie durch einen langen Schwanz und dünne Gliedmaßen charakterisiert sind. Die Hinterbeine übertreffen dabei die Vorderbeine deutlich an Länge, ebenso sind die Füße und unteren Gliedmaßenabschnitte verlängert. Dadurch besitzen die Rüsselspringer ausgesprochen gute Laufeigenschaften, sodass sie sich schnell laufend oder springend fortbewegen können. Die Hauptnahrung besteht vorwiegend aus Insekten und anderen Wirbellosen, zusätzlich kommt noch ein geringer Anteil an Pflanzen hinzu. Männchen und Weibchen bilden monogame Paare, deren Bindung über das gesamte Leben anhält. Die einzelnen Reviere oder Territorien der Tiere überschneiden sich bei den Paaren teilweise oder vollständig, außerhalb der Paarungszeit leben die jeweiligen Partner aber einzelgängerisch. Die Fortpflanzung der Rüsselspringer ist gekennzeichnet durch eine vergleichsweise lange Tragzeit und eine geringe Anzahl an Nachwuchs je Wurf.
| Rüsselspringer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Kurzohrrüsselspringer (Macroscelides proboscideus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Macroscelidea | ||||||||||||
| Butler, 1956 |
In der westlichen Wissenschaft wurden die Rüsselspringer erstmals gegen Ende des 17. Jahrhunderts durch Beobachtungen im südlichen Afrika bekannt. Die Benennung der ersten Art folgte über einhundert Jahre später. Aufgrund des äußerlichen Aussehens wurden die Tiere über lange Zeit mit den Spitzmäusen verglichen und in eine verwandtschaftliche Nähe mit den Insektenfressern gestellt. Diese Meinung galt noch bis weit in das 20. Jahrhundert, auch als die Rüsselspringer in der Mitte der 1950er Jahre in eine eigene Ordnung platziert wurden. In den 1970er bis 1990er Jahren favorisierten einige Wissenschaftler eine nähere Stellung zu den Nagetieren. Erst genetische Untersuchungen an der Wende zum 21. Jahrhundert erbrachten eine nähere Beziehung der Rüsselspringer zu anderen originär afrikanischen Tiergruppen wie den Tenreks, den Goldmullen und dem Erdferkel. Die Stammesgeschichte der Rüsselspringer als Familie reicht bis in das Eozän zurück und vollzog sich vollständig auf dem afrikanischen Kontinent. Das fossile Fundmaterial setzt sich aber zumeist nur aus Zahn- und Gebissresten zusammen. Neufunde und neuere Erkenntnisse aus dem Beginn des 21. Jahrhunderts lassen annehmen, dass der Ursprung der Gruppe in der heutigen Holarktis lag und in das Paläozän datiert.
Merkmale
Habitus

Rüsselspringer haben eine gewisse Ähnlichkeit mit Spitzmäusen, sind aber im Regelfall deutlich größer. Sie erreichen eine Gesamtlänge von 17 bis 58 cm, der Schwanz nimmt davon 8 bis 26 cm ein. Dadurch beträgt die Schwanzlänge etwa 80 bis 120 % der Länge des restlichen Körpers. Die relative Schwanzlänge ist häufig ein wichtiges Unterscheidungskriterium zwischen den einzelnen Arten. Das Gewicht reicht bei den kleineren Formen von 22 bis 280 g, die etwas größeren Rüsselhündchen können dagegen zwischen 320 und 750 g schwer werden.[1][2] Ein Sexualdimorphismus ist bezüglich der Körpergröße kaum ausgebildet. Die Färbung des Felles variiert an der Oberseite abhängig vom Lebensraum von gelbgrau über rötlichbraun bis dunkelbraun, die Unterseite ist heller – meist weißlich oder hellgrau – gefärbt. Bei den Rüsselhündchen ist ein deutliches bis unscheinbares streifiges Fleckenmuster auf dem Rücken ausgebildet, bei der Rüsselratte können gelegentlich auch Streifen auftreten. Die Fellbedeckung besteht aus dem Deckhaar und der Unterwolle. Die Deckhaare des Rückens werden 11 bis 18 mm lang und sind teilweise mittig verdickt. Ihr Durchmesser liegt bei 40 bis 70 μm, der Querschnitt ist zumeist rund. Die Haarschuppen bilden an der Basis ein welliges, an der Spitze ringförmiges Muster. Allgemein haben Rüsselhündchen ein gröberes und weniger dichtes Fell als die übrigen Rüsselspringer.[3][4][5]
Die Tiere haben große, runde Augen, die bei manchen Arten von einem auffälligen Ring umrahmt werden. Die Nase ist charakteristisch rüsselartig verlängert und sehr beweglich, die Ohren sind verhältnismäßig groß. Auffällig ist zudem der lange, fast unbehaarte und damit rattenähnliche Schwanz. Ein weiteres Kennzeichen stellen die langen und sehr schlanken Beine dar, wobei die Hinterbeine die Vorderbeine an Länge übertreffen. Die großen Zehen (Hallux) sowie der Daumen (Pollex) sind stark verkleinert oder fehlen vollständig. Je nach Art können an den Fußsohlen, der Brust, am After und am Schwanz Duftdrüsen ausgebildet sein, die der innerartlichen Kommunikation dienen. Die Weibchen besitzen bei den Elefantenspitzmäusen und bei den Vertretern der Gattung Macroscelides drei, bei den Rüsselhündchen und der Rüsselratte zwei Paar Zitzen auf der Bauchseite.[6][4][5]
Schädel- und Gebissmerkmale
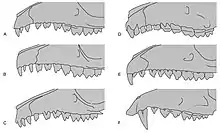
Die wichtigsten Merkmale, die eine Abgrenzung der Rüsselspringer als eigene Ordnung begründen (Autapomorphien), finden sich wie bei den meisten Säugetiergruppen im Bau des knöchernen Schädels. Der Schädel entspricht im Wesentlichen dem typischen Säugetierschädel. Er ist verhältnismäßig groß und besitzt eine in der Aufsicht dreieckige Form mit langem Rostrum und einer großen und breiten Gehirnkapsel. Die Jochbögen laden seitlich weit aus und sind vollständig geschlossen. Die Orbita ist sehr groß und nach hinten nicht durch eine vollständig geschlossene Knochenspange (Postorbitalspange) abgeschlossen. Der Oberkiefer hat keinen Anteil am Rand der Augenhöhle. Dagegen besitzt das Gaumenbein große Flügel, die den vorderen, unteren Rand der Augenhöhle bilden. Das Nasenbein ist generell lang ausgebildet. In der Ansicht von unten fallen vor allem die teils sehr komplexe Durchlöcherung des Gaumenbeins, die mit Ausnahme der Rüsselhündchen bei allen Vertretern der Rüsselspringer vorkommt, und die aufgeblähte knöcherne Gehörkapsel (Bulla tympanica) auf. Diese Aufblähung ist bei Macroscelides am weitesten fortgeschritten, sodass Bereiche des Warzenteils, des Schuppenteils, des Scheitelbeins und des Hinterhauptsbeins am Aufbau der Paukenblase beteiligt sind. Das Volumen der beiden Paukenblasen zusammengenommen übersteigt bei Macroscelides das Gehirnvolumen, bei Elephantulus und den anderen Angehörigen der Rüsselspringer sind beide Gehörstrukturen deutlich kleiner. Sie unterstützen aber die Wahrnehmung niederfrequenter Töne in offenen Landschaften.[7][8] Der Unterkiefer ist lang und schlank, der Gelenkast ragt sehr weit nach oben, sodass das Kiefergelenk weit über der Kauebene liegt. Der Kronenfortsatz (Processus coronoideus) ist kurz und erhebt sich kaum über den Gelenkfortsatz (Processus condylaris). Am hinteren Ende des Unterkiefers befindet sich ein spitzer, häkchenförmiger Winkelfortsatz (Processus angularis). Am horizontalen Knochenkörper ist ein zumeist doppeltes Foramen mentale ausgebildet, das unterhalb der Prämolaren liegt.[9][10][4][5]
Die Zahnformel der Rüsselspringer lautet: , es sind also insgesamt 34 bis 42 Zähne vorhanden. Die oberen Schneidezähne fehlen bei den Rüsselhündchen, die unteren sind zweispitzig. Bei den anderen Rüsselspringern haben sie oben und unten eine häufig nagelartige Form und sind je nach Art unterschiedlich groß gestaltet. Bezogen auf die obere Zahnreihe weisen die Elefantenspitzmäuse ein variables Gebiss auf, bei der Rüsselratte ist der vordere Schneidezahn deutlich größer als die beiden hinteren. Macroscelides und Galegeeska haben jeweils gleich große obere Schneidezähne, während bei Petrosaltator der mittlere verkleinert ist. Der obere Eckzahn erinnert nur bei den Rüsselhündchen an einen Fangzahn, ansonsten ist er wie der untere klein und variabel ausgeprägt. Die ersten beiden Prämolaren sind zumeist klein, wobei der zweite in der Länge gestreckt und ein- oder zweihöckrig aufgebaut ist. Die beiden hinteren Vorbackenzähne haben eine breite Gestalt, der letzte ist stark molarisiert und gleicht so den Molaren. Alle hinteren Backenzähne haben moderat hohe Zahnkronen (subhypsodont) und ein fehlendes Cingulum (ein Wulst oder eine Leiste an der Zahnbasis). Sie sind groß, quadratisch im Umriss und besitzen vier spitze, scharfe Höckerchen auf der Kauoberfläche (sectoriale oder secodonte Zahngestaltung). Die Anordnung der Höckerchen und der sich zwischen ihnen befindenden Rippeln lassen eine dilambdodont verlaufende Schneidkante des Zahnschmelzes entstehen (in Form des lateinischen Buchstabens W oder zweier aneinandergereihter griechischer Λs), wodurch die Zähne ein wenig an die der Huftiere erinnern. Die jeweils letzten Backenzähne fehlen im Oberkiefer immer, im Unterkiefer treten sie gelegentlich bei einigen Arten der Elefantenspitzmäuse auf und sind dann nur sehr klein ausgebildet. Die Rüsselspringer haben, wie die meisten Säugetiere, einen Zahnwechsel, bei dem erst ein Milchgebiss und später ein dauerhaftes Zweitgebiss gebildet wird.[9][10][4][5]
Skelettmerkmale
Die Wirbelsäule besteht aus 7 Hals-, 13 Brust-, 7 bis 8 Lenden-, 3 Kreuzbein- und 20 bis 28 Schwanzwirbeln. Im Vergleich zu den anderen Rüsselspringern haben die Rüsselhündchen dabei durchschnittlich mehr Lenden- und Schwanzwirbel, zudem sind bei ihnen am Schwanz Chevronknochen ausgebildet. Bei allen Vertretern der Familie zeichnen sich die hinteren Lendenwirbel durch lange Dorn- und Querfortsätze aus, an denen die kräftige Beckenmuskulatur angebracht ist, was in Verbindung mit der teils springenden Fortbewegung steht. Die Unterarmknochen sind bei den meisten Arten miteinander verwachsen, lediglich bei den Rüsselhündchen liegen sie sehr nah aneinander. Bei diesen hat auch abweichend von den meisten Säugetieren der äußerste Fingerstrahl nur zwei Glieder. Eine Besonderheit im Bau der Extremitäten sind die langen Hinterbeine. Insbesondere das Waden- und das Schienbein sind gegenüber dem Oberschenkelknochen stark verlängert, ebenso die Mittelfußknochen, was ein typisches Kennzeichen schnell laufender Tiere ist. So kann der untere Beinabschnitt den oberen um 25 bis 43 % an Länge übertreffen, der Mittelfuß weist bei einigen Arten die gleiche Länge wie der Oberschenkelknochen auf. Am Schaft des letzteren tritt ein markanter dritter Rollhügel (Trochanter tertius) auf. Die beiden Unterschenkelknochen sind im distalen Bereich zu zwei Dritteln miteinander verwachsen.[11][9][5]
Weichteilanatomie der Nase

Die rüsselartig verlängerte Nase der Rüsselspringer ist hochflexibel und ständig in Bewegung, allerdings im Gegensatz zu den ähnlichen Bildungen wie bei den Elefanten und Tapiren nicht zur Manipulation von Objekten geeignet. Analog zu den Tieren mit echtem Rüssel besitzt die Nase der Rüsselspringer keinen knöchernen Unterbau, was die hohe Beweglichkeit ermöglicht. Bei den Rüsselhündchen bilden rund 30 knorpelige Ringe die verlängerte Nase, was jedoch auf Untersuchungen von Embryos basiert.[12] Bei ausgewachsenen Vertretern der Elefantenspitzmäuse sind solche knorpeligen Ringstrukturen nur an der Basis der Nase vorhanden. Im restlichen Teil der Nase findet sich unabhängiges Knorpelgewebe als Nasenscheidewand, die teilweise löchrig ist, und im oberen, unteren sowie seitlichen Bereich. Daneben existieren zwei Hauptmuskelstränge: ein seitlich längsverlaufender und ein oberer querverlaufender. Beide dienen nicht nur der Bewegung der Nase, sondern vermögen auch je nach Umständen die Größe der Nasenlöcher zu verändern. Ein bauchseitiger Muskel, der aktiv die Nase herabsenkt, fehlt dagegen. Bedeckt ist die Nase zudem mit teils behaarter Haut. In diese sind Talg- und seltener Schweißdrüsen eingebettet. Insgesamt erscheint die Nasenregion der Rüsselspringer nicht stark spezialisiert, da die Tiere nur wenig Kontrolle über die Nasenspitze haben. Die Nase hat dadurch weniger eine Tastfunktion, sondern dient in erster Linie als Riechorgan, das durch seine außerordentliche Beweglichkeit mit der Nahrungssuche im Blätterabfall oder zwischen Steinen am Boden im Zusammenhang steht.[13]
Innere Organe
Der gesamte Verdauungstrakt wird bei den kleinen Rüsselspringern wie den Elefantenspitzmäusen und den Arten von Macroscelides 51 bis 60 cm lang, bei der Rüsselratte erreicht er 139 cm. Der Anteil einzelner Organe variiert zwischen den Gattungen, der Dickdarm nimmt bei den Elefantenspitzmäusen zwischen 16 und 20 % ein, bei Macroscelides sind es 21 % und bei der Rüsselratte nur 9 %. Möglicherweise hängen diese Variationen mit der Befähigung zur Speicherung von Wasser in trockenen Habitaten zusammen. Bei einigen Elefantenspitzmäusen ist zudem eine Veränderung der Länge des Verdauungstraktes über das Jahr bei konstantem Körpergewicht nachgewiesen, mit auffälligen Reduktionen außerhalb der Fortpflanzungsphase. Markant ist auch der große Blinddarm, der bei der Verdauung der pflanzlichen Nahrung eine große Rolle spielt.[15][16] Die Nieren besitzen einen einlappigen Aufbau mit einer deutlich getrennten Rindenregion, einer Markröhre und einer verlängerten Papille, die in Richtung des Beckens reicht.[17] Die Weibchen haben eine zweihörnige Gebärmutter (Uterus bicornis), die bei den Rüsselhündchen weniger deutlich ausgeprägt ist als bei den anderen Rüsselspringern. Ein Gebärmutterhals und eine echte Vagina sind nicht vorhanden. Der hintere Teil des Gebärmutterkörpers ersetzt die Vagina funktionell.[18][19] Die Hoden der Männchen liegen nicht in einem äußeren Hodensack, sie bleiben im Bereich der Nieren und wandern nicht, wie bei vielen anderen Säugern, abwärts (primäre Testicondie). Ihre Größe beträgt bei kleineren Arten etwa 10 × 4 mm bei einem Gewicht von 0,08 g. Der Penis liegt im Bezug auf die Körperlänge ebenfalls relativ weit vorn, je nach Art zwischen 20 und 40 % vor dem Anus, was bei Macroscelides eine Distanz von etwa 4 cm ausmacht.[20][6] Mit 50 bis 75 % der Körperlänge ist der Penis im eregierten Zustand außerordentlich lang. Das Gehirn wiegt bei den kleineren Elefantenspitzmäusen 1270 bis 1330 mg, bei den größeren Rüsselhündchen zwischen 5400 und 7230 mg. Im Vergleich zu Tieren mit einer ähnlichen Lebens- und Ernährungsweise ist das Gehirn bei den Rüsselspringern durchschnittlich größer.[21][5]
Verbreitung und Lebensraum
Die Rüsselspringer sind eine endemisch in Afrika auftretende Säugetiergruppe. Das Hauptverbreitungsgebiet liegt im zentralen, östlichen und südlichen Teil des Kontinents und erstreckt sich vom südlichen Sudan (Südsudan) und der Demokratischen Republik Kongo bis nach Südafrika. Lediglich eine Art, die Nordafrikanische Elefantenspitzmaus (Petrosaltator rozeti), ist im Norden und Nordwesten von Marokko bis Libyen beheimatet und durch die Sahara von den südlichen Vertretern getrennt. Auffällig an der Gesamtverbreitung der Rüsselspringer ist ihr vollständiges Fehlen im westlichen Afrika, da das Kongobecken mit seinen großen Flüssen Kongo und Ubangi die Nord- und Westgrenze des südlichen Vorkommens darstellen. Es ist nicht geklärt, warum die Rüsselspringer in Westafrika fehlen. Möglich ist, dass die großen Ströme und Flüsse Ausbreitungsbarrieren darstellen, da die Lebensweise der Tiere keine Überschwemmungsgebiete oder oberflächennahes Grundwasser befürwortet. Im östlichen und südlichen Afrika begrenzen Flüsse wie der Tana, der Sambesi oder der Oranje das Vorkommen einiger Arten.[22][4][5]
Die Rüsselspringer bewohnen eine Vielzahl von Lebensräumen und Landschaften, folgende Grundtypen lassen sich unterscheiden:
- trockene Felslandschaften und teils Savannengebiete, die mit Steinblöcken beziehungsweise Kopjes durchsetzt sind oder gebirgige Regionen in bis zu 2700 m Höhe; dazu gehören die Östliche (Elephantulus myurus) und die Westliche Klippen-Elefantenspitzmaus (Elephantulus rupestris), die Kap-Elefantenspitzmaus (Elephantulus edwardii), die Karoo-Klippen-Elefantenspitzmaus (Elephantulus pilicaudus), die Nordafrikanische Elefantenspitzmaus und eventuell auch die Somali-Elefantenspitzmaus (Galegeeska revoili).
- trockene Geröllfelder, vor allem Gebiete der Karoo und der Namib mit nur spärlicher Vegetation; dazu gehören alle Vertreter der Gattung Macroscelides.
- trockenes Waldsavannen- und Buschland mit offener Vegetation auf sandigen Böden mit niedrigem Grasstand und mit Gestrüpp durchsetzt; dazu gehören die Trockenland-Elefantenspitzmaus (Elephantulus intufi) und die Rotbraune Elefantenspitzmaus (Galegeeska rufescens).
- mesisches Waldsavannen- und Buschland mit teils offenen, teils geschlossenen Wäldern und Dickichten auf unterschiedlichen Böden; dazu gehören die Kurznasen-Elefantenspitzmaus (Elephantulus brachyrhynchus), die Dunkle Elefantenspitzmaus (Elephantulus fuscus), die Dunkelfuß-Elefantenspitzmaus (Elephantulus fuscipes) und einige Unterarten der Rüsselratte (Petrodromus tetradactylus).
- Wälder mit geschlossenem Kronendach und reicher Blätterschicht auf unterschiedlichen Böden; dazu gehören eine Unterart der Rüsselratte und alle Vertreter der Rüsselhündchen (Rhynchocyon).
Die vielfältigen Landschaften bedingen, dass in einigen Regionen verschiedene Arten gemeinsam vorkommen, sie nutzen dann aber ein jeweils anderes Habitat. Auch sind bei einzelnen Vertretern mit größerem Verbreitungsgebiet klinale Anpassungen an die Umgebung im Bezug auf die Fellfärbung nachgewiesen.[22][4][5]
Lebensweise
Territorialverhalten


Die Rüsselspringer leben bodenbewohnend und sind polyzyklisch aktiv, wobei sie zumeist am Tage oder während der Dämmerung auftreten. Während der größten Hitze des Tages ruhen die Tiere in der Regel. Einige Arten wie der Kurzohrrüsselspringer (Macroscelides proboscideus) sind auch stärker nachtaktiv. Die Tiere können sich sehr schnell fortbewegen und erreichen Geschwindigkeiten von bis zu 29 km/h. Es sind zwei Arten der Fortbewegung bekannt, eine vierfüßig schnell laufende (cursoriale) und eine springende (saltatorische). Beim Laufen wird der Schwanz horizontal gehalten und nur bei Ruhe auf den Boden gelegt. An die hohen Laufgeschwindigkeiten sind die Tiere durch ihre stark verlängerten Hinterbeine angepasst, vor allem durch die gegenüber dem Oberschenkelknochen nahezu gleich langen Mittelfußknochen.[23] Beim saltatorischen Laufen bewegen sich die Hinterbeine synchron zueinander, während die Vorderbeine alternierend aufsetzen, weswegen diese Fortbewegung auch als „halbspringend“ bezeichnet wird. Vor allem bei den kleineren Rüsselspringern wie den verschiedenen Vertretern der Elefantenspitzmäuse (Elephantulus) und der Gattung Macroscelides kommt es dabei häufig dazu, dass eines der Hinterbeine nicht auftritt, sondern in arhythmischen Abständen in der Luft hängen bleibt. Möglicherweise korrigieren die Tiere durch den ausgelassenen Auftritt die Schrittfrequenz und nehmen Kraft aus dem Lauf. Verantwortlich dafür sind eventuell anatomische Gründe, da die kleineren Rüsselspringer im Vergleich zu den größeren Rüsselhündchen einen verkürzten Oberkörper aufweisen. Die hohe Kraftentfaltung durch die außerordentlich kräftigen Hinterbeine könnte dann ohne diese notwendigen Korrekturen zu häufigeren Stürzen führen.[24] Die gelegentlich bei der Flucht ausgeübten hohen Sprünge ähneln denen von Huftieren, etwa den Springböcken. Auch der beim Laufen verwendete Zehengang, der untypisch für zahlreiche Kleinsäuger erscheint, erinnert eher an Huftiere, ebenso wie der schlanke Körperbau, der besonders bei der Rüsselratte und den Rüsselhündchen auffällig ist.[22] Eine häufig geäußerte Annahme, die Tiere würden sich ähnlich den Kängurus nur auf den Hinterbeinen springend mit weiten Sätzen fortbewegen, ist falsch, ebenso die Meinung, sie würden sich auf den Hinterbeinen aufrichten.[25] Als Verstecke suchen sich die Vertreter von Macroscelides und der Elefantenspitzmäuse, die felsige oder trockene Landschaften bewohnen, zumeist Bodennischen, Felsspalten, Termitenhügel oder auch verlassene Nagetierbaue. Da sie selbst nicht gut graben können, legen sie äußerst selten eigene Erdbaue an. Die Rüsselratte (Petrodromus tetradactylus) und die Elefantenspitzmäuse der stärker bewachsenen Regionen ziehen sich dagegen in dichtes Gestrüpp zurück. Von den Rüsselhündchen ist bekannt, dass sie Nester aus Pflanzenmaterial errichten.[26][22][4][5]


Die Vertreter der meisten Arten sind territorial und halten Eigenreviere. Deren Größe schwankt von weniger als 1 ha bis zu 100 ha, abhängig von der bewohnten Region und den dort herrschenden Klimaverhältnissen sowie der Dichte der lokalen Population. Charakteristisch bei einigen Arten der Elefantenspitzmäuse und der Gattung Macroscelides sowie der Rüsselratte sind Pfade, die die verschiedenen Aktivitätspunkte und Unterschlüpfe innerhalb eines Territoriums miteinander verbinden. Diese verlaufen mitunter schnurgerade durch Felslandschaften oder durch dichte Vegetationsgebiete. In manchen dicht bewachsenen Gebieten bestehen die Pfade auch nur aus einzelnen gesäuberten Flächen. Das Wegesystem dient der schnellen Fortbewegung und wird von den Tieren selbst angelegt und gepflegt, wobei sie die Pfade mit schwingenden Armbewegungen von Steinchen und Zweigen oder Blättern befreien. Bei den Rüsselhündchen dagegen ist das Anlegen von Pfaden bisher nicht beobachtet worden. Markierungen der Territorien erfolgen mit Hilfe von Duftmarken von Sekret aus Drüsen, die sich je nach Art an den Füßen, der Brust, dem Steiß oder am Schwanz befinden. Daneben ist neben einzelnen Lautäußerungen vor allem ein trommelartiges Geräusch als Kommunikationsmittel bekannt. Dieses Fußtrommeln wird mit schnellen Schlägen der Hinterfüße auf dem Untergrund erzeugt. Dabei besteht diese als Podophonie bezeichnete Verständigungsform aus einer festgelegten Abfolge von regelmäßigen und unregelmäßigen Schlägen, die nur kurz währt, aber nach einer gewissen Zeit wiederholt wird. Die einzelnen Trommelserien variieren artspezifisch und können so als taxonomisches Merkmal herangezogen werden. Ein ähnliches Verhalten ist auch bei einigen Hasenartigen und Nagetieren belegt. Die Funktion des Fußtrommelns bei den Rüsselspringern ist nicht ganz eindeutig. Häufig tritt die Kommunikationsform in Stresssituationen auf, die mit Territorialkämpfen und Paarungsritualen in Verbindung stehen, kann aber auch bei Anwesenheit von Beutegreifern vorkommen. Hier ist es möglicherweise als Warnsignal für Artgenossen zu interpretieren oder als Hinweis an den Beutegreifer, dass er bemerkt wurde.[27][28][22][4][5]

Allgemein leben die Rüsselspringer in monogamen Paarbindungen, die in der Regel das gesamte Leben halten. Die Territorien der gebundenen Tiere überschneiden sich dabei teilweise oder vollständig. Die Paarbindungen sind allerdings nicht sehr tief, gemeinsame Aktivitäten gehen selten über die Fortpflanzung hinaus. Jedoch werden die einzelnen Territorien gegen Eindringlinge verteidigt, was vom Partner des gleichen Geschlechts erfolgt. Eine mögliche Ursache für die Paarbildung bei den Rüsselspringern kann in der größeren Intoleranz von Weibchen untereinander liegen, wie es etwa bei der Östlichen Klippen-Elefantenspitzmaus beobachtet wurde. Die höhere Abneigung unter Weibchen entsteht durch größere Konkurrenz um Nahrungsressourcen in den unter Umständen kargen Landschaften, während gleichzeitig für die Männchen der Paarungspartner eher rar ist.[29] Für die Männchen bestehen die wahrscheinlichen Vorteile einer monogamen Beziehung in der gesicherten Fortpflanzung und den geringen Kosten für die Verteidigung des Weibchens und/oder des gemeinsamen Territoriums. Dadurch sinkt auch die Gefahr, dass sich eindringende fremde Männchen mit der Partnerin paaren. Herumziehende Männchen, die auf der Suche nach empfangsbereiten Weibchen gehen, wären demgegenüber stärker in die Territorialverteidigung sesshafter Männchen involviert. Darüber hinaus unterlägen sie beim Durchstreifen von unbekanntem Terrain einer größeren Gefahr, von Fressfeinden erbeutet zu werden.[30] Unter Umständen kommt es aber vor, dass ein gebundenes Männchen sich in ein benachbartes Revier begibt, dessen Halterin ungebunden ist oder ihren Partner verloren hat. Daraus resultiert auch eine gewisse Promiskuität bei den männlichen Tieren. Untersuchungen zufolge erleidet dieses aber häufig bei der Unterhaltung von zwei Territorien mit jeweils einem Weibchen einen starken Gewichtsverlust, was auf hohe Kosten dieser Lebensweise schließen lässt. Dementsprechend zieht sich das Männchen zumeist in sein eigenes Territorium zurück, wenn ein ungebundenes Männchen auftaucht. Das Verhalten lässt aber darauf schließen, dass die Männchen bei den Rüsselspringern neben der Fortpflanzung innerhalb des Paares gelegentlich auch eine Weitergabe ihrer Gene außerhalb dieser Bindungen suchen, was bei einigen Arten auch daran erkennbar ist, dass männliche Tiere teils deutlich größere Territorien als weibliche haben und häufiger zu Grenzüberschreitungen neigen.[31][32][33][22][5]
Ernährung und Thermoregulation


Die Hauptnahrung der Rüsselspringer besteht im großen Maße aus Wirbellosen. Dabei ernähren sich die Rüsselhündchen von einer weiten Palette an Invertebraten, die von Gliederfüßern wie Insekten, Spinnen und Tausendfüßer bis hin zu Ringelwürmern reicht. Sie gehen bei der Nahrungssuche verstärkt opportunistisch und nur in seltenen Fällen selektiv vor. Bei allen anderen Rüsselspringern dominiert eine insekten- bis allesfressende Ernährungsweise mit einer Bevorzugung von Ameisen, Termiten und Käfern. Jahreszeitlich bedingt bereichern sie ihren Speiseplan mit pflanzlicher Nahrung wie Samen, Früchten und grünen Pflanzenteilen. In Einzelfällen spielt auch Nektar eine Rolle, wodurch einige Arten auch als wichtige Verbreiter von Pollen fungieren.[34][35] Aus morphologischen Gründen sind Rüsselspringer nicht befähigt, größere Beutetiere wie kleinere Wirbeltiere zu fressen. Für die Nahrungssuche wird der hervorragende Geruchssinn eingesetzt, wobei die Tiere mit der Nase sondierend den Blätterabfall und sonstige Verstecke absuchen. Die Zunge ist sehr lang und kann bis mehrere Millimeter vor die Nasenspitze ausgestreckt werden. Mit ihr wird die Nahrung in das unterständige Maul befördert, die Backenzähne mit den scharfen Spitzen zerkleinern anschließend die Beute. Abweichend von anderen, sich insektenfressend ernährenden Säugetieren besitzen die Rüsselspringer einen funktionalen Blinddarm, der für die Verdauung der pflanzlichen Nahrungsteile verantwortlich ist.[26][22][4][5]
Vor allem die Arten trockener bis wüstenartiger Landschaften mit ihren heißen Tagen und kühlen Nächten zeigen eine gewisse Heterothermie mit einer schwankenden Körpertemperatur im Verlauf des Tages. Zum Ausgleich halten sich die Tiere während der heißen Phase an schattigen Plätzen oder in kühleren Felsspalten auf. In den Morgenstunden können dagegen ausgiebige Sonnenbäder beobachtet werden.[36][37] Außerdem sind die Nieren bei Arten der Wüstengebiete befähigt, Urin hoch anzureichern und somit den Wasserverlust zu verringern.[17] Bei sehr niedrigen Nachttemperaturen oder auch in Verbindung mit schlechten Nahrungsbedingungen verfallen einige Vertreter der Rüsselspringer, vor allem die Arten der Gattung Macroscelides und einige Vertreter der Elefantenspitzmäuse, in einen Torpor, der über mehrere Stunden anhält und bei dem die Körpertemperatur auf nur wenige Grad über die Außentemperatur absinkt. Bei den Arten, die in Regionen mit eher ausgeglichenen Klimaverhältnissen leben wie der Rüsselratte oder den Rüsselhündchen, tritt dieses Verhalten nicht auf.[26][22][4][5]
Fortpflanzung
Je nach Lebensraum und dessen klimatischen Bedingungen kann die Paarung ganzjährig (tropische Gebiete) oder seltener in jahreszeitlicher Abhängigkeit (Regionen höherer Breitengrade und Gebirgslagen) stattfinden. Der Geschlechtsakt dauert in der Regel nur wenige Sekunden, das Männchen vollführt dies in nahezu aufrechter Position. Für beides wird die verhältnismäßig weit nach vorn verlagerte Position des Penis als Ursache angesehen.[38] Einige Arten der Elefantenspitzmäuse und der Kurzohrrüsselspringer zeigen in der Keimzellenentwicklung bzw. der -entlassung als Besonderheit eine Polyovulation, bei der beim Follikelsprung zwar mehrere reife Eizellen die Eierstöcke verlassen und auch befruchtet werden, allerdings sich von diesen meistens nur zwei in die Gebärmutter einbetten. Ein neuer Eisprung erfolgt bei den Tieren immer nach dem Wurf der Jungtiere (Postpartum-Östrus). Die Ursache für diese Polyovulation ist bisher unbekannt.[19] Die Tragzeit dauert rund sechs bis zehn Wochen, was relativ lang ist für derartig kleine Tiere. In der Regel tragen Weibchen je nach äußeren Bedingungen zwischen drei und sechs Würfe im Jahr aus.[26][22][4][5]
Zumeist werden ein bis zwei Jungtiere geboren, selten umfasst ein Wurf bis zu vier Neugeborene. Bei den Rüsselhündchen kommt der Nachwuchs als Nesthocker zur Welt und besitzt nur wenig Fellbedeckung und geschlossene Augen. Bei den anderen Rüsselspringern sind die Jungen Nestflüchter und können innerhalb weniger Stunden laufen. Die Jungen bewohnen eigene, von den Eltern getrennte Unterschlüpfe. Das Muttertier besucht die Jungen nur kurz während des Tages, um sie zu säugen, was als „System des Absentismus der Mutter“ bezeichnet wird. Den Begriff prägte E. G. Franz Sauer 1973 an Populationen des Kurzohrrüsselspringers in der Namib, die Form der Aufzucht ist aber auch bei anderen, gut untersuchten Rüsselspringern nachgewiesen.[39][40] Ein Grund für diese Verhaltensweise könnte sein, dass dadurch der Nachwuchs geruchsneutral bleibt, was einen besseren Schutz vor Fressfeinden gewährt.[41] Das Vatertier dagegen beteiligt sich nicht unmittelbar an der Aufzucht, indirekt kann es aber durch Vertreiben von oder Warnen vor Fressfeinden involviert sein.[30] Die Säugezeit dauert nur zwei bis drei Wochen, danach werden die Jungen zunehmend unabhängig und gründen eigene Territorien. Die Lebenserwartung in freier Wildbahn umfasst je nach Größe der Tiere ein bis vier Jahre. Das höchste bekannte Lebensalter eines Rüsselspringers in menschlicher Obhut betrug rund neun Jahre bei einer Trockenland-Elefantenspitzmaus und rund elf Jahre bei einem Goldenen Rüsselhündchen.[42][26][22][4][5]
Systematik
Äußere Systematik
Innere Systematik der Afrotheria nach Heritage et al. 2021[43]
|
Die Rüsselspringer bilden die rezent einzige Familie in der Ordnung der Macroscelidea, die dadurch monotypisch ist. Die Macroscelidea wiederum stellen einen Teil der Überordnung der Afrotheria dar, einer der vier Hauptlinien innerhalb der Höheren Säugetiere. Die Afrotheria selbst sind eine molekulargenetisch definierte Gruppe überwiegend in Afrika heimischer Tiere oder deren Ursprung auf dem Kontinent liegt. Innerhalb der Afrotheria können zwei größere Verwandtschaftsgemeinschaften unterschieden werden, die Paenungulata und die Afroinsectiphilia. Die Paenungulata waren schon länger durch anatomische Übereinstimmungen bekannt und schließen die heutigen Elefanten, die Schliefer und die Seekühe ein. In die Afroinsectiphilia werden neben den Rüsselspringern auch die Tenreks, Otterspitzmäuse und Goldmulle gestellt, die drei zuletzt genannten formen zusammen die Ordnung der Afrosoricida. In der Regel gilt auch das Erdferkel, das als einziges Mitglied die Ordnung der Tubulidentata stellt, als Teil der Afroinsectiphilia. Dabei unterstützen die gegenwärtigen Daten sowohl eine Schwestergruppenbeziehung der Rüsselspringer zum Erdferkel[44] als auch zu den Afrosoricida,[45][46] letztere Gruppierung wird auch manchmal als Afroinsectivora bezeichnet.[47] Den molekulargenetischen Untersuchungen zufolge haben die Afrotheria ihren Ursprung in der Oberkreide vor 90,4 bis 80,9 Millionen Jahren. Die Aufspaltung der beiden Hauptgruppen erfolgte etwa 15 Millionen Jahre später. Die Rüsselspringer traten dann im Verlauf des Unteren Eozäns vor 49,1 bis 47,5 Millionen Jahren erstmals in Erscheinung, was relativ gut mit dem Fossilreport übereinstimmt.[46]
Innere Systematik
Innere Systematik der Macroscelidea in einer klassischen Sichtweise nach Tabuce 2018[48]
Die Positionen von Palaeothentoides, Miosengi und Pronasilio wurden nach Holroyd 2010[49] nachgetragen. |
Innerhalb der Ordnung der Rüsselspringer (Macroscelidea) wurde in der Regel eine rezente Familie (Macroscelididae) mit zwei Unterfamilien (Macroscelidinae und Rhynchocyoninae) und momentan 20 bestehenden Arten unterschieden. Eine Studie aus dem Jahr 2021 stufte die Unterfamilien jedoch auf den Familienrang hoch, was vor allem mit der Einbeziehung der fossilen Verwandtschaft und ihren stark variablen Gebisseigenschaften begründet wurde. Dadurch bestehen mit den Macroscelididae und den Rhynchocyonidae heute zwei eigenständige Familien.[50] Die artenreichste Gruppe sind die Macroscelididae, welche die Arten der Gattungen Elephantulus (Elefantenspitzmäuse), Macroscelides, Galegeeska, Petrosaltator (Nordafrikanische Elefantenspitzmaus) und Petrodromus (Rüsselratte) einschließt. Letztere vier formen eine engere Einheit und werden in der Unterfamilie der Macroscelidinae zusammengefasst, während erstere alleinig die Elephantulinae bildet (beide wurden ursprünglich jeweils auf der Ebene einer Tribus geführt).[51][50] Die Macroscelididae sind durch ein Gaumenbein mit paarigen Öffnungen charakterisiert und bewohnen trockene und offene bis gestrüppreiche Landschaften. Dem gegenüber stehen die Rhynchocyonidae, die nur die Gattung Rhynchocyon (Rüsselhündchen) enthalten. Bei diesen wiederum ist das Gaumenbein geschlossen, zudem treten an den unteren vorderen Prämolaren zusätzliche Höckerchen auf. Die oberen Schneidezähne fehlen bei den heutigen Arten, kommen aber bei ausgestorbenen Formen vor. Die Rüsselhündchen sind generell größer als die anderen Rüsselspringer und bewohnen geschlossene Habitate. Allgemein haben die heutigen Rüsselspringer eher hochkronige (subhypsodonte) Backenzähne, denen ein Cingulum (ein tieferliegender Zahnschmelzwulst) fehlt. Des Weiteren ist der letzte Vorbackenzahn molarenartig gestaltet und der letzte Molar in der Regel reduziert.[49][4][52]
Neben den heutigen Familien sind noch weitere ausgestorbene Gruppen bekannt. Auch diese wurden ursprünglich als Unterfamilien geführt, erhielten aber im Jahr 2021 eine unterschiedliche taxonomische Rangeinstufung.[50] Die stammesgeschichtlich älteste Gruppe bilden die Herodotiidae, deren genaue systematische Stellung innerhalb der Rüsselspringer nicht eindeutig ist. Besondere Charakteristika stellen die allgemein niederkronigen (brachyodonten) Backenzähne, die Ausbildung eines breiten Cingulums an der Zahnbasis und das Vorhandensein eines hintersten Molars dar. Die Unterfamilie ist nur aus dem Eozän belegt. Die Metoldobotidae sind derzeit als ein monotypisches Taxon aufzufassen. Dessen einzige Art und Gattung ist durch die besonders große Körpergröße und den Verlust des unteren hinteren Molars gekennzeichnet. Als weitere, ebenfalls monotypische Gruppe können die Afrohypselodontidae herausgestellt werden, deren Charakterform Afrohypselodontus über wurzellose, ständig wachsende und somit stark hochkronige Backenzähne verfügte.[50] Alle anderen Gruppen sind den Macroscelididae zuzuweisen. Hierzu zählen die Myohyracinae, die auf das Untere und Mittlere Miozän beschränkt sind. Einzelne Merkmale lassen darauf schließen, dass die Vertreter der Gruppe sich eher pflanzenfressend ernährten mit Spezialisierung auf Gräser und Samen. Dazu gehören die ersten beiden vergrößerten und mit einer Schneidkante ausgestatteten Schneidezähne, die zudem schräg nach vorn stehen (procumbent), und außerdem ein massiverer Unterkiefer für eine stärkere Kaumuskulatur. Die hintersten Molaren sind noch ausgebildet aber klein, dafür ist der jeweils zweite Prämolar molarisiert, wodurch entsprechend die Kaufläche der gesamten Zahnreihe vergrößert wurde. Die Mylomygalinae wiederum umfassen nur eine Art und Gattung aus dem Pliozän. Sie zeichnen sich durch hochkronige Zähne und einen fehlenden hinteren Backenzahn aus. Darüber hinaus tritt auf den Kauflächen der Molaren stark gefalteter Zahnschmelz auf, wie es typisch für Nagetiere ist. Die Namasenginae wiederum repräsentieren kleine Vertreter der Rüsselspringer mit vollständiger unterer Bezahnung.[50] Die Rhynchocyonidae und den Macroscelididae einschließlich ihrer Fossilgruppen (Myohyracinae, Mylomygalidae und andere) gehören nach gegenwärtiger Auffassung zur Kronengruppe der Rüsselspringer, während die Herodotiidae und die Metoldobotidae die Stammgruppe bilden.[49][53][10][48]
Innere Systematik der Macroscelidea in einer erweiterten Sichtweise nach Hooker et al. 2012[54]
|
Ursprünglich galt die Ordnung der Macroscelidea sowohl rezent als auch fossil als monotypisch und enthielt nur die Familie der Rüsselspringer. Kleinsäuger aus der geologischen Vergangenheit sind häufig nur über Gebissreste nachgewiesen, ihre morphologische Zuweisung ist daher aufgrund sich häufig ähnelnder Lebens- und Ernährungsweisen nicht immer eindeutig. Studien an postcranialem Skelettmaterial aus den Jahren 2005 und 2008 zeigten deutliche Übereinstimmungen der Apheliscidae mit den Rüsselspringern, was vor allem die Merkmalskombination an den Hinterbeinen und den Hinterfüßen betrifft, etwa am stark verlängerten Unterschenkel und der speziellen Ausprägung des Fersen- und Sprungbeins. An letzterem ist unter anderem eine tiefe Furche zur Artikulation mit dem Schienbeingelenk ausgebildet, die auch bei den Rüsselspringern, den Schliefern und beim Erdferkel vorkommt. Die Apheliscidae sind eine nordamerikanisch verbreitete Gruppe, die im ausgehenden Paläozän und beginnenden Eozän im heutigen westlichen Teil des Kontinents auftrat und charakteristische dreieckige bis quadratische, bunodonte (mit rundhöckrigem Kauflächenmuster versehene) obere hintere Backenzähne besaß. Aufgrund der Zahnmerkmale wurden sie anfänglich mit den Hyopsodontidae in Verbindung gebracht, die zu den „Condylarthra“ zählen, einer vielgestaltigen, aber in sich nicht geschlossenen Gruppe urtümlicher Huftiere.[55][56] Eng verwandt mit den Apheliscidae sind die Louisinidae, sie galten ursprünglich wie die Apheliscidae als Teil der Hyopsodontidae und stellen das europäische Gegenstück der ersteren dar mit einer ähnlichen zeitlichen Verbreitung. Diese bilden den phylogenetischen Untersuchungen zufolge die Schwestergruppe der Rüsselspringer und der Apheliscidae.[57][55] Diese Ergebnisse konnten bei weiteren Studien reproduziert werden. Die neuen Analysen ergaben aber zusätzlich, dass bei Einbeziehung der Apheliscidae und der Louisinidae in die Macroscelidea, wie vorher vorgeschlagen, auch die Amphilemuridae und die Adapisoricidae berücksichtigt werden müssen. Beide Familien (teilweise wurden sie auch synonym geführt) wurden über lange Zeit als Mitglieder der Insektenfresser gesehen und standen in der Ahnenreihe der Igel.[58][59] Im Bezug auf die Amphilemuridae kamen an dieser Zuweisung aber bereits Ende der 1980er Jahre Zweifel auf, sowohl zahn- als auch skelettanatomische Merkmale zeigen dem gegenüber Übereinstimmungen mit den Apheliscidae. Die variantenreichen Amphilemuridae sind aus dem Mittleren Paläozän bis zum Mittleren Eozän von Nordamerika und Europa bekannt, sehr gut erhaltene Skelettreste lassen bei diesen sowohl auf vergrößerte Hintergliedmaßen als auch eine verlängerte Nase schließen. Die Adapisoricidae, die gegenwärtig nur eine Gattung beinhalten, beschränken sich auf das Paläozän Europas.[60][54] Die Eingliederung der genannten Gruppen in die Macroscelidea wird aber nicht vollständig geteilt, da andere Autoren in der speziellen Ausbildung des Bewegungsapparates eher eine konvergente Entwicklung sehen.[61] Außerdem ergeben sich je nach Studie und Wichtung der einzelnen Merkmale recht unterschiedliche Verwandtschaftsbeziehungen zwischen den einzelnen Gruppen.[62][63] Als problematisch für die Apheliscidae und die Louisinidae erweist sich das Fehlen von eindeutigem Schädelmaterial, das zur Klärung beitragen könnte.[48]
Überblick über die Familien und Gattungen der Rüsselspringer
Die Ordnung der Rüsselspringer gliedert sich im klassischen Sinne folgendermaßen:[64][49][65][66][67][52][50][68]
- Ordnung: Macroscelidea Butler, 1956
- Familie: Herodotiidae Simons, Holroyd & Brown, 1991
- Chambius Hartenberger, 1986
- Herodotius Simons, Holroyd & Brown, 1991
- Nementchatherium Tabuce, Coiffait, Coiffait, Mahboubi & Jaeger, 2001
- Eotmantsoius Tabuce, Jaeger, Marivaux, Salem, Bilal, Benammi, Chaimanee, Coster, Marandat, Valentin & Brunet, 2012
- Familie: Metoldobotidae Simons, Holroyd & Brown, 1991
- Metoldobotes Schlosser, 1910
- Familie: Afrohypselodontidae Senut & Pickford, 2021
- Afrohypselodontus Senut & Pickford, 2021
- Familie: Rhynchocyonidae Gill, 1872
- Eorhynchocyon Senut & Pickford, 2021
- Oligorhynchocyon Stevens, O’Connor, Mtelela & Roberts, 2021
- Brevirhynchocyon Senut & Georgalis, 2014
- Hypsorhynchocyon Senut, 2008
- Miorhynchocyon Butler, 1984
- Rhynchocyon Peters, 1847
- Familie: Macroscelididae Bonaparte, 1838
- Palaeothentoides Stromer, 1932
- Hiwegicyon Butler, 1984
- Pronasilio Butler, 1984
- Miosengi Grossman & Holroyd, 2009
- Unterfamilie: Macroscelidinae Bonaparte, 1838
- Macroscelides A. Smith, 1829
- Galegeeska Heritage & Rayaleh, 2020
- Petrodromus Peters, 1846
- Petrosaltator Dumbacher, Carlen & Rathbun, 2016
- Unterfamilie: Elephantulinae Dumbacher, Carlen & Rathbun, 2016
- Elephantulus Thomas & Schwann, 1906
- Unterfamilie: Myohyracinae Andrews, 1914
- Promyohyrax Senut & Pickford, 2021
- Rukwasengi Stevens, O’Connor, Mtelela & Roberts, 2021
- Myohyrax Andrews, 1914
- Protypotheroides Stromer, 1922
- Unterfamilie: Mylomygalinae Patterson, 1965
- Mylomygale Broom, 1948
- Unterfamilie: Namasenginae Senut & Pickford, 2021
- Namasengi Senut & Pickford, 2021
Obwohl Rüsselspringer als lebende Tiere wissenschaftlich spätestens seit dem Beginn des 19. Jahrhunderts bekannt waren, konnten erst in den 1930er Jahren fossile Vertreter eindeutig erkannt und benannt werden. Erstmals gelang dies Robert Broom an einigen südafrikanischen Vertretern von Elephantulus,[69] später beschrieb er mit Mylomygale auch eine ausgestorbene Gattung.[70] Bereits zuvor benannte Vertreter wurden anderen Gruppen zugewiesen. Max Schlosser verwies im Jahr 1910 Metoldobotes aufgrund von Ähnlichkeiten zu Olbodotes zu den ausgestorbenen insektenfressenden Mixodectidae, die den Riesengleitern nahestehen (Schlosser übernahm dabei auch den damals bestehenden Schreibfehler von Oldobotes).[71][72] Wiederum vier Jahre später hatte Charles William Andrews Myohyrax aufgrund des spezialisierten Zahnbaus zu den Schliefern gestellt.[73] Dagegen erkannte Ernst Stromer 1921 in Protypotheroides einen Verwandten der Südamerikanischen Huftiere oder der Schliefer,[74] während er zehn Jahre darauf Palaeothentoides wegen vermeintlich vier vorhandenen Molaren den Beuteltieren zuordnete (der vorderste Molar war aber ein molarisierter Prämolar).[75] Erst eine detaillierte anatomische Studie aus der Mitte der 1960er Jahre erbrachte den Nachweis, dass alle diese ausgestorbenen Formen Rüsselspringer darstellten.[10]
Unter Berücksichtigung von Untersuchungsergebnissen seit dem Jahr 2005 müssen folgende Gruppen in die Macroscelidea eingegliedert werden:[76][55][56][54][61]
- Litocherus Gingerich, 1983
- Adunator Russell, 1964
- Familie: Adapisoricidae Schlosser, 1887
- Adapisorex Lemoine, 1883
- Familie: Amphilemuridae (= Dormaaliidae) Hill, 1953
- Neomatronella Russell, Louis & Savage, 1975
- Patriolestes Walsh, 1998
- Unterfamilie: Placentidentinae Russell, Louis & Savage, 1973
- Placentidens Russell, Louis & Savage, 1973
- Unterfamilie: Amphilemurinae Hill, 1953
- Alsaticopithecus Hürzeler, 1947
- Amphilemur Heller, 1935
- Gesneropithex Hürzeler, 1946
- Macrocranion (= Dormaalius) Weitzel, 1949
- Pholidocercus von Koenigswald & Storch, 1983
- Unterfamilie: Scenopaginae Novacek, 1985
- Ankylodon Patterson & McGrew, 1937
- Scenopagus McKenna & Simpson, 1959
- Unterfamilie: Sespedectinae Novacek, 1985
- Colpocherus Beard & Dawson, 2009
- Crypholestes Novacek, 1980
- Proterixoides Stock, 1935
- Sespedectes Stock, 1935
- Zionodon Dunn & Rasmussen, 2009
- Familie: Apheliscidae Matthew, 1918
- Litomylus Simpson, 1935
- Aletodon Gingerich, 1977
- Haplaletes Simpson, 1935
- Utemylus Gingerich, 1983
- Dorraletes Gingerich, 1983
- Haplomylus Matthew, 1915
- Unterfamilie: Apheliscinae Matthew, 1918
- Gingerichia Zack, Penkrot, Krause & Maas, 2005
- Phenacodaptes Jepsen, 1930
- Apheliscus Cope, 1975
- Familie: Louisinidae Sudre & Russell, 1982
- Cingulodon De Bast & Smith, 2017
- Walbeckodon Hooker & Russell, 2012
- Paschatherium Russell, 1964
- Berrulestes Hooker & Russell, 2012
- Dipavali van Valen, 1978
- Gigarton Hooker & Russell, 2012
- Monshyus (= Prolatidens) Sudre & Russell, 1982
- Thryptodon Hooker & Russell, 2012
- Prolouisina Hooker & Russell, 2012
- Teilhardimys (= Microhyus) Kretzoi & Kretzoi, 2000
- Louisina Russell, 1964
Teilweise werden die Scenopaginae und die Sespedectinae auch als eigenständige Familien geführt.[76]
Forschungsgeschichte
Entdeckung und Taxonomie


Erstmals wurden Europäer auf die Rüsselspringer Ende des 17. Jahrhunderts aufmerksam. Zwischen 1685 und 1696 führte Simon van der Stel (1639–1712), der spätere Gouverneur der Kapprovinz, eine Expedition auf der Suche nach Kupferlagerstätten ins Namaqualand. Dabei sichtete er neben zahlreichen anderen Tieren am 25. September 1685 auch Rüsselspringer, die der mitreisende Zeichner Hendrik Claudius auf Papier festhielt. Bedeutend sind die Expeditionen von Robert Jacob Gordon (1743–1795), die er 1772 bis 1773 und von 1777 an bis zu seinem Tod tätigte. Während seiner vierten Reise in die Kapregion des südlichen Afrikas in den Jahren 1779 und 1780 beobachtete er einige Rüsselspringer. In seinem Bericht von 2. August 1779 benannte er diese aufgrund der langen, rüsselartigen, sich ständig bewegenden Nase als Oliphantsmuis („Elefantenmaus“). Zudem bemerkte er die kurzen Vorder- und langen Hinterbeine und die hohe Geschwindigkeit, die die Tiere erreichten. Für beide Beobachtungen, jene von 1685 und jene von 1779 wird aufgrund des Verbreitungsgebietes angenommen, dass es sich um Kurzohrrüsselspringer handelte.[77][23] Im Jahr 1793 verwendete Thomas Pennant erstmals in seiner History of Quadrupeds die Bezeichnung Elephant shrew für den Kurzohrrüsselspringer, von der sich der deutsche Trivialname „Elefantenspitzmaus“ ableitet. Pennant ordnete die Tiere innerhalb der Spitzmäuse ein.[78]
Sieben Jahre später berief sich George Shaw auf Pennant und gab dem Kurzohrrüsselspringer die wissenschaftliche Bezeichnung Sorex proboscideus, womit er die Stellung innerhalb der Spitzmäuse bestätigte.[79] Wiederum knapp drei Dekaden später, im Jahr 1829, verwies Andrew Smith (1797–1872) den Kurzohrrüsselspringer in die neue Gattung Macroscelides (benannte ihn aber mit der Art Macroscelides typus, heute ein Synonym zu Macroscelides proboscideus). Der Name setzt sich aus den griechischen Wörtern μακρὁς (makros „groß“) und σκέλος (skélos „Bein“) zusammen und bezieht sich somit auf die deutlich verlängerten Hinterbeine.[80] Im Jahr 1838 führte dann Charles Lucien Jules Laurent Bonaparte (1803–1857) den auf den Gattungsnamen beruhenden Begriff Macroscelidina ein.[81] Der Name wurde zwar erst 1868 von St. George Mivart in die heute korrekte Familienbezeichnung Macroscelididae umbenannt,[82] doch gilt Bonaparte als Erstbeschreiber der Familie. Bis in das 21. Jahrhundert umschrieb diese die gesamte Gruppe der heutigen Rüsselspringer.[83][84] Die Bezeichnung der Ordnung Macroscelidea geht auf Percy M. Butler (1912–2015) zurück, der sie im Jahr 1956 einführte, ohne sie aber genauer zu definieren.[85] Das blieb Bryan Patterson vorbehalten, der im Jahr 1965 eine detaillierte Studie über die fossilen Vertreter der Ordnung im Vergleich zu ihren rezenten ablieferte.[10] Bereits im Jahr 1855 hatte Paul Gervais mit Tribu des Rhynchocyons und Tribu des Macroscélidens eine Einteilung der Rüsselspringer in zwei Gruppen vorgeschlagen.[86] Theodore Nicholas Gill stufte diese 17 Jahre später mit Rhynchocyoninae und Macroscelidinae auf den Rang von Unterfamilie hoch.[87] Die Zweiteilung der rezenten Rüsselspringer ist bis heute gültig, eine Verschiebung auf Familienebene erfolgte allerdings erst im Jahr 2021.[50]
Spitzmäuse, Nager oder afrikanische Tiere – Zur systematischen Stellung der Rüsselspringer
Die äußerlichen Ähnlichkeiten der Rüsselspringer mit den Spitzmäusen machten es nahezu unvermeidlich, dass sie in die im Jahr 1821 von Thomas Edward Bowdich proklamierten Insectivora („Insektenfresser“) aufgenommen wurden. Diesen gehörten ursprünglich neben den Spitzmäusen auch die Igel, Goldmulle, Tenreks und Maulwürfe an.[88] So führten Wilhelm Peters 1852[11] und Johann Andreas Wagner 1855[89] die damals bekannten Rüsselspringer innerhalb der Insektenfresser. Das zunehmende Wissen über die Rüsselspringer, das im Verlauf des 19. Jahrhunderts durch Neuentdeckungen angereichert wurde, veranlasste Peters dazu, die Insectivora neu zu gruppieren. Er etablierte zwei namenlose Gruppen, eine mit Blinddarm, in die er die Rüsselspringer neben den Eigentlichen Spitzhörnchen und zusätzlich noch die Riesengleiter einordnete, und eine ohne Blinddarm, die die restlichen Insectivora enthielt.[90] Im zweiten Band seines Werkes Generelle Morphologie der Organismen gab Ernst Haeckel im Jahr 1866 diesen beiden Gruppen die formellen Namen Menotyphla (mit Blinddarm) und Lipotyphla (ohne Blinddarm), allerdings schloss er die Riesengleiter wieder aus.[91]
Die Ansicht der Einstufung der Rüsselspringer in das Taxon Insectivora hielt sich noch bis weit in das 20. Jahrhundert, auch wenn die von Haeckel propagierte Zweiteilung teilweise angezweifelt wurde und die Eigentlichen Spitzhörnchen in einer näheren Verwandtschaft zu den Primaten stehen sollten. In einer anatomischen Studie der Rüsselspringer im Vergleich zu den Eigentlichen Spitzhörnchen und den Igeln erkannte Francis Gaynor Evans im Jahr 1942 zahlreiche Übereinstimmungen zwischen den ersten beiden Gruppen, etwa in den großen Augenhöhlen, dem vollständig ausgebildeten Jochbogen, dem aufgewölbten Hinterhaupt oder der langen Symphyse am Becken, die vom Sitzbein und Schambein gemeinsam gebildet wurde. Für ihn bedeuteten die Ergebnisse seiner Studien, dass die Aufteilung der Insectivora in zwei Großgruppen nach Haeckel tatsächlich eine reale Grundlage besaß.[9] George Gaylord Simpson folgte Evans in seiner generellen Taxonomie der Säugetiere nicht. Er verschob die Eigentlichen Spitzhörnchen zu den Primaten und untergliederte die damalige Ordnung Insectivora in fünf rezente Überfamilien, von denen eine die Rüsselspringer unter der Bezeichnung Macroscelidoidea darstellten; den Begriff hatte Theodore Gill 1872 eingeführt.[87] Später wurde zutreffend angemerkt, dass die von Evans herangezogenen Skelettmerkmale als eher primitive Eigenschaften der Höheren Säugetiere (Plesiomorphie) aufzufassen sind und demnach keine gemeinsam erworbenen Charaktere (Synapomorphie) der Rüsselspringer und der Eigentlichen Spitzhörnchen darstellen.[83][10]
Bei der Untersuchung fossiler Schädel von Insektenfressern und deren ausgestorbenen Verwandten konnte Percy M. Butler im Jahr 1956 bedeutende Unterschiede zu den Rüsselspringern und den Eigentlichen Spitzhörnchen herausarbeiten. Dies betrifft etwa den Bau des Augenfensters und der daran beteiligten Schädelknochen sowie die Anordnung der Kaumuskulatur, was Butler veranlasste, die Menotyphla aufzulösen und die Spitzhörnchen in die Nähe der Primaten zu stellen. Die Rüsselspringer verwies er in eine eigene Ordnung Macroscelidea mit näherer Stellung zu den Spitzhörnchen und Primaten als zu den Insektenfressern.[85] Eine relativ nahe Verwandtschaft der Rüsselspringer mit den Insektenfressern blieb aber vorerst dennoch bestehen, etwa bei Leigh Van Valen 1967, welcher die Macroscelidea als Unterordnung innerhalb der Insectivora ansah.[58] Mitte der 1970er Jahre postulierte Malcolm C. McKenna dagegen eine Nahverwandtschaft mit den Hasenartigen. Dazu vereinte McKenna die beide Gruppen unter dem Taxon Anagalida. Er leitete die Macroscelidea von ursprünglichen Vertretern der Anagalidae her, welche im Paläozän in Asien lebten und noch nicht die verwachsenen Knochen des Unterschenkels der Rüsselspringer sowie noch einen unreduzierten dritten Molaren aufwiesen.[92] Dem schloss sich Michael J. Novacek im Jahr 1986 weitgehend an, nachdem er eine Detailuntersuchung zu Schädeln von urtümlichen, insektenfresserartigen Tieren vorgelegt hatte. In seiner Systematik standen die Rüsselspringer den Glires, welche die Nagetiere und die Hasenartigen zusammenfasst, als Schwestergruppe gegenüber.[59] McKenna wiederholte seine Auffassung zusammen mit Susan K. Bell 1997 in ihrer Klassifikation der Säugetiere.[76]
Eine neue Perspektive erbrachten erst biochemische und molekulargenetische Untersuchungen, die im ausgehenden 20. Jahrhundert aufkamen. Analysen von Strukturproteinen ergaben bereits Mitte der 1980er Jahre eine mögliche nähere Verwandtschaft der Rüsselspringer zu den Elefanten und Schliefern.[93] Dies bestätigten dann genetische Untersuchungen Ende der 1990er Jahre, die zusätzlich eine nähere Verwandtschaft der Rüsselspringer mit den Tenreks, Goldmullen und dem Erdferkel und damit zu in Afrika beheimateten insektenfressend lebenden Tieren erbrachten. Daher erhielt diese äußerlich stark variable Gruppe die Bezeichnung Afrotheria.[94][95][47] Diese Ergebnisse konnten durch spätere Untersuchungen untermauert werden, unter anderem durch die Isolierung eines spezifischen Retroposons, des sogenannten AfroSINEs, das alle Vertreter der Afrotheria gemein haben.[96][97]
Stammesgeschichte
Die Herkunft der Rüsselspringer

Die Macroscelidea stellen eine alte Gruppe der Höheren Säugetiere dar, die wenigstens schon seit dem Unteren oder Mittleren Eozän in Afrika nachweisbar ist. Der Ursprung der Gruppe ist bis heute nicht geklärt. Unter Annahme einer Nahverwandtschaft mit den Glires und den ausgestorbenen Anagalidae wäre eine Herkunft aus Asien zu vermuten. Dieser Verwandtschaft widersprechen allerdings einzelne anatomische Befunde vor allem an der Fußwurzel. Demnach stellen die morphologischen Ähnlichkeiten zwischen den Nagern und den Rüsselspringern, die etwa im Bau der Gliedmaßen zu beobachten sind, eine eher parallele Entwicklung bei ähnlichen Fortbewegungsweisen dar. Einige Forscher bevorzugen dagegen eine Herleitung der Rüsselspringer aus der hochdiversen Gruppe der „Condylarthra“ (Apheliscidae und Louisinidae) unter Einbeziehung weiterer Gruppen (Amphilemuridae und Adapisoricidae), die aus verschiedenen Gründen in die Nähe der Insektenfresser gestellt wurden. In Übereinstimmung mit einer Abstammung von den Anagalidae würde dies den Ursprung der Macroscelidea bis weit in das Paläozän zurückverlagern, allerdings waren die vier genannten Gruppen zu dieser Zeit im heutigen Nordamerika und Europa verbreitet. Sowohl die Apheliscidae in Nordamerika als auch die Louisinidae in Europa traten vor 63 bis 62 Millionen Jahren erstmals auf. Die anderen Vertreter sind zumeist aus dem Eozän nachgewiesen.[55][56][54] Dabei sind unter anderem von Macrocranion und Pholidocercus aus der Gruppe der Amphilemuridae sehr gut erhaltene Skelette aus der Grube Messel überliefert, die in das Mittlere Eozän vor rund 47 Millionen Jahren datieren.[60] Bereits zu jener Zeit ist auch ein Faunenaustausch mit Afrika nachweisbar, da einzelne Angehörige der Louisinidae ebenfalls im nördlichen Afrika auftreten.[98]
Eozän
Das früheste Auftreten der Rüsselspringer im engeren Sinne fällt in das Untere und Mittlere Eozän. Sie erschien erstmals im nördlichen Afrika mit der Familie der Herodotiidae. Bedeutend in dem Zusammenhang ist die Fundstelle Chambi in Tunesien, nach der Chambius benannt wurde.[99][48] Dieser bisher urtümlichste Vertreter der Familie ist über zahlreiche Schädelreste und Zähne sowie über Teile des Körperskeletts nachgewiesen, die auf ein kleines Tier von schätzungsweise nur 13 g schließen lassen. Während der Zahnbau noch sehr ursprünglich ist, lassen sich im Bewegungsapparat aber schon Anpassungen an eine cursoriale Lebensweise erkennen. Dafür sprechen etwa die Leisten an der rollenartig ausgebildeten Trochlea des Sprungbeins, die für eine seitliche Stabilisierung des Fußes bei dynamischen Bewegungen sorgten, aber auch die langgestreckte Ausbildung des Fersenbeins, was charakteristisch für schnelllaufende Tiere ist.[100] Abweichend von den heutigen Arten besaß Chambius noch keine aufgeblähte Paukenblase und keine vergrößerten Ohrknöchelchen, sodass die Tiere möglicherweise noch keine Töne in niedrigen Frequenzen wahrnehmen konnten.[101] Die Gattung ist möglicherweise auch über einen einzelnen Backenzahn aus der Glib-Zegdou-Formation in der Region Gour Lazib in Algerien belegt. Dieser datiert bereits in den Übergang zum Mittleren Eozän.[102] Etwa zu diesem Zeitpunkt erscheinen auch Eotmantsoius und Nementchatherium in Dor el-Talha in Libyen. Erstere Gattung basiert aber nur auf einem einzelnen Zahn. Von letzterer sind neben einem fragmentierten linken Oberkiefer noch zahlreiche isolierte Zähne entdeckt worden.[65] Nementchatherium ist zusätzlich über Einzelzähne aus der spätmitteleozänen Fundstelle Bir El Ater in Algerien dokumentiert. Die Form zeigt gegenüber dem älteren Chambius schon einen deutlich molarisierten letzten Prämolaren.[103] Aus den unteren Abschnitten der Gebel-Quatrani-Formation des Fayyum in Ägypten wurde Herodotius. beschrieben. Benannt ist die Form nach den griechischen Historiker und Geographen Herodot, der im 5. Jahrhundert v. Chr. die antiken Städten des Fayyum beschrieb. Der Gattung liegen mehrere Ober- und Unterkieferfragmente zu Grunde, deren Alter auf etwa 34 Millionen Jahren geschätzt wird, womit sie dem Oberen Eozän angehören.[104][49]
Einige Fundstellen im Diamantensperrgebiet von Namibia im südwestlichen Afrika enthalten ebenfalls Fossilien von Rüsselspringern. Als überaus bedeutend erwies sich hier das Fundgebiet von Eocliff am westlichen Fuß der Klinghardtberge, das wahrscheinlich in das Mittlere bis Obere Eozän datiert. Hier verweisen einzelne Unterkiefer und Oberkieferfragmente von Eorhynchocyon auf das erste Auftreten der Rhynchocyonidae und somit der Verwandtschaft der Rüsselhündchen. Zu den Macroscelididae wiederum gehört Namasengi aus der Gruppe der Namasenginae. Diese Form von der Größe heutiger Elefantenspitzmäuse trat recht häufig auf und ist über mehrere hundert Schädelfragmente belegt. Als Besonderheiten erwiesen sich nicht nur die vollständige hintere Bezahnung, sondern auch die fehlenden Öffnungen im Gaumen. Promyohyrax wiederum repräsentiert die Myohyracinae, dessen hintere Zähne noch nicht ganz so hochkronig waren wie bei seinen späteren Verwandten aus dem östlichen Afrika. Auffallend sind hier auch die oberen Schneidezähne, die spatelartig breit wirken und kammartige Auffächerungen aufweisen. Die Afrohypseldontidae mit Afrohypselodontus als Charakterform konnten bisher nur aus dem südlichen Afrika dokumentiert werden. Sie zeichnen sich durch ihre extrem hochkronigen Backenzähne aus. Das umfangreich aufgefundene Schädelmaterial lässt anhand der variierenden Größe der Funde auf wenigstens zwei Arten schließen, von denen die größere rund 220 g wog und damit die Ausmaße der heutigen Rüsselratte erreichte. Daneben wurden auch zahlreiche Reste des Bewegungsapparates von Rüsselspringern geborgen, die sich aber momentan nicht genau zuordnen lassen. Weitere, gleichfalls nicht genauer klassifizierte Funde, stammen aus der Fundstelle Silica North, wiederum im Diamantensperrgebiet.[105][106][50]
Oligozän
Aus dem nachfolgenden Oligozän gibt es nur wenige Nachweise der Macroscelidea. In den oberen Bereichen der Gebel-Quatrani-Formation tritt bisher Metoldobotes aus der Familie der Metoldobotidae auf. Die Gattung wird durch wenigstens einen Unterkiefer sowie einen Zahn repräsentiert. Die Länge der vollständigen Zahnreihe liegt bei 32 mm, wodurch Metoldobotes deutlich größer war als seine Vorgänger.[71][72][104] Die oberoligozäne Nsungwe-Formation des Rukwa-Beckens im südwestlichen Tansania barg Oberkuíferreste und Zähne von Rüsselspringern, die zwei Formen umfassen, eine kleinere und eine größere. Sie stehen intermediär zwischen den älteren Vertretern des Paläogens und den jüngeren des Neogens. Im Jahr 2021 wurde die größere Form als Oligorhynchocyon und die kleinere als Rukwasengi wissenschaftlich beschrieben. Erstere gehört zu den Rüsselhündchen, letztere zu den Myohyracinae.[107][68]
Miozän
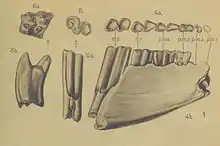
Im Unteren Miozän sind die Macroscelidea verstärkt im östlichen und südlichen Afrika präsent, ihrem heutigen Hauptverbreitungsgebiet. Eine Besonderheit bilden die Myohyracinae, deren spezielle Struktur der Backenzähne auf eine stärkere pflanzliche Ernährung schließen lässt. Zu den häufigen Formen zählt Myohyrax, das erstmals von Karungu in Kenia anhand eines Unterkieferfragmentes beschrieben wurde.[73] Bis heute liegen rund 50 weitere Unterkieferreste von der Fundstelle vor, weitere mehr als zwei Dutzend Fossilreste kamen in der Hiwegi-Formation von Rusinga, einer Insel im Victoriasee, und im angrenzenden Kaswanga zum Vorschein. Das bekannte Fundmaterial schließt auch einige postcranial Skelettteile ein, die in ihrer Gestaltung an die der Macroscelidinae, besonders der Rüsselratte, erinnern. Der Großteil des Fossilmaterials datiert auf etwa 20 bis 17 Millionen Jahre. Die jüngsten Funde Ostafrikas stammen aus Fort Ternan, ebenfalls im südwestlichen Kenia, und sind rund 13,8 Millionen Jahre alt.[108] In Namibia stellt Myohyrax mit mehr als 400 Einzelfunden allein von Arrisdrift am Oranje den häufigsten miozänen Vertreter der Rüsselspringer dar. Das Material setzt sich überwiegend aus Gebissresten und Zähnen zusammen und gehört in den gleichen Zeitraum wie der Großteil der ostafrikanischen Funde.[109] Einige weitere Unterkieferfragmente aus der Region um Lüderitz im Südwesten von Namibia werden zum nahe verwandten Protypotheroides gestellt, das die Größe der heutigen Rüsselhündchen erreichte.[74][49][53][10]
Ebenfalls im Unteren Miozän lassen sich wieder Vertreter nachweisen, die in der Entwicklungslinie der heutigen Arten stehen. Miorhynchocyon repräsentiert die Rhynchocyonidae und somit die Rüsselhündchen, es lebte im Zeitraum von vor 22 bis 14 Millionen Jahren in Ostafrika und schließt mehrere Arten ein. In ihrer Größe reichten die Tiere noch nicht an die heutigen Formen heran.[108] Etwa zeitgleich traten im südlichen Afrika Brevirhynchocyon und Hypsorhynchocyon auf, von denen zahlreiche Skelettelemente im Gebiet des Oranje aufgedeckt wurden.[109][64] Die Macroscelididae sind ebenfalls schon sehr früh dokumentiert und bilden eine variantenreiche Gruppe mit allein vier ausgestorbenen Gattungen. Allerdings ist das Fundmaterial eher beschränkt, sodass noch einzelne Unsicherheiten bestehen. Hiwegicyon wurde anhand eines Unterkiefer eines nicht ausgewachsenen Tieres aus der Hiwegi-Formation von Kaswanga beschrieben.[108] Die Lothidok-Formation im nordwestlichen Kenia barg ein Unterkieferfragment mit nur einem erhaltenen hinteren Backenzahn und dem Zahnfach eines weiteren, das Miosengi zugewiesen wird. Der zweite Backenzahn zeigt noch einige sehr primitive Merkmale, etwa die geringe Kronenhöhe. Beiden Fundstellen wird ein Alter von 17,8 bis 16,8 Millionen Jahren zugeschrieben.[110] Wiederum aus Fort Ternan stammen drei Gebissreste von Pronasilio. Auch hier sind noch einzelne urtümliche Merkmale wie die Ausbildung des hintersten dritten Molars und dem wenig molarisierten vierten Prämolaren zu erkennen.[49][108]
Aus dem weiteren Verlauf des Mittleren und Oberen Miozäns sind keine Reste von Rüsselspringern bekannt. Lediglich aus Ägypten wurden aus dem Karstgebiet in der Libyschen Wüste im Westen des Landes einzelne Zähne und ein Langknochen beschrieben, die eventuell Rhynchocyon angehören. Die Funde sind zwischen 10 und 11 Millionen Jahren alt, zu dieser Zeit war das Gebiet der heutigen Sahara noch deutlich feuchter.[111]
Plio- und Pleistozän
Erst im Pliozän treten Rüsselspringer wieder häufiger in Erscheinung, in der Regel gehören sie den modernen Entwicklungslinien an. In Ostafrika ist Rhynchocyon mit einigen Ober- und Unterkiefern in Laetoli in Tansania nachgewiesen. Das Alter der Fundstelle liegt bei 3,5 bis 3,6 Millionen Jahren.[112] Etwa in den gleichen Zeitraum lassen sich auch Funde aus südafrikanischen Höhlen einstufen. Von herausragender Stellung ist Makapansgat, in dessen Brekzien bisher rund 250 Individuen von Rüsselspringern entdeckt wurden. Die meisten Funde werden Elephantulus zugeordnet, einige wenige repräsentieren Macroscelides. Beide Gattungen haben hier ihren ältesten Fossilbeleg. Bereits im Übergang zum Pleistozän vor rund 2,5 Millionen Jahren stehen die bedeutenden Fundstellen von Sterkfontein und Swartkrans, in denen Rüsselspringer ebenfalls in nennenswerten Umfang vorkommen.[113][114][49]
Möglicherweise ebenso in den Übergang vom Pliozän zum Pleistozän gehört Palaeothentoides, von dem nur wenige Unterkieferreste aus Flussablagerungen von Klein Zee südlich von Port Nolloth im westlichen Südafrika überliefert sind. Bei diesem Vertreter der Macroscelidinae ist wie bei den meisten fossilen Gattungen der Gruppe der letzte Molar noch ausgebildet.[75] Die einzige Form jener Zeit, die nicht in die moderne Entwicklungslinie gehört, ist Mylomygale aus der Unterfamilie der Mylomygalinae. Sie wurde anhand eines Unterkiefers aufgestellt, der in einer Höhle nur wenige hundert Meter nördlich der berühmten Fundstelle von Taung zum Vorschein kam, sein exaktes Alter ist unbekannt.[70] Im weiteren Verlauf des Pleistozän sind vor allem Elephantulus und Macroscelides im südlichen und deutlich seltener im östlichen Afrika dokumentiert. Lediglich von Petrodromus gibt es bis heute keinen Fossilnachweis.[49][10]
Etymologie
Im deutschsprachigen Raum wurde der Begriff „Elefantenspitzmaus“, der mitunter auch für die gesamte Familie Verwendung fand, teilweise durch „Rüsselspringer“ abgelöst. Er bezieht sich einerseits auf die rüsselartige Nase, andererseits auf die typisch springende Fortbewegung. Im englischen Sprachraum dagegen setzte sich gegenüber der traditionellen Bezeichnung Elephant-shrew („Elefantenspitzmaus“) das Swahili-Wort Sengi durch, das die gleiche Bedeutung hat und 1997 erstmals von Jonathan Kingdon benutzt wurde. Sengi leitet sich aus dem Kigiriama ab, einer Bantusprache, wo es sanje lautet. Gründe von der Abkehr von „Elefantenspitzmaus“ oder Elephant-shrew sind einerseits die Erkenntnis, dass die Rüsselspringer nicht mit den Spitzmäusen verwandt sind, andererseits auch ihre endemische Verbreitung in Afrika, was eine eigenständige Benennung befürwortet.[115][116]
Gefährdung
Die Arten, die trockene bis wüstenartige Landschaften bewohnen, also alle Vertreter der Gattung Macroscelides und ein größerer Teil der Elefantenspitzmäuse, sind in ihrem Bestand nicht gefährdet. Da diese Gebiete für die Menschen eher unattraktiv sind, gibt es nur wenig Konfliktpotential und die Ausdehnung menschlicher Siedlungen oder Wirtschaftsflächen hält sich stark in Grenzen beziehungsweise beschränkt sich auf Flusstäler. Anders dagegen weisen die Bestände der Bewohner von Waldlandschaften, also aller Vertreter der Rüsselhündchen, starke Rückgänge auf. Hauptursachen sind die Abholzung und Vernichtung der Wälder und die dadurch verursachte Verinselung des Lebensraumes der Tiere. Zudem haben drei der fünf bekannten Arten der Rüsselhündchen ein sehr begrenztes Verbreitungsgebiet. Aufgrund dessen werden sie von der IUCN als bedroht eingestuft. Die Rüsselratte ist zwar weit verbreitet und wird generell als nicht gefährdet betrachtet, lokal unterliegen einzelne Populationen aber einer starken Gefährdung. Für einige Arten können aufgrund ihrer Seltenheit keine Angaben zur Bestandsbedrohung gemacht werden.[117]
Literatur
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 ISBN 978-84-16728-08-4
- Patricia A. Holroyd: Macroscelidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley/London/New York 2010, S. 89–98
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 258–287
- Gea Olbricht, Alexander Sliwa: Elefantenspitzmäuse – die kleinen Verwandten der Elefanten? Zeitschrift des Kölner Zoos 53 (3), 2010, S. 135–147
- Galen B. Rathbun: Why is there discordant diversity in sengi (Mammalia: Afrotheria: Macroscelidea) taxonomy and ecology? African Journal of Ecology 47, 2009, S. 1–13
Einzelnachweise
- John P. Dumbacher, Galen B. Rathbun, Timothy O. Osborne, Michael Griffin und Seth J. Eiseb: A new species of round-eared sengi (genus Macroscelides) from Namibia. Journal of Mammalogy 95 (3), 2014, S. 443–454
- Francesco Rovero, Galen B. Rathbun, A. Perkin, T. Jones, D. O. Ribble, C. Leonard, R. R. Mwakisoma und N. Doggart: A new species of giant sengi or elephant-shrew (genus Rhynchocyon) highlights the exceptional biodiversity of the Udzungwa Mountains of Tanzania. Journal of Zoology 274 (2), 2008, S. 126–133
- Michael F. Schneider und Victorino a Buramuge: Atlas of the microscopic hair structure of Southern African shrews, hedgehogs, goldem moles and elephant-shrews (Mammalia). Bonner zoologische Beiträge 54 (3), 2006, S. 103–172
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 258–287
- Stephen Heritage: Macroscelididae (Sengis). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 206–234 ISBN 978-84-16728-08-4
- Gea Olbricht und William T. Stanley: The topographic distribution of the penis and mammary glands in sengis (Macroscelidea) and its usefulness for taxonomic distinctions. Zoosystematics and Evolution 85 (2), 2009, 297–303
- Jan Ihlau, Friederike Kachel und Ulrich Zeller: Graphical description of the ventral side of a sengi's (Macroscelides proboscideus) skull. Afrotherian Conservation 4, 2006, S. 11–12
- Matthew J. Mason: Structure and function of the mammalian middle ear. I: Large middle ears in small desert mammals. Journal of Anatomy 228 (2), 2016, S. 284–299, doi:10.1111/joa.12313
- Francis Gaynor Evans: The osteology and relationships of the elephant-shrews (Macroscelididae). Bulletin of the American Museum of Natural History 80, 1942, S. 85–125
- B. Patterson: The fossil elephant shrews (Family Macroscelididae). Bulletin of The Museum of Comparative Zoology 133, 1965, S. 297–335
- Wilhelm Peters: Naturwissenschaftliche Reise nach Mossambique: auf Befehl seiner Majestät des Königs Friedrich Wilhelm IV in den Jahren 1842 bis 1848 ausgeführt. Berlin, 1852, S. 1–205 (S. 87–110) ()
- William Kitchen Parker: On the Structure and Development of the Skull in the Mammalia. Part III. Insectivora. Transactions of the Philosophical Society of London 176, 1885, S. 121–275 (S. 241–249)
- Jean E. Kratzing und Peter F. Woodall: The rostral nasal anatomy of two elephant shrews. Journal of Anatomy 157, 1988, S. 135–143
- Peter F. Woodall und R. I. Mackie: Caecal size and function in the rock elephant shrew Elephantulus myurus (Insectivora, Macroscelididae) and the Namaqua rock mouse Aethomys namaquensis (Rodentia, Muridae). Comparative Biochemistry and Physiology 87A, 1987, S. 311–314
- Peter F. Woodall: Digestive tract dimensions and body mass of elephant shrews (Macroscelididae) and the effects of season and habitat. Mammalia 51 (4), 1987, S. 537–545
- C. T. Downs: Renal structure, and the effect of an insectivorous diet on urine composition of Southern African Elephant-Shrew species (Macroscelidea). Mammalia 60 (4), 1996, S. 577–589
- Cornelius Jan van der Horst: Some observations of the structure of the genital tract of Elephantulus. Journal of Morphology 70, 1942, S. 403–429
- H. R. H. Tripp: Reproduction in elephant-shrews (Macroscelididae) with special reference to ovulation and implantation. Journal of Reproduction and Fertility 26, 1971, S. 149–159
- P. F. Woodall: The penis of elephant shrews (Masmmalia: Macroscelididae). Journal of Zoology 237, 1995, S. 399–410
- Jason A. Kaufman, Gregory H. Turner, Patricia A. Holroyd, Francesco Rovero und Ari Grossman: Brain Volume of the Newly-Discovered Species Rhynchocyon udzungwensis (Mammalia: Afrotheria: Macroscelidea): Implications for Encephalization in Sengis. PlosOne 8 (3), 2013, S. e58667, doi:10.1371/journal.pone.0058667
- Galen B. Rathbun: Why is there discordant diversity in sengi (Mammalia: Afrotheria: Macroscelidea) taxonomy and ecology? African Journal of Ecology 47, 2009, S. 1–13
- Barry G. Lovegrove und Metobor O. Mowoe: The evolution of micro-cursoriality in mammals. The Journal of Experimental Biology 217, 2014, S. 1316–1325
- Juri A. Miyamae, Talia Y. Moore und Galen B. Rathbun: Observations on an Unusual “Arrhythmic” Gait in Sengis. Afrotherian Conservation 14, 2018, S. 44–47
- J. Clevedon Brown: Observations on the Elephant shrews (Macroscelididae) of equatorial Africa. Proceedings of the Zoological Society of London 143, 1964, S. 103–119
- Galen B. Rathbun: Order Macroscelidea. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 22–34
- A. S. Faurie, E. R. Dempster und M. R. Perrin: Footdrumming patterns of southern African elephant-shrews. Mammalia 60 (4), 1996, S. 567–576.
- Fred W. Koontz und Nancy J. Roeper: Elephantulus rufescens. Mammalian Species 204, 1983, S. 1–5
- Sasha Hoffmann, Nigel C. Bennett, Bettine Jansen van Vuuren und Heike Lutermann: Space use and the evolution of social monogamy in eastern rock sengis. Ethology 126 (4), 2020, S. 393–402, doi:10.1111/eth.12983
- Clare D. FitzGibbon: The adaptive significance of monogamy in the golden-rumped elephant-shrew. Journal of Zoology 242, 1997, S. 167–177
- Melanie Schubert, Neville Pillay, David O. Ribble und Carsten Schradin: The Round-Eared Sengi and the Evolution of Social Monogamy: Factors that Constrain Males to Live with a Single Female. Ethology 115, 2009, S. 972–985
- Melanie Schubert, Carsten Schradin, Heiko G. Rödel, Neville Pillay und David O. Ribble: Male mate guarding in a socially monogamous mammal, the round-eared sengi: on costs and trade-offs. Behavioral Ecology and Sociobiology 64, 2009, S. 257–264
- David O. Ribble und Michael R. Perrin: Social organization of the Eastern Rock Elephant-shrew (Elephantulus myurus): the evidence for mate guarding. In: Belgian Journal of Zoology 135 (suppl.), 2005, S. 167–173.
- Petra Wester: Sticky snack for sengis: The Cape rock elephant-shrew, Elephantulus edwardii (Macroscelidea), as a pollinator of the Pagoda lily, Whiteheadia bifolia (Hyacinthaceae). Naturwissenschaften 97, 2010, S. 1107–1112
- Steven D. Johnson, Priscilla M. Burgoyne, Lawrence D. Harder und Stefan Dötterl: Mammal pollinators lured by the scent of a parasitic plant. Proceedings of the Royal Society B 278, 2011, S. 2303–2310
- Mike Perrin: Comparative aspects of the metabolism and thermal biology of elephant-shrews (Macroscelidea).Mammal Review 25, 1995, S. 61–78
- Colleen T. Downs und Mike R. Perrin: The thermal biology of three Southern African Elephant-shrews. Journal of thermal Biology 20 (6), S. 445–450
- Susan Lumpkin and Fred W. Koontz: Social and Sexual Behavior of the Rufous Elephant-Shrew (Elephantulus rufescens) in Captivity. Journal of Mammalogy 67 (1), 1986, S. 112–119
- Galen B. Rathbun und C. D. Rathbun: Social structure of the bushveld sengi (Elephantulus intufi) in Namibia and the evolution of monogamy in the Macroscelidea. Journal of Zoology 269, 2006, S. 391–399
- Galen B. Rathbun: The social structure and ecology of Elephant-shrews. Zeitschrift für Tierpsychologie Beiheft 20 (Fortschritte der Verhaltensforschung), 1979, S. 1–76
- E. G. Sauer: Zum Sozialverhalten der Kurzohrigen Elefantenspitzmaus Macroscelides proboscideus. Zeitschrift für Säugetierkunde 38, 1973, S. 65–97
- Gea Olbricht: Longevity and fecundity in sengis (Mavcroscelidea). Afrotherian Conservation 5, 2007, S. 3–5
- Steven Heritage, Erik R. Seiffert und Matthew R. Borths: Recommended fossil calibrators for time-scaled molecular phylogenies of Afrotheria. Afrotherian Conservation 17, 2021, S. 9–13
- Erik R Seiffert: A new estimate of afrotherian phylogeny based on simultaneous analysis of genomic, morphological, and fossil evidence. BMC Evolutionary Biology 7, 2007, S. 224, doi:10.1186/1471-2148-7-224
- Matjaž Kuntner, Laura J. May-Collado und Ingi Agnarsson: Phylogeny and conservation priorities of afrotherian mammals (Afrotheria, Mammalia). Zoologica Scripta 40 (1), 2011, S. 1–15
- Robert W. Meredith, Jan E. Janečka, John Gatesy, Oliver A. Ryder, Colleen A. Fisher, Emma C. Teeling, Alisha Goodbla, Eduardo Eizirik, Taiz L. L. Simão, Tanja Stadler, Daniel L. Rabosky, Rodney L. Honeycutt, John J. Flynn, Colleen M. Ingram, Cynthia Steiner, Tiffani L. Williams, Terence J. Robinson, Angela Burk-Herrick, Michael Westerman, Nadia A. Ayoub, Mark S. Springer und William J. Murphy: Impacts of the Cretaceous Terrestrial Revolution and KPg Extinction on Mammal Diversification. Science 334, 2011, S. 521–524
- Peter J. Waddell, Hirohisa Kishino und Rissa Ota: A Phylogenetic Foundation for Comparative Mammalian Genomics. Genome Informatics 12, 2001, S. 141–154
- Rodolphe Tabuce: New remains of Chambius kasserinensis from the Eocene of Tunisia and evaluation of proposed affinities for Macroscelidea (Mammalia, Afrotheria). Historical Biology 30 (1–2), 2018, S. 251–266, doi:10.1080/08912963.2017.1297433
- Patricia A. Holroyd: Macroscelidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 89–98
- Brigitte Senut und Martin Pickford: Micro-cursorial mammals from the late Eocene tufas at Eocliff, Namibia. Communications of the Geological Survey of Namibia 23, 2021, S. 90–160
- Galen B. Rathbun: Sengi Taxonomy – a 2017 update. Afrotherian Conservation 13, 2017, S. 9–10
- Steven Heritage, Houssein Rayaleh, Djama G. Awaleh und Galen B. Rathbun: New records of a lost species and a geographic range expansion for sengis in the Horn of Africa. PeerJ 8, 2020, S. e9652, doi:10.7717/peerj.9652
- Percy M. Butler: Fossil Macroscelidea. Mammal Review 25 (1/2), 1995, S. 3–14
- Jerry J. Hooker und Donald E. Russell: Early Palaeogene Louisinidae (Macroscelidea, Mammalia), their relationships and north European diversity. Zoological Journal of the Linnean Society 164, 2012, S. 856–936
- Shawn P. Zack, Tonya A. Penkrot, Jonathan I. Bloch und Kenneth D. Rose: Affinities of ‘hyopsodontids’ to elephant shrews and a holarctic origin of Afrotheria. Nature 434, 2005, S. 497–501
- Tonya A. Penkrot, Shawn P. Zack, Kenneth D. Rose und Jonathan I. Bloch: Postcranial morphology of Apheliscus and Haplomylus (Condylarthra, Apheliscidae): evidence for a Paleocene Holarctic origin of Macroscelidea. In: E. J. Sargis und M. Dagosto (Hrsg.): Mammalian evolutionary morphology: a tribute to Frederick S. Szalay. Vertebrate Paleobiology and Paleoanthropology Series, Springer, 2008, S. 73–106
- Shawn P. Zack, Tonya A. Penkrot, David W. Krause und Mary C. Maas: A new apheliscine ‘condylarth’ mammal from the late Paleocene of Montana and Alberta and the phylogeny of ‘hyopsodontids’. Acta Palaeontologica Polonica 50 (4), 2005, SD. 809–830
- Leigh van Valen: New Paleocene Insectivores and Insectivore classification. Bulletin of the American Museum of Natural History 135, 1967, S. 217–284
- Michael J. Novacek: The skull of leptictid insectivorans and the higher-level classification of eutherian mammals. Bulletin of the American Museum of Natural History 183, 1986, S. 1–111
- Kenneth D. Rose: The beginning of the age of mammals. Johns Hopkins University Press, Baltimore, 2006, S. 1–431 (S. 145–147)
- Eric De Bast und Thierry Smith: The oldest Cenozoic mammal fauna of Europe: implication of the Hainin reference fauna for mammalian evolution and dispersals during the Paleocene. Journal of Systematic Palaeontology 15 (9), 2017, S. 741–785, doi:10.1080/14772019.2016.1237582
- Jerry J. Hooker: New postcranial bones of the extinct mammalian family Nyctitheriidae (Paleogene, UK): Primitive euarchontans with scansorial locomotion. Palaeontologia Electronica 17 (3), 2014, S. 47A (1–82) ()
- Carly L. Manz und Jonathan I. Bloch: Systematics and Phylogeny of Paleocene-Eocene Nyctitheriidae (Mammalia, Eulipotyphla?) with Description of a new Species from the Late Paleocene of the Clarks Fork Basin, Wyoming, USA. Journal of Mammalian Evolution 22 (3), 2015, S. 307–342
- Brigitte Senut: Macroscelididae from the lower Miocene of the Northern Sperrgebiet, Namibia. Memoir of the Geological Survey of Namibia 20, 2008, S. 185–225
- Rodolphe Tabuce, Jean-Jaques Jaeger, Laurent Marivaux, Mustapha Salem, Awad Abolhassan Bilal, Mouloud Benammi, Yaowalak Chaimanee, Pauline Coster, Bernard Marandat, Xavier Valentin und Michel Brunet: New stem elephant-shrews (Mammalia, Macroscelidea) from the Eocene of Dur at-Talah, Libya. Palaeontology 55 (5), 2012, S. 945–955
- Brigitte Senut und G. Georgalis: Brevirhynchocyon gen. nov., a new name for the genus Brachyrhynchocyon Senut, 2008 (Mammalia, Macroscelidea) preoccupied by Brachyrhynchocyon Loomis, 1936 (Mammalia, Carnivora). Communications of the Geological Survey of Namibia 15, 2014, S. 69
- John P. Dumbacher, Elizabeth J. Carlen und Galen B. Rathbun: Petrosaltator gen. nov., a new genus replacement for the North African sengi Elephantulus rozeti (Macroscelidea; Macroscelididae). Zootaxa 4136 (3), 2016, S. 567–579
- Nancy J. Stevens, Patrick M. O’Connor, Cassy Mtelela und Eric M. Roberts: Macroscelideans (Myohyracinae and Rhynchocyoninae) from the late Oligocene Nsungwe formation of the Rukwa Rift Basin, southwestern Tanzania. Historical Biology, 2021, doi:10.1080/08912963.2021.1938565
- Robert Broom: On some new Pleistocene mammals from limestone caves of the Transvaal. South African Journal of Science 33, 1937, S. 750–768
- Robert Broom: Some South African Pliocene and Pleistocene Mammals. Annals of the Transvaal Museum 21, 1948, S. 1–38
- Max Schlosser: Über einige fossile Säugetiere aus dem Oligocän von Ägypten. Zoologischer Anzeiger 35, 1910, S. 500–508 ()
- Max Schlosser: Beiträge zur Kenntnis der oligozänen Landsäugetiere aus dem Fayum, Ägypten. Beiträge zur Paläontologie und Geologie Österreich-Ungarns 24, 1911, S. 51–164 (S. 70–72) ()
- Charles William Andrews: On the lower Miocene vertebrates from British East Africa collected by Dr. Felix Oswald. Quarterly Journal of the geological Society of London 70, 1914, S. 163–186 ()
- Ernst Stromer: Erste Mitteilung über tertiäre Wirbeltier-Reste aus Deutsch-Südwestafrika. Sitzungsberichte der mathematisch-physikalischen Klasse der Bayerischen Akademie der Wissenschaften 1921, S. 331–340
- Ernst Stromer: Palaeothentoides africanus, nov. gen., nov. spec., ein Erstes Beuteltier aus Afrika. Sitzungsberichte der mathematisch-naturwissenschaftlichen Abteilung der Bayerischen Akademie der Wissenschaften 1931, S. 177–190
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 86–87 und S. 274–276)
- L. C. Rookmaker: The Zoological Exploration of Southern Africa. Rotterdam, 1989, S. 1–368 (S. 25, 99 und 306)
- Thomas Pennant: History of Quadrupeds. London, 1793, S. 226 ()
- George Shaw: General Zoology or Systematic Natural History. Volume I Part II. Mammalia. London, 1800, S. 249–552 (S. 536) ()
- Andrew Smith: Contributions to the natural history of South Africa. Zoological Journal of London 4, 1829, S. 433–444 (S. 435–436) ()
- Charles Lucien Jules Laurent Bonaparte: Synopsis vertebratorum systematis. Nuovi annali delle scienze naturali, Bologna 2, 1838, S. 105–133 ()
- St. George Mivart: Notes on the osteology of the Insectivora. Journal of Anatomy and Physiology London 2, 1868, S. 117–154 ()
- George Gaylord Simpson: The principles of classification and a classification of mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 50 und 175–179)
- Don E. Wilson und DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. A taxonomic and geographic Reference. Johns Hopkins University Press, Baltimore MD 2005, ISBN 0-8018-8221-4 ()
- Percy M. Butler: The skull of Ictops and the classification of the Insectivora. Proceedings of the Zoological Society of London 126, 1956, S. 453–481
- Paul Gervais: Histoire naturelle des Mammifères. Paris 1855, S. 1–418 (S. 238) ()
- Theodore Gill: Arrangement of the families of mammals with analytical tables. Prepared for the Smithsonian institution. Smithsonian Miscellaneous Collections 11, 1872, S. 1–98 ()
- Thomas Edward Bowdich: An analysis of the natural classifications of Mammalia for the use of students and travellers. Paris, 1821, S. 1–115 (S. 31–33) ()
- Johann Andreas Wagner: Die Säugethiere in Abbildungen nach der Natur. Supplementband, fünfte Abteilung: Die Affen, Zahnlücker, Beutelthiere, Hufthiere, Insektenfresser und Handflügler. Leipzig, 1855, S. 1–810 (S. 521–591)()
- Wilhelm Peters: Über die Säugethiergattung Selenodon. Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin 1863, S. 1–22 ()
- Ernst Haeckel: Generelle Morphologie der Organismen. Band 2. Berlin, 1866, S. 1–462 (S. CLX)()
- Malcolm C. McKenna: Toward a phylogenetic classification of the Mammalia. In W. Patrick Luckett und Frederick S. Szalay (Hrsg.): Phylogeny of the primates: a multidisciplinary approach. New York, London, 1975, S. 21–46
- Wilfried de Jong, J. A. M. Leunissen und G. J. Wistow: Eye lens crystallins and the phylogeny of placental orders: Evidence for a Macroscelid-Paenungulate clade? In: Frederick S. Szalay, Michael J. Novacek und Malcolm C. McKenna (Hrsg.): Mammal Phylogeny: Placentals. Springer, 1993, S. 5–12
- Michael J. Stanhope, Victor G. Waddell, Ole Madsen, Wilfried de Jong, S. Blair Hedges, Gregory C. Cleven, Diana Kao und Mark S. Springer: Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals. PNAS 95, 1998, S. 9967–9972
- Michael J. Stanhope, Ole Madsen, Victor G. Waddell, Gregory C. Cleven, Wilfried W. de Jong und Mark S. Springer: Highly Congruent Molecular Support for a Diverse Superordinal Clade of Endemic African Mammals. Molecular Phylogenetics and Evolution 9 (3), 1998, S. 501–508
- Masato Nikaido, Hidenori Nishihara, Yukio Hukumoto und Norihiro Okada: Ancient SINEs from African Endemic Mammals. Molecular Biology and Evolution 20 (4), 2003, S. 522–527
- Hidenori Nishihara, Yoko Satta, Masato Nikaido, J. G. M. Thewissen, Michael J. Stanhope und Norihiro Okada: A Retroposon Analysis of Afrotherian Phylogeny. Molecular Biology and Evolution 22 (9), 2005, S. 1823–1833
- Rodolphe Tabuce, Sylvain Adnet, Henri Cappetta, Abdelmajid Noubhani und Frédéric Quillevere: Aznag (bassin d’Ouarzazate, Maroc), nouvelle localité à sélaciens et mammifères de l’Eocène moyen (Lutétien) d’Afrique. Bulletin de la Societe géologique de France 176 (4), 2005, S. 381–400
- Jean-Louis Hartenberger: Hypothèse paléontologique sur l’origine de Macroscelidea (Mammalia). Comptes rendus de l'Académie des sciences. Série 2 302, 1986, S. 247–249 ()
- Rodolphe Tabuce, Laurent Marivaux, Mohammed Adaci, Mustapha Bensalah, Jean-Louis Hartenberger, Mohammed Mahboubi, Fateh Mebrouk, Paul Tafforeau und Jean-Jacques Jaeger: Early Tertiary mammals from North Africa reinforce the molecular Afrotheria clade. Proceedings of the Royal Society B 274, 2007, S. 1159–1166
- Julien Benoit, Maeva Orliac und Rodolphe Tabuce: The petrosal of the earliest elephant-shrew Chambius (Macroscelidea: Afrotheria) from the Eocene of Djebel Chambi (Tunisia) and the evolution of middle and inner ear of elephant-shrews. Journal of Systematic Palaeontology 11 (7/8), 2013, S. 907–923
- Mohammed Adacia, Rodolphe Tabuce, Fateh Mebrouk, Mustapha Bensalah, Pierre-Henri Fabre, Lionel Hautier, Jean-Jacques Jaeger, Vincent Lazzari, M’hammed Mahboubic, Laurent Marivaux, Olga Otero, Stéphane Peigné und Haiyan Tong: Nouveaux sites à vertébrés paléogènes dans la région des Gour Lazib (Sahara nord-occidental, Algérie). Comptes Rendus Palevol 6, 2007, S. 535–544
- Rodolphe Tabuce, Brigitte Coiffait, Philippe Emmanuel Coiffait, Mohamed Mahboubi und Jean-Jaques Jaeger: A new genus of Macroscelidea (Mammalia) from the Eocene of Algeria: a possible origin for elephant-shrews. Journal of Vertebrate Paleontology 21, 2001, S. 535–546
- Elwyn L. Simons, Patricia A. Holroyd und Thomas Thomas M. Brown: Early tertiary elephant-shrews from Egypt and the origin of the Macroscelidea. PNAS 88, 1991, S. 9734–9737
- Martin Pickford, Brigitte Senut, Jorge Morales, Pierre Mein und Israel M. Sánchez: Mammals from the Lutetian of Namibia. Memoirs of the Geological Survey of Namibia 20, 2008, S. 465–514
- Martin Pickford: Late Eocene Chrysochloridae (Mammalia) from the Sperrgebiet, Namibia. Communications of the Geological Survey of Namibia 16, 2015, S. 153–193
- Nancy Stevens, Sifa Ngasala, Michael Gottfried Patrick O’Connor und Erik Roberts: Macroscelideans from the Oligocene of Southwestern Tanzania. Journal of Vertebrate Paleontology 26 (3, suppl), 2006, S. 128A
- Percy M. Butler: Macroscelidea, Insectivora and Chiroptera from the Miocene of East Africa. Palaeovertebrata 14 (3), 1984, S. 117–200
- Brigitte Senut: The Macroscelididae from the Miocene of the Orange River, Namibia. Memoir of the Geological Survey of Namibia 19, 2003, S. 119–141
- Ari Grossman und Patricia A. Holroyd: Miosengi butleri, gen. et sp. nov., (Macroscelidea) from the Kalodirr Member, Lothidok Formation, Early Miocene of Kenya. Journal of Vertebrate Paleontology 29 (3), 2009, S. 957–960
- H. A. Wanas, M. Pickford, P. Mein, H. Soliman und L. Segalen: Late Miocene karst system at Sheikh Abdallah, between Bahariya and Farafra, Western Desert, Egypt: Implications for palaeoclimate and geomorphology. Geologica Acta 7 (4), 2009, S. 475–487
- Alisa J. Winkler: Macroscelidea. In: Terry Harrison (Hrsg.): Paleontology and Geology of Laetoli: Human Evolution in Context: Volume 2: Fossil Hominins and the Associated Fauna. Springer Science, 2011, S. 67–74
- T. N. Pocock: Plio-Pleistocene fossil mammalian microfauna of Southern Africa - a preliminary report including description of two new fossil muroid genera (Mammalia: Rodentia). Palaeontologia Africana 26, 1987, S. 69–91
- Patricia A. Holroyd: Past records of Elephantulus and Macroscelides: geographic and taxonomic issues. Afrotherian Conservation 7, 2009, S. 3–7
- Galen Rathbun und Jonathan Kingdon: The etymology of “SENGI”. Afrotherian Conservation 4, 2006, S. 14–15
- Gea Olbricht und Alexander Sliwa: Elefantenspitzmäuse – die kleinen Verwandten der Elefanten? Zeitschrift des Kölner Zoos 53 (3), 2010, S. 135–147
- IUCN: The IUCN Red List of Threatened Species. Version 2015.2. (); zuletzt abgerufen am 16. August 2015
Weblinks
- Fotos und Videos zu den Rüsselspringern (Sengi) der California Academy of Sciences, erstellt von Galen B. Rathbun (Afrotheria Specialist Group der IUCN)