Weichtiere
Die Weichtiere (Mollusca) oder Mollusken (lateinisch molluscus „weich“) sind ein sehr arten- und formenreicher Tierstamm der Gewebetiere (Eumetazoa). Sie leben vorwiegend im Meer (marin), kommen mit einigen Formen aber auch auf dem Festland und im Süßwasser vor. Die Wissenschaft von den Weichtieren wird auch als Malakologie (altgriechisch μαλακός malakós „weich“) oder Malakozoologie bezeichnet.
| Weichtiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Einige Vertreter der Mollusken (v.l.o.n.r.u.): Eine Käferschnecke der Gattung Chiton, eine Herzmuschel der Art Dinocardium robustum, eine Amerikanische Kronenschnecke (Melongena corona) und ein Gewöhnlicher Tintenfisch (Sepia officinalis). | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Mollusca | ||||||||||||
| Cuvier, 1797 |
Anatomie
Allgemein
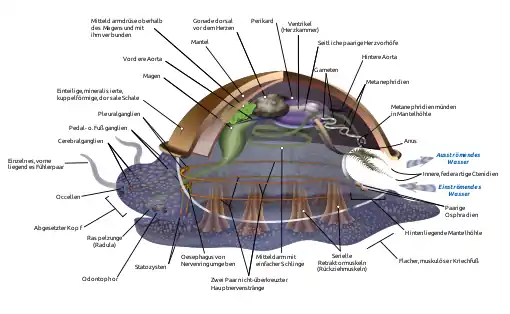
Der Körper der Weichtiere ist ursprünglich unsegmentiert, streng zweiseitig (bilateral) symmetrisch gebaut und gliedert sich in vier Regionen:
- den mit einer Raspelzunge (Radula) ausgestatteten, mehr oder weniger deutlich abgesetzten Kopf am vorderen Körperende,
- den „bauchseitig“ (ventral) gelegenen, muskulösen Fuß,
- die „rückenseitig“ (dorsal) gelegene, mehr oder weniger als Eingeweidesack abgesetzte Visceralmasse sowie
- den Mantel (Pallium), der die Visceralmasse dorsal bedeckt bzw. umschließt.
Kopf und Fuß, die zusammen eine funktionelle Einheit bilden, die für die Fortbewegung, Nahrungsaufnahme und – damit eng verknüpft – die Informationsverarbeitung zuständig sind, werden auch zum Kopffuß (Cephalopodium) zusammengefasst. Mantel und Eingeweidesack übernehmen als funktionelle Einheit vor allem die grundlegenden Lebensfunktionen und werden daher auch zum Visceropallium zusammengefasst.
Der Fuß ist bei den meisten Weichtiergruppen als Kriech- oder Grab- und Haftorgan ausgebildet, wobei die Kriech-Haft-Funktion als die ursprüngliche gilt. Die äußere Zellschicht des Mantels, das Mantelepithel, scheidet bei vielen Arten zum besseren Schutz des Eingeweidesacks ein Außenskelett aus Calciumcarbonat ab. Dieses Außenskelett tritt in verschiedenen Formen auf: Es kann aus einer Episphäre, d. h. aus einer chitinösen Schicht (Cuticula), in die zahlreiche einzelne, kleine Kalknadeln (Spicula) eingelagert sind, bestehen, eine Art flächigen Panzer bilden oder aber ein gestrecktes oder spiralig gewundenes Gehäuse, in das sich das Tier vollständig zurückziehen kann. Die flächigen oder gehäuseartigen Außenskelette sind unter den Mollusken weit verbreitet und werden auch als Schale bezeichnet. Kalkspicula gelten als ursprüngliches („primitives“) Merkmal und finden sich nur bei Wurmmollusken (Aplacophora) und Käferschnecken (Polyplacophora), wobei letztgenannte auch flächige Strukturen ausbilden. Das Epithel des Kopffußes trägt oft Wimpern (Cilien) und zahlreiche Drüsen, die verschiedene Sekrete absondern.
Der Mantel bildet (ursprünglich am Körperende) eine mehr oder weniger voluminöse Einstülpung, die Mantelhöhle. In ihr liegen Organe, die als Ctenidien („Kammorgane“) bezeichnet werden. Sie erzeugen zusammen mit vielen kleinen im Mantelepithel sitzenden Wimpern einen Wasserstrom, der dafür sorgt, dass ein stetiger Wasseraustausch zwischen der Mantelhöhle und der Umgebung erfolgt, denn in die Mantelhöhle münden der Darm und die Nierengänge (siehe unten) ein. Das Mantelepithel der Mantelhöhle dient zudem der Sauerstoffaufnahme und Kohlendioxidabgabe. Bei größeren Mollusken (mit Ausnahme der Landschnecken und Kahnfüßer) übernehmen die Ctenidien auch eine Kiemenfunktion.
Das Exkretionssystem der Mollusken gilt als einzigartig. Die Ultrafiltration des Primärharns aus der Hämolymphe, einer Art primitivem Blut, erfolgt dabei über die Wände der Herzvorkammern (Atrien, Aurikel) in das Perikard (Herzbeutel) hinein, den Coelomraum, der das Herz umgibt. Die den Atrien aufliegenden und mit Podocyten ausgekleideten Bereiche des Perikardialepithels werden aus historischen Gründen auch „Perikardialdrüsen“ genannt. Ermöglicht wird die Filtration durch den vom Herzmuskel erzeugten „Blutdruck“. Der Primärharn (Perikardialflüssigkeit) passiert nachfolgend die Perikardiodukte (auch Nephridien, Metanephridien, oder Nephridialkanäle genannt, jeweils einer pro Körperhälfte), bewimperte Gänge, die an einem Ende mit dem Perikard und am anderen Ende mit der Mantelhöhle in Verbindung stehen. Bei „höheren“ Mollusken sind die Perikardiodukte abschnittsweise relativ komplex aufgebaut, wobei diese Abschnitte dann „Nieren“ genannt werden. In den Perikardiodukten erfolgt die Rückresorption von Wasser und lebenswichtigen im Primärharn enthaltenen Stoffen. So entsteht der Sekundärharn. Dieser wird in die Mantelhöhle abgegeben. Das Exkretionssystem der Mollusken ähnelt damit in seinem Aufbau relativ stark dem der Wirbeltiere. Perikardialdrüsen und Perikard fungieren dabei analog zu den Glomeruli und Bowman’schen Kapseln der Nierenkörperchen und die Perikardiodukte analog zu den Nierenkanälchen der Wirbeltierniere.[1]
Während einige Gruppen der „höheren“ Mollusken (Eumollusca, Testaria) einen vergleichsweise konservativen Körperbau aufweisen, der dem vermuteten ursprünglichen Bauplan (siehe unten) mit Kriechfuß, Radula, einfachem Außenskelett mit reiner Schutzfunktion, strenger Bilateralsymmetrie und After am hinteren Körperende relativ nahe kommt (Einschaler, Käferschnecken – wobei diese Vertreter mit u. a. der Vervielfachung der Ctenidien bzw. einer mehrplattigen Schale eine Pseudosegmentierung entwickelt haben), ist in anderen Gruppen dieser Bauplan noch stärker abgewandelt worden. So sind bei den Kopffüßern (Cephalopoda) die ursprünglichen Körperachsen um 90° gedreht, sodass die ursprüngliche Dorsalseite das hintere Körperende bildet und das ursprüngliche Hinterende mit After und Mantelhöhle kopfnah ventral liegt. Entsprechend bildet der Kopffuß das Vorderende, wobei er einen um die Mundöffnung angeordneten Tentakel- oder Armkranz aufweist, während das Gehäuse nicht nur Schutz bietet, sondern auch als Teil eines hydrostatischen Apparates zur Regulierung des statischen Auftriebs fungiert. Bei den modernen Kopffüßern (Coleoidea) ist der Auftriebskörper ins Körperinnere verlagert oder sehr stark reduziert. Ebenfalls sehr stark modifiziert sind die Muscheln (Bivalvia), bei denen der Kopf und die Radula reduziert und der Fuß zu einem Graborgan umgebildet und die Schale zweiklappig ausgebildet sind. Bei den Schnecken erfolgte eine teilweise Reduktion der Bilateralsymmetrie, einhergehend mit einer Drehung des Eingeweidesacks um 180°. Daher zeigen bei Schnecken Mantelhöhle und After in Kopfrichtung.
Ernährung
Das Verdauungssystem der Weichtiere differiert entsprechend ihrer physiologischen Bedürfnisse erheblich.[2][3] Besonders stabile Biopolymere finden sich oft an den Nahrung ergreifenden und zerkleinernden Strukturen (Radula oder Papageienschnabel-artigen Kiefern der Kopffüßer) in Form von Chitin.[4] Einzelne herbivore Weichtiere nutzen in ihrem Verdauungssystem auch endogene Cellulasen zum Abbau von Cellulose, welche nachgewiesen wurde bei einigen Schnecken[5] wie der Weinbergschnecke[6] und einigen Muscheln: Corbicula japonica und Lyrodus pedicellatus.[7] Die Herkunft des Cellulase-Gens wird auf den letzten gemeinsamen Vorfahren der Bilateria zurückgeführt.[8]
Sinnesorgane
Sinneszellen kommen unter anderem in Form von Tast-, Geruchs-, Geschmacks- und Lichtsinneszellen vor.
Während einfache Lichtsinneszellen bei den meisten Gruppen vorkommen, haben Kopffüßer, Schnecken und einige Muscheln echte Augen ausgebildet. Die Sinnesorgane werden besonders vom Zerebralganglion innerviert. Ihre höchste Organisationsstufe erreichen sie in den Augen der Kopffüßer, die in ihrer Leistungsfähigkeit und ihrem Aufbau mit den Augen der Wirbeltiere zu vergleichen sind, sich aber anders entwickeln.
Andere Sinnesorgane sind die vielfach vorhandenen Tentakel. Sie dienen teilweise der Mechanorezeption (Tastsinn), Chemorezeption (Schmecken), Olfaktion (Riechen), Photorezeption (Lichtwahrnehmung) sowie auch der Wahrnehmung von Strömung. Weitere charakteristische Sinnesorgane sind die Osphradien, die bei wasserlebenden Formen am Mantelrand liegen, in die Mantelhöhle hineinragen und der chemischen Sinneswahrnehmung dienen.
Fortbewegung und Sessilität
Fortbewegung
Schnecken: Schnecken bewegen sich ursprünglich kriechend vor. Typische Landschnecken ziehen das Hinterende ihres Fußes in regelmäßigen, kleinen Abständen nach vorne und setzen es dort wieder auf, wodurch sich wellenförmige Linien an der Unterseite des Fußes ergeben.
Muscheln: Typische Muscheln verändern nur langsam ihre Position. Sie suchen sich eine geeignete Stelle, um sich mit ihrem muskulösen Fuß einzugraben oder festzuheften. Durch Muskelkontraktion im Fuß können sie ihre Position verändern. Bei manchen Muscheln (Miesmuschel, Wandermuschel) lösen sich zusätzlich Byssusfäden aus der Fußrinne, mit denen sie sich an festem Untergrund oder anderen Miesmuscheln festhalten und ihre Lage verändern können.
- Alle Kopffüßer können Atemwasser in die Mantelhöhle saugen und dieses Wasser anschließend unter Druck durch den Trichter wieder ausstoßen. Dies erzeugt einen Rückstoß und ermöglicht – bei vielen Tintenfischen zusätzlich unterstützt durch Öffnen und schnelles, kraftvolles Schließen des mit Schwimmhäuten versehenen Armkranzes – relativ hohe Geschwindigkeiten.
- Vor allem die Zehnarmigen Tintenfische besitzen an der Außenseite des Mantels Flossen oder einen Flossensaum, mit denen bzw. dem sie durch wellenartige Bewegungen Vortrieb erzeugen. Auf diese Weise ist eine langsamere, dosiertere Fortbewegung möglich. Perlboote mit ihrem größtenteils im Gehäuse verborgenen Mantel haben hingegen keinerlei Flossen.
Anheftung, Schutz
Viele Weichtiere produzieren Seide bzw. Seidenproteine:
Muscheln, beispielsweise Miesmuscheln, produzieren Muschelseide (Byssus), um sich anzuheften, oft nur im Juvenilstadium. Byssus ist der Seide der Insekten in seinem Aufbau homolog, es enthält die Seidenproteine Fibroin und Sericin.
Viele Vertreter verschiedener Klassen der Schalenweichtiere, einschließlich einiger Kopffüßer (wie Perlboote), bilden Schalen, deren innerste Schicht, das Hypostracum, im Wesentlichen aus Perlmutt besteht, einem biologischen Verbundstoff aus Calciumcarbonat und unter anderem fibroinartigen Proteinen.[9]
Die Anlagen zur Produktion von Seidenproteinen sind beim gemeinsamen Vorfahren von Weichtieren und Gliedertieren zu suchen. Im Verlauf der weiteren Evolution gingen daraus vielfältige Verwendungen, viele verschiedene Sekretionsorgane und vielfältige Molekülstrukturen der jeweiligen „Seiden“ hervor, die noch nicht vollständig aufgeklärt sind.[10]
Fortpflanzung und Entwicklung
Die meisten Muscheln, alle Kopffüßer und viele Schnecken sind getrenntgeschlechtlich. Zwittertum ist jedoch bei manchen Gruppen verbreitet oder sogar die Norm, v. a. bei den Lungenschnecken. Die Befruchtung erfolgt ursprünglich im freien Wasser, in das die Eier und Spermien abgegeben werden; bei vielen abgeleiteten Molluskengruppen hat sich eine innere Befruchtung entwickelt, z. B. bei sämtlichen auf dem Festland lebenden Schnecken.
Die Entwicklung der Weichtiere erfolgt meist durch eine Spiralfurchung. Im weiteren Verlauf entwickelt sich zunächst ein Larvenstadium. Dies kann eine Hüllglockenlarve, ein Präveliger oder Veliger sein, die äußerlich einer Trochophora-Larve ähneln. Die dotterreichen Eier der Kopffüßer weisen eine diskoidale Furchung auf und zeigen eine direkte Entwicklung. Bei manchen Gruppen, insbesondere bei den im Süßwasser und auf dem Land lebenden Lungenschnecken, ist die Entwicklung ebenfalls direkt und ohne freilebendes Larvenstadium.
Manche Arten betreiben Brutfürsorge: Arten der Einschaler (Monoplacophora) behalten die Embryonen bis zum Schlüpfen in der Mantelhöhle, ähnlich wie dies auch die Erbsenmuscheln (Pisidiidae) im Süßwasser machen. Kraken der Gattung Octopus bewachen ihr Gelege und auch vereinzelte tropische Süßwasserschnecken zeigen Formen von Brutfürsorge.[11]
Verbreitung und Artenzahl
Weichtiere leben mit Ausnahme der Polarregionen und der Hochgebirge in allen Lebensräumen der Erde. Die meisten Mollusken leben allerdings im Meer, fast alle Gruppen sind ausschließlich marin (Kopffüßer, Kahnfüßer, Einschaler, Wurmmollusken, Käferschnecken). Die Muscheln finden sich auch im Süßwasser und teilweise sogar in feuchter Erde, wie beispielsweise die Erbsenmuscheln (Pisidium spec.). Alle anderen Lebensräume werden von der größten Gruppe der Weichtiere, den Schnecken, besiedelt.
Die Gesamtartenzahl wird sehr unterschiedlich angegeben, von teilweise deutlich über 100.000 Arten bis manchmal lediglich 50–60.000 Arten. Hauptgründe für die verschiedenen Angaben sind unklare Artabgrenzungen und insbesondere das Fehlen einer Gesamtübersicht über die Artenvielfalt der verschiedenen Teilgruppen.
Paläontologie und frühe Evolution
Aufgrund ihrer gut fossil erhaltungsfähigen Außenskelette aus Calciumcarbonat weisen Weichtiere einen generell sehr dichten Fossilbericht auf. Die ältesten Fossilien, die mit Sicherheit von Weichtieren stammen, finden sich in der Small-Shelly-Fauna des untersten Kambriums, doch ist der Tierstamm höchstwahrscheinlich schon im späten Präkambrium entstanden. So wird die aus der Ediacara-Fauna bekannte Kimberella als ein möglicher Stammgruppenvertreter der Weichtiere betrachtet.[12] Über den gemeinsamen Grundbauplan der heute lebenden Molluskengruppen (Mollusken-Kronengruppe) herrscht noch Unklarheit. Einige vermuten als jüngsten gemeinsamen Vorfahren der Kronengruppe eine kleine, kaum einen halben Zentimeter lange, wurmartige Spezies mit gestrecktem Darmtrakt (After am hinteren Körperende) und einer relativ strengen Bilateralsymmetrie, die keine geschlossene Schale hatte, sondern eine Episphäre und einen Fuß mit bewimperter Gleitsohle wie einige heutige Wurmmolusken.[13] Andere gehen, gestützt auf den Fossilbericht und Beobachtungen an rezenten Arten, davon aus, dass Wurmollusken nicht die primitivsten Formen, sondern aus käferschneckenartigen Vorfahren hervorgegangen sind. Dies stellt die Rekonstruktion der Stammart der heutigen Weichtiere als wurmmoluskenähnlicher Organismus in Frage.[12]
Systematik
Die Evolution der Weichtier-Klassen und ihre stammesgeschichtliche Beziehung zueinander ist noch nicht vollständig aufgeklärt.[14]
Äußere Systematik
Zusammen mit anderen Tierstämmen werden die Weichtiere heute in die Großgruppe der Lophotrochozoen gestellt. Innerhalb dieser Gruppe gelten derzeit die Kelchwürmer (Entoprocta, auch Kamptozoa genannt) als am nächsten verwandt. Die früher oft geäußerte Vermutung einer unmittelbaren Verwandtschaft der Weichtiere zu den Ringelwürmern (Annelida) wird kaum noch diskutiert.
Als zentrales und systematisch bedeutsames Charakteristikum des Stammes der Weichtiere im Sinne einer Autapomorphie (gemeinsames abgeleitetes Merkmal) gilt die Radula (Raspelzunge). Die anderen zentralen morphologischen Merkmale im ursprünglichen Bauplan der Weichtiere sind die Dreigliederung des Körpers in Kopf, Fuß und Eingeweidesack, die Ausbildung eines Mantels mit einer Mantelrinne, die Reduktion des Coeloms auf das Perikardialsystem sowie die Ausbildung eines (ursprünglich stets) offenen Blutgefäßsystems mit einem Ventrikel und ein bis mehreren Arterien. Daneben ist insbesondere die Schale ein bedeutsames Merkmal fast aller Mollusken, wobei aber die primär einteilige Schale mit dem typischen dreischichtigen Aufbau nur bei den Schalenweichtieren (Conchifera) auftritt.

Innere Systematik
Zum Stamm der Weichtiere werden acht lebende und mehrere ausgestorbene Klassen gezählt. Die folgenden drei Klassen haben keine typische Molluskenschale. Sie werden als Stachelweichtiere (Aculifera) bezeichnet. Molekularbiologische Untersuchungen legen nahe, dass diese Gruppe tatsächlich aus gemeinsamen Vorfahren hervorging.[14]
- Schildfüßer (Caudofoveata), ca. 70 Arten, Meer (Tiefsee)
- Furchenfüßer (Solenogastres), ca. 250 Arten, Meer (Tiefsee)
- Käferschnecken (Polyplacophora), ca. 600 Arten, Meer (Felsküstenbereich)
Die folgenden fünf Klassen werden auch als Schalenweichtiere (Conchifera) zusammengefasst und bilden wohl eine monophyletische Einheit. Sie zeichnen sich durch die charakteristische Molluskenschale aus.
- Einschaler (Monoplacophora, selten auch Tryblidia), ca. 27 Arten, Meer (Tiefsee)
- Schnecken (Gastropoda), angegebene Artenzahlen schwanken stark je nach Autor (50.000–150.000[15]), Meer + Süßwasser + Land
- Kahnfüßer (Scaphopoda), ca. 350 Arten, Meer
- Muscheln (Bivalvia), ca. 8000 Arten, Meer + Süßwasser
- Kopffüßer (Cephalopoda), ca. 786 Arten, Meer
Hierzu kommen einige ausgestorbene Klassen, wobei ihre Zuordnung zu den Weichtieren teilweise umstritten ist; häufig werden in diesem Zusammenhang genannt:
- † Schnabelschaler (Rostroconchia)
- † Helcionelliden (Helcionellida)
- † Tentakuliten (Tentaculitoidea oder Cricoconarida)
- † Hyolithiden (Hyolitha)
Die phylogenetischen Beziehungen der obigen Gruppen sind derzeit weiterhin im Fluss. Insgesamt werden derzeit rund ein halbes Dutzend verschiedene Stammbäume (Kladogramme) allein für die noch lebenden Klassen diskutiert, die jeweils durch verschiedene Befunde unterstützt werden. Im Folgenden wird ein Kladogramm vorgestellt, das sich auf eine im Jahr 2020 in der Zeitschrift Scientific Reports veröffentlichte Studien stützt.[16]
| Weichtiere (Mollusca) |
| ||||||||||||||||||||||||||||||||||||||||||
Literatur
- D. T. Anderson: Invertebrate Zoology. Oxford Univ. Press, Oxford 2001, ISBN 0-19-551368-1, S. 120.
- Richard Stephen Kent Barnes: The invertebrates – a synthesis. 3. Auflage. Blackwell, Malden MA 2001, ISBN 0-632-04761-5, S. 119.
- Richard C. Brusca, G. J. Brusca: Invertebrates. 3. Auflage. Sinauer Associates, Sunderland MA 2003, 2002, ISBN 0-87893-097-3, S. 701.
- Rosina Fechter, G. Falkner: Weichtiere. Europäische Meeres- und Binnenmollusken. (= Steinbachs Naturführer. Band 10). Mosaik-Verlag, München 1990, ISBN 3-570-03414-3.
- Janet Moore: An Introduction to the Invertebrates. Cambridge Univ. Press, Cambridge 2001, ISBN 0-521-77076-9, S. 131.
- Edward E. Ruppert, R. S. Fox, R. P. Barnes: Invertebrate Zoology – A functional evolutionary approach. Brooks/Cole, Southbank Vic 2004, ISBN 0-03-025982-7, S. 283.
- John David Taylor: Origin and Evolutionary Radiation of the Mollusca. Oxford Univ. Press, Oxford 1996, ISBN 0-19-854980-6.
- Geerat J. Vermeij: A Natural History of Shells. Princeton Univ. Press, Princeton 1993, ISBN 0-691-08596-X.
- K. G. Wingstrand: On the anatomy and relationships of Recent Monoplacophora. In: Galathea Report. Leiden/ Kopenhagen 16.1985, S. 7–94. ISSN 0416-704X
Weblinks
- Weichtiere (sehr viele Informationen und Abbildungen)
- Übersichtsseite zu Weichtieren (englisch)
- CLECOM-Gesamtliste mit Änderungen
- www.schnecken-der-welt.de Fotosammlung von Mollusken aus der ganzen Welt
- www.mollbase.de Systematische Übersicht der Land- und Süßwassermollusken Nord- und Mitteleuropas
Einzelnachweise
- Absatz nach Elizabeth B. Andrews: Excretory Systems of Molluscs. In: E. R. Trueman, M. R. Clarke (Hrsg.): The Mollusca. Volume 11: Form and Function. Academic Press, Orlando 1988, S. 381 ff.
- P. B. Van Weel: The comparative physiology of digestion in molluscs. In: American Zoologist. 1961, S. 245–252.
- L. von Salvini-Plawen: The structure and function of molluscan digestive systems. In: The Mollusca. Band 11, 1988, S. 301–379.
- S. Hunt, M. Nixon: A comparative study of protein composition in the chitin-protein complexes of the beak, pen, sucker disc, radula and oesophageal cuticle of cephalopods. In: Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. Band 68, Nr. 4, 1981, S. 535–546.
- Eintrag zu Cellulose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. August 2013.
- Fay L. Myers, D. H. Northcote: Partial Purification and some Properties of a Cellulase from Helix pomatia. (PDF; 1,3 MB). Department of Biochemistry, University of Cambridge, 23. Juli 1958.
- EC 3.2.1.4 - cellulase. bei BRENDA, abgerufen am 9. August 2013.
- Nathan Lo, Hirofumi Watanabe, Masahiro Sugimura: Evidence for the presence of a cellulase gene in the last common ancestor of bilaterian animals. In: Proceedings of the Royal Society of London. Series B: Biological Sciences. 270. Suppl 1, 2003, S. S69–S72.
- Katharina Gries: Untersuchungen der Bildungsprozesse und der Struktur des Perlmutts von Abalonen. Dissertation, Universität Bremen, 2011 (PDF 25,4 MB).
- Tara D. Sutherland: Insect silk: one name, many materials. In: Annual review of entomology. Band 55, 3. September 2009, S. 171–188, doi:10.1146/annurev-ento-112408-085401 (englisch).
- C. Albrecht, M Glaubrecht: Brood care among basommatophorans: a unique reproductive strategy in the freshwater limpet snail 'Protancylus' (Heterbranchia: Protancylidae), endemic to ancient lakes on Sulawesi, Indonesia. In: Acta Zool. 87, 2006, S. 49–58.
- Jakob Vinther: The origins of molluscs. Palaeontology. Band 58, Nr. 1, 2015, S. 19–34, doi:10.1111/pala.12140 (Open Access).
- Gerhard Haszprunar, Klaus-Jürgen Götting: Mollusca, Weichtiere. In: Wilfried Westheide, Gunde Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. 2. Auflage. Spektrum Akademischer Verlag (Elsevier), München 2007, ISBN 978-3-8274-1575-2, S. 306 (Abb. 405), 313.
- Stephen A. Smith, Nerida G. Wilson, Freya E. Goetz, Caitlin Feehery, Sónia C. S. Andrade, Greg W. Rouse, Gonzalo Giribet, Casey W. Dunn: Resolving the evolutionary relationships of molluscs with phylogenomic tools. In: Nature. 480, S. 364–367, 15. Dezember 2011, doi:10.1038/nature10526.
- Winston F. Ponder, David R. Lindberg: Phylogeny and Evolution of the Mollusca. University of California Press, Berkeley 2008.
- Kevin M. Kocot, Albert J. Poustka, Isabella Stöger, Kenneth M. Halanych & Michael Schrödl: New data from Monoplacophora and a carefully-curated dataset resolve molluscan relationships. in Scientific Reports 10(1) · 2020 doi:10.1038/s41598-019-56728-w.