Dreifinger-Faultiere
Die Dreifinger-Faultiere (Bradypus) sind die einzige Gattung innerhalb der Familie der Bradypodidae und stellen eine der zwei heute noch bestehenden Linien der Faultiere (Folivora) dar. Der Name Dreizehen-Faultiere, der diesen Tieren manchmal gegeben wird, ist insofern missverständlich, als auch die Zweifinger-Faultiere (Choloepus), die zweite, rezente Linie, an den Hinterfüßen ebenfalls drei Zehen besitzen. Die Dreifinger-Faultiere leben in den subtropischen bis tropischen Gebieten Mittel- und Südamerikas und bewohnen dort vor allem Regenwälder. Dort führen sie einzelgängerisch ein Leben in den Kronen der Bäume, woran sie durch einzelne Körpermerkmale angepasst sind. Sie ernähren sich vorwiegend von Blättern, einer sehr energiearmen Pflanzenkost. Bekannt sind die Tiere vor allem für ihre niedrige Stoffwechselrate und die damit verbundene energiesparende Lebensweise. Aus systematischer Sicht stehen die Dreifinger-Faultiere allen anderen Faultiergruppen, sowohl heute lebend als auch ausgestorben, gegenüber, über ihre Stammesgeschichte ist aber mangels Fossilfunden nichts bekannt. Es existieren heute vier Arten: das Zwergfaultier, das Kragenfaultier und das Weiß- und Braunkehl-Faultier, wobei die ersteren beiden in ihrem Bestand bedroht sind.
| Dreifinger-Faultiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Braunkehl-Faultier (Bradypus variegatus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Bradypodidae | ||||||||||||
| J. E. Gray, 1821 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Bradypus | ||||||||||||
| Linnaeus, 1758 |
Beschreibung
Habitus

Der Körperbau der Dreifinger-Faultiere ist an eine kopfunter in den Bäumen hängende Lebensweise angepasst. Sie erreichen eine Kopf-Rumpf-Länge von 40 bis 80 cm und ein Gewicht von 3 bis 10 kg, sind also etwa gleich groß wie ihre zweifingrigen Verwandten (Choloepus). Der Kopf der Dreifinger-Faultiere ist klein und rund, die Nase erhebt sich leicht aus dem Gesicht. Die Augen sind klein und nach vorn gerichtet, die ebenfalls kleinen Ohren bleiben im Fell verborgen. Die Gliedmaßen besitzen einen langen und kräftigen Bau, wobei die vorderen Extremitäten die hinteren um das etwa anderthalbfache an Länge übertreffen, was eine spezielle Anpassung an die Lebensweise in den Bäumen darstellt.[1] Sie enden in Händen und Füßen mit jeweils drei Strahlen, die etwa gleich lang sind und scharfe, hakenförmige Krallen tragen. Rudimentär verkürzt liegen allerdings an den entsprechenden Innen- und Außenseiten noch die jeweils ersten und fünften Strahlen an. Im Gegensatz zu den schwanzlosen Zweifinger-Faultieren haben die Tiere einen kurzen, zwei bis elf Zentimeter langen Schwanz. Das Fell des Körpers ist meist graubraun bis grau gefärbt, einige Arten besitzen jedoch eine teils ausgeprägte Gesichts- und Rückenfärbung, letztere vor allem bei männlichen Tieren in Form von gelben oder orangefarbenen Flecken.[2][3][4][5][6]
Schädel- und Gebissmerkmale
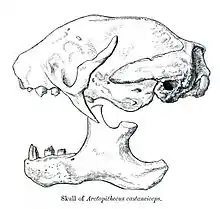
Der Schädel der Dreifinger-Faultiere ist mit durchschnittlich 6,9 cm Länge eher kurz, kürzer noch als bei den Zweifinger-Faultieren. Mit hervorgerufen wird dies unter anderem durch in seiner Länge stark reduzierte Stirnbein, das nur rund 50 % der Ausdehnung von jenem der Zweifinger-Faultiere erreicht. Typisch für Faultiere allgemein ist der Oberkiefer zwar verlängert, der Mittelkieferknochen dagegen deutlich verkürzt. Dieser steht zudem nicht mit dem Nasenbein in Kontakt. Der extrem gekürzte Schädel stellt ein abgeleitetes Merkmal der Dreifinger-Faultiere dar und kommt so bei keiner anderen bekannten Faultierform vor. Weiterhin ist der Jochbogen nicht vollständig ausgebildet. Am Jochbein setzt dafür neben dem Ansatz des Jochbogens ein weiterer, schräg nach hinten und unten weisender Knochenauswuchs an. Bei den Dreifinger-Faultieren reicht der Jochbogenansatz weiter nach oben und übertrifft sowohl in relativen als auch absoluten Längenmaßen den der Zweifinger-Faultiere. Weitere Unterschiede finden sich in der Ohrregion, wo bei den Dreifinger-Faultieren eine Paukenblase ausgebildet ist, im Gegensatz zu ihren rezenten Verwandten mit einem tympanischen Ring.[7]
Der Unterkiefer besitzt eine massive, gut verknöcherte Symphyse, die nicht spatelartig nach vorn gezogen ist wie bei den Zweifinger-Faultieren. Im Vergleich zu diesen reichen die aufsteigenden Gelenkäste deutlich weiter nach oben und liegen markant über der Kauebene. Das Gebiss ist wie bei allen Faultieren stark reduziert und von dem der meisten anderen Höheren Säugetiere abweichend strukturiert. Grundsätzlich fehlen den Dreifinger-Faultieren die Schneide- und Eckzähne, insgesamt haben sie 18 Zähne, fünf auf jeder Oberkiefer- und vier auf jeder Unterkieferseite. Dabei sind die jeweils vordersten Zähne deutlich kleiner und meißel- oder pflockartig geformt sowie vorn und hinten abgeplattet, ebenfalls ein von den anderen Faultieren abweichendes Charakteristikum. Die hinteren Zähne schließen direkt an und sind nicht wie bei den Zweifinger-Faultieren durch ein Diastema vom vordersten getrennt. Insgesamt ähneln sie zwar den Backenzähnen, können aber den Molaren und Prämolaren der anderen Säugetiere nicht genau zugeordnet werden. Sie weisen eine rundliche oder rechteckige Form auf und wachsen das ganze Leben hindurch. Ein besonderes Merkmal ist das Fehlen des Zahnschmelzes. Im geschlossenen Maul stehen sich die Backenzähne direkt gegenüber, abweichend von der alternierenden Stellung bei den Zweifinger-Faultieren[7][8]
Skelettmerkmale

Einige Besonderheiten liegen im Bereich der Wirbelsäule. Ausgehend vom vordersten, rippentragenden Brustwirbel besitzen Dreifinger-Faultiere 8 bis 10 zwischen diesem und dem Kopf liegende Wirbel, die ursprünglich alle als Halswirbel gedeutet wurden. Einige Forscher sehen in den hintersten eins bis drei zusätzlichen Halswirbeln lediglich Brustwirbel, die sich vor den Schultergürtel verlagert haben und keine Gelenkansätze für die Rippen aufweisen, was unter anderem auch an Verknöcherungsstadien der Wirbel bei Embryonen erkannt wurde. Diese Anpassung ermöglicht den Tieren eine größere Beweglichkeit des Kopfes, um bis zu 270° vertikal und 330° horizontal,[3] um mehr Nahrungsquellen zu erreichen.[9] Ebenfalls ausgehend vom ersten rippentragenden Brustwirbel besitzen Zweifinger-Faultiere nur 5 bis 7 Halswirbel, womit deren Hals deutlich kürzer ist.[10] Weiterhin sind bei den Dreifinger-Faultieren insgesamt 14 Rippenpaare ausgebildet und damit deutlich weniger als bei ihren rezenten Verwandten (23 bis 24). Durch die Vorverlagerung der rippenlosen Brustwirbel als Teil der Halswirbelsäule kam es gleichzeitig zur Rückverlagerung des Schultergürtels und damit auch der Vordergliedmaßen. Dadurch änderte sich auch teilweise der Muskelaufbau, da unter anderem der Musculus levator scapulae und der Musculus rhomboideus minor, die normalerweise eine wichtige Rolle zur Stabilisierung des Schulterblattes bei der Fortbewegung haben, nicht mehr mit dem Hinterhaupt verbunden sind. Vor allem im Bereich der Vordergliedmaßen kam es auch zu einigen Veränderungen sowohl im skelett- wie im muskelanatomischen Bereich, die eine besondere Anpassung an die kopfüberhängende und baumbewohnende Lebensweise darstellen, wobei im Gegensatz zu bodenlebenden Säugetieren der Antrieb zur Fortbewegung von den Vorderbeinen ausgeht.[11]
Fell

Der Körper ist von einem dichten Fell bedeckt, das sich aus zwei Lagen zusammensetzt: Zuunterst befindet sich ein weiches Unterfell aus farblosen und lichtdurchlässigen Haaren mit einem Durchmesser von bis zu 0,05 mm, darüber ein zottiges, dickes (etwa 0,4 mm im Durchmesser) Deckhaar, das den Tieren ihre Färbung gibt. Mit Ausnahme des Kragenfaultiers (Bradypus torquatus) weisen männliche Tiere am Rücken ein sogenanntes speculum auf, einen Fleck, an dem kein Deckhaar ausgebildet ist und das Unterfell durchscheint. Ein besonderes Kennzeichen der Haare der Faultiere stellt das Fehlen des Markkanals (Medulla) dar. Die Haare sind im Gegensatz zu den meisten anderen Säugetierarten vom Bauch weg gescheitelt, um ein besseres Abfließen des Regenwassers zu ermöglichen. Das Deckhaar besitzt teils querverlaufende Brüche, in denen sich vor allem in der Regenzeit Wasser ansammelt und Lebensraum für Algen bietet. Zu den häufigsten Algenformen gehören Rotalgen der Gattung Rufusia und Grünalgen wie Dictyococcus und Chlorococcum. Aufgrund der Algen besitzt das Fell unter bestimmten Lichtverhältnissen oft einen grünlichen Farbton, ein Effekt, der besonders stark in der Regenzeit zum Vorschein kommt. Dies dient den Tieren teilweise als Tarnung.[12][1]
Lautäußerungen und Sinnesleistungen
Generell geben Dreifinger-Faultiere nur wenige Laute von sich. Daher sind nur wenige Lautäußerungen bekannt, die meist Pfiffe beinhalten. Am bekanntesten ist das durchdringende ai oder ai-ai des Weißkehl-Faultiers, welches meist bei extremer Gefahr ausgestoßen wird und dem dieses seinen weiteren Trivialnamen (Ai) verdankt. Das Ohr der Dreifinger-Faultiere ist auf einen eher niedrigen Frequenzbereich zwischen 0,3 und 30 kHz ausgelegt, was vor allem mit dem Aufbau der Hörschnecke zu begründen ist. Erwachsene Tiere werden überwiegend durch Laute von 2 bis 8 kHz aktiviert, was sich auch die Jungtiere zunutze machen, wenn sie von der Mutter getrennt werden. Da den Dreifinger-Faultieren der Musculus ciliaris fehlt, ist der Sehsinn unterentwickelt, und die Tiere sind kurzsichtig. Weiterhin ist die Hornhaut stark konvex gekrümmt und die Augenlinse sehr dick, wodurch nur eine geringe Auflösung des Sichtfeldes erfolgt. Allerdings ist die Sehfähigkeit der Jungtiere besser als die der ausgewachsenen.[13][6]
Verbreitung
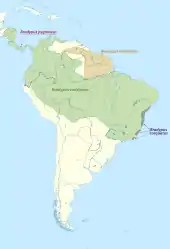
Die Dreifinger-Faultiere leben in den subtropisch bis tropisch geprägten Bereichen des amerikanischen Kontinents, ihr Verbreitungsgebiet erstreckt sich von Mittelamerika, wobei die Nordgrenze in Honduras liegt, bis nach Südamerika im zentralen Brasilien. Sie bewohnen ausschließlich tropische Regenwälder, Bergnebelwälder und die tropischen Küstenregenwälder (Mata Atlântica), dadurch fehlen die Tiere im Bereich der Hochlagen der Anden und in den offeneren Llanos-Regionen entlang des Orinocos. Da sie keine kalten Temperaturen vertragen, sind sie ebenfalls in bewaldeten Regionen im Süden des Kontinents nicht anzutreffen. Teilweise überschneidet sich das Verbreitungsgebiet mit dem der Zweifinger-Faultiere, vor allem in Mittelamerika und im nördlichen und westlichen Südamerika. Die Vertreter dieser Faultiergruppe sind aber aufgrund des fehlenden Unterfells stärker für Kälte empfindlich und besitzen eine höhere Thermoneutralität (24 °C) als die Dreifinger-Faultiere (18 °C).[14][12][6]
Lebensweise
Sozialverhalten und Aktivitäten
Die Dreifinger-Faultiere leben in den Kronen von Bäumen (arboreal), ihre Lebensweise ist geprägt durch einen kopfunter hängenden Lebensstil und eine nährstoffarme Ernährung, die zu einer äußerst energiesparenden Lebensweise führt. Sie fressen und schlafen in den Bäumen, auch die Paarung und die Geburt findet dort statt. Die Bewegungen erfolgen äußerst langsam sowohl vertikal als auch horizontal in den Bäumen, Schätzungen über die Höchstgeschwindigkeit belaufen sich auf maximal 4 bis 5 m pro Minute (0,25 bis 0,35 km pro Stunde).[15] Im Verlauf eines Tages werden jedoch insgesamt nur höchstens 133 m, meist jedoch weniger als 36 m zur Futtersuche zurückgelegt.[16] Die Tiere kommen nur auf den Boden, um zu urinieren und defäkieren, was aufgrund der niedrigen Stoffwechselrate durchschnittlich alle 8 Tage nötig ist.[17] Ein Baumwechsel zur Futtersuche erfolgt häufig über das Geäst, seltener über den Boden, und findet im Durchschnitt alle drei Tage statt. Am Boden bewegen sich die Dreifinger-Faultiere unbeholfen, sie krabbeln mit den Unterarmen und Sohlen der Hinterbeine vorwärts. Allerdings können sie gut schwimmen.[12][1][6]
Die Tiere sind Einzelgänger, die außer zur Paarung keinen Kontakt mit Artgenossen suchen. Sie bewohnen ein Gebiet von durchschnittlich 2 bis 5 ha Größe, in ihrer natürlichen Umgebung beträgt die Populationsdichte abhängig von der Region bei 0,09 bis 8 Individuen pro Hektar. Im Gegensatz zu den Zweifinger-Faultieren, die hauptsächlich nachtaktiv sind, haben diese Tiere keine festen Aktivitätszeiten, die wenigen Stunden, die sie nicht schlafend oder ruhend verbringen, können sowohl am Tag als auch in der Nacht liegen.[12][16][6]
Ernährung und Stoffwechsel

Die Nahrung der Dreifinger-Faultiere besteht mit über 94 % fast ausschließlich aus Blättern (folivor), gelegentlich ergänzt durch Früchte und Blüten, die meist von Bäumen und untergeordnet von Lianen gezupft werden. Dabei gehören überwiegend junge Blätter zum Speiseplan, seltener ältere. Häufig bevorzugen die Tiere die Blätter von Ameisenbäumen (Cecropia), weiterhin aber unter anderem auch von Feigen (Ficus) und von Clitoria. Allgemein vertilgen Dreifinger-Faultiere insgesamt Blätter von zahlreichen Nahrungspflanzen, einzelne Individuen spezialisieren sich jedoch auf einige wenige Pflanzenarten, meist 5 bis 8, die zwischen 50 und 80 % der Nahrung ausmachen. Dabei erlernen die Jungtiere diese Spezialisierung vom Muttertier.[12][16] Bei der Nahrungsaufnahme sind die lange Zunge und die Lippen behilflich, ebenso die Hände, welche die Nahrung in die richtige Position schieben. Der Bau des Unterkiefers mit den hohen Seitenästen und die Anordnung der Kaumuskulatur bewirken, dass die Dreifinger-Faultiere ihre Nahrung überwiegend mit vertikalen und vor- und rückwärts gerichteten Kaubewegungen zerkleinern.[7][6]
Die Stoffwechselrate der Dreifinger-Faultiere liegt 40 bis 45 % niedriger als die von Säugetieren vergleichbarer Größe, auch benötigen sie sehr lange, um die Nahrung zu verdauen. Einem vergrößerten Verdauungstrakt, der Magen erreicht im gefüllten Zustand etwa ein Drittel des Körpergewichtes, steht eine geringe Muskelmasse gegenüber. Der niedrige Stoffwechsel führt auch dazu, dass die Muskelkontraktion etwa 3- bis 4-mal langsamer abläuft als bei einer vergleichbar großen Hauskatze. Die Körpertemperatur der Dreifinger-Faultiere ist niedriger und variabler als die der meisten anderen Säugetiere. Sie liegt bei rund 34 °C und kann im Schlaf, während kühlerer Tageszeiten und bei feuchtem Wetter stark absinken, was ebenfalls Energie spart. Zum Ausgleich aalen sich diese Tiere, ähnlich vielen Reptilien, häufig in der Sonne. Zu ihrer energiesparenden Lebensweise gehören auch die langen Ruhezeiten, die bis zu 20 Stunden pro Tag andauern, etwas mehr als die der Zweifinger-Faultiere. Allerdings sind die Länge der Schlaf- und Ruhephasen über das Jahr verteilt unterschiedlich und abhängig von den Jahreszeiten, was aber bei den einzelnen Arten abweichend ausfällt: So verbringen Dreifinger-Faultiere während aktiverer Zeiten nur rund 60 % des Tages mit Schlafen und Ruhen, während es in weniger aktiven 80 bis 90 % sind.[18][19] An einigen wildlebenden Populationen der Dreifinger-Faultieren wurde mittels EEG-Messungen eine durchschnittliche Schlafzeit von rund 9,6 Stunden pro Tag festgestellt,[20] insgesamt umfasst die aktive Zeit nur etwa 10 % dessen, was ein gleich großes anderes Säugetier in einem vergleichbaren Zeitraum aufbringt.[13][6]
Eine weitere Folge der niedrigen Stoffwechselrate ist, dass der Stuhlgang nur alle ein bis zwei Wochen nötig ist. Zu diesem Zweck verlassen die Tiere die Bäume und klettern auf den Boden. Sie graben mit ihrem kurzen Schwanz ein Loch und entleeren ihren Darm. Dieser Vorgang ist sehr gefährlich für die Dreifinger-Faultiere, da rund die Hälfte aller erwachsenen Tiere dabei von Fressfeinden erbeutet wird. Warum die Tiere den mühsamen Weg auf den Boden unternehmen, statt ihren Stuhlgang in üblicher hängender Weise zu verrichten, war lange Zeit unklar. Ursprünglich wurde teilweise angenommen, dass sich das Verhalten evolutionär dadurch ausbildete, dass die auf diese Weise erfolgende Düngung der Bäume die Anzahl der notwendigen Reisen zu anderen Bäumen sinken ließ.[21] Neuere Untersuchungen ergaben ein anderes Bild. Das Fell der Dreifinger-Faultiere dient mehreren Insektenarten als Lebensraum, darunter Käfer und Schmetterlinge. Eine besondere Beziehung besteht dabei zu den Motten, insbesondere aus den Gattungen Cryptoses und Bradipodicola, die auch „Faultiermotten“ genannt werden und von denen bis zu 120 Individuen auf einem Dreifinger-Faultier vorkommen können. Wenn ein Dreifinger-Faultier auf den Boden klettert, um zu defäkieren, verlässt die Motte das Fell ihres Wirts und legt ihre Eier in die Exkremente. Die Larven ernähren sich davon und suchen sich nach der Metamorphose einen neuen Faultierwirt.[12] Dabei besteht ein symbiotisches Verhältnis zwischen dem Dreifinger-Faultier und den Motten, da letztere unter anderem Stickstoff- und Phosphorverbindungen in das Fell abgeben, durch die wiederum das Wachstum der im Fell lebenden Algen gefördert wird. Während der Fellpflege fressen die Dreifinger-Faultiere die Algen und erhalten dadurch wichtige Ergänzungsstoffe, die sie durch ihre sehr energiearme Blätterkost sonst nicht erhalten. Die höhere Konzentration von Algen im Fell verstärkt weiterhin teilweise den Tarneffekt der Dreifinger-Faultiere im Geäst.[17][6]
Fortpflanzung
Im Gegensatz zu den Zweifinger-Faultieren erfolgt die Fortpflanzung der Dreifinger-Faultiere eher jahreszeitlich gebunden, was möglicherweise mit der unterschiedlichen Ernährungsweise der beiden Faultier-Vertreter zusammenhängt. Insgesamt ist das Fortpflanzungsverhalten der Dreifinger-Faultiere bisher nur unzureichend erforscht. Die Tiere sind mit rund drei Jahren geschlechtsreif. Die Paarung erfolgt in der typischen hängenden Lebensweise. Danach zieht sich das Männchen wieder zurück und überlässt die Aufzucht des Nachwuchses allein den Weibchen. Nach einer Tragzeit von rund sechs Monaten kommt ein einzelnes, 190 bis 300 g schweres und 14 bis 20 cm großes Jungtier zur Welt. Meist fallen die Geburten in den Ausgang der Regen- und den Beginn der Trockenzeit, womit eine Aufzucht des Jungtiers während einer eher stressarmen Zeit gewährleistet ist.[22] Faultiere errichten keine Nester für ihre Jungen, sondern tragen sie in den ersten Lebenswochen auf dem Bauch mit sich. Die erste feste Nahrung nimmt das Jungtier mit etwa ein bis zwei Wochen zu sich. Nach rund vier bis acht Wochen wird es entwöhnt, bleibt aber noch einige Zeit bei seiner Mutter. Der Abstand zwischen zwei Geburten beträgt etwa ein Jahr. Die Lebenserwartung dieser Tiere ist nicht bekannt. Das älteste aufgefundene Dreifinger-Faultier war zwölf Jahre alt, aber immer noch fortpflanzungsfähig. Experten gehen aber davon aus, dass diese etwa der der Zweifinger-Faultiere entspricht, von denen einige Individuen bis zu 30 Jahre alt werden.[23][24][6]
Fressfeinde und Überlebensstrategien
Zu den Fressfeinden der Dreifinger-Faultiere zählen vor allem größere und kleinere Katzen wie der Jaguar, die Langschwanzkatze und der Ozelot, aber auch Greifvögel wie die Harpyie und Riesenschlangen wie die Anakondas. Überwiegend werden die Tiere durch ihre Tarnfarbe und ihre nur geringen und langsamen Bewegungen geschützt.[13]
Systematik
Innere Systematik der Faultiere nach Presslee et al. 2019 (basierend auf Proteinanalysen)[25]
Die Unterteilung der Megalocnoidea erfolgt nach Delsuc et al. 2019[26] |
Innere Systematik der Faultiere nach Varela et al. 2019 (basierend auf skelettanatomischen Merkmalen)[27]
|
Die Dreifinger-Faultiere (Bradypus) bilden eine Gattung aus der monotypischen Familie der Bradypodidae innerhalb der Unterordnung der Faultiere (Folivora). Die Faultiere formen gemeinsam mit den Ameisenbären (Vermilingua) die engere Verwandtschaftsgruppe der Zahnarmen (Pilosa), eine Ordnung innerhalb der Überordnung der Nebengelenktiere (Xenarthra), welche wiederum eine der vier Hauptlinien der Höheren Säugetiere darstellen. Mit Hilfe molekulargenetischer Untersuchungen konnte eine Abspaltung der Faultiere von der gemeinsamen Linie mit den Ameisenbären im ausgehenden Paläozän vor etwa 58 Millionen Jahren ermittelt werden.[28][29]
Die Stellung der Bradypodidae innerhalb der Faultiere wird unterschiedlich bewertet. In einer klassischen Sichtweise, die auf Merkmalen der Skelettanatomie beruht, bilden die Dreifinger-Faultiere das Schwestertaxon zu allen anderen Faultiergruppen, sowohl rezent als auch fossil. Als Gründe hierfür wurden vor allem die Struktur des Mittelohrs mit einer verknöcherten Paukenblase herangezogen, die bei anderen Faultieren nicht auftritt. Auch in der weiteren Schädelmorphologie und im Gebissaufbau ließen sich Unterschiede ermitteln.[30][31][27] Dem widersprechen jedoch molekulargenetische und proteinbasierte Analysen aus dem Jahr 2019, die die Dreifinger-Faultiere mit den Megatheriidae, den Nothrotheriidae und den Megalonychidae – alle drei Gruppen schließen ausgestorbene, teils riesige Bodenfaiultiere ein – in die Überfamilie der Megatherioidea verweisen.[26][25]
Die nächstverwandte rezente Gruppe innerhalb der Faultiere stellen die Zweifinger-Faultiere (Choloepus) aus der Familie der Choloepodidae dar. Früher hielt man die Drei- und Zweifinger-Faultiere für eng miteinander verwandt, man ordnete sie sogar zusammen in die Familie Bradypodidae und stellte sie den ausgestorbenen bodenbewohnenden Faultieren gegenüber.[7] Jedoch beruhen die äußerlichen Ähnlichkeiten zum Teil auf konvergenter Evolution, die baumbewohnenden Faultiere sind eine paraphyletische Gruppe, da die Zweifinger-Faultiere nach den genetischen Untersuchungen aus dem Jahr 2019 näher mit den Mylodontidae verwandt sind als mit den Dreifinger-Faultieren. Die Zweifinger-Faultiere werden daher in die Überfamilie der Mylodontoidea eingeordnet.[26][25] Die beiden heutigen Gattungen der Faultiere hatten sich gemäß der molekulargenetischen Daten bereits im Oligozän vor rund 30 Millionen Jahren getrennt.[28][29]
Es werden vier Arten in zwei Untergattungen unterschieden:[32][1]
Innere Systematik der Gattung Bradypus nach Gibb u. a. 2015[29]
|
- Untergattung Bradypus Linnaeus, 1758
- Zwergfaultier (Bradypus pygmaeus Anderson & Handley, 2001)
- Weißkehl-Faultier oder Ai (Bradypus tridactylus Linnaeus, 1758)
- Braunkehl-Faultier (Bradypus variegatus Schinz, 1825)
- Untergattung Scaeopus Peters, 1864
- Kragenfaultier (Bradypus torquatus Illiger, 1811)
Die Gattung Bradypus spaltete sich, gestützt durch molekulargenetische Daten, vergleichsweise früh auf. Zuerst trennte sich das Kragenfaultier im Unteren Miozän vor rund 19 Millionen Jahren von der gemeinsamen Linie mit den anderen Dreifinger-Faultieren ab; die drei übrigen Arten bildeten im Verlauf des Miozäns und im Übergang zum Pliozän vor 12 bis 5,7 Millionen Jahren eigene Linien aus. Die Abfolge ist aber nicht ganz eindeutig, da je nach Analyse das Zwergfaultier entweder sehr früh oder eher später abzweigte.[33][29][34] Die Art selbst differenzierte sich möglicherweise erst vor rund 10.000 Jahren auf der Insel Escudo de Veraguas vor der Nordküste Panamas durch Inselverzwergung heraus.[30] Fossilfunde der Dreifinger-Faultiere liegen nicht vor.[1]
Die Untergattung Scaeopus unterscheidet sich von Bradypus durch die gleichförmige Fellfärbung, mit Ausnahme einer dunkleren Mähne, die auch nur für diese Untergattung typisch ist, und das Fehlen des speculums (Farbfleck) am Rücken der männlichen Tiere.[1] Die deutlichen Abweichungen gepaart mit der frühen Abspaltung des Kragenfaultiers von den anderen Dreifinger-Faultieren würde nach neueren Studien aus dem Jahr 2019 eine eigenständige Gattung Scaeopus befürworten. Nach weiteren genetischen Untersuchungen könnte es sich bei der Andenpopulation des Braunkehl-Faultiers um eine eigenständige Art handeln.[34][35]
Benannt wurde die Gattung Bradypus im Jahr 1758 von Linnaeus, der in diese neben Bradypus tridactylus auch noch Bradypus didactylus einordnete, wobei er die Arten anhand der Anzahl der Fingerstrahlen der Vorderfüße unterschied.[36] Letztere Art wird heute aber zu den Zweifinger-Faultieren gezählt. Als Typuslokalität für Bradypus tridactylus gab Linnaeus Americae meridionalis arboribus an, erst 1911 wurde von Oldfield Thomas Suriname als eigentliche Typuslokalität festgelegt.[37] In den früheren Ausgaben von Linnés Systema Naturae hatte dieser die Faultiere noch zu den Primaten gezählt,[38] seine Angaben bezog er zum Großteil aus Albert Sebas Thesaurus von 1734.[39] Der Gattungsname Bradypus stammt aus der griechischen Sprache und leitet sich von βραδύς (bradys „langsam“) und πούς (poús „Fuß“) her, er bezieht sich somit auf die langsamen Bewegungen der Tiere.[1] Die heutige Bezeichnung der Familie der Bradypodidae geht auf John Edward Gray zurück, der diese 1821 erstmals (als „Bradypidae“) verwendete und darin sowohl die Drei- als auch die Zweifinger-Faultiere vereinte.[40]
Dreifingerfaultiere und Menschen
Historisches
Faultiere genossen seit ihrer Entdeckung durch die Europäer einen denkbar schlechten Ruf, der sich auch in ihrem Namen widerspiegelt. Sie galten als träge, verachtenswerte Geschöpfe. Es gibt auch indianische Legenden, in denen die vermeintliche Antriebslosigkeit dieser Tiere zum Ausdruck kommt. Da sich diese Sichtweisen allerdings auf beide Faultierfamilien beziehen, sind weiterführende Informationen zu diesem Thema im Artikel Faultiere zu finden.
Bedrohung

Aufgrund ihrer spezialisierteren Ernährung lassen sich Dreifinger-Faultiere schwerer in menschlicher Obhut halten als ihre zweifingrigen Verwandten, dementsprechend sind auch die meisten in Zoos gehaltenen Tiere Zweifinger-Faultiere. Über den Bedrohungsstand dieser Tiere lassen sich nur ungenaue Angaben machen. Als Bewohner tropischer Regenwälder werden sie zweifelsohne durch die Waldrodungen in Mitleidenschaft gezogen, darüber hinaus werden sie wegen ihres Fleisches gejagt, diese Praxis ist aber rückläufig. Das Kragenfaultier, das nur in den Regenwäldern Südostbrasiliens vorkommt, wird von der IUCN als „gefährdet“ (vulnerable) gelistet. Diese Region ist eine der am dichtesten besiedelten Regionen Brasiliens und daher stark der Rodung ausgesetzt. Schätzungen zufolge sind nur mehr zwei Prozent der ursprünglichen Fläche vorhanden, was sich besorgniserregend auf die dort vorhandenen Tierarten auswirkt. Bradypus pygmaeus gilt aufgrund seines kleinen Verbreitungsgebietes als „vom Aussterben bedroht“ (critically endangered). Die übrigen beiden Arten haben ein größeres Verbreitungsgebiet und gelten nicht als gefährdet.[14]
Literatur
- Bernhard Grzimek: Grzimeks Tierleben. Enzyklopädie des Tierreichs. Augsburg, 2001 ISBN 3-8289-1603-1.
- Gene Montgomery: The Evolution and Ecology of Armadillos, Sloths and Vermilinguas. Smithsonian Institute Press, Washington DC, 1985 ISBN 0-87474-649-3.
- Ronald Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore, 1999 ISBN 0-8018-5789-9.
- Jonathan N. Pauli: Bradypodidae (Three-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 118–132 ISBN 978-84-16728-08-4.
Einzelnachweise
- Alfred L. Gardner: Family Bradypodidae Gray, 1821. In: Alfred L. Gardner (Hrsg.): Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008, ISBN 978-0-226-28240-4, S. 158–164.
- Virginia Hayssen: Bradypus variegatus (Pilosa: Bradypodidae). In: Mammalian Species. 42, (1), 2010, S. 19–32.
- Virginia Hayssen: Bradypus tridactyla (Pilosa: Bradypodidae). In: Mammalian Species. 839, 2009, S. 1–9.
- Virginia Hayssen: Bradypus torquatus (Pilosa: Bradypodidae). In: Mammalian Species. 829, 2009, S. 1–5.
- Virginia Hayssen: Bradypus Pygmaeus (Pilosa: Bradypodidae). In: Mammalian Species. 812, 2008, S. 1–4.
- Jonathan N. Pauli: Bradypodidae (Three-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 118–132 ISBN 978-84-16728-08-4.
- Virginia L. Naples: Cranial osteology and function in the tree sloths. Bradypus and Choloepus. In: American Museum Novitates. 2739, 1982, S. 1–21.
- Sergio F. Vizcaíno: The teeth of the “toothless”: novelties and key innovations in the evolution of xenarthrans (Mammalia, Xenarthra). In: Paleobiology. 35 (3), 2009, S. 343–366.
- Lionel Hautier, Vera Weisbecker, Marcelo R. Sánchez-Villagra, Anjali Goswami, Robert J. Asher: Skeletal development in sloths and the evolution of mammalian vertebral patterning. In: PNAS. 107 (44), 2010, S. 18903–18908 (pnas.org).
- Hideki Endo, Osamu Hashimoto, Hajime Taru, Keisuke Sugimura, Shin-ichi Fujiwara, Takuya Itou, Hiroshi Koie, Masato Kitagawa, Takeo Sakai: Comparative Morphological Examinations of the Cervical and Thoracic Vertebrae and Related Spinal Nerves in the Two-Toed Sloth. In: Mammal Study. 38 (3), 2013, S. 217–224.
- John A. Nyakatura und Martin S. Fischer: Functional morphology of the muscular sling at the pectoral girdle in tree sloths: convergent morphological solutions to new functional demands? In: Journal of Anatomy. 219, 2011, S. 360–374.
- D. P. Gilmore, C. P. Da Costa, D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. In: Brazilian Journal of Medical and Biological Research. 34 (1), 2001, S. 9–25 (scielo.br).
- Desmond Gilmore, Denia Fittipaldi Duarte, Carlos Peres da Costa: The physiology of two- and three-toed sloth. In: Sergio F. Vizcaíno, W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 130–142.
- Mariella Superina, Tinka Plese, Nadia Moraes-Barros, Agustín Manuel Abba: The 2010 Sloth Red List Assessment. In: Edentata. 11 (2), 2010, S. 115–134.
- Alberto Galvao de Moura Filho, Sara Espe Huggins, Salustiano Gomes Lines: Sleep and awaking in the Three-toed Sloth, Bradypus tridactylus. In: Comparative Biochemistry and Physiology. 76A (2), 1983, S. 345–355.
- Adriano Garcia Chiarello: Sloth ecology. An overview of field studies. In: Sergio F. Vizcaíno, W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 269–280.
- Jonathan N. Pauli, Jorge E. Mendoza, Shawn A. Steffan, Cayelan C. Carey, Paul J. Weimer, M. Zachariah Peery: A syndrome of mutualism reinforces the lifestyle of a sloth. In: Proceedings of the Royal Society. B 281, 2014, S. 20133006, doi:10.1098/rspb.2013.3006.
- Leyn Castro-Vásquez, Marlon Meza, Tinka Plese, Sergio Moreno-Mora: Activity Patterns, Preference and Use of Floristic Resources by Bradypus variegatus in a Tropical Dry Forest Fragment, Santa Catalina, Bolívar, Colombia. In: Edentata. 11 (1), 2010, S. 62–69.
- Adriano G. Chiarello: Activity budgets and ranging patterns of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). In: Journal of Zoology (London). 246, 1998, S. 1–10.
- Niels C. Rattenborg, Bryson Voirin, Alexei L. Vyssotski, Roland W. Kays, Kamiel Spoelstra, Franz Kuemmeth, Wolfgang Heidrich, Martin Wikelski: Sleeping outside the box: electroencephalographic measures of sleep in sloths inhabiting a rainforest. In: Biology Letters. 4 (4), 2008, S. 402–405 (rsbl.royalsocietypublishing.org).
- G. G. Montgomery, M. E. Sunquist: Impact of sloths on Neotropical forest energy flow and nutrient cycling. In: F. B. Golley, E. Medina (Hrsg.): Tropical Ecology Systems: Trends in Terrestrial and Aquatic Research. Ecology Studies 11, Springer-Verlag, New York 1975, S. 69–111.
- Bernardo B. Dias, Luis Alberto Dias dos Santos, Paula Lara-Ruiz, Camila Righetto Cassano, Laurenz Pinder, Adriano G. Chiarello: First observation on mating and reproductive seasonality in maned sloths Bradypus torquatus (Pilosa: Bradypodidae). In: Journal of Ethology. 27, S. 97–103.
- Erica Taube, Joël Keravec, Jean-Christophe Vié, Jean-Marc Duplantier: Reproductive biology and postnatal development in sloths, Bradypus and Choloepus: review with original data from the field (French Guiana) and from captivity. In: Mammal Review. 31 (3), 2001, S. 173–188.
- Paula Lara-Ruiz, Adriano Garcia Chiarello: Life-history traits and sexual dimorphism of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). In: Journal of Zoology. 267, 2005, S. 63–73.
- Samantha Presslee, Graham J. Slater, François Pujos, Analía M. Forasiepi, Roman Fischer, Kelly Molloy, Meaghan Mackie, Jesper V. Olsen, Alejandro Kramarz, Matías Taglioretti, Fernando Scaglia, Maximiliano Lezcano, José Luis Lanata, John Southon, Robert Feranec, Jonathan Bloch, Adam Hajduk, Fabiana M. Martin, Rodolfo Salas Gismondi, Marcelo Reguero, Christian de Muizon, Alex Greenwood, Brian T. Chait, Kirsty Penkman, Matthew Collins, Ross D. E. MacPhee: Palaeoproteomics resolves sloth relationships. In: Nature Ecology & Evolution. 3, 2019, S. 1121–1130, doi:10.1038/s41559-019-0909-z.
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Emil Karpinski, Dirk Hackenberger, Paul Szpak, Jorge G. Martínez, Jim I. Mead, H. Gregory McDonald, Ross D. E. MacPhee, Guillaume Billet, Lionel Hautier, Hendrik N. Poinar: Ancient mitogenomes reveal the evolutionary history and biogeography of sloths. In: Current Biology. 29 (12), 2019, S. 2031–2042, doi:10.1016/j.cub.2019.05.043.
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald, Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. In: Systematic Biology. 68 (2), 2019, S. 204–218.
- Frédéric Delsuc, Sergio F Vizcaíno, Emmanuel J. P. Douzery: Influence of Tertiary paleoenvironmental changes on the diversification of South American mammals: a relaxed molecular clock study within xenarthrans. In: BMC Evolutionary Biology. 4 (11), 2004, S. 1–13.
- Gillian C. Gibb, Fabien L. Condamine, Melanie Kuch, Jacob Enk, Nadia Moraes-Barros, Mariella Superina, Hendrik N. Poinar, Frédéric Delsuc: Shotgun Mitogenomics Provides a Reference Phylogenetic Framework and Timescale for Living Xenarthrans. In: Molecular Biology and Evolution. 33 (3), 2015, S. 621–642.
- Robert P. Anderson, Charles O. Handley, Jr: A new species of three-toed sloth (Mammalia: Xenarthra) from Panamá, with a review of the genus Bradypus. In: Proceedings of the Biological Society of Washington. 114, 2001, S. 1–33.
- Timothy J. Gaudin: Phylogenetic relationships among sloths (Mammalia, Xenarthra, Tardigrada): the craniodental evidence. In: Zoological Journal of the Linnean Society. 140, 2004, S. 255–305.
- Don E. Wilson, DeeAnn M. Reeder: Mammal Species of the World. Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4 ().
- Nadia de Moraes-Barros, Juliana A. B. Silva, João Stenghel Morgante: Morphology, molecular phylogeny, and taxonomic inconsistencies in the study of Bradypus sloths (Pilosa: Bradypodidae). In: Journal of Mammalogy. 92 (1), 2011, S. 86–100.
- Manuel Ruiz-García, Diego Chacón, Tinka Plese, Ingrid Schuler, Joseph Mark Shostell: Mitogenomics phylogenetic relationships of the current sloth’s genera and species (Bradypodidae and Megalonychidae). In: Mitochondrial DNA Part A. 29 (2), 2018, S. 281–299, doi:10.1080/24701394.2016.1275602.
- Manuel Ruiz-García, Diego Chacón, Tinka Plese, Joseph Mark Shostell: Molecular phylogenetics of Bradypus (Three-toed sloth, Pilosa: Bradypodidae, Mammalia) and phylogeography of Bradypus variegatus (Brown-throated three-toed sloth) with mitochondrial gene sequences. In: Journal of Mammalian Evolution., 2019, doi:10.1007/s10914-019-09465-w.
- Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 34 ().
- Oldfield Thomas: The mammals of the tenth edition of Linnaeus; an attempt to fix the types of the genera and the exact bases and localities of the species. In: Proceedings of the Zoological Society of London. 1911, S. 120–158.
- Carl von Linné: Systema naturae. 1. Auflage, 1735, ohne Seitenangabe ().
- Albert Seba: Locupletissimi rerum naturalium thesauri accurata descriptio, et iconibus artificiosissimis expressio, per universam physices historiam. Amsterdam, 1734, Taf. 34 sowie S. 53 ().
- John Edward Gray: On the natural arrangement of vertebrose animals. In: London Medical Repository. 15, 1821, S. 297–310 (304–305) ().
Weblinks
- Gefährdungsgrad der einzelnen Arten in der Roten Liste gefährdeter Arten der IUCN.