Sexualdimorphismus
Sexualdimorphismus (lateinisch sexus „Geschlecht“, und altgriechisch δίμορφος dímorphos, deutsch ‚zweigestaltig‘),[1][2] Geschlechtsdimorphismus oder sekundäres Geschlechtsmerkmal bezeichnet in der Biologie deutliche Unterschiede in der Erscheinung zwischen geschlechtsreifen männlichen und weiblichen Individuen derselben (Tier-)Art, die nicht auf die Geschlechtsorgane bezogen sind;[3] Beispiele sind unterschiedliche Körpergröße oder Körperfärbung von Weibchen und Männchen.

Morphologie: Unterschiede im Erscheinungsbild
Bei vielen Tieren sind die mit der Geschlechtsreife sich herausbildenden sekundären Geschlechtsmerkmale dauerhaft, andere Arten zeigen den Sexualdimorphismus nur zur Paarungszeit. Oft besteht ein Zusammenhang zwischen Geschlechtshormonen, den sich dadurch bildenden unterschiedlichen Balzkleidern, dem unterschiedlichen Verhalten bei der Paarung und der arbeitsteiligen elterlichen Fürsorge um den Nachwuchs. Die makroskopischen Sexualdimorphismen sind genetisch determiniert. Die vielfältigen physiologischen Unterschiede reichen vom Hormonsystem über den allgemeinen Stoffwechsel bis zur Steuerung von Wachstumsprozessen und Ausbildung von Präferenzen.
Körpergröße
.png.webp)
Die Männchen sind größer oder kleiner als die Weibchen. Bei Säugetieren und vielen Vögeln sind häufig die Männchen größer als die Weibchen. Dagegen ist bei Raubvögeln wie Greifvögeln und Eulen, bei Reptilien, Kröten und Gliederfüßern das Weibchen oft größer als das Männchen. Der Extremfall sind die Zwergmännchen: Bei manchen Tiefseefischen wie den Tiefsee-Anglerfischen degenerieren die Männchen zu „Anhängseln“ des Weibchens, mit denen sie vollkommen verwachsen sind und über deren Blutkreislauf sie mit ernährt werden. Ähnlich ist es beim Grünen Igelwurm, bei dem die Zwergmännchen im Inneren des Weibchens leben und dort auch die Eier befruchten.
Färbung

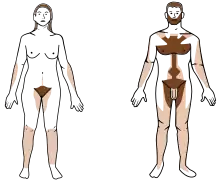
Wenn die Körperoberflächen der Geschlechter sich farblich unterscheiden, wird dies Sexualdichromatismus genannt (beispielsweise die Gefiederfärbung bei Vögeln, Fellfärbung bei Säugern, Schuppenfärbung bei Fischen). Unterschiede in der Färbung können dauerhafte Merkmale sein, manche treten nur während der Balz auf.
Unterschiedliche Organausbildungen
Bei manchen Tierarten bilden die Geschlechter unterschiedlich gestaltete Organe. Diese können Waffen sein für den Kampf zwischen den Männchen (z. B. das Gehörn von Schafen oder vergrößerte Eckzähne wie bei Wildschweinen, Zweizahnwalen, Moschustieren), Merkmale, um einen Geschlechtspartner aufmerksam zu machen (z. B. der Hahnenkamm oder Duftdrüsen für Pheromone oder Schwanzfedern der Fasane) oder Sensoren, um die Reize eines Geschlechtspartners wahrzunehmen (z. B. die Antennen der Schmetterlinge). Bei Säugetieren können Männchen und Weibchen unterschiedlich ausgeprägte Körperbehaarung besitzen (z. B. die Brust- und Bartbehaarung des Menschen, Mähne vieler Löwen), auch Skelett und Muskulatur können unterschiedlich sein.[4][5]
Zusätzliche Organbildungen
Bei einigen Tierarten produziert eines der Geschlechter zusätzliche Organe. Diese können Waffen sein für Rivalitätskämpfe (z. B. das Geweih der Hirsche oder der Sporn der Hähne), Merkmale, um einen Geschlechtspartner aufmerksam zu machen (z. B. das Pfauenrad oder Leuchtorgane bei Leuchtkäfern) oder Organe zur Brutpflege (z. B. voll ausgebildete Milchdrüsen bei weiblichen Säugetieren, äußerlich erkennbar als weibliche Brust oder Euter; Bruttaschen bei Seenadeln oder Marsupium der Asseln oder Stachelhäutern).
Ethologie: Unterschiede im Verhalten
Häufig zeigen die Geschlechter unterschiedliche Verhaltensweisen. Diese werden als tertiäre Geschlechtsmerkmale bezeichnet.[6][7] Die Unterschiede verstärken sich oft während der Balz, meist stehen sie in direktem Zusammenhang mit der Partnersuche und Partnerwahl. Ein Beispiel ist der Gesang der Singvogelmännchen. Dazu können auch langwierige Verhaltensmuster zum Bau von Einrichtungen durch eines der Geschlechter gehören wie Nestbau für die kommende Brutpflege (z. B. durch Spechte oder Siamesische Kampffische) oder auch für die Balz geeignete Vorrichtungen (wie Lauben durch Laubenvögel).
Erklärung der Unterschiede

Ursächlich für alle sekundären Geschlechtsmerkmale sind geschlechtsspezifische Selektionsdrücke, welche sowohl äußerer (natürlicher) wie sexueller Selektion unterliegen.[8]
Bei vielen Arten mit promiskem Verpaarungsverhalten können Männchen potentiell deutlich mehr Nachkommen zeugen als die Weibchen. Die Weibchen dieser Arten zeigen bei der Partnerwahl ein wählerischeres Verhalten als die Männchen. Es erhöht die biologische Fitness der Nachkommen der Weibchen, wenn sie bei diesem Paarungsverhalten solche Männchen auswählen, deren Merkmale eine besonders hohe Qualität aufweisen. Dies wiederum führt dazu, dass sich vorwiegend Männchen mit starker Ausprägung dieser Merkmale verpaaren, woraus ein sexuell bedingter Selektionsdruck entsteht. Umgekehrt steigert es den Erfolg der Männchen, wenn sie sich mit möglichst vielen Weibchen verpaaren, woraus ebenfalls ein entsprechender Selektionsdruck entsteht.
Für den Bruterfolg ist es vorteilhaft, wenn der Nachwuchs vor Prädatoren geschützt aufwächst. Brutpflegende Eltern sind daher in ihrem Habitat meist unauffällig und gut getarnt.
Erfolgt die Brutpflege nur durch einen Elternteil, so stellt diese Verhaltensweise einerseits einen ethologischen Sexualdimorphismus dar und begünstigt andererseits die Ausbildung weiterer Sexualdimorphismen, da die Erfordernisse an die Brutpflege geschlechtsspezifisch wirksam sind. Ein ausgeprägter Geschlechtsdimorphismus kann auch ein Maß für den Grad der ethologischen Unterschiede zwischen den Geschlechtern darstellen, häufig betrifft dies Unterschiede im Paarungsverhalten wie Polygynie oder, seltener, Polyandrie.
Es gibt eine Reihe von Arten, bei denen die Weibchen größer sind als die Männchen, weil das Weibchen eine große Anzahl von Eiern legt, wie beispielsweise bei Insektenköniginnen, oder es ihre Gebärfähigkeit erhöht.
Eine weitere Erklärung kommt ohne erkennbaren Nachweis eines deutlichen Vorteils aus und macht primär eine sich selbst verstärkende sexuelle Präferenz verantwortlich.[9] Beispielsweise wurde der Einfluss der sexuellen Präferenz für bestimmte Körpergrößen bei riffbewohnenden Fischen untersucht.[9]
Renschsche Regel
Die Renschsche Regel, 1950 von dem deutschen Zoologen Bernhard Rensch formuliert,[9][10] ist eine allometrische Regel zum geschlechtsspezifischen Größenunterschied bei Tieren. Sie besagt, dass unter verwandten Arten Größenunterschiede bei größeren Arten deutlicher sind, und dass bei großen Arten die Männchen, bei kleinen Arten die Weibchen tendenziell größer sind.[11]
Zu den Tiergruppen, die diesem Muster folgen, gehören insbesondere Reptilien,[12] aber auch Primaten, Robben, Paarhufer,[13] Küstenvögel,[10][14] Kolibris und blütenbesuchende Milben.[15]
Siehe auch
- Dimorphismus (zwei verschiedene Erscheinungsvorkommen bei derselben Art)
- Polymorphismus (mehrere Genvarianten innerhalb einer Population)
Literatur
- Charles Darwin: Die Abstammung des Menschen und die geschlechtliche Zuchtwahl. 2. Bände. 3., gänzlich umgearbeitete Auflage, aus dem Englischen übersetzt von Julius Victor Carus. In: Ch. Darwin’s gesammelte Werke. Band 5 und 6. Schweizerbart’sche Verlagshandlung/ Koch, Stuttgart 1875 (Band 1 und Band 2 bei Wikisource).
- Ronald Fisher: The Genetical Theory of Natural Selection. Oxford University Press, New York 1930 (englisch; Neuauflage 1999: ISBN 0-19-850440-3).
- Matt Ridley: Eros und Evolution. Die Naturgeschichte der Sexualität. Droemer Knaur, München 1998, ISBN 3-426-77315-5.
Dokumentarfilme
- Véronique Kleiner: Warum sind Frauen kleiner als Männer? ARTE France, Frankreich 2013 (52 Minuten, Info bei Arte; internationale Wissenschaftler verschiedener Fachrichtungen zur Evolutionsgeschichte).
Weblinks
- Gerhard Medicus: Fragen zur Geschlechterdifferenz – eine verhaltensbiologische Annäherung. (PDF; 108 kB) 2000, abgerufen am 25. Januar 2014 (8 Seiten; siehe dazugehörige Quelle/Übersicht/Richtlinie).
- Gerhard Medicus, Sigrid Hopf: Ethologie: Biopsychologie der Geschlechterdifferenz. In: Einführung in die Humanethologie. Universität Innsbruck, 1995, abgerufen am 25. Januar 2014 (PDF-Dokumente).
Einzelnachweise
- Erich Pertsch: Langenscheidts Großes Schulwörterbuch Lateinisch-Deutsch. Langenscheidt, Berlin 1978, ISBN 3-468-07201-5.
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. Freytag/ Hölder-Pichler-Tempsky, München/ Wien 1965.
- Sexualdimorphismus. In: Lexikon der Biologie. Band 7. Herder, Freiburg.
- Thomas F. Lang: The Bone-Muscle Relationship in Men and Women. In: Hindawi Journal of Osteoporosis. 5. Oktober 2001.
- Ego Seemann: Sexual Dimorphism in Skeletal Size, Density, and Strength. In: The Journal of Clinical Endocrinology and Metabolism. 1. Oktober 2001.
- Bernhard Rensch: Die stammesgeschichtliche Sonderstellung des Menschen. 1957, S. 33.
- Wolfgang Clauss, Cornelia Clauss: Humanbiologie kompakt (= Bachelor.). Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1899-9, S. 348.
- Brian J. Olsen, Russell Greenberg, Jeffrey R. Walters, Robert C. Fleischer: Sexual dimorphism in a feeding apparatus is driven by mate choice and not niche partitioning. In: Behavioral Ecology. Band 24, Nr. 6, 2013, S. 1327–1338, doi:10.1093/beheco/art071.
- Stefan P. W. Walker, Mark I. McCormick: Sexual selection explains sex-specific growth plasticity and positive allometry for sexual size dimorphism in a reef fish. In: Proceedings of the Royal Society B: Biological Sciences. Band 276, Nr. 1671, 22. September 2009, 3335–3343, doi:10.1098/rspb.2009.0767.
- James Dale, Peter O Dunn, Jordi Figuerola, Terje Lislevand, Tamás Székely, Linda A Whittingham: Sexual selection explains Rensch’s rule of allometry for sexual size dimorphism. In: Proceedings of the Royal Society B: Biological Sciences. Band 274, Nr. 1628, 7. Dezember 2007, S. 2971–2979, doi:10.1098/rspb.2007.1043.
- Ehab Abouheif, Daphne J. Fairbairn: A comparative analysis of allometry for sexual size dimorphism: assessing Rensch’s rule. In: American Naturalist. Band 149, Nr. 3, März 1997, S. 540–562, JSTOR 2463382.
- Robert M. Cox, Marguerite A. Butler, Henry B. John-Alder: The evolution of sexual size dimorphism in reptiles. (PDF) In: Sex, Size and Gender Roles: Evolutionary Studies of Sexual Size Dimorphism. 2007, S. 38–49.
- D. J. Fairbairn: Allometry for sexual size dimorphism: Pattern and process in the coevolution of body size in males and females. In: Annual Review in Ecology and Systematics, 28, 1997, S. 659–687, JSTOR 2952508.
- Tamás Székely, Robert P. Freckleton, John D. Reynolds: Sexual selection explains Rensch’s rule of size dimorphism in shorebirds. In: Proceedings of the National Academy of Sciences of the United States of America. Band 101, Nr. 33, 2003, S. 12224–12227, doi:10.1073/pnas.0404503101.
- R. K. Colwell: Rensch’s rule crosses the line: convergent allometry of sexual size dimorphism in hummingbirds and flower mites. In: The American Naturalist. Band 156, 2000, S. 496–510, JSTOR 10.1086/303406.