Schliefer
Die Schliefer (Procaviidae) sind eine Familie innerhalb der im Deutschen gleichnamigen Ordnung der Hyracoidea. Es handelt sich um gut kaninchengroße und im äußeren Erscheinungsbild an Murmeltiere erinnernde Angehörige der Säugetiere. Ihr Körper und ihre Gliedmaßen sind kräftig, die Schnauze ist kurz und der Schwanz im Fell verborgen. Eine charakteristische Bildung findet sich am Rücken, wo ein auffälliger farbiger Fleck eine Drüse markiert. Auffallend sind auch die zahlreichen Tasthaare, die nicht nur im Gesicht, sondern verteilt am gesamten Körper auftreten. Die Tiere kommen endemisch in Afrika vor, als einzige Ausnahme lebt der Klippschliefer auch in Vorderasien. Dabei bewohnen der Klipp- und der Buschschliefer felsige, offene und teils trockene Gegenden, die Baumschliefer sind dagegen an Wälder angepasst. Der Lebensraum der Schliefer umfasst sowohl Flachländer als auch hohe Gebirgslagen.
| Schliefer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Buschschliefer (Heterohyrax brucei) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Ordnung | ||||||||||||
| Hyracoidea | ||||||||||||
| Huxley, 1869 | ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Procaviidae | ||||||||||||
| Thomas, 1892 |
Die Tiere können gut klettern und sind aufgrund einiger Anpassungen am Fuß auch in steilem, unebenem oder rutschigem Terrain schnell unterwegs. Die bodenbewohnenden Klipp- und Buschschliefer leben tagaktiv und formen große Familiengruppen. Demgegenüber treten die baumlebenden Baumschliefer nachts auf und sind weitgehend Einzelgänger. Alle Arten verhalten sich territorial, bedeutend sind die lauten Rufe der Männchen. Die Hauptnahrung der Schliefer besteht aus Pflanzen, die einzelnen Arten unterscheiden sich in der Bevorzugung von härteren oder weicheren Bestandteilen. Wasser wird nur selten getrunken. Die Fortpflanzung erfolgt zumeist einmal jährlich. Weibchen haben eine ausgesprochen lange Tragzeit. Ein Wurf umfasst ein bis vier Jungtiere.
Die Ordnung der Schliefer ist relativ alt, die frühesten Vertreter sind bereits im Eozän vor fast 50 Millionen Jahren sowohl im nördlichen als auch im südlichen Afrika nachgewiesen. Im Gegensatz zu den heutigen Schliefern waren die ursprünglichen Formen sehr variantenreich. Neben kleinen Tieren kamen auch riesenhafte mit einem Gewicht von über einer Tonne vor. Die ursprünglichen Schliefer bewegten sich auf die unterschiedlichsten Weisen laufend, springend oder kletternd fort. Dadurch besetzten sie eine Vielzahl von Lebensräumen. Spätestens im Miozän erreichten die Schliefer auch Eurasien und verbreiteten sich weit über beide Erdteile. Allerdings ging die hohe Variabilität in der Folgezeit durch Konkurrenz mit anderen Tiergruppen, hauptsächlich den Huftieren, verloren. Lediglich die kleinen Vertreter der modernen Schliefer überlebten bis heute. Aufgrund ihrer teils reichhaltigen Fossilfunde und der zahlreichen nachgewiesenen Formen haben die ausgestorbenen Schliefer eine große Bedeutung für die Biostratigraphie Afrikas.
Die nächsten Verwandten der Schliefer stellen die Rüsseltiere und Seekühe dar. Alle drei Ordnungen werden als Paenungulata zusammengefasst, die wiederum einen Teil der sehr heterogenen Gruppe der Afrotheria bilden. Die genauen Beziehungen der Schliefer zu anderen Säugetieren waren aber lange Zeit unklar. Im 18. Jahrhundert, als die ersten naturwissenschaftlichen Berichte über die Schliefer entstanden, hielt man sie für Nagetiere. Später wurden sie häufig mit verschiedenen Huftiergruppen in Verbindung gebracht. Dies resultierte in einer intensiven Debatte, die im Verlauf des 20. Jahrhunderts geführt und in der über die Verwandtschaftsverhältnisse diskutiert wurde. Einerseits sahen Wissenschaftler eine Verbindung der Schliefer zu den Unpaarhufern, anderseits zu den Elefanten. Der Streit konnte erst im Übergang zum 21. Jahrhunderts mit dem Aufkommen biochemischer und molekulargenetischer Untersuchungsmethoden aufgelöst werden. Die wissenschaftliche Benennung der Familie erfolgte im Jahr 1892, der Ordnungsname war bereits 1869 geprägt worden. Der Bestand der einzelnen Arten wird mit einer Ausnahme als nicht gefährdet eingestuft.
Merkmale
Habitus

Heutige Schliefer sind relativ kleine Säugetiere von der Größe eines Kaninchens. Ihre Kopf-Rumpf-Länge liegt zwischen 32 und 60 cm. Der Schwanz ist winzig und meistens kaum sichtbar, im Höchstfalle 3 cm lang. Schliefer erreichen ein Gewicht von 1,3 bis 5,4 kg. Unterschiede zwischen Männchen und Weibchen sind nicht ausgeprägt. Quer durch das Verbreitungsgebiet lassen sich aber teils beträchtliche Größenvariationen innerhalb einer Art feststellen, die teils umweltbedingt sind. Äußerlich ähneln die heutigen Schliefer den Meerschweinchen. Sie sind sehr robuste, stämmige Tiere, die sich alle durch einen muskulösen, kurzen Hals und einen langen, nach oben gewölbten Leib auszeichnen. Ihre Fellfärbung variiert nach Gattung und Art und reicht von grau über hell- und dunkelbraun bis schwarz, häufig erscheint der Bauch heller. Auf dem Rücken ist eine Drüse von einem andersfarbigen Fellfleck bedeckt. Tiere trockener Landschaften haben ein kurzes Fell, Bewohner der Wälder und alpiner Hochlagen dagegen ein langes und dichtes. Es ist von zahlreichen Vibrissen durchsetzt, deren Länge bis zu 30 mm beträgt. Weitere, mit bis zu 90 mm besonders lange Tasthaare treten im Gesicht auf. Der Kopf der Schliefer ist abgeflacht, die Schnauze allgemein kurz, ebenso die Ohren. Die Oberlippe zeigt sich gespalten. Die Augen wölben sich nach vorn, sie verfügen über ein zusätzliches Lid, das sich bei grellem Sonnenlicht von der Iris über die Pupille schiebt und umbraculum genannt wird. Es ermöglicht den Schliefern in die Sonne zu schauen.[1][2] Teilweise treten im Gesicht helle Flecken auf, etwa an den Augenbrauen. Die Gliedmaßen sind kurz, vorn enden sie in vier Zehen, die kleine Hufe tragen. An den Hinterbeinen kommen drei Zehen vor, der jeweils innerste besitzt eine gebogene Klaue, an den anderen sind dagegen auch Hufe ausgebildet. Die Zehen und Finger sind bis zur Basis des letzten Glieds miteinander vereint. Die nackten, häufig dunklen Sohlen werden von zahlreichen Drüsen durchsetzt.[3][4][5]
Schädel- und Gebissmerkmale

Der Schädel der Schliefer zeigt sich relativ generalisiert mit einer breiten und flachen Stirnlinie, einem senkrecht aufgestellten Hinterhauptsbein und ausladenden Jochbögen. In Seitenansicht erreicht er eine relativ große Höhe, wobei mehr als die Hälfte davon durch den massigen Unterkiefer eingenommen wird. Das Rostrum ist kurz und endet stumpf. Auf den Scheitelbeinen treten deutliche Temporallinien auf, die sich beim Klippschliefer (Procavia) zu einem Scheitelkamm vereinen können, der aber nicht besonders massiv ausfällt. Einen markanten Knochen stellt das Os interparietale dar, ein Element des Schädeldaches zwischen den beiden Scheitelbeinen und dem Hinterhauptsbein. Je nach Art kann ein Postorbitalbogen ausgebildet sein, das den hinteren Rand der Orbita schließt. Dies ist etwa bei den Baumschliefern (Dendrohyrax) der Fall, nicht jedoch beim Klippschliefer und beim Buschschliefer (Heterohyrax). Als einzigartiges Merkmal der Schliefer beteiligt sich das Scheitelbein am Schluss des hinteren Augenrandes. Das Tränenbein formt einen Teil der Augenhöhle. An der Schädelbasis wird die Glenoidgrube für das Gelenk des Unterkiefers sowohl vom Jochbein als auch vom Schläfenbein gebildet. Der Unterkiefer fällt vor allem durch seinen massigen und breiten sowie hohen aufsteigenden Ast auf. Der Kronenfortsatz erhebt sich nur wenig über den Gelenkfortsatz. Am hinteren Ende ist der Winkelfortsatz deutlich gerundet ausgeformt.[6][7][8][5]
Das Gebiss der heutigen Schliefer besitzt eine etwas reduzierte Zahnanzahl, was hauptsächlich die vorderen Zähne betrifft. Es besteht aus insgesamt 34 Zähnen mit folgender Zahnformel: . Bei einigen Populationen des Klippschliefers sind aber die jeweils unteren ersten Prämolaren zurückgebildet, so dass bei diesen nur 32 Zähne ausgebildet sind. Der obere Schneidezahn wächst permanent und ist deutlich vergrößert. In der Form des Zahns lässt sich ein deutlicher Geschlechtsdimorphismus ausmachen, da er bei männlichen Tieren größer sowie dreieckig im Querschnitt und mit einer scharfen vorderen Kante versehen ist. Weibchen dagegen haben einen kleineren und eher runden oder abgeflachten oberen Schneidezahn. Die unteren Schneidezähnen sind meißelartig flach, bei den Baumschliefern ist jeder Zahn in jeweils drei kleine Stifte unterteilt, so dass eine Art Zahnkamm entsteht. Bei den anderen beiden Arten ist das Merkmal nicht so stark ausgeprägt und häufig nur im Jungstadium vorhanden. Ein Eckzahn kommt nicht vor, ist aber im Milchgebiss ausgebildet. Zum hinteren Gebiss besteht ein deutliches Diastema. Die Prämolaren und Molaren zeigen bezüglich der Zahnkronenhöhe Unterschiede zwischen den Arten. Der Klippschliefer besitzt hochkronige (hypsodonte) Zähne, die anderen Vertreter sind mit mehr oder weniger niederkronigen (brachyodonte) Zähnen ausgestattet. Vor allem die Mahlzähne erinnern ein wenig an die der Unpaarhufer. Die oberen Molaren weisen zwei quergestellte Schmelzleisten (Protoloph und Metaloph) auf der Kauoberfläche auf, so dass ein bilophodontes Muster entsteht. Entlang der Zahnaußenkante werden beide Leisten durch eine weitere (Ectoloph) miteinander verbunden. Dadurch wirkt das Schmelzmuster π-förmig, eine Entsprechung findet sich bei den Nashörnern. Im Unterschied zu den Nashörnern ist das Ectoloph nicht durchlaufend, sondern von einer Furche geteilt. Im Unterkiefer zeigen die Mahlzähne analog zu den Nashörnern eine Doppel-Halbmondform.[9][6][5] Der Zahnwechsel vom Milch- hin zum Dauergebiss findet bei den Schliefern wie bei einigen anderen Vertretern der Afrotheria auch sehr spät in der Individualentwicklung statt, häufig erst im ausgewachsenen und sexuell reifen Stadium.[10]
Skelettmerkmale

Einzelne Besonderheiten finden sich auch im Skelettbau. Die Wirbelsäule besteht aus 7 Hals-, 19 bis 22 Brust-, 6 bis 9 Lenden-, 5 bis 7 Kreuzbein- und 4 bis 10 Schwanzwirbeln. Wie bei den Afrotheria üblich, ist die Anzahl der Rückenwirbel (Brust- und Lendenwirbel) mit 27 bis 30 höher als bei anderen Verwandtschaftsgruppen; innerhalb der Afrotheria haben die Schliefer die meisten Einzelelemente.[11][12] Die Lendenwirbelsäule ist ausgesprochen gestreckt und erreicht mit 10 cm Länge mehr als die Hälfte der Länge der Brustwirbelsäule, die rund 15 cm misst. Es kommen zwischen 19 und 22 Rippenpaare vor, wobei 21 und 22 häufiger auftreten. Von diesen sind sieben bis acht Paare mit dem Brustbein verbunden. Ein Schlüsselbein ist nicht ausgebildet. Am Schulterblatt fehlt außerdem das Acrominion, stattdessen läuft die Schultergräte allmählich aus. Elle und Speiche sind etwa gleich lang und umeinander gedreht. Das Darmbein ist extrem kopfwärts gestreckt, der Beckenabschnitt vor der Hüftgelenkspfanne nimmt dadurch gut das Doppelte der übrigen Beckenlänge ein. Am Oberschenkelknochen kommt ein dritter Rollhügel vor, der meist nur als schwacher Rippel ausgebildet ist. Das Wadenbein wird an der Basis durch Bänder mit dem Schienbein verbunden.[13][14]
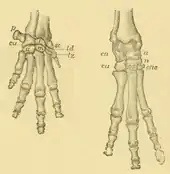
Die Hand- und Fußwurzelknochen zeigen eine serielle (taxeopode) Anordnung, das heißt, die einzelnen Wurzelknochen jeder Reihe liegen hintereinander und überschneiden sich nicht wechselseitig. Dadurch gelenkt an der Handwurzel das Kopfbein direkt mit dem Mondbein, an der Fußwurzel steht das Sprungbein nur mit dem Kahnbein und das Fersenbein nur mit dem Würfelbein in Verbindung. Das Sprungbein ist durch die beiden seitlichen Knöchel fest fixiert. Durch den speziellen Bau der Gliedmaßen sind die Schliefer nicht fähig, Hände und Füße im Gelenkbereich zu rotieren, dies erfolgt hauptsächlich im Bereich zwischen den Wurzelknochen, bei der Hand zusätzlich durch Drehung des Schultergelenks. Die Hand besitzt fünf Strahlen (I bis V), von denen der Daumen (Strahl I) rudimentär ist und unter der Haut verborgen bleibt. Der äußere Strahl (V) ist ebenfalls in der Größe reduziert. Am Fuß bestehen drei Strahlen (II bis IV). Sowohl bei der Hand als auch beim Fuß verläuft die Hauptachse durch den jeweils dritten Strahl, wodurch ein mesaxonischer Aufbau entsteht.[15][16][13][14]
Drüsen und taktile Haare
_fur_skin.jpg.webp)
Eine eher ungewöhnliche Bildung ist die Rückendrüse der Schliefer, die als nackte Hautfläche von einem markant gefärbten Haarfleck umgeben wird. Die Drüse weist Längen von etwa 1,5 cm auf und besteht aus sieben oder acht Läppchen aus drüsenhaltigem Gewebe, die tief in der Haut sitzen. Jedes einzelne Läppchen enthält 25 bis 40 Fächer, die mit sekrethaltigem Epithel gefüllt sind, welches wiederum einen irregulär geformten Hohlraum umgibt. Von hier führen gut entwickelte Kanäle zur Oberfläche. Die Läppchen schwellen vor allem bei sexuell aktiven Tieren unabhängig vom Geschlecht an. Die Haare des farbigen Flecks um die Drüse liegen normalerweise flach entsprechend dem übrigen Fell und überdecken die Drüse. Sie können aber bei Erregung aufgerichtet werden und formen dann ein auffälliges Büschel, das die Drüse entblößt.[17]
Weitere Drüsen finden sich an den Sohlen der Hände und Füße. Die Schliefer laufen nicht auf den Hufen, sondern auf der nackten Sohle, die von einer rund 1 cm dicken Epithelschicht überzogen ist. Darin befinden sich Drüsen, die die Hautschicht in hoher Dichte mit etwa 300 Drüsenkanälen je Quadratzentimeter durchsetzen. Die einzelnen Drüsen haben einen Durchmesser von etwa 15 bis 45 μm und sind von Fett- und Bindegewebe umgeben. Prinzipiell ähneln die Drüsen denen von Primaten, die Zellen sind hell oder dunkel gefärbt. Letztere stellen die eigentlichen Sekretproduzenten dar und enthalten den Golgi-Apparat. Sie erzeugen Glykoproteine. Die Sekrete halten die Sohlen der Hände und Füße beständig feucht. In Verbindung mit der Muskelkraft, die die Sohle entlang der zentralen Schwielenspalte einzieht, erzeugen die Tiere eine hohe Adhäsionskraft, die sie befähigt, an Bäumen und Felsen zu klettern oder über glatte, rutschige und unebene Flächen zu laufen.[18][19][20][5]
Ein besonderes Merkmal der Schliefer findet sich in der Verteilung der Tasthaare nicht nur im Gesicht, sondern regelmäßig über den gesamten Körper.[19] Dieses Merkmal tritt nur selten bei anderen Säugetiergruppen auf, bekannt ist es etwa von den Seekühen. Die einzelnen Tasthaare sind schwarz gefärbt und länger als die restlichen Haare. Sie zeigen an der Basis den für sensorisch empfindliche Haare typischen Aufbau mit dem Haarbalg und dem umgebenden Blutsinus, die eingeschlossen sind in eine Kapsel aus Bindegewebe. Die gesamte Struktur der Basis ist gegenüber der anderer Haare gestreckt und von zahlreichen Nerven durchsetzt, die am Haarbalg enden. Die Haut um die Kapsel wiederum ist reich an Blutgefäßen und mit fibrösem Gewebe angereichert. Die Tasthaare dienen der Orientierung der Tiere in engen Höhlen, Felskammern und -gängen.[21]
Weichteilanatomie
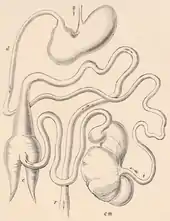
Der Verdauungstrakt ist relativ komplex, aber nicht so stark wie bei einigen Paarhufergruppen. Der Magen besitzt zwei Kammern und teilt sich somit in zwei funktionale Teile. Der vordere Abschnitt weist keine Drüsen auf und fungiert primär als Nahrungsreservoir. Der hintere Abschnitt mit dem Magenpförtner ist dagegen drüsenreich. Der anschließende Dünndarm wird bis zu 130 cm lang, er mündet in den Blinddarm. Dieser ist ungewöhnlich aufgebaut, da er aus einer vorderen, ungeteilten Kammer und einer hinteren sackartigen Struktur (auch „Darmsack“ genannt) mit zwei konischen Anhängseln besteht; beide Teile des Blinddarms sind durch einen 11 bis 20 cm langen Teil des Darms miteinander verbunden. Der vordere Blinddarmabschnitt dient als Fermentationsraum und produziert eine größere Menge an flüchtigen Fettsäuren. In der hinteren sackartigen Kammer werden die Verdauungsrückstände langsam gemischt.[22][23][24] Die Leber ist stark untergliedert, eine Gallenblase besteht nicht.[25][5] Die Zunge weist rund 5 cm Länge auf. Ihre Oberfläche besteht aus fadenförmigen mechanischen sowie pilz- und blattförmigen Geschmackspapillen. Die fadenförmigen Papillen der Zungenspitze haben einen schaufelförmigen Fortsatz. Pilzförmige Papillen verteilen sich an den Zungenrändern und auf der Unterseite der Zungenspitze. Am Zungenkörper kommen hingegen blattförmige Papillen vor, zusätzlich sind hier einige kuppelartige Papillen ausgebildet. Speicheldrüsen finden sich häufig an der Zungenwurzel.[26]
Weibchen haben eine paarige (Klippschliefer) oder zweihörnige Gebärmutter (Baum- und Buschschliefer). Für gewöhnlich verfügen sie über eins bis drei Zitzenpaare. Die Anzahl ist bei den Baumschliefern generell geringer und die Position der Zitzen variabel zwischen dem Brust- und dem Leistenbereich verteilt. Beim Busch- und beim Klippschliefer kommen häufig ein Paar in der Brust- und zwei in der Leistengegend vor.[27] Die Hoden der Männchen sind in der Bauchhöhle verborgen. Sie wiegen bei sexuell inaktiven Tieren zwischen 1,0 und 1,65 g. Der Penis ist bei den einzelnen Gattungen unterschiedlich aufgebaut. Er hat bei den Baumschliefern eine einfache, leicht gekrümmte Gestalt, beim Klippschliefer ist er kurz, elliptisch geformt und verdickt sich leicht nach oben, während er beim Buschschliefer einen Anhängsel mit der Öffnung des Harnkanals aufweist. Als markant erweist sich auch der differierende Abstand zum Anus, der bei den Baumschliefern mit durchschnittlich 1,7 bis 2,5 cm am kürzesten und beim Buschschliefer mit 8,0 cm am längsten ist. Der Klippschliefer liegt mit Werten um 3,5 cm dazwischen.[28][29][30]
Schliefer besitzen zwei Muskelgruppen die bis zur Nasenspitze verlaufen. Sie bilden keine größeren Sehnen und sind nur in ihrem vorderen Abschnitt gut voneinander getrennt. Beide Muskeln bewegen die Nase, was aber nur eingeschränkt ausgeführt werden kann. Der Kauapparat der Schliefer ähnelt dem der pflanzenfresserischen Huftiere. Er zeigt eine Dominanz des Masseter- gegenüber dem Temporalis-Muskelkomplex, was auch durch die hohe Lage des Unterkiefergelenkes und dem ausgedehnten Winkelfortsatz angezeigt wird. Jedoch ist bei den Schliefern im Gegensatz zu vielen Pflanzenfressern der Temporalis-Muskel verhältnismäßig größer. Dies geht mit einer relativ kurzen Schnauze einher. Die Tiere sind daher einerseits zu komplexeren Kaubewegungen wie die Huftiere befähigt, können aber auch mehr Kraft in den vorderen Gebissbereich legen. Der kurze Kronenfortsatz bewirkt, dass das Maul weit aufgesperrt werden kann, etwa zur Präsentation der oberen spitzen Schneidezähne.[8]
Verbreitung und Lebensraum
Die Schliefer sind weitgehend endemisch in Afrika verbreitet. Eine Ausnahme bildet der Klippschliefer, der auch in Vorderasien, speziell in der Levante und auf der Arabischen Halbinsel vorkommt. Abseits dieses Vorkommens leben sowohl der Klipp- als auch der Buschschliefer überwiegend im östlichen und südlichen Teil Afrikas. Sie bevorzugen häufig felsige, aride Gegenden, sind aber auch in Savannen- und Waldlandschaften zu finden, in denen steinreiche Areale oder verschiedene Felsformationen zur Verfügung stehen. Beide Arten treten teilweise sympatrisch auf. Die Baumschliefer dagegen sind weitgehend auf Wälder beschränkt. Ihre Verbreitung reicht vom westlichen über das zentrale bis zum östlichen Afrika und streut von hier bis in den südlichen Teil des Kontinentes. Die verschiedenen Arten können im Flachland ebenso wie im Gebirge bis teilweise in Höhen von 4500 m beobachtet werden. Die Anwesenheit und Häufigkeit von Schliefern in einer bestimmten Region wird von äußeren Bedingungen beeinflusst. Zu den abiotischen Faktoren zählen beispielsweise die Temperatur und der Niederschlag wie auch die Häufigkeit von Höhlen und Schlupflöchern als Verstecke. Biotische Faktoren beziehen sich auf die Häufigkeit von Beutegreifern oder Parasiten, aber auch die inner- und überartliche Konkurrenz um Nahrungsressourcen.[3][4][5]
Lebensweise
Territorialverhalten



Im Verhalten gibt es starke Unterschiede zwischen dem Klipp- und dem Buschschliefer einerseits und den Baumschliefern andererseits, wobei die Lebensweise vorwiegend bei ersteren beiden gut untersucht ist. Die Baumschliefer leben baumkletternd (arboreal), sie sind nachtaktiv, einzelgängerisch und ziehen sich in Baumhöhlen zurück. Es werden vor allem Bäume genutzt, die mehrere Möglichkeiten an Verstecken bieten. Gelegentlich treten zwei bis drei Individuen gemeinsam auf, bei denen es sich um Mutter-Jungtier-Gruppen handelt. Die ausgewachsenen Tiere sind territorial. Die Reviere der Männchen überschneiden sich mit denen von mehreren Weibchen und werden gegen Rivalen verteidigt.[32] Dagegen bilden sowohl der Klipp- als auch der Buschschliefer größere Familiengruppen oder Kolonien, sie sind tagsüber aktiv und bodenbewohnend. Die Tiere können aber wie die Baumschliefer aufgrund ihrer Fußanatomie gut klettern und bewegen sich schnell in unebenem Terrain. Ebenso sind sie befähigt Bäume zu besteigen. Die einzelnen Gruppen bewohnen Felslandschaften, die von zahlreichen Felsklüften und Hohlräumen durchzogen sein müssen. Diese dienen als Verstecke oder Rückzugsorte. Eine Kolonie besteht aus einem dominanten Männchen und miteinander verwandten Weibchen sowie deren Nachwuchs. Die Mitglieder einer Kolonie nutzen ein mehr oder weniger fest umrissenes Territorium, das vom Männchen verteidigt wird. In den Savannenlandschaften des östlichen und südlichen Afrikas können solche Territorien einen einzelnen Kopje umfassen. Größere Kopjes und weiträumigere Felslandschaften werden von mehreren Familiengruppen bewohnt. Hier können dann auch einzelgängerische Männchen oder Wanderer auftreten. Dabei handelt es sich häufig um junge ausgewachsene Tiere, die noch keine eigene Gruppe gegründet haben.[33][34] Teilweise treten der Klipp- und der Buschschliefer sympatrisch auf und bilden – abhängig von der Jahreszeit – tagsüber gemischte Gruppen.[3][4][5]
Energiehaushalt und Tagesrhythmik
Die Baumhöhlen der Baumschliefer und die Felsklüfte des Klipp- und des Buschschliefers bieten nicht nur Schutz vor Fressfeinden, sondern bewirken auch ausgeglichenere Umweltbedingungen mit stabileren Temperatur- und Luftfeuchtigkeitsverhältnissen. Die Körpertemperatur der Schliefer liegt bei 35 bis 37 °C. Sie schwankt aber mit der Außentemperatur. Die Anpassung der Körpertemperatur an die Außentemperatur geschieht durch Akklimatisierung und folgt keinem vorgegebenen Tagesrhythmus. Bei höhere Umgebungstemperatur, meist über 25 °C, erfolgt die Thermoregulation über die Transpiration an den Nasenöffnungen und an den Fußsohlen sowie über Hecheln und einen erhöhten Speichelfluss. Niedrigen Temperaturen begegnen die Tiere meist mit einer erhöhten Sauerstoffzufuhr.[35] Außerdem haben die Schliefer einen geringen Stoffwechsel, der etwa 30 % unter dem Wert liegt, der für ein gleich großes Tier zu erwarten wäre. Sowohl die labile Körpertemperatur als auch der niedrige Metabolismus tragen zur Energieersparnis bei. Die Nieren sind sehr effizient und können Urin beziehungsweise Elektrolyte stark konzentrieren. Dies ermöglicht zumindest den Klipp- und den Buschschliefer in sehr trockenen Arealen zu leben ohne viel Flüssigkeit aufnehmen zu müssen.[4][5]
Die labile Körpertemperatur bestimmt weitgehend den Tagesverlauf der Schliefer. Die koloniebildenden Arten formieren sich am frühen Morgen in Gruppen mit neben- oder übereinander liegenden Tieren. Die Formationen brechen auf, sobald die Sonne die Felsen erwärmt. Dann baden die Tiere zumeist in loser Formation in der Sonne. An den heißen Stunden des Tages ziehen sie sich in den Schatten zurück.[36] Ein wichtiger Bestandteil ist das Kratzen und Putzen, was mit der Putzkralle des Hinterfußes und mit den unteren Schneidezähnen ausgeführt wird. Gelegentlich baden die Tiere auch im Sand und entfernen so Ektoparasiten. Schliefer nutzen Latrinen, in denen sie ihren Kot und ihr Urin absetzen. Bei den koloniebildenden Arten werden diese gemeinsam genutzt. Die Vertreter der Baumschliefer steigen dafür von den Bäumen herunter. Ihre Latrinen befinden sich häufig an gut einsehbaren Stellen. Der mit Kalziumkarbonat durchsetzte Kot bildet eine flächendeckende Substanz, die teilweise als „Hyraceum“ Verwendung findet.[4][5]
Soziale Kommunikation
Die innerartliche Kommunikation der Schliefer ist vielfältig. Bei der Interaktion verschiedener Individuen spielt die jeweilige Position und Körperhaltung eine wichtige Rolle. Generell gelten Kopf-zu-Kopf-Begegnungen als Konfrontationsverhalten. Im sozialen Miteinander wie bei der Haufenbildung während der kühlen Tageszeiten sind daher die Köpfe der Tiere immer auswärts orientiert. Auch beim gemeinsamen Fressen oder Sonnenbaden der Familiengruppen der beiden koloniebildenden Arten kommt es dabei immer zu radialen oder gegenständigen Positionen der Tiere zueinander.[36] Als aggressives Gebaren kann ein geöffnetes Maul und die Präsentation der oberen, langen Schneidezähne angesehen werden. Als wichtiger visueller Signalgeber dienen die Haare des Flecks um die Rückendrüse, die bei Erregung aufgerichtet werden können. Der Winkel, in dem die Haare aufsteigen, gibt Aufschluss über die Intensität der Erregung eines Tieres. Der Farbfleck hat dadurch vor allem während der Paarungszeit und bei den Dominanzkämpfen der Männchen eine bedeutende Funktion. Die Sekrete der Rückendrüse werden darüber hinaus zur Geruchserkennung eingesetzt, etwa zwischen Mutter- und Jungtieren.[37][17] Weitere olfaktorische Kennzeichen nutzen Männchen, die speziell in der Fortpflanzungsphase die Latrinen nach Gerüchen der empfangsbereiten Weibchen absuchen. Auffallend ist allerdings, dass die Schliefer kaum Geruchsmarken zum Kennzeichnen ihrer Reviere abgeben.[3][4][5]
Die Lautgebung der Schliefer ist sehr variantenreich und besteht aus zahlreichen Rufen, die in den unterschiedlichsten Situationen hervorgebracht werden. Die Rufe drücken verschiedenste Befindungen wie Aggression, Bedrohung, Befriedung oder Rückzug aus.[38] Von hoher Bedeutung sind die Rufe der Männchen, die als „territorialer“ oder „großer Ruf“ bezeichnet werden. Sie ertönen zumeist das gesamte Jahr über zu festen Tageszeiten, können aber während der Paarungszeit stark zunehmen. Häufig animieren sich die Männchen während einer Rufperiode gegenseitig, so dass die Laute weit getragen werden. Sie bestehen aus einer Abfolgen von sich abwechselnden Rufelementen, die zum Ende hin an Intensität zunehmen. Die gesamte Serie wird mehrfach wiederholt.[29] Teilweise sind sie stark individualisiert, es lassen sich zudem auch Unterschiede in lokalen Populationen erkennen. Für den Klippschliefer wurde ermittelt, dass einzelne Tiere mit ihren Rufen individuelle Informationen über ihre körperlichen Eigenschaften oder ihren sozialen Status übermitteln.[39][3][4][5]
Ernährung
.jpg.webp)
Alle Schliefer sind reine Pflanzenfresser. Ihre Hauptnahrung besteht aus weichen Pflanzenteilen wie Blätter, Zweige, Früchte und Rinde. Lokal treten deutliche Unterschiede bei den bevorzugten Pflanzen auf, die wohl auf die Verfügbarkeit für die einzelnen Populationen zurückzuführen sind. Der Klipp- und der Buschschliefer nehmen darüber hinaus größere Mengen an Gräsern auf. Der Anteil kann vor allem in der Regenzeit stark ansteigen, beim Klippschliefer ist er aber deutlich höher als beim Buschschliefer. Beide Arten sind wegen des stärkeren Abriebes durch die harten Gräser dafür mit höheren Zahnkronen an den Backenzähnen ausgestattet. Die unterschiedliche Ernährung der beiden Schliefervertreter konnte auch mittels Isotopenanalysen[40] und durch Abrasionsspuren[41] belegt werden. Wasser zum Trinken ist keine Voraussetzung, da die Tiere oft genug Flüssigkeit aus ihrer Nahrung ziehen können.[3][4][5]
Die Nahrung wird mit den Zähnen aufgenommen, die Vorderfüße kommen nicht zum Einsatz. Die Zerkleinerung der Nahrung im Maul erfolgt mit seitlichen Kaubewegungen.[42] Die aufgenommene Nahrung passiert den Körper in einem Zeitraum von etwa vier bis fünf Tagen, was ausgesprochen lang ist. Der Magen-Darm-Trakt vermag dabei auch faseriges Pflanzenmaterial zu verdauen.[22] Im Gegensatz zu einzelnen älteren und jüngeren Beobachtungen (einschließlich einer Erwähnung im Alten Testament)[43][44][45] kauen die Tiere ihre Nahrung nicht wieder. Der Magen der Schliefer ist einfacher gebaut als der der Wiederkäuer. Möglicherweise handelt es sich um eine Fehldeutung einer Stresshandlung, bei der einzelne Individuen mit mahlenden Kaubewegungen auf sie unbekannte Faktoren reagieren, dabei aber keine Nahrung zerkleinern. Dies wird heute als „Zähneknirschen“ bezeichnet und kann bis zu eine halbe Stunde anhalten.[42][38]
Fortpflanzung
.jpg.webp)
Die Fortpflanzung ist nur beim Klipp- und Buschschliefer genügend untersucht. Die Paarung findet einmal jährlich statt und ist saisonal abhängig, der Sexualzyklus der Weibchen wiederholt sich dabei innerhalb von mehreren Wochen. In den beiden koloniebildenden Arten ist die Paarungszeit der Weibchen einer Familiengruppe untereinander synchronisiert.[46][47] Für die Baumschliefer wird auch eine ganzjährige Fortpflanzung angenommen. Während der Paarungszeit rufen die Männchen laut und suchen die Latrinen nach den Gerüchen paarungsbereiter Weibchen ab. Ihre Hoden können stark anschwellen, teilweise um das 10 bis 20fache des normalen Gewichts.[48][49] Paarungsbereite Tiere führen einen Paarungstanz auf, der aus gegenseitigem Jagen, Aneinanderreiben und Präsentieren des Rumpfes besteht. Vor dem Geschlechtsakt lässt das Männchen meist einen schrillen Ruf vernehmen. Das Aufsteigen des Männchens auf das Weibchen kann mehrfach innerhalb von wenigen Stunden erfolgen. Bisher sind aber nur wenige Paarungen beobachtet worden, da diese zumeist in den Verstecken stattfinden.[3][4][5]
Die Tragzeit ist bei den Schliefern ausgesprochen lang und währt zwischen 26 und 32 Wochen. Die Baumschliefer bringen pro Wurf eins bis zwei Junge zur Welt, beim Klipp- und Buschschliefer sind es eins bis vier. Die Anzahl ist vom Gewicht und vom Alter des Muttertiers abhängig, junge Weibchen gebären häufig weniger Nachwuchs. Wie die Paarung setzt auch die Geburt bei den Weibchen einer Kolonie synchron ein. Die Jungen kommen weit entwickelt zur Welt, sie sind voll behaart, haben geöffnete Augen und können bereits laufen und klettern. Das Geburtsgewicht der Jungen variiert zwischen 180 und 380 g. Die Jungen der koloniebildenden Arten formen häufig Spielgruppen. Sie haben ein ausgeprägtes Spielverhalten, das aus beißen, klettern, schupsen oder einem sich gegenseitig Verfolgen besteht.[50] Die Entwöhnung findet nach fünf bis sieben Monaten statt, die Geschlechtsreife tritt zwischen dem 16. und dem 30. Monat ein. Beim Klipp- und Buschschliefer werden die jungen Weibchen in die Kolonie integriert, die jungen Männchen verlassen die heimatliche Familiengruppe und gründen eine eigene. Die Lebenserwartung kann bis zu 14 Jahre betragen.[3][4][5]
Fressfeinde
Wegen ihrer geringen Größe werden die Schliefer von zahlreichen Tieren gejagt, unter anderem von Schlangen, Greifvögeln und Raubtieren. Vor allem der Klipp- und der Buschschliefer gehören zur Hauptbeute des Klippenadlers, zu dem aufgrund der Beutemenge auch eine ökologische Beziehung besteht. Unter den Säugetieren ist besonders der Leopard hervorzuheben.[4][5]
Systematik
Äußere Systematik
Innere Systematik der Afrotheria nach Heritage et al. 2021[51]
|
Die Hyracoidea bilden eine Ordnung innerhalb der Überordnung der Afrotheria. Die Afrotheria stellen wiederum eine der vier Hauptlinien der Höheren Säugetieren dar und schließen verschiedene Gruppen ein, deren Ursprungsgebiet mehr oder weniger auf dem afrikanischen Kontinent liegt oder die zu dessen ursprünglichen Bewohnern zählen. Die Zusammengehörigkeit der Afrotheria beruht hauptsächlich auf molekulargenetischen Untersuchungen, weniger auf anatomischen Gemeinsamkeiten. Innerhalb der Afrotheria werden mit den Paenungulata und den Afroinsectiphilia zwei Großgruppen unterschieden. In letzterer stehen die Rüsselspringer und die Tenrekartigen, teilweise gehört auch das Erdferkel dazu. In der Regel gelten die Schliefer als verwandt mit den Rüsseltieren und Seekühen, die alle drei zusammen wiederum die Paenungulata formen. Während die enge Verwandtschaft von Schliefern, Elefanten und Sirenen heute kaum angezweifelt und sowohl genetisch als auch morphologisch-anatomisch belegbar ist, sind die direkten Beziehungen der Gruppen zueinander in Diskussion.[52] Einerseits können die Schliefer als die Schwestergruppe der beiden anderen Linien aufgefasst werden. In diesem Fall werden die Elefanten und Seekühe in die gemeinsame Übergruppe der Tethytheria eingegliedert. Andererseits stehen die Schliefer den Elefanten gegenüber, während die Seekühe die Position der Außengruppe einnehmen.[53][54] Als dritte Konstellation kommt eine engere Bindung der Schliefer an die Seekühe in Betracht mit den Elefanten als Schwestertaxon zu beiden.[55][56] Den molekulargenetischen Untersuchungen zufolge liegt der Ursprung der Afrotheria in der Oberkreide vor 90,4 bis 80,9 Millionen Jahren. Rund 15 Millionen Jahre später spaltete sich diese Ursprungsgruppe in die beiden heutigen Hauptlinien auf. Die Schliefer differenzierten sich im Paläozän vor etwa 60 Millionen Jahren heraus, was in etwa mit dem Fossilbericht übereinstimmt. Dabei stellen aber die Vorfahren der heutigen Schliefer eine relativ junge Entwicklungslinie dar, die erst im Unteren Miozän vor etwa 20 Millionen Jahren erschien.[55][54][57]
Innere Systematik
Innere Systematik der rezenten Schliefer nach Maswanganye et al. 2017[58]
|
Die Ordnung der Hyracoidea setzt sich rezent nur aus der Familie der Procaviidae zusammen und ist dadurch monotypisch. Besondere Kennzeichen finden sich neben dem charakteristischen äußeren Erscheinungsbild der Tiere in dem reduzierten Gebiss und in einzelnen besonderen Zahnmerkmalen.[59] In der Regel werden innerhalb der Procaviidae mit dem Klippschliefer als Nominatform, dem Buschschliefer und den Baumschliefern drei Gattungen differenziert. Sie weichen anatomisch unter anderem in der Zahnanzahl, der Höhe der Zahnkronen der Mahlzähne beziehungsweise in der Ausprägung oder dem Fehlen eines Postorbitalbogens oder eines Scheitelkamms voneinander ab. Zudem bestehen Unterschiede in der Lebensweise. Die ersten beiden Gattungen enthalten nur jeweils eine Art, die letzte insgesamt vier. Die genaue Artanzahl ist umstritten, generell werden die heutigen Schliefer als taxonomisch zu stark zusammengefasst angesehen.[60][61] Auch besteht die Möglichkeit, dass einzelne Arten noch verborgen leben und bisher nicht beschrieben wurden.[62]
Fossil sind noch wenigstens fünf weitere Familien anerkannt. Die Geniohyidae setzen sich aus weitgehend ursprünglichen, kleinen Formen mit noch verlängertem Schädel und wenig spezialisierten Zähnen zusammen. Die nahe mit diesen verwandten Namahyracidae zeichnen sich durch sehr niederkronige Zähne mit voluminösen Höckerchen auf der Kaufläche der Molaren aus. Die Titanohyracidae, die fast zeitgleich auftraten, waren demgegenüber mit einfachen Leisten auf den Backenzähnen schon spezialisierter. Sie brachten zudem die ersten Riesenformen der Schliefer hervor. Die Saghatheriidae wiederum umfassten überwiegend kleinere Mitglieder, die schon deutliche Längenkürzungen im Schädel besaßen. Innerhalb der Saghatheriidae findet sich möglicherweise die Ursprungsgruppe für die Entwicklung der Procaviidae und auch der Pliohyracidae. Letztere sind durch stark hochkronige Backenzähne charakterisiert, ebenso wie durch eine massive Körpergrößenzunahme während der Stammesgeschichte. Die sechs Familien werden manchmal in zwei verschiedenen Unterordnungen aufgeteilt, wobei die Geniohyidae, Namahyracidae und Titanohyracidae dann innerhalb der Pseudhippomorpha, die anderen innerhalb der Procaviamorpha stehen.[63][64] Die beiden höherrangigen Gruppen innerhalb der Schliefer gehen auf Thomas Whitworth aus dem Jahr 1954 zurück, der damit die langschnauzigen frühen Formen von den kurzschnauzigen späteren abtrennte. Whitworth wählte die Bezeichnung Pseudhippomorpha, da ihn die oberen hinteren Zähne der stammesgeschichtlich älteren Schliefer an die der ursprünglichen Pferde erinnerten, während die Procaviamorpha eher Zähne vergleichbar den Nashörnern haben.[65]
Teilweise werden alle nicht-procaviiden Schliefer innerhalb einer Familie geführt, den Pliohyracidae. In diesem Gliederungssystem besitzen die anderen Familien dann den Status einer Unterfamilie. Dieses Schema wurde mehrfach kritisiert, da die Variationsbreite der ausgestorbenen Formen wesentlich größer ist als die der heute lebenden. So stehen auch die Formen des Mittleren und Oberen Miozäns den heutigen Schliefern deutlich näher als den frühen Formen des Eozäns und Oligozäns.[66][63]
Überblick über die Familien und Gattungen der Schliefer
Die Ordnung der Schliefer wird in fünf Familien untergliedert mit mehr als zwei Dutzend Gattungen, drei davon rezent. Die hier vorgestellte Gliederung basiert auf Martin Pickford et al. 1997[63] und D. Tab Rasmussen et al. 2010,[59] berücksichtigt weiterhin auch neuere Entwicklungen:[67][68][69][70][71][64]
- Ordnung: Hyracoidea Huxley, 1869
- Unterordnung: Pseudhippomorpha Whitworth, 1954
- Rukwalorax Stevens, O’Connor, Roberts & Gottfried, 2009
- Familie: Namahyracidae Pickford, 2015
- Dimaitherium Barrow, Seiffert & Simons, 2010
- Namahyrax Pickford, Senut, Morales, Mein & Sanchez, 2008
- Seggeurius Crochet, 1986
- Familie: Geniohyidae Andrews, 1906
- Geniohyus Andrews, 1904
- Bunohyrax Schlosser, 1910
- Pachyhyrax Schlosser, 1910
- Brachyhyrax Pickford, 2004
- Familie: Titanohyracidae Matsumoto, 1926
- Titanohyrax Matsumoto, 1921
- Antilohyrax Rasmussen & Simons, 2000
- Afrohyrax Pickford, 2004
- Rupestrohyrax Pickford, 2015
- Unterordnung: Procaviamorpha Whitworth, 1954
- Familie: Saghatheriidae Andrews, 1906
- Microhyrax Sudre, 1979
- Saghatherium Andrews & Beadnell, 1902
- Selenohyrax Rasmussen & Simons, 1988
- Thyrohyrax Meyer, 1973
- Megalohyrax Andrews, 1903
- Regubahyrax Pickford, 2009
- Familie: Pliohyracidae Osborn, 1899
- Meroëhyrax Whitworth, 1954
- Prohyrax Stromer, 1924
- Parapliohyrax Lavocat, 1961
- Pliohyrax Osborn, 1899
- Kvabelihyrax Gabunia & Vekua, 1966
- Hengduanshanhyrax Chen, 2003
- Sogdohyrax Dubrovo, 1978
- Postschizotherium von Koenigswald, 1932
- Familie: Procaviidae Thomas, 1892
- Heterohyrax Gray, 1868 (Buschschliefer, einschließlich einer rezenten Art)
- Dendrohyrax Gray, 1868 (Baumschliefer, einschließlich vier rezente Arten)
- Procavia Storr, 1780 (Klippschliefer, einschließlich einer rezenten Art)
- Gigantohyrax Kitching, 1965
Forschungsgeschichte
Taxonomie



Die Erforschung der Schliefer reicht bis in das ausgehende 18. Jahrhundert zurück. Die erste wissenschaftliche Beschreibung eines Schliefers geht auf Peter Simon Pallas (1741–1811) zurück, der im Jahr 1766 den Klippschliefer als Cavia capensis benannte.[72] Das Wort Cavia ist eigentlich karibischen Ursprungs und bezeichnet die Meerschweinchen, deren Hauptverbreitungsgebiet in Südamerika liegt. Die für ein afrikanisches Tier eher ungewöhnliche Namensgebung veranlasste Gottlieb Conrad Christian Storr (1749–1821) im Jahr 1780 den Gattungsnamen durch Procavia auszutauschen.[73] Nur drei Jahre darauf kreierte Johann Hermann (1738–1800) die Gattung Hyrax für den Klippschliefer.[74] Hyrax wiederum ist dem Griechischen entlehnt (ὕραξ hýrax) und bedeutet „Spitzmaus“. Das Wort verbreitete sich schnell und wurde in der Folgezeit vielfach verwendet. In der Regel wurde es auf alle Schliefer bezogen. Auf ihm basieren auch die weiteren Gattungsbezeichnungen Heterohyrax für den Buschschliefer und Dendrohyrax für die Baumschliefer, die beide von John Edward Gray (1800–1875) aus dem Jahr 1868 stammen.[75] Ebenso geht auf Hyrax die Familienbezeichnung Hyracidae zurück, bereits 1821 ebenfalls von Gray eingeführt. Er definierte die Schliefer folgendermaßen: nose and ears short; toes four in front, three behind; hoofs small, round, except the inner-hinder toes, which have an arched claw; teeth cutting, two above, four below; canine, two below, two above, when young; stomach two-lobed, caecum large. („Nase und Ohren kurz; vier Zehen vorne, drei hinten; Hufe klein, rund, mit Ausnahme der inneren hinteren, welche gebogene Krallen haben; Schneidezähne, zwei oben, vier unten; Eckzahn, im Jugendstadium zwei unten, zwei oben; Magen zweikammerig, Blinddarm groß“).[76] Thomas Huxley (1825–1895) schuf dann 1869 die Bezeichnung Hyracoidea für die Ordnung der Schliefer. Huxley verwendete dabei eine Definition, die stark der von Gray ähnelte. Die Ordnung enthielt damals Hyrax als einzige Gattung.[77] Erstmals 1886 wies Fernand Lataste darauf hin, dass die Gattungsbezeichnung Procavia drei Jahre vor Hyrax eingeführt worden war.[78] Im Folgenden führte dies Oldfield Thomas (1858–1929) im Jahr 1892 weiter aus und hob noch einmal die Namenspriorität von Procavia gegenüber Hyrax hervor. Er schlug daraufhin auch die Familienbezeichnung Procaviidae vor, da diese im Gegensatz zu Hyracidae auf einem gültigen Gattungsnamen fußte. Die Ordnung Hyracoidea behielt Thomas bei, da für diese keine anerkannte Gattung als Namensgrundlage notwendig ist.[79]
Die Entdeckung der fossilen Schliefer
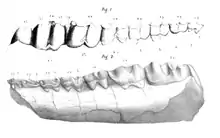
Schliefer sind der Wissenschaft zwar schon wenigstens seit der zweiten Hälfte des 18. Jahrhunderts bekannt, fossile Formen wurden aber relativ spät entdeckt. Forschungsgeschichtlich frühe Funde sind aus Griechenland belegt. Diese wurden in Pikermi in der Region Attika seit der zweiten Hälfte des 19. Jahrhunderts aufgedeckt. Albert Gaudry publizierte 1867 einen ersten umfangreichen Fossilkatalog der Lagerstätte und stellte dabei zwei Unterkiefer vor, die er der Gattung Leptodon zuwies. Deren Verwandtschaftsverhältnisse waren zu dem damaligen Zeitpunkt nicht bekannt, Gaudry vermutete aber eine enge Bindung an die Nashörner.[80] Mehr als 30 Jahre später stellte Henry Fairfield Osborn den Gesichtsschädel eines Schliefers vor, der von der griechischen Insel Samos stammt und sich in der Sammlung der Krupp-Familie befand. Osborn erkannte die Zugehörigkeit zu den Schliefern und kreierte für den Fund die neue Gattung Pliohyrax.[81] Noch im gleichen Jahr belegte Max Schlosser, dass die Reste sowohl von Pikermi als auch von Samos die gleiche Gattung repräsentieren (Leptodon als Gattungsname ist allerdings durch einen Vertreter der Greifvögel präokkupiert, weswegen die Funde heute unter Pliohyrax geführt werden).[82] Sie stellten mit einer Datierung in das Obere Miozän die damals ältesten bekannten Nachweise von Schliefern dar.[7][83]
Nahezu zeitgleich kamen Funde von Schliefern im Fayyum im nördlichen Ägypten zum Vorschein, die aber mit einer Altersstellung vom Oberen Eozän bis zum Unteren Oligozän deutlich älter sind. Hier war Hugh John Llewellyn Beadnell seit dem Ende des 19. Jahrhunderts als Geologe aktiv und sammelte Fossilien. Bereits 1902 stellt er gemeinsam mit Charles William Andrews den Schädel eines Schliefers vor, den sie mit Saghatherium bezeichneten.[84] Im Winter des gleichen Jahres entdeckte Beadnell einen Oberkieferrest und einen Unterkiefer weiterer Schliefer. Beide wurden darauffolgend von Andrews beschrieben. Ersteren benannte er aufgrund seiner Größe Megalohyrax,[85] für letzteren schuf er die Gattung Geniohyus. Die höckerigen Zahnstruktur verleitete Andres allerdings dazu, die Form zu den Schweinen zu gruppieren.[86] Der Fehler wurde erst 1911 von Max Schlosser bei seiner Aufarbeitung der Fayyum-Fossilien verschiedener Sammlungen in Deutschland erkannt. Vor allem Schlossers Arbeit und später, 1926, die von Hikoshichiro Matsumoto erbrachten eine vielfältige Schliefer-Gemeinschaft im Fayyum, die die der heutigen Vertreter bei weitem übertraf.[87][88][7]
In der nachfolgenden Zeit kamen dann in anderen Regionen Afrikas Fossilformen der Schliefer zum Vorschein, so etwa in den 1920er Jahren in Namibia oder in den 1930er Jahren in Südafrika. Bei den letzteren handelte es sich um den ersten Nachweis ausgestorbener Vertreter der heutigen Arten.[89] Auch in Asien gelangen in dieser Zeit erste Belege heute nicht mehr bestehender Linien der Schliefer.[66][83]
Schliefer in Südamerika?
Eine Kontroverse entstand im Übergang vom 19. zum 20. Jahrhundert mit der Ansicht einer ursprünglichen Verbreitung der Schliefer auch in Südamerika. Bereits Theophil Noack hatte 1894 auf die Ähnlichkeit der Schliefer mit den südamerikanischen Notoungulata hingewiesen. Bei den Notoungulata handelt es sich um eine sehr formenreiche, ausgestorbene Gruppe, die heute allgemein zu den „Südamerikanischen Huftieren“ gestellt wird. Noack bezog sich in seiner Schrift auf Florentino Ameghino, der fünf Jahre zuvor eine umfangreiche Fossiliensammlung aus Argentinien vorgestellt hatte. Einige der beschriebenen Schädel erinnerten Noack dabei an Schliefer.[90] Ameghino teilte offenbar diese Auffassung und schuf im Jahr 1897 die Familie der Archaeohyracidae, in die er unter anderem Archaeohyrax stellte. Die Familie sah er als Vorläufer der Schliefer an, die sich seiner Meinung nach in Südamerika entwickelt hatten.[91] Später führte er noch Gattungen wie Pseudhyrax oder Eohyrax ein. Seine Position über die Einbeziehung der Archaeohyracidae in die Schliefer bekräftigte Ameghino noch einmal im Jahr 1906 in einem Überblickswerk zur südamerikanischen Faunengeschichte.[92]
Zahlreiche Forscher jener Zeit standen dieser Interpretation kritisch gegenüber. Richard Lydekker verwies bereits 1896 in einer Antwort auf Noacks Aussagen auf die unterschiedlich gebauten Handgelenke bei Schliefern und Notoungulata hin, deren Wurzelknochen bei ersteren seriell, bei letzteren wechselseitig angeordnet sind. Auch brachte er paläogeographische Argumente gegen eine derartige Verwandtschaftsbeziehung hervor.[93] Max Schlosser sprach sich zunächst für diese verwandtschaftliche Beziehung aus,[82] kritisierte dann aber in seiner Aufarbeitung der Fossilien aus dem Fayyum im Jahr 1911 Ameghino und wandte sich gegen dessen Auffassung.[87] Die Meinung einer engen Verwandtschaft der Notoungulata und der Schliefer wird heute nicht mehr geteilt, auch wenn einzelne Forscher bestimmte anatomische Ähnlichkeiten zwischen den Afrotheria und den „Südamerikanischen Huftieren“ herausgearbeitet haben.[94] Molekulargenetische Untersuchungen machen eine engere Beziehung der Notoungulata zu den Unpaarhufern wahrscheinlicher.[95][96] Aus heutiger Sicht sind die Archaeohyracidae eine weitgehend auf das Eozän beschränkte Gruppe früher Vertreter der Notoungulata, die sich durch eine gewisse Hochkronigkeit der Zähne auszeichnen. Aus eher traditionellen Gründen werden heute immer noch Gattungen der Archaeohyracidae mit einem Namenszusatz -hyrax eingeführt, so etwa 2008 mit Punohyrax.[97] Eine Studie aus dem Jahr 2021 vereint allerdings die Notoungulata einschließlich der Archaeohyracidae zusammen mit einem Teil der übrigen „Südamerikanischen Huftiere“ in dem übergeordneten Taxon der Sudamericungulata und weist dieses als ausgestorbene Schwestergruppe der Schliefer aus.[98]
Die systematische Stellung der Schliefer – eine forschungsgeschichtliche Debatte
Im Laufe ihrer Forschungsgeschichte wurden die Schliefer unterschiedlichen systematischen Verwandtschaftsverhältnissen zugewiesen. Pallas und Storr hielten sie in der zweiten Hälfte des 18. Jahrhunderts für Vertreter der Nagetiere. Die Ansicht wurde aber zu diesem Zeitpunkt nicht in jedem Fall geteilt.[99] Johann Karl Wilhelm Illiger schuf Anfang des 19. Jahrhunderts eine eigene Familie unter der Bezeichnung Lamnunguia für die Schliefer und übersetzte diese mit „Nagelhufer“, bezogen auf die charakteristische Hufbildung.[100] Im gleichen Zeitraum beschrieb Georges Cuvier einen Schädel des Klippschliefers und erkannte eine nähere Beziehung zu anderen Huftieren.[101] Daraufhin ordnete er sie (unter der Bezeichnung Hyrax) zu der von ihm benannten Gruppe der Pachydermes (Dickhäuter), in der er unter anderem auch die Rüsseltiere, Nashörner, Tapire, Flusspferde und Pekaris verwies. Cuvier sah die Schliefer dabei in einer Vermittlerrolle zwischen den Tapiren und Nashörnern. Unterstützt wurde diese vermutete nähere Verwandtschaft dadurch, dass die Schliefer Backenzähne besitzen, die in etwa denen von Nashörnern ähneln.[102] Nachdem sich das Konzept der „Dickhäuter“ nicht durchgesetzt hatte, schloss Richard Owen die Schliefer in seiner Erstbeschreibung der Unpaarhufer im Jahr 1848 in diese Gruppe mit ein, während Othniel Charles Marsh sie in seinen konzeptionell ähnlichen Mesaxonia nicht berücksichtigte.[103][104] Die Annahme einer näheren Verwandtschaft der Schliefer mit den Unpaarhufern hielt sich noch bis in die 1980er Jahre. So galten die Schliefer innerhalb der Perissodactyla als Schwestergruppe der Mesaxonia, die die Unpaarhufer im heutigen und traditionellen Sinne einnahmen (Nashörner, Pferde und Tapire).[103]
Parallel zu dieser Annahme wurde auch eine nähere Verwandtschaft zu den Rüsseltieren und Seekühen postuliert, was 1870 erstmals durch Theodore Gill Erwähnung fand. Allerdings formulierte Gill keine Bezeichnung für dieses Verwandtschaftsverhältnis (zuvor hatte 1834 Henri Marie Ducrotay de Blainville die Rüsseltiere und Seekühe unter dem Begriff Gravigrades vereint; diese Bezeichnung wurde im 19. Jahrhundert aber eher mit den Bodenfaultieren in Verbindung gebracht).[105] Die unschlüssige Zuweisung der Hyracoidea zeigt sich auch in Edward Drinker Copes Bezeichnung Taxeopoda aus dem Jahr 1882, in die er die Schliefer aufgrund ihres besonderen Fußskeletts zusammen mit den Condylarthra, urtümlichen, heute ausgestorbenen Huftieren, gruppierte,[106] während William Henri Flower und Richard Lydekker 1891 die Schliefer in dem übergeordneten Taxon Subungulata sahen, zusammen mit den Rüsseltieren, den Condylarthra, den sogenannten Amblypoda (Pantodonta und Dinocerata) und südamerikanischen Huftieren.[25] Max Schlosser griff 1923 die Idee der Subungulata auf und vereinte unter diesen neben den Schliefern und den Rüsseltieren auch die Seekühe und die Embrithopoda. Im Jahr 1945 führte George Gaylord Simpson die Bezeichnung Paenungulata ein, unter der er die vorangegangenen Klassifizierungsversuche von Cope, Lydekker und Flower und vor allem Schlosser vereinte. Die Nichtweiterführung der Subungulata im Sinne Schlossers – der Begriff hatte sich in der Folgezeit sehr gut etabliert – war darauf zurückzuführen, dass er bereits 1811 von Illiger für eine Gruppe der Nagetiere, speziell der Meerschweinchenverwandten, verwendet worden war.[100][107][104]
In der zweiten Hälfte des 20. Jahrhunderts kam die Debatte der näheren Verwandtschaft der Schliefer entweder mit den Rüsseltieren und Seekühen oder mit den Unpaarhufern wieder auf. Dazu wurden verschiedenste Argumente ausgetauscht. Einige Forscher sahen in der speziellen taxeopoden, also seriellen, Anordnung der Hand- und Fußwurzelknochen einen Hinweis auf eine nähere Verwandtschaft sowohl mit den Condylarthra als auch mit den Rüsseltieren, bei denen dieses Merkmal ebenfalls auftritt. Die meisten anderen Huftiere besitzen dagegen eine zueinander alternierende Anordnung der Knochen des Hand- und Fußgelenkes (diplarthrale Anordnung). Doch sahen andere Forscher die Taxeopodie der Schliefer und Rüsseltiere als konvergente Entwicklung an und befürworteten eine Stellung in der Nähe der Unpaarhufer. Dafür sollte unter anderem die sackartige hintere Ausbildung der Ohrtrompete (Eustachi-Röhre) des Mittelohres sprechen, dass sowohl ein Merkmal der Schliefer als auch der Unpaarhufer ist. Somit konnte die Frage auf morphologisch-anatomischen Weg nicht eindeutig geklärt werden, da für beide Möglichkeiten Argumente vorlagen.[16][13][104] Bereits Anfang der 1980er Jahre ergaben sich durch innovative Forschungsansätze neue Einblicke in die verwandtschaftlichen Beziehungen der Schliefer zu anderen Tiergruppen. So verwiesen Untersuchungen von Strukturproteinen die Schliefer in die Nähe der Seekühe, der Elefanten und des Erdferkels.[108][109] Dies konnte Ende der 1990er Jahre mit Hilfe von molekulargenetischen Analysen bestätigt werden. Diese zeigten auf, dass die Schliefer zusammen mit den Elefanten und Seekühen sowie mit dem Erdferkel und darüber hinaus auch mit den Tenreks, den Goldmullen und den Rüsselspringern eine Einheit bilden basierend auf genetischen Gemeinsamkeiten, die Afrotheria genannt wurde.[110][111][112] Zahlreiche weitere Untersuchungen unterstützen diese Ansicht bisher.[53][54][57]
Stammesgeschichte
Adaptive Radiation
Die Schliefer sind eine sehr alte Ordnung und haben ihren Ursprung in Afrika. Im Paläogen, als Afrika eine isolierte Insel ohne Verbindung zu anderen Festlandsmassen war, nahmen sie die Nische der heutigen Paarhufer und Unpaarhufer ein, die erst im Neogen beginnend vor etwa 23 Millionen Jahren einwanderten.[83] Dies hatte zur Folge, dass die Schliefer vor allem im Paläogen eine extrem hohe Formenvielfalt aufwiesen, die von kleinen, hasengroßen Tieren bis hin zu solchen mit den Ausmaßen eines kleineren Nashorns reichten. Dabei waren sie sowohl an eine schwere Gangart angepasst, brachten aber auch schnellläufige oder sich mit Sprüngen fortbewegende Vertreter hervor, ebenso wie einige eine baumkletternde Lebensweise verfolgten. Neben den ebenfalls aus Afrika stammenden Rüsseltiere stellen die Schliefer somit eine der bedeutendsten endemischen Gruppen des Kontinentes dar. Innerhalb der Stammesgeschichte der Schliefer können drei verschiedene Radiationsphasen unterschieden werden. Die erste umfasst die frühesten Formen des Paläogen mit den Familien der Namahyracidae, Geniohyidae, Saghatheriidae und Titanohyracidae, die eine hohe ökologische und morphologische Diversität erreichten. Diese formten ein Schlüsselelement in den frühtertiären Säugetiergemeinschaften Afrikas und gelten zudem als wichtige Anzeiger für die Biostratigraphie. Die zweite Radiationsphase beschränkt sich auf die mit besonders hochkronigen Zähnen ausgestatteten Pliohyracidae und begann im ausgehenden Oligozän. Sie stellte den Grundstock für die späteren eurasischen Schlieferformen, die erstmals im Miozän nachweisbar sind und später enorme Körpergrößen erreichten. Im Oberen Miozän erfolgte die dritte, weitaus weniger Auswirkung erzielende Radiationsphase. Diese durchliefen die heute noch bestehenden Procaviidae, deren Vertreter sich aufgrund des ansteigenden und starken Konkurrenzdruckes, verursacht durch die nun in Afrika dominierenden eurasischen Huftiere, in randliche ökologische Nischen einnisteten. Dadurch konnten diese modernen Schliefer der einst formenreichen Hyracoiden bis in die heutige Zeit überleben.[113][59]
Eozän
Das früheste gesicherte Auftreten der Schliefer datiert in den Übergang vom Unteren zum Mittleren Eozän vor etwa 50 Millionen Jahren. Bedeutend sind hier die Funde von El Kohol am Südrand des Atlas in Algerien. Es handelt sich überwiegend um Unterkieferreste und isolierte Zähne, die der Gattung Seggeurius aus der Familie der Geniohyidae zugewiesen werden. Charakteristisch war das bunodonte (höckerig gestaltete) Kauflächenmuster der Molaren, was die Gattung als sehr urtümlich innerhalb der Schliefer einstuft.[114][115] Wahrscheinlich handelt es sich um einen Vertreter der Namahyracidae.[64] Noch älter könnte ein isolierter hinterer Backenzahn aus dem Ouled-Abdoun-Becken in Marokko sein, der dem Unteren Eozän angehört und eventuell gleichfalls von Seggeurius stammt.[116] Ähnlich alt wie El Kohol sind die Funde von Chambi in Tunesien, die neben einigen kleineren Schlieferformen[117] mit Titanohyrax auch einen ersten Vertreter der Titanohyracidae erbrachten; der Vertreter erreichte aber noch nicht die riesigen Ausmaße seiner späteren Verwandten.[118] Noch im Übergang vom Mittleren zum Oberen Eozän erscheint Bunohyrax, überliefert anhand einiger Zähne aus Bir el-Ater in Algerien, das zu den eher urtümlichen Formen mit einfach gestalteten Kauflächenmustern auf den Molaren gehört und dadurch mit Seggeurius näher verwandt ist.[119] Aus dem überaus fossilreichen und bedeutenden Fayyum in Ägypten stammt Dimaitherium, ein kleiner Schliefer aus der Qasr-el-Sagha-Formation, der möglicherweise ein agiler Kletterer war. Sein Alter wird auf rund 37 Millionen Jahre geschätzt.[68] Nach anfänglich unklaren Verwandtschaftsbeziehungen wird die Gattung seit dem Jahr 2015 zur Familie der Namahyracidae gestellt.[64] Die Gebel-Qatrani-Formation des Fayyum ist von herausragender Bedeutung. Sie datiert allgemein zwischen 34 und 28 Millionen Jahren, womit die unteren Abschnitte noch in das ausgehende Eozän zu stellen sind. Einen bisher singulären Auftritt in diesem Zeitraum hat Antilohyrax, ein Vertreter der Titanohyracidae. Von ihm konnten mehrere vollständige Schädel geborgen werden.[120][121] Andere bedeutende Gattungen haben in diesem unteren Formationsabschnitt ihren teilweise ersten Nachweis, wie etwa Saghatherium oder Thyrohyrax, beide aus der Gruppe der Saghatheriidae.[122][123][59]
Abseits all dieser nordafrikanischen Fundstellen ist bereits im Mitteleozän Namahyrax aus dem Sperrgebiet von Namibia über ein Fragment des Vorderschädels nachgewiesen, das extrem niederkronige Zähne besaß und wohl in näherer Beziehung zu Dimaitherium und Seggeurius stand. Ein zusätzlich aufgefundener Unterkiefer sticht durch seine lang ausgezogene Symphyse hervor, wodurch die vorderen Zähne deutlich von den Backenzähnen getrennt waren. Wahrscheinlich besaß Namahyrax sensible und bewegliche Lippen, was auf eine spezielle Ernährungsweise schließen lässt.[70][67][124][125] In der gleichen Region konnte das nur wenig jüngere, aber deutlich größere Rupestrohyrax anhand eines Schädels beschrieben werden, dass aber eine Verwandtschaftsgruppe mit Titanohyrax bildet.[64]

Insgesamt erscheinen diese frühen Schliefer des Eozäns schon sehr vielfältig mit unterschiedlichsten Anpassungserscheinungen. Vor allem der Bau der Backenzähne, die zu den häufigsten Fossilresten der frühen Schliefer gehören, zeigt verschiedenste Nahrungspräferenzen und damit eine Anpassung an unterschiedliche Lebensweisen an. So verfolgten die archaischen Geniohyidae und Namahyracidae mit ihrem bunodonten Kauflächenmuster eine eher allesfresserische Ernährung ähnlich den heutigen Schweinen. Dem gegenüber zeigen die saghatheriiden und titanohyraciden Schliefer mit zwei querstehenden Schmelzleisten (bilophodont) auf den Kauoberflächen schon stärkere Spezialisierungen. Demnach war das riesenhafte Titanohyrax ein strikter Blattfresser. Das wesentlich kleinere Antilohyrax bevorzugte allgemein weiche Pflanzenkost, erkennbar an dem selenodonten Überbau der Zähne, der an die Kauflächenmuster heutiger Wiederkäuer erinnert. Gemäß seinem Bewegungsapparat war Antilohyrax ein sehr schnellläufig und wohl auch zum springen befähigt. Saghatherium wiederum vertilgte aufgrund eines massiv gestalteten Unterkiefers auch härtere Pflanzennahrung wie Samen und Nüsse.[126] Thyrohyrax war ein sehr kleiner Vertreter der frühen Hyracoiden und wog rund 6,5 kg, er liegt damit in der Variationsbreite der heutigen Schliefer. Er stellte einen agilen Kletterer dar, sein Schädelbau und die Zahngestaltung erinnern frappierend an die heutigen Baumschliefer, die gegenüber den anderen rezenten Formen eine längere Schnauze und niederkronigere Zähne aufweisen. Möglicherweise gehört Thyrohyrax zu einer größeren Ursprungsgruppe kleiner Hyracoiden, aus denen die späteren procaviiden Schliefer entstanden.[68][123] Bei zahlreichen frühen Schliefern wie etwa Thyrohyrax und Saghatherium tritt eine anatomische Besonderheit in Form von kammerartigen Hohlräumen im Unterkiefer auf, die bei heutigen Schliefern nicht belegt ist. Über die Funktion der Kammern wird diskutiert, möglicherweise stehen sie im Zusammenhang mit der Lautgebung. Da die Kammern scheinbar nur bei männlichen Tieren ausgebildet sind, drücken sie womöglich einen Sexualdimorphismus aus.[127]
Oligozän

Eine große Vielfalt erreichten die Schliefer im Oligozän mit mehr als einem Dutzend nachgewiesenen Gattungen aus vier Familien. Die Reichhaltigkeit spiegelt sich vor allem in der Gebel-Qatrani-Formation im Fayyum-Becken wider. So treten die aus den unteren Sequenzen der Gesteinsbildung bekannten Formen wie Bunohyrax, Saghatherium oder Thyrohyrax auf, weiterhin erscheinen Pachyhyrax, ein vermutlich semi-aquatisch lebender Schliefer, oder Megalohyrax, eine große Form von 160 kg Gewicht und 39 cm langem Schädel.[126][128] Titanohyrax übertraf an Körpergröße in jener Zeit alle anderen Schliefer und erreichte ein Gewicht von 800 bis 1000 kg, ist aber insgesamt eher selten belegt.[129] Bisher einmalig sind die Funde eines nahezu vollständig artikulierten Skelettes und mehrerer weiterer Teilskelette, die in Gebel al Hasawnah in Libyen zum Vorschein kamen; sie gelten als die bisher einzigen eines paläogenen Schliefers überhaupt. Die Skelette repräsentieren Saghatherium und erlaubten erstmals die vollständige Rekonstruktion eines kleinen ausgestorbenen Hyracoiden, dessen Körperbau dem der heutigen Formen deutlich ähnelte. Dadurch konnte anhand des Fußbaus die taxeopode Anordnung der Wurzelknochen erstmals bei den frühen Schliefern vollumfänglich dokumentiert werden. Es finden sich aber auch auffallende Unterschiede: So trugen die frühen Schliefer offensichtlich Krallen, die hufartigen Nägel der heutigen Arten stellen damit wohl spätere Bildungen dar. Außerdem bewegten sich die frühen Schliefer als Zehengänger fort, abweichend vom Sohlengang der rezenten Angehörigen.[130][131] Aus paläobiogegraphischer Sicht hervorzuheben sind die unteroligozänen Funde von Malembo in Angola, die einzelne Zähne von Geniohyus und Pachyhyrax beinhalten, erstere Form war zuvor nur aus dem nordafrikanischen Fayyum-Gebiet dokumentiert.[132][133] Auf ein Alter von rund 33 Millionen Jahren datieren die Erstnachweise von Schliefern auf der Arabischen Halbinsel, die damals mit Afrika noch eine Einheit bildete. So sind von Taqah und Thaytiniti in Oman Reste von Saghatherium und Thyrohyrax geborgen worden.[134]
In der nachfolgenden Zeit sind Schliefer in moderater Vielfalt in Chilga in Äthiopien überliefert, das auf etwa 27 Millionen Jahre datiert. Unter den meist fragmentierten Knochenmaterial dominieren vor allem ältere Formen wie Pachyhyrax, Bunohyrax und Megalohyrax.[135] Im weiteren Verlauf des Oligozän sind nur wenige Fossilfundstellen aus Afrika bekannt. Bedeutend ist hier die Fundstelle Lothidok im nordwestlichen Kenia, welche auf einen Zeitraum von 27 bis 24 Millionen Jahre datiert. Auch hier sind ältere Formen der Geniohyidae mit Brachyhyrax vertreten, die Saghatheriidae werden durch Thyrohyrax und die Titanohyracidae durch Afrohyrax repräsentiert. Als einer der frühesten Vertreter der Pliohyracidae tritt zudem Meroëhyrax auf, dessen Fundmaterial zahlreiche Unterkieferfragmente umfasst. Bei ihm zeichnen sich schon stärker hochkronige Backenzähne ab, was typisch für die Pliohyracidae ist, aber bei den früheren Linien nicht auftritt.[136] Aus der Nsungwe-Formation in Tansania, die auf etwa 25 Millionen Jahren zu datieren ist, stammt der Nachweis von Rukwalorax. Allerdings liegt von diesem bisher nur ein unterer, innerer Schneidezahn vor, der aber charakteristisch und ähnlich wie bei zahlreichen anderen Schliefern auch durch mehrere seitlich aneinander stehende hohe Stifte gekennzeichnet ist, so dass die Zahnkrone kammartig aufgefächert wirkt. In seiner höheren Anzahl an Stiften erinnert der Zahn im Gesamthabitus ein wenig an den des älteren Antilohyrax.[69]
Miozän

Anfänglich traten noch ältere Linien auf, wie Brachyhyrax und Afrohyrax in Kenia und Uganda,[137][138] letzteres hatte aber eine weitaus größere Verbreitung und ist auch auf der Arabischen Halbinsel und im südlichen Afrika nachgewiesen.[139] Im frühesten Mittelmiozän erscheint noch Regubahyrax, ein blätterfressender Vertreter der Saghatheriidae, der anhand mehrerer Unterkieferfragmente aus Libyen beschrieben wurde.[71] Im Miozän kam es jedoch zum Aufstieg der Pliohyracidae, eine hoch spezialisierte Gruppe mit hochkronigen Zähnen, die aus saghatheriiden Schliefern hervorging. Das bereits aus dem Oligozän bekannte, kleine Meroëhyrax tritt auch im Unteren Miozän Ostafrikas auf.[137][140] Ab dem späten Unter- und dem frühen Mittelmiozän sind weitere Formen der Pliohyracidae in Afrika nachgewiesen. Hierzu gehört vor allem das kleine, nur 4,5 kg schwere Prohyrax, von dem zahlreiche Funde im südlichen Afrika zu Tage kamen, so unter anderem Ober- und Unterkieferfragmente in Langental, Elisabethfeld und Arrisdrift in Namibia, an letzterer macht Prohyrax mehr als 40 % aller Fossilfunde aus. Einige stammen auch aus Ostafrika.[63][141] Parapliohyrax, das mit rund 90 kg schon deutlich größer war als seine Vorgänger,[129] tritt erstmals im Mittelmiozän auf und ist mit Funden vom östlichen und nördlichen Afrika belegt.[66] Zu Beginn des Obermiozäns starben die Pliohyracidae in Afrika wieder aus. Der jüngste Fund, ein isolierter Zahn eines unbestimmten Vertreters aus der Namurungule-Formation der Samburu-Berge in Kenia, ist auf etwa 9 Millionen Jahre taxiert.[142][71] Etwa eine Million Jahre älter ist der erste Nachweis procaviider Schliefer, der mit zahlreichen Funden eines erwachsenen Individuums und zweier Jungtiere aus den Otavibergen in Namibia stammt. Sie stellen ausgestorbene Vertreter des heutigen Buschschliefers dar.[143] Dem Baumschliefer werden Funde aus Lemudong’o in Kenia zugewiesen, die ganz an das Ende des Miozäns vor etwa 6,1 Millionen Jahren gestellt werden.[144]

Das Schließen des Tethys-Ozeans und die Entstehung einer Landbrücke nach Eurasien ermöglichte es den Schliefern ähnlich den Rüsseltieren Afrika zu verlassen, allerdings gelang dies ausschließlich Vertretern der Pliohyracidae. Der älteste eindeutige Nachweis eines Hyracoiden außerhalb Afrikas (und der verbundenen Arabischen Halbinsel) ist aus der untermiozänen Pandánassa-Formation bei Mélambes auf Kreta in Griechenland bekannt. Dabei handelt es sich um einen beschädigten Unterkiefer und ein Fersenbein,[145] es ist aber unklar, ob die Funde mit Pliohyrax oder Prohyrax in Verbindung stehen.[83] Pliohyrax wird als Nachfahre von Parapliohyrax angesehen und war im westlichen Eurasien weit verbreitet, die meisten Funde datieren in das Obermiozän. Bedeutende Fossilien stammen aus Casablanca und Can Llobateres in Spanien, sie umfassen meist aber isolierte Zähne und vereinzelt postcraniales Skelettmaterial.[63] Weitere Funde wurden in Frankreich entdeckt, aus dem östlichen Mittelmeerraum sind die Funde von Pikermi und Samos (beides Griechenland) und von verschiedenen Fundstellen in der Türkei hervorzuheben. Ein Unterkiefer stammt wiederum aus Maragheh im Iran. Im Gegensatz zu den Pliohyraciden Afrikas erreichten die Formen in Eurasien eine recht hohe Vielfalt. Sie nahmen im Laufe ihrer Entwicklung stark an Körpergröße zu und entwickelten extrem hochkronige Zähne. Die Zunahme der Kronenhöhe der Backenzähne lässt vermuten, dass die Schliefer jener Zeit einen höheren Anteil an Gras konsumierten.[71]
Pliozän und Pleistozän
Im Pliozän und im Pleistozän war Afrika ausschließlich von Vertreter der Procaviidae besiedelt. Die Procaviidae unterscheiden sich von den anderen Schliefern durch ihr reduziertes Vordergebiss. Vor allem fossile Verwandte des heutigen Klippschliefers sind recht häufig vertreten, die ältesten Fund liegen aus Langebaanweg im südwestlichen Afrika vor und gehören in den Beginn des Pliozäns vor rund 5 Millionen Jahren.[146] Auch die meisten anderen Fossilien beschränken sich weitgehend auf das südliche Afrika, darunter sind einige von bedeutenden Fundstellen wie Swartkrans, Sterkfontein oder Makapansgat. Neben den drei heute noch bestehenden Gattungen tritt zusätzlich im Pliozän noch Gigantohyrax im südlichen und östlichen Afrika auf, der aber im Gegensatz zu seinem Namen nur unwesentlich größer wurde als die heutigen Schliefer.[59]
Abweichend von den relativ kleinen Procaviiden in Afrika entwickelten die Pliohyracidae in Eurasien riesenhafte Formen. Allerdings hatten sie nach dem Ende des Miozäns die europäischen Regionen weitgehend wieder verlassen. Aus dem Pliozän des heutigen Georgiens ist das nahe mit Pliohyrax verwandte Kvabebihyrax überliefert, das etwa 350 kg wog und dessen Gestaltung der Schnauze eine semi-aquatische Lebensweise mit Ernährung von Wasserpflanzen vermuten lässt. Mit einem Alter von rund 3 Millionen Jahren ist es der jüngste Fund im westlichen Eurasien. Ähnlich alt und ebenfalls nahe verwandt ist Sogdohyrax aus Tadschikistan, von welchem aber nur ein fragmentierter Schädels gefunden wurde.[147] Die Vertreter der Gattung erreichten ein Gewicht von bis zu 820 kg. Anhand der Zahnmorphologie wird teilweise angenommen, dass die Gattung synonym zu Pliohyrax ist. In das ausgehende Pliozän datiert weiterhin ein Teilschädel von Hengduanshanhyrax aus der Wangbuding-Formation in der chinesischen Provinz Sichuan.[148] Die östlichste und nördlichste Verbreitung aller Hyracoiden weist Postschizotherium auf, das ursprünglich als Angehöriger der Chalicotheriidae aus der Gruppe der Unpaarhufer galt.[66] Die Gattung stellte mit einem Gewicht von etwa 1170 kg auch den größten Vertreter der Pliohyracidae dar. Ein bisher singulärer Fund stammt aus Udunga westlich des Baikalsees, der als einzige Fundregion für eurasische Hyracoiden nördlich des 45. Breitengrades liegt.[149] Das überwiegende Fossilmaterial ist bisher aus China berichtet worden. Zu den jüngsten Funden zählen fünf Teilschädel und zugehörige Unterkieferfragmente aus dem Tianzhen-Becken in der Provinz Shanxi, die dem Altpleistozän angehören.[150] Offensichtlich starben die Pliohyracidae im Altpleistozän aus, da jüngere Funde bisher nicht bekannt sind. Insgesamt ist die Fossilüberlieferung der Pliohyracidae in Eurasien bisher aber zu lückenhaft, um eine genauere Verbreitungsgeschichte der Gruppe zu erhalten.[71][83][129]
Etymologie
Klippschliefer sind in Palästina seit Jahrtausenden bekannt und werden schon in der Bibel viermal erwähnt.[43] Das hebräische Wort שפן (shaphan) für den Klippschliefer bedeutet so viel wie „der sich verbergende“ und bezieht sich auf seine Lebensweise in Felsklüften. In den meisten Regionen Europas waren Schliefer unbekannt, die verschiedenen Bibelübersetzungen verglichen den shaphan daher meist mit regional vertrauten Tieren wie dem Kaninchen, dem Igel oder dem Murmeltier. Martin Luther übersetzte in seiner Gesamtübersetzung der Bibel 1534 den shaphan mit „Caninchen“, erst die Revision der Lutherbibel von 1912 tauschte die fehlerhafte Deutung durch die Bezeichnung „Klippdachs“ aus.[151]
Der deutsche Trivialname „Schliefer“ kommt vom Wort schliefen für „kriechen“ oder „herumrutschen“. Er wurde bereits 1792 von Johann Christian von Schreber in seinem Werk Die Säugthiere in Abbildungen nach der Natur mit Beschreibungen benutzt.[152] Im englischen Sprachgebrauch ist die umgangssprachliche Bezeichnung hyrax üblich, was sich von Johann Hermanns Gattungsnamen Hyrax ableitet. Dagegen bezieht sich im südlichen Afrika das Wort dassie auf einen Schliefer. Die Bezeichnung wurde von den burischen Kolonisten Südafrikas geprägt, sie geht auf das niederländische Wort das zurück, welches „Dachs“ bedeutet (dassie dementsprechend „Dächschen“). Die französische Sprache wiederum kennt das Wort daman. Dieses geht auf den daman Israel des englischen Klerikers und Reisenden Thomas Shaw zurück, der die Bezeichnung 1738 gebrauchte. Shaw verwies dabei wiederum auf Prospero Alpini, der Ende des 16. Jahrhunderts den Klippschliefer Ägyptens als agnus filiorum Israel („Lamm der Kinder Israels“) erwähnte. Der daman Israel lässt sich dabei eventuell auf ein Missverständnis zurückführen, da im Arabischen die Klippschliefer mit ganamn banî israîl („Vieh der Kinder Israels“) oder rhanem israel („Schaf der Israeliten“) benannt werden.[151][153][5]
Die Gleichsetzung von Kaninchen und Klippschliefer ist aber nicht nur auf die Bibel beschränkt: Die Phönizier hielten einer gängigen Hypothese zufolge um 1000 v. Chr. auf der iberischen Halbinsel gesichtete Kaninchen für Schliefer und gaben ihr den Namen I-Shapan-im („Land der Schliefer“). Die Römer wandelten dies später in den lateinischen Namen Hispania um. Die namensgebenden Tiere waren zu dem Zeitpunkt dort aber schon längst ausgestorben.[151]
Bedrohung und Schutz
Die Schliefer werden hauptsächlich wegen ihres Fleisches und ihrer Felle gejagt. Dies kann zu deutlichen Rückgängen der lokalen Bestände führen. Für die Baumschliefer stellt die Abholzung der Wälder und Fragmentierung der Landschaftsräume eine Bedrohung dar. Der Klippschliefer gilt mitunter in einigen Regionen als Schädling. Die IUCN führt gegenwärtig (2018) lediglich den Bergwald-Baumschliefer in der Vorwarnstufe „potentiell gefährdet“ (near threatened), die anderen Arten sieht die Umweltschutzorganisation als nicht gefährdet an. Alle Vertreter der Schliefer sind in Naturschutzgebieten präsent. Teilweise sind aber Untersuchungen zur tatsächlichen Verbreitung der Tiere notwendig.[154]
Literatur
- Robert M. Eley: The hyrax: a most mysterious mammal. Biologist 41 (4), 1994, S. 141–144
- Herbert Hahn: Von Baum-, Busch- und Klippschliefern, den kleinen Verwandten der Seekühe und Elefanten. Wittenberg, 1959, ISBN 3-7403-0193-7
- Angela Gaylard: Procavia capensis (Pallas, 1766) – Rock hyrax. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 41–50
- Hendrik Hoeck: Family Procaviidae (Hyraxes). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 28–47 ISBN 978-84-96553-77-4
- Ronald M. Nowak: Walker's Mammals of the World. Johns Hopkins University Press, 1999, ISBN 0-8018-5789-9
- Jeheskel Shoshani, Paulette Bloomer und Erik R. Seiffert (einschließlich weiterer Autoren): Order Hyracoidea – Hyraxes. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 148–171
Einzelnachweise
- R. P. Millar: An unusual light shielding structure in the eyes of the dassie (Procavia capensis Pallas) (Mammalia: Hyracoidea). Annals of the Transvaal Museum 28 (11), 1973, S. 203–205
- George Lindsay Johnson: Contributions to the comparative anatomy of the mammalian eye, chiefly based on opthalmoscopic examination. Philosophical Transaction of the Royal Society (B) 194, 1901, S. 1–82 ()
- Angela Gaylard: Procavia capensis (Pallas, 1766) – Rock hyrax. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 41–50
- Hendrik Hoeck: Family Procaviidae (Hyraxes). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 28–47 ISBN 978-84-96553-77-4
- Jeheskel Shoshani, Paulette Bloomer und Erik R. Seiffert (einschließlich weiterer Autoren): Order Hyracoidea – Hyraxes. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 148–171
- Herbert Hahn: Die Familie der Procaviidae. Zeitschrift für Säugetierkunde 9, 1934, S. 207–358 ()
- Grant E. Meyer: Hyracoidea. In: Vincent J. Maglio und H. B. S. Cooke (Hrsg.): Evolution of African Mammals. Harvard University Press, 1978, S. 284–314
- Christine M. Janis: Muscles of the Masticatory Apparatus in Two Genera of Hyraces (Procavia and Heterohyrax). Journal of Morphology 176, 1983, S. 61–87
- Henry Fairfield Osborn: Evolution of mammalian molar teeth to and from the triangular type. New York, 1907 S. 1–250 (S. 185–186) ()
- Robert J. Asher und Thomas Lehmann: Dental eruption in afrotherian mammals. BMC Biology 6, 2008, S. 14 doi:10.1186/1741-7007-6-14
- Yuichi Narita und Shigeru Kuratani: Evolution of the Vertebral Formulae in Mammals: A Perspective on Developmental Constraints. Journal of Experimental Zoology 304 B, 2005, S. 91–106
- Marcelo R. Sanchez-Villàgra, Yuichi Narita, Shigeru Kuratani: Thoracolumbar vertebral number: the first skeletal synapomorphy for afrotherian mammals. Systematics and Biodiversity 5, 2007, S. 1–7
- Martin S. Fischer: Die Stellung der Schliefer (Hyracoidea) im phylogenetischen System der Eutheria. Courier Forschungsinstitut Senckenberg 84, 1986, S. 1–132
- Martin S. Fischer: Die Lokomotion von Procavia capensis (Mammalia, Hyracoidea). Abhandlungen des Naturwissenschaftlichen Vereins in Hamburg NF 33, 1998, S. 1–188
- Edward Drinker Cope: The classification of the ungulate Mammalia. Proceedings of the American Philosophical Society 20, 1882, S. 438–461 ()
- D. Tab Rasmussen, Mario Gagnon und Elwyn S. Simons: Taxeopody in the carpus and tarsus of Oligocene Pliohyracidae (Mammalia: Hyracoidea) and the phyletic position of Hyraxes. PNAS 87, 1990, S. 4688–4691
- J. B. Sale: Unusual External Adaptations in the Rock Hyrax. Zoologica Africana 5 (1), 1970, S. 101–113
- G. E. Dobson: On peculiar structures in the feet of certain species of mammals which enable them to walk on smooth perpendicular surfaces. Proceedings of the Zoological Society of London 1876, S. 525–534 ()
- В. Е. Соколов und Д. Сейл: Структура кожного покрова даманов (Mammalia, Hyracoidea). Зоологический Журнал 60, 1981, S. 1695–1703 und 1849–1860
- P. Stumpf und U. Welsch: Cutaneous Eccrine Glands of the Foot Pads of the Rock Hyrax (Procavia capensis, Hyracoidea, Mammalia). Cells Tissues Organs 171, 2002, S. 215–226
- Diana K. Sarko, Frank L. Rice und Roger L. Reep: Elaboration and Innervation of the Vibrissal System in the Rock Hyrax (Procavia capensis). Brain Behaviour and Evolution 85 (3), 2015, S. 170–188
- J. R. Paul-Murphy, C. J. Murphy, H. F. Hintz, P. Meyers und H. F. Schryver: Comparison of the transit time of digesta and digestive efficiency in the Rock hyrax, the Barbados sheep and the Domestic rabbit. Comparative Biochemistry and Physiology 72A (3), 1982, S. 611–613
- G. Björnhag, G. Becker, R. Heller und W. von Engelhardt: The gastrointestinal tract of the rock hyrax (Procavia habessinica). 1. Morphology and motility patterns of the tract. Journal of Comparative Biochemistry and Physiology 109A (3), 1994, S. 649–653
- G. Björnhag, G. Becker, R. Heller und W. von Engelhardt: The gastrointestinal tract of the rock hyrax (Procavia habessinica). 2. Fluid flow, production of short chain fatty acids and absorption of water and electrolytes. Journal of Comparative Biochemistry and Physiology 111A (3), 1995, S. 433–438
- William Henri Flower und Richard Lydekker: An introduction to the study of mammals living and extinct. London, 1891, S. 1–763 (S. 415–418) ()
- Shoichi Emura, Toshihiko Okumura und Huayue Chen: Morphology of the Lingual Papillae and their Connective Tissue Cores in the Cape Hyrax. Okajimas folia anatomica Japonica 85 (1), 2008, S. 29–34
- M. Eley: The hyrax: a most mysterious mammal. Biologist 41 (4), 1994, S. 141–144
- C. G. Coetzee: The relative position of the penis in Southern African dassies (Hyracoidea) as a character of taxonomic importance. Zoologica Africana 2 (2), 1966, S. 223–224
- Hendrik Hoeck: Systematics of the Hyracoidea: toward a clarification. In: Duane A. Schlitter (Hrsg.): Ecology and taxonomy of African small mammals. Bulletin of the Carnegie Museum of Natural History 6, 1978, S. 146–151
- T. D. Glover und J. B. Sale: The reproductive system of male rock hyrax (Procavia and Heterohyrax). Journal of Zoology 156, 1968, S. 351–362
- Jos M. Milner und Stephen Harris: Habitat use and ranging behaviour of tree hyrax, Dendrohyrax arboreus, in the Virunga Volcanoes, Rwanda. African Journal of Ecology 37 (3), 1999, S. 281–294
- H. N. Hoeck, H. Klein und P. Hoeck: Flexible social organization in hyrax. Zeitschrift für Tierpsychologie 59, 1982, S. 265–298
- L. J. Fourie und M. R.Perrin: Social behaviour and spatial relationship of the rock hyrax. South African Journal of Wildlife Research 17 (3), 1987, S. 91–98
- C. R. Taylor und J. B. Sale: Temperature regulation in the hyrax. Comparative Biochemistry and Physiology 31 (6), 1969, S. 903–907
- J. B. Sale: The Behaviour of the Resting Rock Hyrax in Relation to its Environment. Zoologica Africana 5 (1), 1970, S. 87–99
- J. B. Sale: Observations on Parturition and Related Phenomena in the Hyrax (Procaviidae). Acta Tropica 22, 1965, S. 37–54
- Petrus Bernardus Fourie: Acoustic communication in the rock hyrax, Procavia capensis. Zeitschrift für Tierpsychologie 44, 1977, S. 194–219
- Lee Koren und Eli Geffen: Complex call in male rock hyrax (Procavia capensis): a multi-information distributing channel. Behavioral Ecology and Sociobiology 63, 2009, S. 581–590
- Michael J. DeNiro und Samuel Epstein: Carbon Isotopic Evidence for Different Feeding Patterns in Two Hyrax Species Occupying the Same Habitat. Science 201, 1978, S. 906–908
- Alan Walker, Hendrik N. Hoeck und Linda Perez: Microwear of Mammalian Teeth as an Indicator of Diet. Science 201, 1978, S. 908–910
- J. B. Sale: Daily food consumption and mode of ingestion in the hyrax. Journal of the East African Natural History Society 25 (3), 1966, S. 215–224
- Lev 11,5 , Dtn 14,7 , Spr 30,26 , Ps 104,18
- James Bruce: Travels to discover the source of the Nile: in the years 1768, 1769, 1770, 1771, 1772, and 1773. Vol. VI. Dublin, 1790 S. 1–286 (S. 171–180) (); deutsch: Reisen zur Entdeckung der Quellen des Nils in den Jahren 1768. 1769. 1770. 1771 und 1772. Band V. Leipzig, 1791, S. 1–384 (S. 145–152) ()
- H. Hendrichs: Wiederkauen bei Klippschliefern und Känguruhs. Naturwissenschaften 50 (12), 1963, S. 454–455
- H. N. Hoeck: Population dynamics, dispersal and genetic isolation in two species of hyrax (Heterohyrax brucei and Procavia johnstoni) on habitat islands in the Serengeti. Zeitschrift für Tierpsychologie 59, 1982, S. 177–210
- Ronald E. Barry: Synchronous parturition of Procavia capensis and Heterohyrax brucei during drought in Zimbabwe. South African Journal of Wildlife Research 24 (1/2), 1994, S. 1–5
- W. B. Neaves: The Annual Testicular Cycle in An Equatorial Colony of Lesser Rock Hyrax, Heterohyrax brucei. Proceedings of the Royal Society of London. Series B, Biological Sciences 206 (1163), 1979, S. 183–189
- L. J. Fourie und M. R.Perrin: Some new data on the reproductive biology of the rock hyrax. South African Journal of Wildlife Research 17 (4), 1987, S. 118–122
- T. M. Caro und R. M. Alawi: Comparative aspects of behavioural development in two species of free-living hyrax. Behaviour 95, 1984, S. 87–109
- Steven Heritage, Erik R. Seiffert und Matthew R. Borths: Recommended fossil calibrators for time-scaled molecular phylogenies of Afrotheria. Afrotherian Conservation 17, 2021, S. 9–13
- Rodolphe Tabuce, Laurent Marivaux, Mohammed Adaci, Mustapha Bensalah, Jean-Louis Hartenberger, Mohammed Mahboubi, Fateh Mebrouk, Paul Tafforeau und Jean-Jacques Jaeger: Early Tertiary mammals from North Africa reinforce the molecular Afrotheria clade. Proceedings of the Royal Society Series B 274, 2007, S. 1159–1166
- Matjaz Kuntner, Laura J. May-Collado und Ingi Agnarsson: Phylogeny and conservation priorities of afrotherian mammals (Afrotheria, Mammalia). Zoologica Scripta 40 (1), 2011, S. 1–15
- Robert W. Meredith, Jan E. Janečka, John Gatesy, Oliver A. Ryder, Colleen A. Fisher, Emma C. Teeling, Alisha Goodbla, Eduardo Eizirik, Taiz L. L. Simão, Tanja Stadler, Daniel L. Rabosky, Rodney L. Honeycutt, John J. Flynn, Colleen M. Ingram, Cynthia Steiner, Tiffani L. Williams, Terence J. Robinson, Angela Burk-Herrick, Michael Westerman, Nadia A. Ayoub, Mark S. Springer und William J. Murphy: Impacts of the Cretaceous Terrestrial Revolution and KPg Extinction on Mammal Diversification. Science 334, 2011, S. 521–524
- Mark S. Springer, William J. Murphy, Eduardo Eizirik und Stephen J. O'Brian: Placental mammal diversification and the Cretaceous-Tertiary boundary. PNAS 100 (3), 2003, S. 1056–1061
- Erik R. Seiffert: A new estimate for afrotherian phylogeny based on simultaneous analysis of genomic, morphological, and fossil evidence. BMC Evolutionary Biology 7, 2007, S. 224
- Maureen A. O’Leary, Jonathan I. Bloch, John J. Flynn, Timothy J. Gaudin, Andres Giallombardo, Norberto P. Giannini, Suzann L. Goldberg, Brian P. Kraatz, Zhe-Xi Luo, Jin Meng, Xijun Ni, Michael J. Novacek, Fernando A. Perini, Zachary S. Randall, Guillermo W. Rougier, Eric J. Sargis, Mary T. Silcox, Nancy B. Simmons, Michelle Spaulding, Paúl M. Velazco, Marcelo Weksler, John R. Wible und Andrea L. Cirranello: The Placental Mammal Ancestor and the Post–K-Pg Radiation of Placentals. Science 339, 2013, S. 662–667
- K. Amanda Maswanganye, Michael J. Cunningham, Nigel C. Bennett, Christian T. Chimimba und Paulette Bloomer: Life on the rocks: Multilocus phylogeography of rock hyrax (Procavia capensis) from southern Africa. Molecular Phylogenetics and Evolution 114, 2017, S. 49–62
- D. Tab Rasmussen und Mercedes Gutiérrez: Hyracoidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 123–145
- Paulette Bloomer: Extant hyrax diversity is vastly underestimated. Afrotherian Conservation 7, 2009, S. 11–16
- Spartaco Gippoliti, Fenton P. D. Cotterill, Dietmar Zinner und Colin P. Groves: Impacts of taxonomic inertia for the conservation of African ungulate diversity: an overview. Biological Reviews 93 (1), 2018, S. 115–130, doi:10.1111/brv.12335
- Simon K. Bearder, John F. Oates, Françoise Dowsett-Lemaire und Robert Dowsett: Evidence of an undescribed form of tree hyrax in the forests of western Nigeria and the Dahomey Gap. Afrotherian Conservation 11, 2015, S. 2–5
- Martin Pickford, Salvador Moyà Solà und Pierre Mein: A revised phylogeny of the Hyracoidea (Mammalia) based on new specimens of Pliohyracidae from Africa and Europe. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 205 (2), 1997, S. 265–288
- Martin Pickford: New Titanohyracidae (Hyracoidea: Afrotheria) from the Late Eocene of Namibia. Communications of the Geological Survey of Namibia 16, 2015, S. 200–214
- Thomas Whitworth: The Miocene hyracoids of East Africa. Fossil Mammals of Africa 7, 1954, S. 1–58 ()
- Martin Pickford und Martin S. Fischer: Parapliohyrax ngororaensis, a new hyracoid from the Miocene of Kenya, with an outline of the classification of Neogene Hyracoidea. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 175 (2), 1987, S. 207–234
- Martin Pickford, Yoshihiro Sawada und Brigitte Senut: Geochronology and palaeontology of the Palaeogene deposits in the Sperrgebiet, Namibia. In: Thomas Lehmann und Stephan F. K. Schaal (Hrsg.): The world at the time of Messel. Puzzles in Palaeobiology, Palaeoenvironment and the History of Early Primates. 22nd International Senckenberg Conference Frankfurt am Main, 15th - 19th November 2011, S. 129–130
- Eugenie Barrow, Erik R. Seiffert und Elwyn L. Simons: A primitive hyracoid (Mammalia, Paenungulata) from the Early Priabonian (Late Eocene) of Egypt. Journal of Systematic Palaeontology 8 (2), 2010, S. 213–244
- Nancy J. Stevens, Patrick M. O'Connor, Eric M. Roberts und Michael D. Gottfried: A Hyracoid from the Late Oligocene Red Sandstone Group of Tanzania, Rukwalorax jinokitana (gen. and sp. nov.). Journal of Vertebrate Paleontology 29 (3), 2009, S. 972–975
- Martin Pickford, Brigitte Senut, Jorge Morales, Pierre Mein und Israel M. Sánchez: Mammalia from the Lutetian of Namibia. Memoir of the Geological Survey of Namibia 20, 2008, S. 465–514
- Martin Pickford: New Neogene hyracoid specimens from the Peri-Tethys region and East Africa. Paleontological Research 13 (3), 2009, S. 265–278
- Peter Simon Pallas: Miscellanea zoologica. Den Haag, 1766, S. 1–224 (S. 30–47) ()
- Gottlieb Conrad Christian Storr: Prodromus methodi mammalium. Tübingen, 1780, S. 1–43 (S. 40) ()
- Johann Hermann: Tabula affinitatum animalium. Straßburg, 1783, S. 1–370 (S. 115) ()
- John Edward Gray: Revision of the species of Hyrax, founded on the specimens in the British Museum. Annals and Magazine of Natural History 4 (1), 1868, S. 35–52 ()
- John Edward Gray: On the natural arrangement of vertebrose animals. London Medical Repository 15, 1821, S. 297–310 (306) (PDF)
- Thomas Huxley: An introduction to the classification of animals. London, 1869, S. 1–147 (S. 101) ()
- Fernand Lataste: Sur le système dentaire du genre daman. Annali del Museo civico di storia naturale di Genova 24, 1886, S. 5–40 ()
- Oldfield Thomas: On the species of Hyracoidea. Proceedings of the Zoological Society of London 1892, S. 50–76 ()
- Albert Gaudry: Animaux fossiles et geologie de l'Attique d'apres les recherches faites en 1855-56 et en 1860. Paris, 1862/1867, S. 1–474 (S. 215–218) () und Tafelband Taf. 34 ()
- Henry Fairfield Osborn: On Pliohyrax kruppii Osborn, a fossil hyracoid, from Samos, Lower Pliocene, in the Stuttgart Collection. A new type and the first known Tertiary hyracoid. In: Adam Sedgwick (Hrsg.): Proceedings of the fourth International Congress of Zoology, Cambridge, 22–27 August, 1898. London, 1899, S. 172–173 ()
- Max Schlosser: Über neue Funde von Leptodon graecus Gaudry und die systematische Stellung dieses Säugethieres. Zoologischer Anzeiger 22, 1899, S. 385–387 ()
- Sevket Sen: Dispersal of African mammals in Eurasia during the Cenozoic: Ways and whys. Geobios 46, 2013, S, 159–172
- Charles William Andrews und Hugh John Llewellyn Beadnell: A preliminary note on some new mammals from the Upper Eocene of Egypt. Survey Department, Public Works Ministry, Kairo, 1902, S. 1–9 ()
- Charles W. Andrews: Notes on an Expedition to the Fayum, Egypt, with Descriptions of some new Mammals. Geological Magazine 4 (10), 1903, S. 337–343 ()
- Charles W. Andrews: Further notes on the mammals of the Eocene of Egypt. Part II. Geological Magazine 5 (1), 1904, S. 157–162 ()
- Max Schlosser: Beiträge zur Kenntnis der Oligozänen Landsäugetiere aus dem Fayum, Ägypten. Beiträge zur Paläontologie und Geologie Österreich-Ungarns und des Orients 24, 1911, S. 51–167 ()
- Hikoshichiro Matsumoto: Contribution to the knowledge of the fossil Hyracoidea of the Fayum, Egypt, with description of several new species. Bulletin of the American Museum of Natural History 56, 1926, S. 253–350
- Robert Broom: On the Fossil Remains Associated with Australopithecus africanus. South African Journal of Science 31, 1934, S. 471–480
- Theophil Noack: Neue Beiträge zur Kenntniss der Säugethier-Fauna von Ostafrika. Zoologische Jahrbücher 7, 1893/1894, S. 523–594 (S. 540–542) ()
- Florentino Ameghino: Mammifères crétacés de l’Argentine. (Deuxième contribution à la connaissance la faune mammalogique des ‘‘couches à Pyrotherium). Boletín del Instituto Geográfico Argentino 18, 1897, S. 406–521 (S. 431–436) ()
- Florentino Ameghino: Les formations sédimentaires du Crétacé supérieur et du Tertiaire de Patagonie avec un paralléle entre leurs faunes et celles de l’ancien continent. Anales del Museo Nacional de Buenos Aires 15 (serie 3, tome 8), 1906, S. 1–568 (S. 467) ()
- Richard Lydekker: A geographical history of mammals. Cambridge, 1896, S. 1–400 (S. 85) ()
- Federico L. Agnolin unfd Nicolás R. Chimento: Afrotherian affinities for endemic South American “ungulates”. Mammalian Biology 76, 2011, S. 101–108
- Michael Westbury, Sina Baleka, Axel Barlow, Stefanie Hartmann, Johanna L. A. Paijmans, Alejandro Kramarz, Analıá M. Forasiepi, Mariano Bond, Javier N. Gelfo, Marcelo A. Reguero, Patricio López-Mendoza, Matias Taglioretti, Fernando Scaglia, Andrés Rinderknecht, Washington Jones, Francisco Mena, Guillaume Billet, Christian de Muizon, José Luis Aguilar, Ross D. E. MacPhee und Michael Hofreiter: A mitogenomic timetree for Darwin’s enigmatic South American mammal Macrauchenia patachonica. Nature Communications 8, 2017, S. 15951 doi:10.1038/ncomms15951
- Michael Buckley: Ancient collagen reveals evolutionary history of the endemic South American ‘ungulates’. Proceedings of the Royal Society B 282, 2015, S. 20142671 DOI: 10.1098/rspb.2014.2671
- Marcelo A. Reguero, Darin C. Croft, Guillermo M. López und Ricardo N. Alonso: Eocene archaeohyracids (Mammalia: Notoungulata: Hegetotheria) from the Puna, northwest Argentina. Journal of South American Earth Sciences 26, 2008, S. 225–233
- Leonardo S. Avilla und Dimila Mothé: Out of Africa: A New Afrotheria Lineage Rises From Extinct South American Mammals. Frontiers in Ecology and Evolution 9, 2021, S. 654302, doi:10.3389/fevo.2021.654302
- Rodolphe Tabuce und Stéphane Schmitt: De l’ombre aux Lumières et réciproquement: redécouverte du crâne de Procavia capensis (Pallas, 1766) (Hyracoidea, Mammalia) décrit en 1767 par Daubenton dans l’Histoire naturelle. Zoosystema 39 (4), 2017, S. 487–499
- Johann Karl Wilhelm Illiger: Prodromus systematis mammalium et avium. Berlin, 1811, S. 1–301 (S. 92 und 95) ()
- Georges Cuvier: Description ostéologique et comparative du Daman Hyrax Capensis. Annales du Muséum national d’Histoire naturelle 3, 1804, S. 171–182 ()
- Georges Cuvier: Le regne animal distribue d'apres son organisation pour servir de base a l'histoire naturelle des animaux et d'introduction a l'anatomie comparee. Tome 1 Paris, 1817, S. 1–540 (S. 240–241) ()
- Robert M. Schoch: A brief historical review of Perissodactyl classification. In: Donald R. Prothero und Robert M. Schoch (Hrsg.): The evolution of perissodactyls. New York und London 1989, S. 13–23
- Martin S. Fischer: Hyracoids, the sister-group of perissodactyls. In: Donald R. Prothero und Robert M. Schoch (Hrsg.): The evolution of perissodactyls. New York und London 1989, S. 37–56
- Theodore Gill: On the relations of the orders of mammals. Proceedings of the American Association for the Advancement of Science, 19th meeting, 1870, S. 267–270 ()
- Edward Drinker Cope: On the Taxeopoda – a new order of mammals. The American Naturalist 16, 1882, S. 522–523 ()
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 250–253)
- Wilfried W. de Jong, Anneke Zweers und Morris Goodman: Relationship of aardvark to elephants, hyraxes and sea cows from α-crystallin sequences. Nature 292, 1981, S. 538–540
- Malcolm C. McKenna: The alpha crystallin A chain of the eye lens and mammalian phylogeny. Annales Zoologice Fennici 28, 1992, S. 349–360
- Mark S. Springer, Gregory C. Cleven, Ole Madsen, Wilfried W. de Jong, Victor G. Waddell, Heather M. Amrine und Michael J. Stanhope: Endemic African mammals shake the phylogenetic tree. Nature 388, 1997, S. 61–64
- Michael J. Stanhope, Victor G. Waddell, Ole Madsen, Wilfried de Jong, S. Blair Hedges, Gregory C. Cleven, Diana Kao und Mark S. Springer: Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals. PNAS 95, 1998, S. 9967–9972
- Michael J. Stanhope, Ole Madsen, Victor G. Waddell, Gregory C. Cleven, Wilfried W. de Jong und Mark S. Springer: Highly Congruent Molecular Support for a Diverse Superordinal Clade of Endemic African Mammals. Molecular Phylogenetics and Evolution 9 (3), 1998, S. 501–508
- D. Tab Rasmussen: The evolution of the Hyracoidea: A review of the fossil evidence. In: Donald R. Prothero und Robert M. Schoch (Hrsg.): The evolution of perissodactyls. New York und London 1989, S. 57–78
- M. Mahboubi, R. Ameur, J. M. Crochet und J. J. Jaeger: El Kohol (Saharan Atlas, Algeria): A new Eocene mammal locality in northwestern Africa. Palaeontographica Abt. A. 192, 1986, S. 15–49
- Nicholas Court und Mohamed Mahboubi: Reassessment of Lower Eocene Seggeurius amourensis: Aspects of Primitive Dental Morphology in the Mammalian Order Hyracoidea. Journal of Paleontology 67 (5), 1993, S. 889–893
- Emmanuel Gheerbrant, Jean Sudre, Henri Cappetta, Cécile Mourer-Chauviré, Estelle Bourdon, Mohamed Iarochene, Mbarek Amaghzaz und Baâdi Bouya: Les localités à mammifères des carrières de Grand Daoui, bassin des Ouled Abdoun, Maroc, Yprésien: premier état des lieux. Bulletin de la Societe Geologique de France 174 (3), 2003, S. 279–293
- Jean-Louis Hartenberger, Claude Martinez und Ahmed Ben Said: Découverte de mammifères d’âge Éocène inférieur en Tunisie centrale. Comptes rendus de l'Académie des sciences. Série 2 301, 1985, S. 649–652 ()
- Nicholas Court und Jean-Louis Hartenberger: A new species of the hyracoid mammal Titanohyrax from the Eocene of Tunisia. Palaeontology 35 (2), 1992, S. 309–317
- Rodolphe Tabuce, Brigitte Coiffait, Philippe-Emmanuel Coiffait, Mohamed Mahboubi und Jean-Jacques Jaeger: A new species of Bunohyrax (Hyracoidea, Mammalia) from the Eocene of Bir El Ater (Algeria). Comptes Rendus de l'Académie des Sciences Paris, Sciences de la Terre et des planètes 331, 2000, S. 61–66
- Donald D. De Blieux und Elwyn L. Simons: Cranial and dental anatomy of Antilohyrax pectidens: A Late Eocene hyracoid (Mammalia) from the Fayum, Egypt. Journal of Vertebrate Paleontology 22 (1), 2002, S. 122–136
- D. Tab Rasmussen und Elwyn L. Simons: Ecomorphological diversity among Paleogene hyracoids (Mammalia): a new species of cursorial browser from the Fayum, Egypt. Journal of Vertebrate Paleontology 20, 2000, S. 167–176
- D. Tab Rasmussen und Elwyn L. Simons: The oldest Egyptian hyracoids (Mammalia: Pliohyracidae): New species of Saghatherium and Thyrohyrax from Fayum. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 182 (2), 1991, S. 187–209
- Eugenie C. Barrow, Erik R. Seiffert und Elwyn L. Simons: Cranial Morphology of Thyrohyrax domorictus (Mammalia, Hyracoidea) from the Early Oligocene of Egypt. Journal of Vertebrate Paleontology 32 (1), 2012, S. 166–179
- Martin Pickford: Additional material of Namahyrax corvusfrom the Ypresian/Lutetian of Black Crow, Namibia. Communications of the Geological Survey of Namibia 18, 2018, S. 81–86
- Martin Pickford: Mandible of Namahyrax corvusfrom the Eocene Black Crow Limestone, Namibia. Communications of the Geological Survey of Namibia 21, 2019, S. 32–39
- Rodolphe Tabuce, Mohamed Mahboubi und Jean Sudre: Reassessment of the Algerian Eocene Hyracoid Microhyrax. Consequences on the early diversity and basal phylogeny of the Order Hyracoidea (Mammalia). Eclogae geologica Helvetiae 94, 2001, S. 537–545
- Donald D. de Blieux, Michael R. Baumrind, Elwyn L. Simons, Prithijit S. Chathrath, Grant E. Meyer und Yousry S. Attia: Sexual dimorphism of the internal mandibular chamber in Fayum Pliohyracidae (Mammalia). Journal of Vertebrate Paleontology 26 (1), 2006, S. 160–169
- J. G. M. Thewissen und E. L. Simons: Skull of Megalohyrax eocaenus (Hyracoidea, Mammalia) from the Oligocene of Egypt. Journal of Vertebrate Paleontology 21 (1), 2001, S. 98–106
- Gary T. Schwartz, D. Tab Rasmussen und Richard J. Smith: Body-Size Diversity and Community Structure of Fossil Hyracoids. Journal of Mammalogy 76 (4), 1995, S. 1088–1099
- Herbert Thomas, Emmanuel Gheerbrant und Jean-Michel Pacaud: Découverte de squelettes subcomplets de mammifères (Hyracoidea) dans le Paléogène d’Afrique (Libye). Comptes Rendus Palevol 3, 2004, S. 209–217
- Emmanuel Gheerbrant, Stéphane Paiggné und Herbert Thomas: Première description du squelette d’un hyracoide paléogène: Sagatherium antiquum de l’Oligocène inférieur de Jebel al Hasawnah, Libye. Palaeontographica, Abteilung A 279 (4–6), 2007, S. 93–145
- Martin Pickford: Première découverte d’une faune mammalienne terrestre paléogène d’Afrique sub-saharienne. Comptes Rendus de l’Académie des Sciences de Paris 302, 1986, S. 1205–1210 ()
- Rodolphe Tabuce, Fabrice Lihoreau, Florias Mees, Maeva J.Orliac, Thierry De Putter und Thierry Smith: A reassessment of the Oligocene hyracoid mammals from Malembo, Cabinda, Angola. Geobios, 2021, doi:10.1016/j.geobios.2021.03.003
- Erik R. Seiffert: Revised age estimates for the later Paleogene mammal faunas of Egypt and Oman. PNAS 103 (13), 2006, S. 5000–5005
- John Kappelman, D. Tab Rasmussen, William J. Sanders, Mulugeta Feseha, Thomas Bown, Peter Copeland, Jeff Crabaugh, John Fleagle, Michelle Glantz, Adam Gordon, Bonnie Jacobs, Murat Maga, Kathleen Muldoon, Aaron Pan, Lydia Pyne, Brian Richmond, Timothy Ryan, Erik R. Seiffert, Sevket Sen, Lawrence Todd, Michael C. Wiemann und Alisa Winkler: Oligocene mammals from Ethiopia and faunal exchange between Afro-Arabia and Eurasia. Nature 426, 2003, S. 549–552
- D. Tab Rasmussen und Mercedes Gutiérrez: A Mammalian fauna from the Late Oligocene of Northwestern Kenya. Palaeontographica Abteilung A 288 (1–3), 2009, S. 1–52
- Martin Pickford: Revision of the Early Miocene Hyracoidea (Mammalia) of East Africa. Comptes Rendus Palevol 3, 2004, S. 675–690
- Hiroshi Tsujikawa und Martin Pickford: Additional specimens of Hyracoidea (Mammalia) from the Early and Middle Miocene of Kenya. Annales de Paléontologie 92, 2006, S. 1–12
- Martin Pickford und Brigitte Senut: Afrohyrax namibensis (Hyracoidea, Mammalia) from the Early Miocene of Elisabethfeld and Fiskus, Sperrgebiet, Namibia. Communications of the Geological Survey of Namibia 18, 2018, S. 93–112
- Martin Pickford: New specimens of Brachyhyrax aequatorialis (Geniohyidae) and Meroehyrax bateae (Pliohyracidae) from East Africa. Geo-Pal Uganda 8, 2013, S. 1–8
- Martin Pickford: Middle Miocene Hyracoidea from the lower Orange River Valley, Namibia. Memoir of the Geological Survey of Namibia 19, 2003, S. 199–203
- Hiroshi Tsujikawa: The updated Late Miocene large mammal fauna from Samburu Hills, northern Kenya. African Study Monographs, Suppl. 32, 2005, S. 1–50
- D. Tab Rasmussen, Martin Pickford, Pierre Mein, Brigitte Senut und Glenn C. Conroy: Earliest Known Procaviid Hyracoid from the Late Miocene of Namibia. Journal of Mammalogy 77 (3), 1996, S. 745–754
- Martin Pickford und Leslea J. Hlusko: Late Miocene procaviid hyracoids (Hyracoidea: Dendohyrax) from Lemundon’o, Kenya. Kirtlandia 56, 2007, S. 106–111
- Siegfrid E. Kuss: Ein erster Fund von Pliohyrax aus dem Vallesium von Kreta/Griechenland. Neues Jahrbuch für Geologie und Paläontologie, Monatshefte 3, 1976, S. 157–162
- Martin Pickford: Fossil hyraxes (Hyracoidea: Mammalia) from the Late Miocene and Plio-Pleistocene of Africa, and the phylogeny of the Procaviidae. Palaeontologia Africana 41, 2005, S. 141–161
- I. A. Dobrovo: New data on fossil Hyracoidea. Палеонтологический Журнал 12 (3), 1978, S. 375–383
- Chen Guan Fang: A new genus of Pliohyracinae (Hyracoidea, Mammalia) from the Late Pliocene of Dege, Sichuan, China. Vertebrata Palasiatica 41 (34), 2003, S. 240–248
- N. P. Kalmykov: The First Find of Hyrax (Mammalia, Hyracoidea, Postschizotherium) in Russia (Western Transbaikal Region). Doklady Earth Sciences, 451 (2), 2013, S. 827–829
- Qiu Zhan-Xiang, Wei Qi, Pei Shu-Wen und Chen Zhe-Ying: Preliminary report of Postschizotherium (Mammalia: Hyracoidea) material from Tianzhen, Shanxi, China. Vertebrata Palasiatica 40 (2), 2002, S. 146–160
- Herbert Hahn: Von Baum-, Busch- und Klippschliefern, den kleinen Verwandten der Seekühe und Elefanten. Wittenberg, 1959, ISBN 3-7403-0193-7
- Johann Christian Daniel Schreber: Die Säugthiere in Abbildungen nach der Natur mit Beschreibungen. Vierter Teil. Erlangen, 1792, S. 923–926 ()
- Nancy Olds und Jeheskel Shoshani: Procavia capensis. Mammalian Species 171, 1982, S. 1–7
- Gefährdungsgrad der einzelnen Arten in der Roten Liste gefährdeter Arten der IUCN.
Weblinks
- Hyraxes (englisch)
- Hyrax vocalizations Rufe der Schliefer, aufgenommen im Rahmen des Eastern Africa Primate Diversity and Conservation Program, zuletzt abgerufen am 15. Dezember 2017