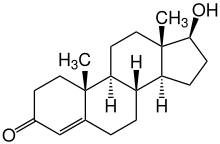
Testosteron
Testosteron ist ein Sexualhormon (Androgen), das bei beiden Geschlechtern vorkommt, sich aber in Konzentration und Wirkungsweise bei Mann und Frau unterscheidet. Wie bei allen Androgenen besteht das Grundgerüst des Testosterons aus Androstan (19 C-Atome). Die Vorläufer des Testosterons sind die Gestagene (21 C-Atome) bzw. Dehydroepiandrosterone (DHEA). Testosteron ist ein Kunstwort, das von testis (Hoden) und Steroid abgeleitet ist.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Testosteron | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C19H28O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und fast geruchloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G03BA03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 288,43 g·mol−1 | |||||||||||||||||||||
| Dichte |
1,17 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (2,41 mg·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Adolf Butenandt versuchte 1930 männliches Sexualhormon aus Stierhodenextrakten und später aus Männerharn zu isolieren, was ihm für Androsteron gemeinsam mit Kurt Tscherning 1931 gelang. Butenandt vermutete anhand seiner Analysen bereits die richtige Strukturformel für Testosteron, dessen Teilsynthese aus Cholesterol 1934 Leopold Ružička in Zürich gelang.[4] Entdeckt und als Testosteron bezeichnet hatte es dann erstmals 1935 Ernst Laqueur, der dieses Steroidhormon aus Stierhoden isolierte.
Bei Männern wird Testosteron zum größten Teil unter dem Einfluss des LH (Luteinisierendes Hormon) in den Leydigschen Zwischenzellen im Hoden produziert. Die Nebennierenrinde bildet zwar kleine Mengen anderer Androgene, jedoch nur in sehr geringem Maße Testosteron.
Bei Frauen produzieren die Eierstöcke und die Nebennierenrinde geringe Mengen an Testosteron. In der Biosynthese des Organismus ist das Cholesterol der Präkursor (Vorstufe) bzw. das Progesteron ein Zwischenprodukt für die Testosteronsynthese.
Das Gesamttestosteron besteht zu 40 bis 50 % aus bioaktivem, d. h. Albumin-gebundenem, Testosteron wie auch SHBG-gebundenem Testosteron (50 bis 60 %) und freiem Testosteron (1 bis 2 %).[5]
Funktion
Testosteron hat verschiedene Wirkungen auf diverse Organe. Es bewirkt z. B. als „männliches Geschlechtshormon“ die Entstehung des männlichen Phänotyps, ist für das Wachstum (insbesondere den Aufbau von Muskelmasse und Fettspeicher) mit verantwortlich und sorgt für die Spermienproduktion.
Testosteron wird, an ein Protein gebunden, über das Blut auch zu vielen anderen Zielorganen transportiert, die Rezeptoren für dieses Hormon haben. Das Transportprotein heißt Sexualhormon-bindendes Globulin (SHBG).
Im Körper wird ein Teil des Testosterons in den Zielzellen durch das Enzym Steroid-5α-Reduktase (SRD5) zu dem biologisch noch aktiveren Dihydrotestosteron (DHT) metabolisiert.
Über eine negative biologische Rückkopplung (Feedback) hemmt Testosteron in der Hirnanhangsdrüse die Sekretion von Luteinisierendem Hormon (LH) und im Hypothalamus die des Gonadoliberins, welches auch Gonadotropin-releasing-Hormon (GnRH) genannt wird.
Testosteron wird über das Androgenbindungsprotein (ABP) der Sertoli-Zellen zu den Samenkanälchen transportiert. Hier bewirkt es die Reifung der Spermatiden zu Spermien (siehe auch Hodenfunktion). Darüber hinaus bewirkt Testosteron bei männlichen Individuen in der Pubertät die Entwicklung des Penis, des Hodensacks, der akzessorischen Geschlechtsdrüsen sowie der sekundären Geschlechtsmerkmale und sorgt bei Erwachsenen für die Aufrechterhaltung dieser Merkmale.
Außerhalb der Geschlechtsorgane fördert das Hormon das Wachstum der Körperbehaarung und der Barthaare (aber nicht der Kopfhauptbehaarung; siehe auch Haarausfall) und besitzt eine anabole, das heißt muskelaufbauende, Wirkung. Des Weiteren verstärkt Testosteron die Knorpel- und Knochenneubildung, ähnlich wie Thyroxin. Ein hoher Testosteronspiegel fördert das Entstehen bzw. die Steigerung sexuellen Verlangens (Libido) und generell Antrieb, Ausdauer und „Lebenslust“ sowie dominante und aggressive Verhaltensweisen. Schließlich kommt es durch Testosteronwirkung zu einer Vermehrung der roten Blutkörperchen (Erythrozyten) durch die Stimulation der Freisetzung von Erythropoetin in der Niere und die Aktivierung des Knochenmarks.[6][7]
Künstliche Testosteronzufuhr bei Frauen kann zu einer Vermännlichung (Stimme, Muskulatur, Gesichtszüge, Behaarung) und Vergrößerung der Klitoris führen, welche sich nach Absetzen oft nicht mehr vollständig zurückbildet (abhängig von der Dauer, Höhe der Dosis und individueller Veranlagung).
Psychische Wirkungen
Als verhaltensbiologische Wirkungen bei Tieren wurden Imponierverhalten, Kampfverhalten, Balz sowie Begattungsdrang erforscht und beobachtet. Dies wurde u. a. durch Kastration (Gonadenentfernung) und anschließende Hormonzufuhr an Tieren (aggressive Hengste werden zu sanften, angepassten Wallachen) bewiesen.[8]
Bei Menschen ist der Einfluss des Hormons auf das Verhalten weniger etabliert als bei Tieren. Eine systematische Übersichtsarbeit zur Beziehung zwischen Testosteron und antisozialem Verhalten ergab, dass ein hoher Testosteronspiegel zu einer beeinträchtigten Regulation emotionaler und motivationaler Prozesse, geringerer sozialer Sensibilität und starker Belohnungsmotivation führt. Ob sich das in antisozialem Verhalten äußert, hängt jedoch von einer Reihe sozialer und genetischer Faktoren ab.[9] Eine Metaanalyse von insgesamt 45 Studien zum Verhältnis zwischen Testosteron und Aggressivität bei Menschen ergab hingegen einen schwachen, aber signifikanten positiven Zusammenhang zwischen Aggressivität und Testosteron.[10] Zwei systematische Übersichtsarbeiten kamen zu dem Schluss, dass es nicht allein Testosteron ist, das aggressives Verhalten steigert, sondern das Verhältnis von Testosteron zu Cortisol. Ein hoher Testosteronspiegel gepaart mit einem niedrigen Cortisolspiegel sei besonders stark mit Aggressivität assoziiert.[11][12] Eine Studie aus dem Jahr 2012 zeigte, dass subjektiv empfundene Wut mit erhöhtem Testosteron zusammenhing, nicht jedoch mit erhöhtem Cortisol.[13]
Einzelne Untersuchungen kommen zu dem Ergebnis, dass Testosteron dissoziales Verhalten wie egozentrische Entscheidungen fördert[14] und kognitive Empathie verringert.[15] Andere Einzelstudien kamen zu umgekehrten Ergebnissen, so zum Beispiel dass die Gabe von Testosteron die Tendenz zum Lügen bei Männern reduziert.[16][17] Eine weitere Studie an Männern kam zu dem Resultat, dass exogenes Testosteron aggressives, anti-soziales Verhalten bei Verhandlungen signifikant erhöhen kann. Männer, denen Testosteron verabreicht wurde, behielten im Vergleich zur Placebo-Gruppe 27 % mehr Geld für sich in Verhandlungssituationen.[18]
Eine Untersuchung zeigte, dass Testosteron bei Frauen dazu führte, dass die Versuchsteilnehmerinnen fairere Angebote in einem Verhandlungsexperiment machten. Die Forscher erklären diese Wirkung damit, dass das Hormon die Sensitivität für den Status erhöht, und vermuteten, dass in der sozial komplexen Umwelt des Menschen nicht Aggression, sondern pro-soziales Verhalten den Status sichert.[19] Bei Frauen im mittleren Lebensalter gehen erhöhte Testosteronwerte mit einem höheren Risiko für eine Depression einher.[20]
Testosteronbiosynthese
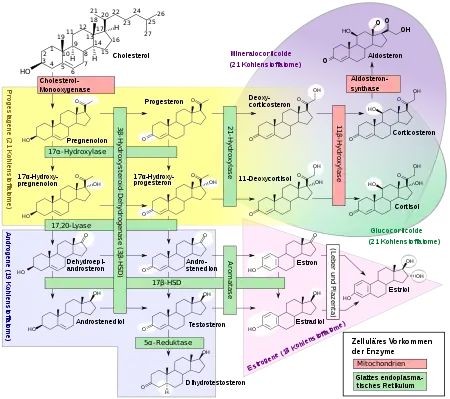
Der Ausgangsstoff für die Testosteronbiosynthese in den Leydig-Zellen ist Cholesterol (Cholesterin), welches über zwei verschiedene Wege verarbeitet werden kann. Den letzten Schritt, die Reduktion von Androstendion, katalysiert das Enzym Testosteron-17β-Dehydrogenase.[21]
Bei Tieren, bei denen Mehrlingsgeburten die Regel sind, also auch den meisten Säugetieren, ist der adulte Testosteronspiegel maßgeblich von der Position der Föten im Uterus abhängig. In der Gebärmutter zwischen zwei Weibchen liegende Föten weisen später eine niedrigere Testosteronkonzentration auf als solche, die zwischen zwei männlichen Geschwistern liegen. Bei adulten Tieren zeigen sich infolgedessen sehr unterschiedliche Verhaltensmuster.[22]
Normwerte und Diagnostik
Der Testosteronspiegel im Blutserum eines gesunden Mannes unterliegt tageszeitlichen Schwankungen und folgt einer circadianen Rhythmik, wobei der Wert frühmorgens ein Maximum und nachmittags ein Minimum durchläuft. Abhängig vom Alter schwanken die Werte morgendlicher Konzentration des Gesamttestosterons dabei bei Jungen vor der Pubertät zwischen 1 und 4 nmol/l[23] und nach Erreichen der Geschlechtsreife zwischen 13 und 23 nmol/l mit einem Mittelwert von etwa 16 für ältere Männer und etwa 18 für jüngere Männer. Der Normbereich liegt für alle Männer zwischen 12 und 40 nmol/l[24] (12 und 30 nmol/l[23]). Testosteronkonzentrationen bei Frauen variieren mit der Phase des Menstruationszyklus und dem Body-Mass-Index, was die Festlegung normaler Bereiche erschwert. Allgemein liegt der Normbereich allerdings etwa zwischen 0,4 und 2,0 nmol/L (12–58 ng/dL).[25]
Es besteht offensichtlich eine Korrelation zwischen der Schlafdauer und dem Testosteronspiegel. So stieg in einer mit 800 gesunden Männern aller Altersstufen durchgeführten Studie der Testosteronspiegel mit zunehmender durchschnittlicher Schlafdauer (gemessen über drei Wochen) zuerst an, erreichte nach etwa acht Stunden einen Höhepunkt und fiel unmittelbar danach überraschenderweise wieder stark ab. Während der Anstieg mit einer vermehrten Hormonproduktion, die vor allem im Schlaf stattfindet, erklärt wird, ist der Abfall bisher noch ungeklärt.[26][27] Der Testosteronwert sinkt mit zunehmendem Lebensalter kontinuierlich ab. Dies allein hat zunächst keinen Krankheitswert. Erst wenn es zusätzlich zu Symptomen eines Testosteronmangels kommt (Hypogonadismus), ist eine Behandlung indiziert.[28] Bei Vorliegen eines Hypogonadismus kann auch bei höheren Spiegeln eine Substitutionstherapie angezeigt sein.[29]
Die häufigste Form des Testosteronmangels ist der altersassoziierte Hypogonadismus (Late-Onset Hypogonadism [LOH]) im sogenannten Klimakterium virile, von dem 3–7 % aller Männer zwischen 30 und 70 Jahren betroffen sind, bei über 70-jährigen sind es ca. 18 %.[30] Testosteronmangel bei alternden Männern wird unter dem Begriff Testosteronmangelsyndrom bzw. dem englischen Fachbegriff partial androgen deficiency in the aging male (abgekürzt mit PADAMEs, PADAM) beschrieben. Eine Studie der Universität Manchester von 2010 stellt allerdings in Frage, ob die beklagten vielschichtigen Symptome überhaupt mit der Höhe des Testosteronspiegels korrelieren und ob eine Testosteronsubstitution ursächlich hilft. Zwischen den vermeintlichen Wechseljahresbeschwerden bei Männern in fortgeschrittenem Alter und einem niedrigen Testosteronspiegel konnten die Forscher keinen Zusammenhang feststellen.[31]
Der Testosteronspiegel wird vorwiegend aus dem Blutserum bestimmt. Auf Grund der tageszeitlichen Schwankungen des Testosteronspiegels findet die Blutabnahme in den Morgenstunden statt.[32] Die Bestimmung erfolgt meist per Immunassay-Methodik. Da diese bei niedrigen Testosteronwerten ungenaue Ergebnisse liefert, wird in einem solchen Fall eine Kombination aus Extraktion, chromatographischen Methoden und nachfolgender Immunoassay- oder massenspektrometrischer Bestimmung empfohlen. Flüssigchromatographie mit Massenspektrometrie-Kopplung ermöglicht die Messung verschiedener Steroide in derselben Probe.[24]
Haarausfall
Das Hormon Dihydrotestosteron (DHT) ist die aktive Form von Testosteron. Beim erblich bedingten Haarausfall kann eine vererbte Überempfindlichkeit der Haarwurzeln gegenüber DHT bestehen und zu einer fortschreitenden Verkleinerung der Haarwurzeln führen. Eine Behandlungsmöglichkeit besteht in Medikamenten zur Senkung des DHT-Spiegels.[33] Eine weitere mögliche Ursache für Haarausfall stellt eine Überempfindlichkeit von Testosteron für den Körper dar. Durch den erhöhten Anteil des männlichen Sexualhormons, steigt auch die Wahrscheinlichkeit an Haarausfall zu erkranken.
Testosteronersatztherapie
Anlässe
Ein Testosteronmangel kann unter anderem zu Erektionsstörungen und Osteoporose führen. Reicht die natürliche Produktion von Testosteron nicht aus, kann eine Langzeittherapie mit von außen zugeführtem Testosteron erfolgen.
Ernährung
In Studien wurde festgestellt, dass starker Konsum von Alkohol die Testosteronwerte beim Menschen deutlich senken kann. Ein moderater Konsum, der z. B. dem Konsum von 1,5 Gläsern Wein entspricht, soll den Testosteronspiegel auch nur moderat um 7 % senken.[34][35][36][37][38][39] Der Verzicht auf Alkohol soll wieder dazu führen, dass wieder normale Mengen an Testosteron produziert werden können[40].
Laut Frank Sommer, Präsident der Deutschen Gesellschaft für Mann und Gesundheit e.V. (DGMG e.V.), könne man mit einigen Lebensmitteln den Testosteronspiegel um bis zu 23 % auf natürlich Weise steigern.[41] So sollen Avenacoside, welche z. B. in Haferflocken vorkommen, dazu führen, dass der Körper mehr biologisch aktives Testosteron produziert. Mit bis zu zwei handtellergroße Portionen Brokkoli und Blumenkohl, Blattspinat oder Grünkohl zum Mittagessen soll von den sekundären Pflanzenstoffen wie etwa dem Senföl Indol-3-Carbinol profitieren. „Sie bewirken, dass weniger Testosteron – das Königshormon des Mannes – in das weibliche Hormon Östradiol umgewandelt wird“, so Sommer.[42]
Leistungscoach Brian Matys empfiehlt, mit Verweis auf Studien, Lebensmittel, welche sowohl den testosteronhemmenden Cortisolspiegel senken als auch den Testosteronwert selbst steigern: Paranüsse, Kakao, Austern und Knoblauch[43] und beschreibt Zusammenhänge zu Zink und Vitamin C.
Ersatztherapie
Als Ersatztherapie gibt es folgende Möglichkeiten:
- „Monats-Spritze“: Älteste Therapieform, Spritzenabstand 3 bis 4 Wochen, jedoch stark schwankende Spiegel.
- Gel zum Auftragen auf die Haut: Das Gel wird täglich auf die Haut aufgetragen und ermöglicht einen relativ konstanten Testosteronspiegel.
- Skrotalpflaster: Täglich auf den Hodensack zu klebendes Pflaster. Wirksam, jedoch manchmal störend in der Anwendung.
- In einigen Ländern sind auch Testosteronimplantate zugelassen. In einer kleinen, ambulanten, Operation werden sie unter die Haut appliziert. Alle 5 bis 6 Monate notwendig. Guter Testosteronspiegel.
- „3-Monats-Spritze“: Neueste Therapieform
- In Form eines Applikators zur Anwendung in den Achselhöhlen
Anmerkungen:
- In der Praxis werden die Injektionsintervalle oft noch weiter ausgedehnt, da im Organismus Mechanismen zur Bindung von Testosteronmolekülen an bestimmte Proteine (SHBG) vorhanden sind.
- Da eine externe Testosteronverabreichung von der Natur nicht vorgesehen ist und künstliche Testosteronsalben und Matrixpflaster erst sehr kurz am Markt sind, ist über Risiken und Langzeitnebenwirkungen noch nichts bekannt. Externe Testosterongaben könnten die Fähigkeit des Körpers, selbst Testosteron zu produzieren, vorübergehend oder gar dauerhaft beeinträchtigen.
Bei Behandlung von Transmännern
Bei Transidentität können Transmänner sich für die Einnahme von Testosteron entscheiden.[44] Dies führt zu einer allgemeinen Vermännlichung mit entsprechender Gesichts- und Körperbehaarung, Veränderung der Fettverteilung, Muskelaufbau und einer wahrnehmbaren Veränderung der Stimmlage.[45]
Testosteron als Dopingmittel
Manche Bodybuilder sowie Ausdauersportler verwenden Testosteron als Dopingmittel, um ihren Muskelaufbau zu beschleunigen oder die natürliche Leistungsgrenze zu überwinden. Dabei besteht aber die Gefahr, eine überhöhte Dosis zu verwenden, die zu ernsthaften, womöglich dauerhaften urologischen Problemen führen kann. Gebräuchlich sind synthetische Testosterone in Form kurzkettiger (Propionat), mittelkettiger (Enanthat/Cypionat) und langkettiger Ester (Undecanoat, Buciclat), wobei der größte Teil über den Schwarzmarkt bezogen wird. Bei diesen Produkten besteht unter anderem die Gefahr der Verunreinigung, der falschen Dosierungen und der Leberschädigung.
Nebenwirkungen
Mögliche Nebenwirkungen, vor allem bei Zufuhr synthetischer Testosterone und Verwendung hoher Dosen, sind:
- Leber- und Nierentumorbildung
- Schädigung des Herzmuskels
- Herzrhythmusstörungen
- Schädigung des Herz-Kreislauf-Systems
- Störung des Fettstoffwechsels, der Blutgerinnung und des Gefäßsystems
- Zyklusstörungen bis hin zum Ausbleiben der Menstruation
- Missbildung des ungeborenen Kindes im Mutterleib während der Schwangerschaft
- Ablagerungen an den Gefäßwänden
- Erhöhung der Cholesterinwerte
- Arteriosklerose
- Blutgerinnsel im Gehirn/Schlaganfall
- Thrombosegefahr
- Gynäkomastie (Anschwellen der Brustdrüsen beim Mann) durch Aromatisation
- Vergröberung der Gesichtszüge, insbesondere Wachstum des Kinns
- Beschleunigte Skelettreife
- Veränderung der Schilddrüsenfunktion
- Zunahme des Unterhautfettgewebes und Wassereinlagerung im Gewebe durch Aromatisation
- Vergrößerung der Talgdrüsen der Haut
- Ausbildung von normaler Akne und „Steroid-Akne“
- Veränderung des Haarverteilungsmusters (z. B. Haupthaarausfall und Vermehrung der Körperbehaarung)
- Gefühlsschwankungen
- Negative Gedächtnisleistung und Konzentrationsfähigkeit
- Psychische Erkrankungen (z. B. Depression)
- Abnahme des Hodenvolumens und der Spermienzahl (nicht immer ganz reversibel)
- Dauerhafte Klitorishypertrophie die meist nicht mehr reversibel ist
- Schwächung des Immunsystems[46][47][48][49]
Siehe auch
Testosteronderivate
Handelsnamen
Monopräparate
Andriol (A, CH), Androgel (A), Androtop (D), Intrinsa (D, A), Livensa (A), Nebido (D, A, CH), Testavan (D, A), Testogel (D, A, CH), Testotop (D), Testoviron (CH), Tostran (D, A, CH)
Literatur
- Lois Jovanovic, Genell J. Subak-Sharpe: Hormone. Das medizinische Handbuch für Frauen (Originalausgabe: Hormones. The Woman’s Answerbook. Atheneum, New York 1987). Aus dem Amerikanischen von Margaret Auer, Kabel, Hamburg 1989, ISBN 3-8225-0100-X, S. 33 f., 362 f. und 386.
Weblinks
- Maria Zeilinger (Dipl.MTA): TESTOSTERON Referenzbereiche ("Normalbereiche") Plasma/Serum. Auf: med4you.at, lletzter Stand: 1. Juli 2003; zuletzt abgerufen am 11. Oktober 2020.
- Universitätsklinikum Ulm: Freies Testosteron - Referenzbereiche. von 2017; zuletzt abgerufen am 11. Oktober 2020.
- Eintrag zu Testosteron bei Vetpharm, abgerufen am 29. Juli 2012.
- Bijay Jassal: Reduction of androstenedione to testosterone. Auf: reactome.org vom 10. Januar 2008; zuletzt abgerufen am 14. Juni 2017.
- Ilka Lehnen-Beyel, Bild der Wissenschaft: Was Frauen empfindlich und Männer schmerzfrei macht. Auf: wissenschaft.de vom 27. August 2005; zuletzt abgerufen am 8. September 2019.
- Florian Rötzer/ Telepolis: Testosteron soll das Misstrauen gegenüber Mitmenschen fördern. Auf: heise.de vom 26. Mai 2010.
- Wissenschaftliche Referenzen zu Testosteron Auf: testosteron-info.com (testosteron-vermarktende Privatseite ohne vollständiges Impressum!) von 2011; zuletzt abgerufen am 14. Juni 2017.
- Arznei-Telegramm 9/10: Therapiekritik - Krank statt vital durch Testosteron. vom 17. September 2010; Auf: arznei-telegramm.de; zuletzt abgerufen am 14. Juni 2017.
Einzelnachweise
- Eintrag zu Testosteron in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- M. Kuhnert-Brandstätter, R. Völlenklee: Beitrag zur Polymorphie von Arzneistoffen, 4. Mitteilung: Oxamniquin, Resorantel, Spiperon, Suloctidil, Ticlopidinhydrochlorid, Parsol 1789 und Testosteroncyptonat. In: Scientia Pharmaceutica Band 55, 1987, S. 27–39.
- SWGDRUG Monographs: Testosterone and Esters (PDF; 2,4 MB), abgerufen am 20. Mai 2013.
- Wolf-Dieter Müller-Jahncke: Testosteron. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 1383.
- J. Griffin, J. Wilson: Disorders of the testes and the male reproductive tract. In: Larson, Kronenberg, Melmed, Polonsky (Hrsg.): Williams Textbook of Endocrinology. 10. Auflage. WB Saunders, Philadelphia 2003, S. 709–769.
- S. Shahani, M. Braga-Basaria, M. Maggio, S. Basaria: Androgens and erythropoiesis: past and present. In: Journal of endocrinological investigation. Band 32, Nr. 8, September 2009, S. 704–716, doi:10.3275/6149, PMID 19494706. (Review).
- Joel S. Finkelstein, Hang Lee u. a.: Gonadal Steroids and Body Composition, Strength, and Sexual Function in Men. In: New England Journal of Medicine. Band 369, 2013, S. 1011–1022, doi:10.1056/NEJMoa1206168.
- Günter Vogel, Hartmut Angermann: dtv-Atlas Biologie. 10. Auflage. Band 2. Deutscher Taschenbuch Verlag, München 2002, ISBN 3-423-03227-8, S. 441.
- Bariş O. Yildirim, Jan J.L. Derksen: A review on the relationship between testosterone and life-course persistent antisocial behavior. In: Psychiatry Research. Band 200, Nr. 2–3, Dezember 2012, S. 984–1010, doi:10.1016/j.psychres.2012.07.044.
- Angela S. Book, Katherine B. Starzyk, Vernon L. Quinsey: The relationship between testosterone and aggression: a meta-analysis. In: Aggression and Violent Behavior. Band 6, Nr. 6, November/ Dezember 2001, S. 579–599, doi:10.1016/S1359-1789(00)00032-X.
- David Terburg, Barak Morgan, Jack van Honk: The testosterone–cortisol ratio: A hormonal marker for proneness to social aggression. In: International Journal of Law and Psychiatry. Band 32, Nr. 4, Juli/ August 2009, S. 216–223, doi:10.1016/j.ijlp.2009.04.008.
- Estrella R. Montoya, David Terburg, Peter A. Bos, Jack van Honk: Testosterone, cortisol, and serotonin as key regulators of social aggression: A review and theoretical perspective. In: Motivation and Emotion. Band 36, Nr. 1, März 2012, S. 65–73, doi:10.1007/s11031-011-9264-3, PMC 3294220 (freier Volltext).
- Carly K Peterson, Eddie Harmon-Jones: Anger and testosterone: Evidence that situationally-induced anger relates to situationally-induced testosterone. In: Emotion. Band 12, Nr. 5, Oktober 2012, S. 899–902, doi:10.1037/a0025300. PMID 21910539.
- Nicholas D. Wright u. a.: Testosterone disrupts human collaboration by increasing egocentric choices. In: Proceedings of the Royal Society. Band 279, Nr. 1736, Juni 2012, S. 2275–2280, doi:10.1098/rspb.2011.2523, PMC 3321715 (freier Volltext).
- Jack van Honk u. a.: Testosterone administration impairs cognitive empathy in women depending on second-to-fourth digit ratio. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 8, Februar 2011, S. 3448–3452, doi:10.1073/pnas.1011891108, PMC 3044405 (freier Volltext).
- Testosteron macht ehrlicher. Wissenschaftler der Universität Bonn untersuchen die biologischen Hintergründe des Lügens. Universitätsklinikum Bonn, 10. Oktober 2012, abgerufen am 18. Juni 2013.
- Matthias Wibral, Thomas Dohmen, Dietrich Klingmüller, Bernd Weber, Armin Falk: Testosterone Administration Reduces Lying in Men. In: PLOS ONE. Band 7, Nr. 10, 2012, doi:10.1371/journal.pone.0046774 (englisch).
- Paul J. Zak u. a.: Testosterone Administration Decreases Generosity in the Ultimatum Game. In: PLoS ONE. Band 4, Nr. 2, 2009, S. 1–7, doi:10.1371/journal.pone.0008330. PMID 20016825.
- C. Eisenegger, M. Naef, R. Snozzi, M. Heinrichs, E. Fehr: Prejudice and truth about the effect of testosterone on human bargaining behaviour. In: Nature. Band 463, 2010, S. 356–359, doi:10.1038/nature08711 (englisch).
- Joyce T. Bromberger, Laura L. Schott, Howard M. Kravitz, u. a.: Longitudinal Change in Reproductive Hormones and Depressive Symptoms Across the Menopausal Transition. In: Archives of General Psychiatry. Band 67, Nr. 6, 2010, S. 598–607.
- E. Mutschler: Arzneimittelwirkungen. 7. Auflage. WVG, Stuttgart 1996, S. 380.
- Peter Kappeler: Verhaltensbiologie. Springer, Berlin/ Heidelberg 2011, ISBN 978-3-642-20653-5, S. 464 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eberhard Nieschlag: Hodenfunktion. In: Lothar Thomas (Hrsg.): Labor und Diagnose: Indikation und Bewertung von Laborbefunden für die medizinische Diagnostik. 7. Auflage. TH-Books-Verlags-Gesellschaft, Frankfurt am Main 2008, ISBN 978-3-9805215-6-7, S. 1497.
- Eberhard Nieschlag, Hermann M. Behre, Susan Nieschlag: Andrologie: Grundlagen und Klinik der reproduktiven Gesundheit des Mannes. 3. Auflage. Springer, Heidelberg 2009, ISBN 978-3-540-92962-8, S. 119–121.
- G. A. Kanakis, C. P. Tsametis, D. G. Goulis: Measuring testosterone in women and men. In: Maturitas. 2019, abgerufen am 1. März 2020 (englisch).
- R. Leproult, E. Van Cauter: Effect of 1 week of sleep restriction on testosterone levels in young healthy men. In: Journal of the American Medical Association. (JAMA.) Band 30, Nr. 21, 2011, S. 2173–2174, doi:10.1001/jama.2011.710 PMC 4445839 (freier Volltext)
- Wenyi Zhang, Katarzyna Piotrowska, Bahman Chavoshan, Jeanne Wallace, Peter Y. Liu: Sleep Duration Is Associated With Testis Size in Healthy Young Men. In: Journal of clinical sleep medicine. Band 14, Nr. 10, 15. Oktober 2018, S. 1757–1764, doi:10.5664/jcsm.7390, PMC 6175801 (freier Volltext)
- G. R. Dohle u. a.: EAU-Leitlinie Männlicher Hypogonadismus. In: Journal of Reproductive Medicine and Endocrinology. 2. Auflage. 2018 (kup.at).
- Substitution trotz normaler Testosteron-Werte. In: aerztezeitung.de. 30. Januar 2007, abgerufen am 3. Mai 2015.
- Nazeem Bassil: Late-Onset Hypogonadism. In: The Medical Clinics of North America. Band 95, Nr. 3, 2011, S. 507–523, doi:10.1016/j.mcna.2011.03.001.
- Frederick C. W. Wu, Abdelouahid Tajar, Jennifer M. Beynon u. a.: Identification of Late-Onset Hypogonadism in Middle-Aged and Elderly Men. In: New England Journal of Medicine. (NJEM) Nr. 363, 16. Juni 2010, doi:10.1056/NEJMoa0911101.
- Testosteron. Auf: laborlexikon.de, abgerufen am 17. Juni 2010.
- Initiative proHaar: Testosteron ist Freud und Leid des Mannes. (Memento vom 14. März 2013 im Internet Archive)
- Effect of Moderate Alcohol Consumption on Plasma Dehydroepiandrosterone Sulfate, Testosterone, and Estradiol Levels in Middle-Aged Men and Postmenopausal Women: A Diet-Controlled Intervention Study. Abgerufen am 2. Januar 2022 (englisch).
- Brian Matys: Wie männlich ist Alkohol wirklich? stronggeneration.com, abgerufen am 2. Januar 2022.
- Can alcohol promote aromatization of androgens to estrogens? A review. 3. November 2000, abgerufen am 2. Januar 2022 (englisch).
- Sex hormones and adrenocortical steroids in men acutely intoxicated with ethanol. Abgerufen am 2. Januar 2022 (englisch).
- Effects of acute alcohol intoxication on pituitary-gonadal axis hormones, pituitary-adrenal axis hormones, beta-endorphin and prolactin in human adults of both sexes. Abgerufen am 2. Januar 2022 (englisch).
- Effects of acute alcohol intake on pituitary-gonadal hormones in normal human males. Abgerufen am 2. Januar 2022 (englisch).
- Das passiert im Körper, wenn wir auf Alkohol verzichten. puarks.de, abgerufen am 2. Januar 2022.
- Julien Wolff: So erhöhen Sie auf natürliche Weise Ihren Testosteronwert. In: welt.de. Axel Springer SE, 15. März 2021, abgerufen am 16. März 2021.
- jp: Wussten Sie's? Diese Lebensmittel wirken stimulierend. In: merkur.de. Ippen Digital GmbH & Co. KG, 17. April 2020, abgerufen am 16. März 2021.
- Brian Matys: Zu viel Stress? – Diese 10 Lebensmittel senken Cortisol. Abgerufen am 2. Januar 2022.
- J. Schölmerich, S. Burdach u. a.: Medizinische Therapie 2005/2006. Springer, Berlin 2005, ISBN 3-540-21226-4, Kapitel: Transsexualität.
- Deutsche Gesellschaft für Phoniatrie und Pädaudiologie (DGPP): Zur stimmlichen Situation von sogenannten Frau-zu-Mann Transsexuellen: Selbstwahrnehmung, Fremdwahrnehmung und akustische Daten zur Geschlechtsdarstellung. Vortrag zur 20. Wissenschaftlichen Jahrestagung der DGPP, 12. bis 14. September 2003, Rostock.
- Janne Kieselbach, DER SPIEGEL: Coronavirus: Trifft es Männer härter? - DER SPIEGEL - Wissenschaft. Abgerufen am 31. März 2020.
- Benjamin C. Trumble, Eric A. Smith, Kathleen A. O'Connor, Hillard S. Kaplan, Michael D. Gurven: Successful hunting increases testosterone and cortisol in a subsistence population. In: Proceedings of the Royal Society Biological sciences. Band 281, Nr. 1776, 11. Dezember 2013, Artikel 20132876, doi:10.1098/rspb.2013.2876 (Volltext)
- Pia Heinemann: Harte Männer - wenig Testosteron. Auf: welt.de vom 1. April 2012; zuletzt abgerufen am 13. Juli 2017.
- Heidi Keller: Unterschiedliches Immunsystem - Männer trifft Schnupfen härter als Frauen. Gespräch mit Martin Thiel, SWR Umwelt und Ernährung Auf: swr.de vom 15. Februar 2017; zuletzt abgerufen am 13. Juli 2017.