Elefanten
Die Elefanten (Elephantidae) sind eine Familie aus der Ordnung der Rüsseltiere. Die Familie stellt die größten gegenwärtig lebenden Landtiere und schließt außerdem die einzigen heute noch lebenden Vertreter der Ordnungsgruppe ein. Es werden drei rezente Arten unterschieden: der Afrikanische Elefant, der die weitgehend offenen Landschaften Afrikas südlich der Sahara bewohnt, der ebenfalls in Afrika heimische, aber weitgehend auf tropische Regenwälder beschränkte Waldelefant und der im südlichen und südöstlichen Asien vorkommende Asiatische Elefant, der eine Vielzahl von Landschaftsräumen nutzt. Alle Elefanten sind durch ihren Rüssel, ein muskulöses Organ, das aus der Verwachsung der Nase mit der Oberlippe hervorgegangen ist, und durch ihre aus den oberen Schneidezähnen gebildeten Stoßzähne gekennzeichnet. Weitere auffällige Merkmale finden sich in dem massiven Körperbau mit säulenförmigen Beinen und der grauen, wenig behaarten Haut.
| Elefanten | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Afrikanische Elefanten | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Elephantidae | ||||||||||||
| Gray, 1821 |
Elefanten sind soziale Tiere, die in Familiengruppen aus weiblichen Individuen und deren Nachwuchs leben. Sie durchstreifen mehr oder weniger große Aktionsräume auf der Suche nach Nahrung. Die Größe der Aktionsräume und die Ausdehnung der Wanderungsbewegungen sind abhängig von lokalen Gegebenheiten wie dem genutzten Landschaftsraum und dem daraus resultierenden Nahrungsangebot. Männliche Tiere leben dagegen entweder einzelgängerisch oder formieren sich in Junggesellengruppen. Die Kommunikation untereinander, sowohl innerhalb als auch zwischen den verschiedenen Familiengruppen, findet auf mehreren Wegen statt. Zu diesen gehören Gerüche, die über Kot, Urin und Drüsensekrete vermittelt werden, Tastkontakte unter anderem mit dem Rüssel, verschiedene Körpergesten und eine reichhaltige Lautgebung, bei der variable Grolllaute im niedrigen Frequenzbereich hervorzuheben sind.
Die Nahrung der Elefanten basiert auf Pflanzen, die mit dem Rüssel aufgenommen werden. In der Regel nutzen die Tiere sowohl harte Bestandteile wie Gräser als auch weichere wie Blätter und Zweige. Die genaue Zusammensetzung wird von der jahreszeitlichen Verfügbarkeit der einzelnen Pflanzen bestimmt. Ausgewachsene männliche Tiere kommen einmal jährlich in die Musth, eine teils mehrmonatig andauernde Phase, die durch einen massiven Hormonanstieg gekennzeichnet wird. Als Resultat daraus kommt es nicht nur zu einer beständigen Sekretausscheidung, sondern auch zu einer erhöhten Aggressivität gegenüber Geschlechtsgenossen. Die Musth ist Teil des Fortpflanzungsverhaltens. Der Sexualzyklus der weiblichen Tiere währt außerordentlich lang und ist ebenfalls durch auffällige Hormonanstiege markiert. Nach einer Tragzeit von fast zwei Jahren wird zumeist ein einziges Jungtier geboren, das in der Familiengruppe aufwächst. Junge weibliche Tiere verbleiben hier nach der Geschlechtsreife, junge männliche verlassen diese dann.
Die Stammesgeschichte der Elefanten reicht bis in das ausgehende Miozän vor rund 7 Millionen Jahren zurück. Sie begann in Afrika und ist Teil der letzten Entwicklungsphase der Rüsseltiere. Neben den heute bestehenden zwei Gattungen (Loxodonta für die afrikanischen Elefanten und Elephas für die asiatischen Vertreter) sind zusätzlich mehrere ausgestorbene Formen überliefert. Die bekanntesten gehören zu den Gattungen Mammuthus (Mammute) und Palaeoloxodon. Diese erreichten auch Gebiete, die von den heutigen Arten nicht bewohnt werden, wozu etwa das westliche und nördliche Eurasien zählt. Beide Regionen durchliefen im Verlauf des Pleistozäns mehrere Vereisungsphasen, in deren Folge verschiedene kälteangepasste Elefantenarten entstanden, darunter das bekannte Wollhaarmammut. Einige Vertreter der Mammute erreichten auch als einzige Elefanten Nordamerika und begründeten dort eine eigene Entwicklungslinie. Ein Großteil der Angehörigen dieser Gattungen starb im Übergang vom Pleistozän zum Holozän vor etwa 10.000 Jahren aus, einige wenige verzwergte Inselformen überlebten noch ein wenig länger.
In der menschlichen Gesellschaftsentwicklung und Geschichte spielten Elefanten eine bedeutende Rolle. Sie wurden anfänglich als Nahrungsressource und Rohstoffquelle gejagt beziehungsweise genutzt, fanden bereits vor mehr als 30.000 Jahren Einzug in Kunst und Kultur und erlangten in späterer Zeit mit der Sesshaftwerdung und der Entstehung verschiedener Hochkulturen ebenfalls große Bedeutung. Einzig der Asiatische Elefant trat als gezähmtes Tier dauerhaft in den Dienst des Menschen. Er fungierte dabei zunächst als Last- und Arbeitstier, später wurde er in Kriegen eingesetzt und galt als Zeichen außerordentlicher Größe und Macht.
Die wissenschaftliche Erstbeschreibung des Afrikanischen und Asiatischen Elefanten datiert in das Jahr 1758. Beide Arten wurden zunächst einer einzigen Gattung zugewiesen, erst Anfang des 19. Jahrhunderts erfolgte die generische Trennung der beiden Vertreter. Der Waldelefant ist erst seit dem Beginn der 2000er Jahre als eigenständige Art anerkannt. Die Familie der Elefanten wurde 1821 eingeführt. Die Bestände der drei Arten gelten in unterschiedlichem Maße als gefährdet.
Merkmale
Habitus
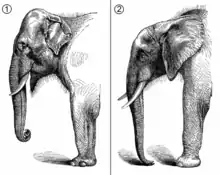
Elefanten sind die größten noch lebenden Landtiere. Der kleinste rezente Vertreter, der Waldelefant (Loxodonta cyclotis), erreicht eine Körperhöhe von rund 2,1 m und ein Gewicht von etwa 2 t, die größte heutige Form, der Afrikanische Elefant (Loxodonta africana) wird bis zu 3,7 m hoch und wiegt dann rund 6,6 t.[1][2] Das größte wissenschaftlich vermessene Exemplar, ein Tier aus Angola, besaß eine Schulterhöhe von 4 m und brachte vermutlich rund 10 t auf die Waage.[3][4][Anm 1] Zwischen diesen beiden Formen vermittelt der Asiatische Elefant (Elephas maximus) hinsichtlich Körpergröße und -gewicht. In ihrer stammesgeschichtlichen Vergangenheit zeigten die Elefanten eine deutlich höhere Variationsbreite. Die kleinsten Formen bilden einige inselbewohnende Zwergelefanten. Bei einigen dieser Elefanten war der Verzwergungseffekt so stark, dass sie nur zwischen 2 und 7 % der Größe der Ausgangsarten aufwiesen.[5] Hierzu zählen unter anderem der Sizilianische Zwergelefant (Palaeoloxodon falconeri) oder das Kreta-Zwergmammut (Mammuthus creticus), die nur rund 1 m hoch wurden und zwischen 170 und 240 kg wogen.[6][7] Die größten Elefanten finden sich mit Palaeoloxodon namadicus und Palaeoloxodon recki beziehungsweise mit dem Steppenmammut (Mammuthus trogontherii) und dem Präriemammut (Mammuthus columbi), deren Körperhöhe jeweils zwischen 4,2 und 4,5 m schwankte. Ihr Körpergewicht dürfte bei 12 bis 15 t gelegen haben.[8][9] Bezüglich der Größe besteht bei den heutigen Arten ein markanter Geschlechtsdimorphismus mit deutlich größeren männlichen Tieren gegenüber den weiblichen.[1][2]
Allgemein sind Elefanten massige Tiere mit einem großen und kurzen, dafür hohen Kopf auf kurzem Hals, säulenförmigen Beinen und einem über einen Meter langen Schwanz mit pinselartigem Ende. Das auffälligste Merkmal bildet der Rüssel, ein schlauchförmiger Muskelkörper entstanden aus der mit der Oberlippe verwachsenen Nase. Die Ausprägung des Rüssels bewirkt, dass die Maulöffnung bei den Elefanten verhältnismäßig klein ist. Als weiteres Kennzeichen kommen die vor allem bei erwachsenen Tieren ausgebildeten oberen Stoßzähne hinzu. Seitlich am Kopf setzen große, fächerartige Ohren an, die je nach Art unterschiedliche Ausmaße haben. Der Körper ist plump, die Rückenlinie verläuft entweder gerade beziehungsweise gesattelt wie bei den afrikanischen Elefanten oder aufgewölbt wie beim Asiatischen. Bei ersteren liegt der höchste Körperpunkt an den Schultern, beim letzteren auf der Stirn. Das Fellkleid der Elefanten ist sehr spärlich ausgebildet, längere Haare treten zumeist am Kinn und an der Rüsselspitze sowie am Schwanzende auf. Die Haut ist grau gefärbt, weist aber häufig pigmentfreie Flächen auf. Die eigentliche Hautfarbe kann durch Erd- und Staubbedeckung übertüncht sein.[1][2]
Die größeren Vorderbeine tragen rund 60 % des Körpergewichts. Vorder- und Hinterfüße enden in jeweils fünf Strahlen. Diese sind aber äußerlich nicht sichtbar, sondern in ein Polster eingebettet, das aus verschiedenen Strängen und Lagen von faserigem Bindegewebe besteht, unterbrochen wiederum durch Kammern aus Fettgewebe. Zusätzlich enthält es noch Kollagen, Reticulin und elastische Fasern. Das Polster durchsetzt den Fuß und füllt den Raum zwischen den einzelnen Knochen aus. Die Fußsohle besteht aus einer einheitlichen Fläche, die vorn rundlich, hinten oval geformt ist. An der jeweiligen Vorderseite bestehen „nagel-“ oder „hufartige“ Strukturen, deren Zahl teilweise zur Artunterscheidung herangezogen wird (Afrikanischer Elefant vorn vier, hinten drei; Waldelefant vorn fünf, hinten vier; Asiatischer Elefant vorn fünf, hinten vier bis fünf), prinzipiell aber stark variabel ist. In der Regel sind die seitlichen Nägel reduziert.[10][11] Die „Hufe“ ähneln weitgehend den vergleichbaren Bildungen bei den Huftieren.[12][10]
Schädel


Der Schädel der Elefanten ist groß gestaltet sowie hoch und kurz. Die Schädeldecke am höchsten Punkt wölbt sich teilweise kuppelartig auf. Der kurze Schädel entstand durch die Reduktion der Schnauzenpartie und die Vorverlagerung des Hinterhauptbeines; das Letztere fällt bei den heutigen Elefanten stark nach vorn ein. Die Kompression des Schädels im vorderen und hinteren Bereich bewirkt auch, dass der Schwerpunkt weit nach hinten verlagert ist. Ein herausragendes Merkmal stellen die großen, bienenwabenartig gestalteten, luftgefüllten Kammern dar, die das Stirnbein, Scheitelbein, Nasenbein und den Zwischenkieferknochen durchsetzen. Dadurch kann die Schädeldecke eine Dicke von bis zu 40 cm erreichen. Die Pneumatisierungen vergrößern die Oberfläche des Schädels enorm und erweitern so die Ansatzfläche für die massive Kau- und Nackenmuskulatur. Gleichzeitig verringern sie das Gewicht des Schädels. Ein weiteres Kennzeichen ist das stark zurückgebildete Nasenbein, wodurch Platz für die außerordentlich große Muskulatur des Rüssels entstand. Beide Merkmale finden sich bei zahlreichen Rüsseltierlinien. Durch die Reduktion des Nasenbeins ist der Zwischenkiefer auch direkt mit dem Stirnbein verbunden, was als generelles Merkmal der Tethytheria gilt. Bei den Elefanten rahmt der Zwischenkieferknochen die jeweilige Alveole der Stoßzähne ein. Die Stoßzahnalveolen stehen eher senkrecht am Schädel, wodurch die Stoßzähne nach unten austreten, was ebenfalls dem kurzen Schädel geschuldet ist. Dies bildet einen deutlichen Kontrast zu den meisten früheren Rüsseltierformen, deren Stoßzahnfächer durch den langen Schädel deutlicher horizontal orientiert sind. Als weitere elefantentypische Charakteristika können die hohe Lage der Nasenöffnung sowie die nach vorn orientierten Orbita herausgehoben werden. Die Stauchung des Schädels führte auch zu Änderungen an der Schädelbasis. Hier sind die senkrechte Stellung der Flügelfortsätze des Keilbeins und der nach unten gedellte Gaumen zu nennen.[13][13][14][15]
Der Unterkiefer der Elefanten ist kurz und hoch. Der horizontale Knochenkörper wirkt massiv, der aufsteigende Ast ist stark verbreitert. Aus der besonderen Form des Unterkiefers ergibt sich, dass der Kronenfortsatz, eine als Muskelansatzstelle dienende knöcherne Verlängerung des aufsteigenden Astes, weit vorn lagert und etwa über dem (Masse)-Schwerpunkt liegt. Gemeinsam mit dem Gelenkfortsatz ragt er weit auf, so dass sich die Gelenkverbindung mit dem Schädel deutlich oberhalb der Kauebene befindet. Die Symphyse, welche die beiden Unterkieferhälften am vorderen Ende miteinander verbindet, zeigt sich ebenfalls kurz. Gegenüber ursprünglicheren Elefantenformen ist der Unterkiefer der heutigen Vertreter somit auffallend gestaltet. Bei ersteren war er noch deutlich gestreckter, besaß eine lange Symphyse, an der sich seitlich die Zahnfächer der Unterkieferstoßzähne anschlossen.[13][13][14][15]
Zahlreiche der elefantentypischen Merkmale an Schädel und Unterkiefer sind auf eine Umstrukturierung im Kauapparat zurückzuführen, welche die Kürzungen in Schädellängsrichtung hervorrief. Der Kauapparat ist auf horizontale Vor- und Rückwärtsbewegungen spezialisiert. Andere frühere Rüsseltierlinien benutzten dagegen vor allem seitlich orientierte Mahlbewegungen.[13][13]
Stoßzähne

Elefanten besitzen zwei Arten von Zähnen: Die zu Stoßzähnen gewandelten, hypertrophierten und wurzellosen mittleren Schneidezähne der oberen Zahnreihe (I2) und die Backenzähne. Ältere Formen wie Stegotetrabelodon besaßen noch Stoßzähne im Unterkiefer, die sich aus den unteren inneren Schneidezähnen entwickelt hatten, im Verlauf der Stammesgeschichte aber durch Kürzungen im Unterkiefer, vor allem im Bereich der Symphyse verlorengingen, ein Prozess, der in mehreren Linien innerhalb der Rüsseltiere nachvollzogen werden kann. Heutige Elefanten benutzen ihre Stoßzähne überwiegend zum Graben, zum Entrinden der Bäume, zum Tragen schwerer Objekte sowie als Waffe gegen Konkurrenten beziehungsweise beim Imponiergehabe. Die Stoßzähne wachsen permanent und das gesamte Leben lang. Sie können sowohl bei beiden Geschlechtern, etwa beim Afrikanischen Elefanten beziehungsweise bei den verschiedenen Mammuten, oder hauptsächlich bei männlichen Tieren, beispielsweise beim Asiatischen Elefanten, ausgebildet sein. In der Regel sind sie nach oben und außen gebogen oder spiralig geformt. Heutige Arten können Stoßzähne von bis zu 345 cm Länge tragen, deren Gewicht mitunter 110 kg überschreitet, wobei der Afrikanische Elefant durchschnittlich größere Stoßzähne als der Asiatische Elefant hat.[16][17] Die längsten bekannten Stoßzähne waren aber bei den verschiedenen Mammuten ausgebildet – Rekordmaße belaufen sich auf 490 cm. In der Regel steckt etwa ein Viertel der Länge der Stoßzähne in den Alveolen.[18] Jungtiere besitzen Milchstoßzähne, sogenannte „Hauer“ (tushes), die noch im ersten Lebensjahr ausfallen und durch die permanenten Zähne getauscht werden.[19]
Die Stoßzähne, allgemein auch Elfenbein genannt, werden aus Carbonat-Hydroxylapatit-Kristallen gebildet (Hauptbestandteil Dahllit), die mit Kollagenfasern verbunden sind. Dabei tragen die Kristalle hauptsächlich zur Härte der Stoßzähne bei, während die Kollagenfasern für die Elastizität sorgen. Strukturell bestehen die Stoßzähne aus drei Zonen. Den Hauptbestandteil bildet das Zahnbein, das der Knochensubstanz ähnelt, aber stark mineralisiert und daher frei von Zellen ist. Es besitzt einen faserigen Aufbau und ist von zahlreichen, mit Kollagen gefüllten Kanälchen durchsetzt. Der mineralische Anteil beträgt rund 59 %, der organische etwa 33 %, der Rest entfällt auf Wasser.[19] Umhüllt wird das Zahnbein von einer dünnen Schicht aus Zahnzement. Im Inneren dehnt sich die Pulpa aus, die hauptsächliche Wachstumszone. Das hier entstehende neue Zahnmaterial lagert sich in mehrfachen Wachstumsschüben ab, deren Länge zwischen wenigen Millimetern bis zu 35 cm variiert. Im Durchschnitt kann mit einer jährlichen Zuwachsrate von etwa 17 cm gerechnet werden.[14] Durch die Wachstumsschübe setzt sich der Stoßzahn aus zahlreichen übereinandergestülpten, konischen „Hüten“ zusammen. Im Querschnitt erscheinen diese Wachstumsphasen als ringartig mit den ältesten Zonen an der Außenseite und den jüngsten im Innern, vergleichbar den Baumringen in umgekehrter Reihenfolge.[20][21] Für die Bildung des Zahnbeins bedarf es großer Mengen an Calcium und Natrium, die beim Asiatischen Elefanten etwa täglich 60 g Calcium und 100 g Natrium betragen.[19] Zahnschmelz ist an den Stoßzähnen der Elefanten in der Regel nicht ausgebildet, er findet sich lediglich an der Spitze, wird dort aber relativ schnell durch Nutzung der Zähne abgeschliffen. Im Gegensatz dazu weisen die Milchstoßzähne noch eine dünne Zahnschmelzschicht auf. Der fehlende Zahnschmelz unterscheidet die Elefanten von stammesgeschichtlich älteren Rüsseltierlinien.[20][19]

Das Zahnbein der Stoßzähne besitzt eine auffällige komplexe Bildung, die als „Schreger-Linien“ bezeichnet werden und ausschließlich bei den Elefanten vorkommen. Es handelt sich dabei um abwechselnd hell und dunkel gefärbte Bereiche, die im Zahnquerschnitt ein Schachbrettmuster formen. Es setzt sich aus rhombischen, wechselnd hell oder dunkel gefärbten Flächen zusammen, die einerseits radial vom äußeren Zahnzement zur inneren Pulpa, andererseits tangential entlang des Zahnzements verlaufen. Größe und Form der Flächen variieren je nach Lage im Zahnquerschnitt mit kleineren Rhomben im Inneren, größeren außen und eher quadratischen Strukturen im zentralen Bereich. Die Größe der einzelnen Flächen reicht von 200 bis 800 μm². Durch die wechselnde Ausdehnung der Flächen entsteht im Zahnquerschnitt die optische Illusion eines Spiralmusters mit sich überschneidenden Linien. Der Winkel, mit dem die Linien aufeinandertreffen, wird als „Schreger-Winkel“ bezeichnet und kann zur Artbestimmung herangezogen werden (Afrikanische Elefanten 118 (L. africana) bis 123 ° (L. cyclotis), Asiatischer Elefant 112 °, Wollhaarmammut 87 °, Europäischer Waldelefant 130 °). In Längsrichtung zum Stoßzahn zeigen sich die „Schreger-Linien“ als Bandmuster aus hellen und dunklen Flächen mit Stärken von rund 500 μm. Der Ursprung des Musters wird kontrovers diskutiert. Einige Forscher sind der Ansicht, dass die „Schreger-Linien“ durch die Anordnung der Zahnbein-Kanälchen entstehen, die wiederum ihren Ursprung in der Wanderung der Odontoblasten während des Stoßzahnwachstums und der Zahnbeinbildung haben. Andere Autoren leiten das Muster aus der speziellen Orientierung der Kollagenfasern her.[21][22][23][19]
Hinteres Gebiss und Zahnwechsel

Oben: Afrikanischer Elefant.
Mitte: Asiatischer Elefant.
Unten: † Wollhaarmammut;
Anzahl und Dicke der Schmelzlamellen geben Aufschluss über die Ernährungsgewohnheiten


Kennzeichnendes Merkmal der hinteren Zähne ist ihr Aufbau aus einzelnen Lamellen, was entsprechend als lamellodont bezeichnet wird.[24] Die einzelnen Lamellen bestehen aus Zahnschmelz und sind in einer Matrix aus Zahnzement eingebettet. Je nach Art unterscheiden sich die Zähne in Anzahl und Verlauf der Schmelzlamellen, sie haben somit taxonomischen Wert. Ein unterscheidendes Kriterium ist dabei die Lamellenfrequenz, die sich aus der Anzahl der Schmelzlamellen auf je zehn Zentimeter Zahnlänge ergibt. Bewertungsgrundlage ist zumeist der dritte Mahlzahn, der am größten wird und dem zufolge die höchste Anzahl an Schmelzfalten aufweist. Er kann bis zu 5 kg wiegen und besitzt beim Afrikanischen Elefanten bis zu 13, beim Asiatischen bis zu 24 Schmelzlamellen. Das ausgestorbene Wollhaarmammut (Mammuthus primigenius) hatte als am stärksten spezialisierte Elefantenart Backenzähne mit bis zu 30 Schmelzlamellen. Generell nimmt die Anzahl der Schmelzlamellen innerhalb der einzelnen Entwicklungslinien (Gattung) der Elefanten zu. Dies geht einher mit einer Ausdünnung des Zahnschmelzes, so dass stammesgeschichtlich jüngere Formen gegenüber älteren weitgehend schmalere und engerstehende Lamellen besitzen. Die Zunahme der Schmelzlamellen je Zahn reflektiert wiederum unmittelbar die wechselnden Ernährungsweisen der Tiere. Um mit dem ausdünnenden Zahnschmelz den starken Abrasionskräften beim Kauen zu widerstehen, formte dieser einerseits extrem enge Faltungen und Windungen aus, andererseits kam es auch zur Aufhöhung der Zahnkronen. Heutige Elefanten haben hochkronige (hypsodonte) Backenzähne (das heißt, die Zahnhöhe übertrifft die Zahnbreite), ursprünglichere Formen wiesen demgegenüber häufig niederkronige (brachyodonte) Zähne auf.[25][13][26][27]
Zwischen den Stoßzähnen und den Backenzähnen befindet sich ein zahnfreier Bereich, der allgemein als Diastema bezeichnet wird. Ein solches Diastema ist typisch für das Gebiss pflanzenfressender Säugetiere. Über das ganze Leben hinweg betrachtet, verfügt ein Elefant über sechs Backenzähne pro Kieferhälfte: drei Prämolaren (Vormahlzähne dP2 bis dP4 beziehungsweise dp2 bis dp4) und drei Molaren (Mahlzähne M1 bis M3 beziehungsweise m1 bis m3), wobei die Prämolaren den Milchbackenzähnen entsprechen, die Molaren den auch bei anderen Säugetieren üblichen permanenten hinteren Backenzähnen. Es sind also insgesamt 24 Backenzähne ausgebildet. Die Zahnformel einschließlich der Stoßzähne wird zumeist folgendermaßen angegeben: .[28] Allgemein hat das Gebiss ausgewachsener heutiger Elefanten demzufolge keine dauerhaften Prämolaren mehr, bei einigen frühen Formen wie Stegotetrabelodon, Primelephas und bei ursprünglichen Vertretern der Gattung Loxodonta kam noch ein dauerhafter letzter Prämolar vor. Dieser bei den urtümlicheren Elefanten üblicherweise kleine Zahn war wesentlich häufiger bei älteren Linien der Rüsseltiere und ging im Laufe der Stammesgeschichte mehrfach unabhängig voneinander verloren, meist im Zusammenhang mit der Reduktion der unteren Stoßzähne und der damit verbundenen Längenabnahme der Unterkiefersymphyse.[29]
Da die Kiefer der Elefanten relativ kurz und die Backenzähne vergleichsweise groß sind, trägt eine Kieferhälfte immer nur eins bis drei Backenzähne gleichzeitig, wobei aber nur ein Teil durchgebrochen, also sichtbar ist. Die Kaufläche wird stets nur von dem Backenzahn oder den Backenzähnen gebildet, die sich nahe dem Diastema befinden (also im vorderen Bereich des Kiefers). Ausgewachsene Elefanten haben so maximal anderthalb Backenzähne je Kieferast gleichzeitig in Funktion.[13][13][2] Beim Kauen beziehungsweise Zermahlen der relativ harten Pflanzennahrung nutzen sich die Zähne stark ab. Um zu gewährleisten, dass die Mahlleistung stets gleichbleibt, wandert vom hinteren Ende des Kiefers kontinuierlich, wie auf einem sehr langsamen Fließband, „frisches“ Zahnmaterial zum Diastema hin. Diese Wanderung wird durch Resorption und Neuaufbau von Kieferknochensubstanz ermöglicht. Bei den stark abgenutzten Zahnteilen unmittelbar am Diastema wird die Wurzel resorbiert, sodass sie absterben, keinen Halt mehr im Kiefer haben und schließlich abbrechen.[30] Nachdem die ersten drei Backenzähne des Jugendstadiums ausgefallen sind, erfolgt der vollständige Durchbruch des vierten im Alter von etwa 10 bis 14 Jahren, der des fünften mit 26 bis 27 Jahren und des sechsten und letzten mit 34 bis 37 Jahren (jeweils gerechnet auf das Lebensalter eines Afrikanischen Elefanten). Wenn ein Elefant noch zu Lebzeiten alle seine 24 Backenzähne verschlissen hat, muss er verhungern.[28] Diese spezielle Form der Erneuerung von Zahnsubstanz wird horizontaler Zahnwechsel genannt und kommt heute fast ausnahmslos bei Elefanten vor. Sie hat sich innerhalb der Rüsseltiere schon stammesgeschichtlich sehr früh entwickelt und ist erstmals bei der Gattung Eritreum im Oberen Oligozän vor rund 27 Millionen Jahren nachgewiesen.[31]
Der horizontale Zahnwechsel führt zu zyklischen Veränderungen des Körpergewichts bei den Elefanten. Hervorgerufen wird dies durch das Nachschieben eines neuen Zahns, der dann als zusätzliche Kaufläche zur Verfügung steht. Dadurch kann ein Tier individuell mehr Nahrung aufnehmen oder intensiver zerkauen. Die Schwankungen des Körpergewichts betragen bis zu 300 kg, sie sind aber nur bei Zootieren mit regelmäßiger und gleichmäßiger Nahrungsversorgung feststellbar. Wildlebende Elefanten unterliegen einem jahreszeitlich sowohl qualitativ als auch quantitativ abweichendem Nahrungsangebot, wodurch dieser Effekt möglicherweise überlagert wird.[32]
Körperskelett


Das Skelett der Elefanten besteht aus 320 bis 346 Einzelknochen. Bei einem untersuchten Asiatischen Elefanten wog es im frischen Zustand 374 kg und machte etwa 15 % der Körpermasse aus. Die Wirbelsäule besteht aus 7 Hals-, 18 bis 21 Brust-, 3 bis 5 Lenden-, 3 bis 6 Kreuzbein- und 18 bis 34 Schwanzwirbeln. Die Anzahl der Wirbel und auch der Rippen (18 bis 21 Paare) variiert je nach Art.[33][14] Den Langknochen fehlt die typische Markhöhle, stattdessen ist das Innere mit spongiösem Material gefüllt. Gleiches gilt für die Rippen. An den Vorderbeinen ist der Oberarmknochen äußerst kräftig gebaut, sein Gelenkkopf hebt sich nur undeutlich vom Schaft ab. Den Unterarm dominiert die Elle, die etwa fünfmal so schwer wie die Speiche wird. Beide Knochen sind nicht miteinander verwachsen. Das Becken wird durch die extrem große und weit ausladende Schaufel des Darmbeins geprägt. Der Oberschenkelknochen ist der längste Knochen des Skeletts. Er kann bei einem Afrikanischen Elefanten bis zu 127 cm lang werden, bei einzelnen ausgestorbenen Formen wie einigen Vertretern der Gattungen Mammuthus und Palaeoloxodon war er 140 bis 165 cm lang.[8][9] Der Gelenkkopf ist typischerweise deutlich gerundet, ein dritter Rollhügel (Trochanter tertius) fehlt und ist nur als schwacher Punkt unterhalb des großen Rollhügels (Trochanter major) am vorderen oberen Schaft ausgebildet. Das Kniegelenk zeigt eine erweiterte Ruheposition, sodass beim Stehen der Winkel zwischen Oberschenkel und Schienbein fast 180 ° beträgt. Dies ist für vierfüßige Landwirbeltiere ungewöhnlich und nur beim zweibeinigen Menschen anzutreffen. Das Oberschenkelgelenk der Elefanten zeigt große Ähnlichkeit mit dem des Menschen. Die Menisken sind sehr schmal und dünn und das Kreuzbandsystem ist ebenfalls vorhanden. Die Bewegungsmuster der gewichtstragenden hinteren Gliedmaßen erinnern ebenfalls mehr an den Menschen als an cursoriale (schnellläufige) Landwirbeltiere. Die Hauptbewegung des Kniegelenks ist eine Extension-Flexion mit einem Aktionsradius von 142 °. Im fortgeschrittenen Alter sind die Kniegelenke anfällig für Arthrose.[34] Wie am Unterarm sind am Unterschenkel Schien- und Wadenbein nicht fusioniert.[35][36]

Die Vorder- und Hinterfußknochen ordnen sich als Bogen an, die Knochen stehen weitgehend vertikal. Dies ist als Anpassung an das extreme Gewicht der Tiere zu betrachten, da dadurch der Widerstand im Bereich des Knöchels beim Laufen vermindert wird. Demnach können die Elefanten aus anatomischer Sicht als Zehenspitzengänger betrachtet werden. Funktional stellen sie Sohlengänger dar, da sich zum Ausgleich für das hohe Gewicht, das auf den Zehenspitzen lastet, das bereits erwähnte Fußpolster mit der durchgehenden Sohle entwickelt hat. Typisch für die Tethytheria sind sowohl die Hand- als auch die Fußwurzelknochen seriell angeordnet, das heißt, die einzelnen Knochen liegen in Reihe hintereinander und nicht wechselseitig zueinander. Dieser Aufbau wird als taxeopod bezeichnet, ein Merkmal, das die Rüsseltiere allgemein mit den Schliefern und den Seekühen teilen.[37] Am Vorderfuß tragen nur die drei mittleren Strahlen (II bis IV) je drei Fingerglieder, der innere (I) besitzt jeweils eines, der äußere (V) zwei. Von den fünf vorhandenen Strahlen am Hinterfuß weisen der zweite bis fünfte jeweils Zehenglieder auf, der innerste Strahl besteht nur aus dem Mittelfußknochen. Drei Zehenglieder kommen allerdings nur am dritten und vierten Strahl vor, ansonsten sind es zwei. Generell ist die Ausprägung der Phalangenanzahl sehr variabel bei den heutigen Elefanten.[38] Die Phalangen sind meist kurz und breit, ihre Größe nimmt von der ersten zur dritten rapide ab. Die äußerst kleine Endphalanx, sofern vorhanden, artikuliert in der Regel nicht direkt mit der mittleren. Zur Unterstützung hat sich bei den Elefanten zu den fünf regulären Strahlen ein sechster ausgebildet, der seitlich an der Innenseite liegt und dem Daumen beziehungsweise dem großen Zeh vorangeht. Er wird entsprechend an den Vorderfüßen als Präpollex („Vordaumen“) und am Hinterfuß als Prähallux („Vorzehe“) bezeichnet. Beide Strukturen entstehen in der Individualentwicklung aus knorpeligen Sesambeinen und verknöchern mit der Zeit. Die Bildung kann mit der Umstrukturierung des Vorder- und Hinterfußes im Laufe der Stammesgeschichte der Rüsseltiere in Verbindung gebracht werden, als sich der Zehenspitzengang aus dem Sohlengang der urtümlicheren Vorläufer heraus entwickelte.[35][36][10][39]
Rüssel


Der Rüssel gehört zu den auffälligsten anatomischen Merkmalen der Elefanten. Er stellt eine Verwachsung der Nase mit der Oberlippe dar, welche bereits im Fötalalter miteinander verschmelzen.[40][41] Äußerlich bildet er einen muskulären Schlauch ohne knöchernen Unterbau, der von den Nasengängen durchzogen wird. Am unteren Ende des „Schlauches“ treten diese durch die Nasenlöcher heraus. Das Füllvolumen beträgt bei einem Asiatischen Elefanten mit rund 1,8 m langem Rüssel etwa 2,2 bis 3,1 l. Umgeben werden die Nasenlöcher von einer breiten, ebenen Fläche, an deren Rändern „fingerförmige“ Ausstülpungen aufragen. Beim Afrikanischen Elefanten sind dies zwei gegenständige „Finger“ am oberen und unteren Rand, beim Asiatischen nur ein einzelner am oberen. Das Wollhaarmammut besaß ebenfalls nur einen „Finger“ an der oberen Kante, wies aber gegenüberstehend einen breiten, schaufelförmigen Zipfel auf. Die Ausstülpungen dienen primär als Greiforgan. Prinzipiell besteht der Rüssel aus Haut, Haaren und Muskeln sowie Blut- und Lymphgefäßen beziehungsweise Nerven und einem geringen Anteil an Fett. Knorpelgewebe ist nur am Nasenansatz ausgebildet. Als hochsensitives Organ wird der Rüssel von zwei Nerven durchzogen, dem Nervus facialis und dem Nervus trigeminus. Die Muskeln wirken unterstützend. Es sind zwei Muskeltypen ausgebildet, die einerseits längs, andererseits quer beziehungsweise diagonal verlaufen. Teils wurde angenommen, dass 40.000 bis 60.000 zu Bündeln verflochtene Muskeln den Rüssel bewegen, Extrapolationen an einem sezierten Tier ergaben dagegen bis zu 150.000 Muskelbündel. Zu den Hauptmuskelgruppen gehören die vorderen levators proboscidis, die am Stirnbein ansetzen, durch den gesamten Rüssel verlaufen und diesen zum Heben bringen. Weiterhin bedeutend sind die depressores proboscidis. Diese nehmen den unteren Bereich des Rüssels ein und sind stark mit den Quermuskeln und der Haut verbunden. Dabei scheinen beim Rüssel des Afrikanischen Elefanten mehr ringartige Quermuskeln aufzutreten, so dass dieser beweglicher und „lappiger“ wirkt als beim Asiatischen Elefanten.[33][14]
Evolutiv entstand der Rüssel schon sehr früh in der Stammesgeschichte der Rüsseltiere. Die Herausbildung des Rüssels führte zu einigen anatomischen Änderungen im Schädelbereich, die vor allem der Ausbildung der massiven Muskulatur geschuldet sind. Die markanteste findet sich in einer außerordentlichen Reduktion des Nasenbeins und einer stark vergrößerten Nasenöffnung. Sekundär kam es auch zur Rückbildung des vorderen Gebisses. Da der Rüssel die Distanz vom Kopf zum Erdboden überbrückt, die der kurze Hals nicht bewerkstelligen kann, ist ersterer unabdingbar bei der Nahrungsaufnahme. Die Schneidezähne, die bei zahlreichen Säugetieren hauptsächlich in schneidender Weise bei der Nahrungsaufnahme Einsatz finden, hatten bei den Rüsseltieren dadurch keine vordergründige Funktion mehr. Mit Ausnahme der Stoßzähne entwickelten sie sich deshalb zurück. Darüber hinaus ist der Rüssel ein Multifunktionsorgan, welches als Tast- und Greiforgan, zur Atmung beziehungsweise Geruchswahrnehmung sowie als Waffe und Drohmittel, zusätzlich auch als Saug- und Druckpumpe beim Trinken dient. Durch die an seinem unteren Ende befindlichen Tasthaare eignet er sich auch als Tastorgan, mit dem die Tiere kleinste Unebenheiten wahrnehmen können. Er findet zudem Einsatz bei der Kontaktaufnahme zu Artgenossen in der Herde, etwa bei den komplexen Begrüßungsritualen und beim Spiel. Mit dem Rüssel werden Staub und Schmutz auf der Haut verteilt, was zum Schutz vor der starken Sonneneinstrahlung und vor Insekten geschieht. Des Weiteren wird der Rüssel zum Greifen von Gegenständen benutzt, beispielsweise, um sie zum Mund zu führen. Mit seiner Hilfe kann ein Tier Äste und Pflanzen aus bis zu sieben Meter Höhe erreichen. Ähnlich einem Giraffenhals verdoppelt er damit seine Streckhöhe. Gelegentlich dient der Rüssel beim Baden oder Schwimmen als eine Art Schnorchel, zum Riechen wird er hoch in die Luft gehalten. Ausgebildete Arbeitselefanten können mit Hilfe des Rüssels und mit Unterstützung der Stoßzähne sowie in Zusammenarbeit mit dem Elefantenführer Gegenstände von erheblichem Gewicht manipulieren, heben und bewegen.[42][2][2]
Haut und Ohren

Die Haut eines untersuchten Asiatischen Elefanten wog insgesamt 211 kg und bedeckte eine Fläche von 11,96 m². Das Gewicht der Haut entsprach demnach etwa 9,8 % des individuellen Körpergewichts.[33] Im Vergleich dazu kann beim Afrikanischen Elefanten die Hautoberfläche bis zu 26 m² betragen. Die Haut ist mitunter sehr dick, beim Asiatischen Elefanten bis 30 mm, beim Afrikanischen Elefanten bis zu 40 mm. Charakteristisch sind eine dicke Hornschicht, verschiedene Hautfalten und das Fehlen von Schweiß- und Talgdrüsen. Die Thermoregulation erfolgt daher über Verdunstungswasser auf der Hautoberfläche und durch Ohrwedeln.[43][44] Individuelle Maßnahmen stellen Wasser- und Schlammbäder dar. Zusätzlich zu den Faltungen der Haut ist diese beim Afrikanischen Elefanten durch tiefe Furchen stark ornamentiert. Die Furchen und Risse entstehen in den obersten Schichten der Epidermis (Stratum corneum), welche bei ausgewachsenen Individuen nur wenige Hautschuppen besitzt und stark verhornt ist, wodurch sie bei Biegebelastung aufbricht. Das in den Rissen eindringende Wasser kann dort fünf- bis zehnmal so lange gespeichert werden wie jenes direkt an der Oberfläche und trägt so zur Regulierung der Körpertemperatur bei.[45]
Die Afrikanischen und der Asiatische Elefant unterscheiden sich in der Ohrgröße. Bei letzterem werden sie rund 60 cm breit und 55 cm hoch und bedecken eine Fläche von 0,5 m² (beide Seiten insgesamt).[33] Erstere haben Ohren von bis zu 137 cm Höhe und 89 cm Breite. Sie nehmen bis zu 20 % der gesamten Hautoberfläche ein.[46][43] Als weiterer Unterschied kann die Faltung der Ohren genannt werden, die beim Asiatischen Elefanten den oberen Abschnitt betrifft, beim Afrikanischen hingegen den seitlichen. Die Ohren des Wollhaarmammuts sind noch einmal deutlich kleiner als beim Asiatischen Elefanten. Hinsichtlich der Ohrgröße lässt sich somit teilweise eine Anpassung an die geographische Breite erkennen, die bei den Afrikanischen Elefanten die Äquatorregion umfasst, beim Wollhaarmammut dagegen die weitgehend hohen arktischen Landschaften.[28] Die Ohren bestehen aus einer beidseitigen Schicht an Haut und einer Lage aus Knorpelgewebe dazwischen.[33]
Temporaldrüse

Ein weiteres markantes und einzigartiges Merkmal bildet die Temporaldrüse („Schläfendrüse“) seitlich des Auges, die bei männlichen Tieren während der Musth ein öliges Sekret absondert. Die Drüse ist auch von fossilen Formen wie dem Wollhaarmammut überliefert.[14] Sie wird 13 bis 14 cm lang und ist flach, ihr Gewicht beträgt etwa 0,23 bis 1,59 kg. Im Innern besteht sie aus verschiedenen lappenartigen Strukturen, die mit Bindegewebe miteinander verbunden sind und einen Hohlraum von rund 5 cm Durchmesser einschließen. Der Hohlkörper führt über eine nur 2 cm weite Öffnung an die Hautoberfläche. Ihn umgeben stäbchen- oder röhrenförmigen Zellen und verschiedene Lumen. Während der ausgeprägten Musth sind die Lumen mit lockerem Zellmaterial, freien Zellkernen und Mitochondrien gefüllt. Letztere weisen einen Aufbau typisch für steroidproduzierende Zellen auf (mit kammartiger innerer Membran) wie beispielsweise Leydig-Zwischenzellen. Diese sind gemeinsam mit dem glatten endoplasmatischen Retikulum sowie den Golgi-Körpern bedeutend für die Testosteron-Produktion. In den Zellen um den Hohlkörper sind wiederum zahlreiche Mikrovilli und Sekretvakuolen eingebettet.[47][33][48]
Während der Testosteron-Produktion hypertrophieren die Zellen. Sowohl ihre Anzahl als auch der Anteil der mitochondrialen inneren Membran, des glatten endoplasmatischen Retikulums und der Golgi-Körper nehmen zu. Zum Höhepunkt brechen die Zellstrukturen zusammen und füllen die Lumen aus. Ihren Ursprung hat die Temporaldrüse offenbar in Schweißdrüsen mit apokrinem Sekretionsmechanismus.[48] In der chemischen Zusammensetzung des produzierten Sekrets unterscheiden sich die heutigen Elefantenarten. Beim Afrikanischen Elefanten ist beispielsweise der Anteil an Proteinen, Natrium oder saurer Phosphatase deutlich geringer als beim Asiatischen Elefanten.[49][50]
Innere Organe
Die inneren Organe der Elefanten sind im Verhältnis nicht größer als bei anderen Säugetieren. Das Gehirn der heutigen Elefanten hat 257 Milliarden Nervenzellen, was etwa der 3-fachen Menge des Menschen entspricht. Mit rund 98 % ist der Großteil davon im Kleinhirn verteilt. Diese außergewöhnliche Konzentration wird auf die taktilen Befähigungen der Tiere zurückgeführt. In der Großhirnrinde, die etwa doppelt so groß ist wie beim Menschen, sind demgegenüber nur 5,6 Milliarden Nervenzellen ausgeprägt. Hier verfügt der Mensch über etwa das Dreifache an Zellen, was wiederum mit seinen kognitiven Fähigkeiten zusammenhängt.[51] Insgesamt weist das Gehirn eines ausgewachsenen Elefanten ein Volumen zwischen 2900 bis 5140 cm³ auf, was das des Menschen um das Dreifache übertrifft. In Relation zum Körpergewicht ist das Gehirn der Elefanten aber kleiner als beim Menschen und bei den Menschenaffen, der Enzephalisationsquotient beträgt bei den heutigen Elefanten etwa 1,7, beim Menschen 7,5.[28] Neugeborene verfügen bereits über 35 % der Größe des Gehirns eines ausgewachsenen Tieres. Bei einigen ausgestorbenen Formen erreichte das Gehirn ein Volumen von über 6000 bis hin zu 9000 cm³, so etwa beim Europäischen Waldelefanten. Der Fund eines fossilisierten Gehirns eines Wollhaarmammuts hatte rekonstruiert ein Volumen von 4100 cm³. Es entsprach im Bau weitgehend dem der heutigen Elefanten.[52] Bemerkenswert ist, dass einige Zwergformen ungewöhnlich große Gehirne in Bezug auf das Körpergewicht besaßen. So wog der Sizilianische Zwergelefant nur rund 189 kg, sein Gehirn erreichte aber ein Volumen von 1800 cm³. Der Enzephalisationsquotient steigt dadurch auf bis zu 3,75 an.[53]
Das Herz wiegt zwischen 12 und 27 kg, in der Länge erreicht es 45 bis 57 cm, in der Breite 32 bis 48 cm. Es besitzt ein zweigeteiltes spitzes Ende, ähnlich wie es auch bei den Seekühen beobachtet wurde. Des Weiteren tritt eine paarige Hohlvene auf. Beide Merkmale gelten als relativ ursprünglich. Es schlägt im Ruhezustand 28 bis 35 Mal pro Minute, was weniger als bei einem Menschen ist. Der Magen fasst rund 77 l und der Darmtrakt über 610 l. Die Gesamtlänge des Darmtraktes beträgt rund 18 bis 35 m, davon beansprucht der Dünndarm mit bis zu 22 m den größten Teil. Der Dickdarm kann bis zu 14 m Länge erreichen. Der Blinddarm ist groß und sackartig geformt, ebenso wie das vordere Ende des Dickdarms. In der Mitte des Blinddarms befindet sich eine Falte, die möglicherweise darauf hindeutete, dass er ursprünglich aus zwei Kammern bestand.[33][54] Die Harnblase nimmt eine Füllmenge von etwa 18 l auf.[55][56] Die Leber ist einfach aufgebaut und teilt sich in zwei unterschiedlich große Kammern.[16][17] Eine Gallenblase ist nicht oder nur rudimentär ausgebildet. Die beiden Flügel der Lunge wiegen rund 98 kg und sind jeweils 1 m lang sowie 1,2 m breit. Als Besonderheit kann herausgestellt werden, dass die Lunge im Unterschied zu den meisten anderen Säugetieren direkt mit der Brusthöhle verbunden ist. Es besteht daher kein Pleuraspalt, da der Zwischenraum durch lockeres Bindegewebe überbrückt ist. Die Pleurablätter sind dadurch weiterhin gegeneinander verschiebbar, aber bei Weitem nicht so empfindlich. Dies ermöglicht es Elefanten beispielsweise, einen Fluss zu durchqueren und währenddessen mit ihrem langen Rüssel zu „schnorcheln“. Dabei atmen die Tiere Luft mit atmosphärischem Druck ein, während sich ihr Körper, und damit insbesondere die Lunge, etwa 2 m unter Wasser befindet. Diese Druckdifferenz würde bei jedem anderen Säugetier (mit „normalem“ Pleuraspalt) die Blutgefäße, die das Wandblatt der Pleura versorgen, förmlich „ausquetschen“ und zerstören.[57][17][58][59]
Die Hoden der männlichen Tiere haben eine Länge von 17 und eine Breite von 15 cm, ihr Gewicht variiert zwischen 1,36 und 3,18 kg. Sie liegen in der Bauchhöhle zwischen und leicht hinter den Nieren.[60] Der Penis ist gut entwickelt und muskulös, er wiegt rund 49 kg bei einer Länge von 100 cm und einem Durchmesser von 15 cm. Eine Penisvorhaut ist gut ausgebildet, der Ausgang der Harnröhre hat einen Y-artigen Verlauf mit der Gabelung zum Rücken zeigend. Der Musculus levator penis ist gedoppelt, beide Stränge vereinen sich rückenseitig auf dem Corpus cavernosum penis und sind wohl dafür verantwortlich, dass der Penis im erigierten Zustand einen S-förmigen Verlauf mit der Spitze nach oben aufweist. Dies ist behilflich, um den Penis beim Paarungsakt in der bauchseitig, zwischen den Hinterbeinen liegenden Vulva der weiblichen Tiere einzuführen.[61] Die deutliche Vorverlagerung der Vulva beim weiblichen Tier zwischen die Hinterbeine ist auf den stark verlängerten Urogenitaltrakt zurückzuführen, der bis zu 130 cm lang wird und rund die Hälfte der Länge des gesamten Genitaltraktes ausmacht. Die Öffnung der Vulva ist zwischen den Beinen verlängert. Die Klitoris besitzt eine Vorhaut und zeigt mit rund 50 cm eine langgestreckte Gestalt. Der Uterus der weiblichen Tiere ist zweihörnig, die Hörner ziehen lang aus, während der Uteruskörper mit rund 15 cm Länge relativ kurz bleibt. Der gefaltete Gebärmutterhals wird ebenfalls rund 15 cm lang und ist auffallend konisch geformt.[62][63] Im Gegensatz zu den meisten anderen Säugetieren befindet sich das Gesäuge bei den Elefantenkühen wie bei den Primaten und Seekühen zwischen den Vorderextremitäten.[28][64][65][66][16][17]
Zytologie
Sowohl der Afrikanische als auch der Asiatische Elefant besitzen einen Chromosomensatz von 2n = 56. Beim Afrikanischen Elefanten besteht der diploide Karyotyp aus 25 acrocentrischen/telocentrischen Paaren sowie zwei metacentrischen/submetacentrischen Paaren. Demgegenüber hat der Asiatische Elefant ein acrocentrisches Paar weniger und ein submetacentrisches Paar mehr. In beiden Arten ist das X-Chromosom groß und submetacentrisch, das Y-Chromosom klein und acrocentrisch. Unterschiede bestehen darin, dass beim Asiatischen Elefanten das entsprechende männliche Geschlechtschromosom etwas größer ist und deutlichere G-Banden aufweist als beim Afrikanischen Elefanten.[67][68]
Verbreitung
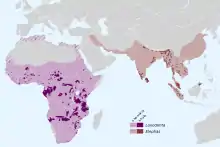
Elefanten sind heute in Asien und Afrika verbreitet. Das natürliche Vorkommen des Asiatischen Elefanten erstreckte sich früher vom östlichen über das südöstliche bis zum südlichen Asien, möglicherweise auch durchgängig bis zum westlichen Teil des Kontinents. Heute ist es stark fragmentiert und beschränkt es sich auf den indischen Subkontinent sowie auf einzelne Teile Hinterindiens, auf Sri Lanka sowie einige der großen Sundainseln beziehungsweise den südlichsten Bereich Chinas. Die Tiere bewohnen sowohl offenere Landschaften als auch waldreichere Gebiete. Der Afrikanische Elefant besiedelte einst nahezu den gesamten afrikanischen Kontinent, heute tritt er ebenfalls in stark zersplitterten Habitaten südlich der Sahara auf. Die nördliche Verbreitungsgrenze befindet sich im Süden des Sudans. Von hier dehnt sich der Lebensraum über Ost- und Westafrika bis nach Südafrika aus. Er bewohnt eine Vielzahl von verschiedenen Lebensräumen wie Savannen, tropische Regenwälder und wüstenartige Gebiete. Der Waldelefant lebt wiederum in den Regenwäldern West- und Zentralafrikas.[1][2]
In ihrer stammesgeschichtlichen Vergangenheit waren die Elefanten insgesamt deutlich weiter verbreitet und kamen nicht nur in ihren heutigen Kerngebieten, sondern auch über weite Teile des nördlichen Eurasiens vor. Die meisten Arten lassen sich allerdings fossil nur in bestimmten Regionen nachweisen und blieben dadurch lokal beschränkt, einige Zwergformen lebten nur auf einzelnen Inseln endemisch.[7][69][5] Manche Vertreter erreichten aber auch eine sehr weite Verbreitung wie der Europäische Waldelefant (Palaoloxodon antiquus), der im westlichen Eurasien auftrat,[70][71] oder das Steppenmammut (Mammuthus trogontherii), das verschiedene Lebensräume von Westeuropa bis Ostasien erschlossen hatte. Einige Angehörige der Mammute (Mammuthus) drangen zudem über die Beringstraße nach Nordamerika vor und besaßen so eine paneurasische und nordamerikanische Verbreitung. Hier ist vor allem das Wollhaarmammut (Mammuthus primigenius) zu nennen, das hauptsächlich während der letzten Kaltzeit die offenen Steppenlandschaften, die sogenannte Mammutsteppe, besiedelte.[72][73][74]
Lebensweise
Allgemein


Die Lebensweise der heutigen Elefanten ist vergleichsweise gut erforscht. Sie haben eine circadiane Lebensweise. Aktivitäten finden sowohl tagsüber als auch nachts statt. Den größten Teil verbringen die Tiere mit der Nahrungsaufnahme, was etwa zwei Drittel bis drei Viertel ihrer aktiven Phase ausmachen kann. Schlaf nimmt in der Regel nur wenige Stunden in Anspruch und erfolgt häufig in der späten Nacht oder um die Mittagszeit. Währenddessen stehen die Tiere zumeist, eine REM-Phase wird selten erreicht.[75][1][2]
Elefanten bewegen sich üblicherweise im Passgang gehend fort, so dass immer wenigstens zwei Beine den Boden berühren. Die durchschnittliche Geschwindigkeit beträgt dann rund 1,4 km/h. Generell können die Tiere auch recht hohe Geschwindigkeiten erreichen, die bei etwa 14 bis 24 km/h liegen. Bedingt durch ihre Größe und enormes Gewicht rennen Elefanten dabei nicht, das heißt, es kommt nicht zu einer Sprungphase, bei der alle vier Beine gleichzeitig vom Boden abheben. Auch bleibt der Passgang weitgehend erhalten und es gibt keinen Übergang zu einer anderen Fortbewegungsform typisch für höhere Geschwindigkeiten (Trab oder Galopp). Vergleichbar zu anderen vierfüßigen Tieren nimmt bei einer höheren Geschwindigkeit die Taktfrequenz der Beinbewegungen und die Schrittlänge zu, in der Regel bleibt aber immer ein Bein im Bodenkontakt. Untersuchungen zum Bewegungsmuster der Elefanten bei höheren Geschwindigkeiten ergaben, dass die Vorderbeine eher gehende Bewegungen ausüben, die Hinterbeine dagegen rennende.[76][77][78] Alle vier Beine üben dabei die gleiche Funktion aus, das heißt, es findet im Unterschied zu anderen vierfüßigen Säugetieren auch bei höheren Geschwindigkeiten keine Aufteilung in vorantreibende und abbremsende Gliedmaßen statt. Allerdings in Übereinstimmung mit anderen Säugetieren ist die Arbeitsleistung der Vorderbeine höher als die der Hinterbeine, was der allgemeinen Gewichtsverteilung entspricht.[79]
Dagegen sind Elefanten sehr gute Schwimmer, die sich mit stürzenden, den Tümmlern ähnlichen Bewegungen durch das Wasser bewegen. Sie bewegen sich dabei mit circa 2,7 km/h fort. Der Rüssel wird als Schnorchel über die Wasseroberfläche gehalten. Beobachtungen zufolge überwinden die Tiere dabei Distanzen von bis zu 48 km über die offene Wasserfläche. Es ist daher plausibel, dass diese Schwimmbefähigung es den Elefanten ermöglichte, in erdgeschichtlicher Vergangenheit abgelegenere Inseln zu erreichen und darauffolgend verschiedene Zwergformen auszubilden. Über die Gründe dafür liegen allerdings nur Vermutungen vor. Angenommen wird, dass die Tiere Nahrungsduft von Inseln in Sichtkontakt witterten und diese dann gezielt ansteuerten.[80]
Sozialstruktur und Raumnutzung


Elefanten sind allgemein gesellige Tiere, die in komplexen Sozialgemeinschaften leben. Es gibt aber Unterschiede zwischen männlichen und weiblichen Tieren. Kühe bilden mit den Kälbern Sozialverbände. Die engste Bindung besteht zwischen dem Muttertier und ihrem Nachwuchs. Darüber hinaus können verschiedene Stufen der Gruppenbildung unterschieden werden. Beim Afrikanischen Elefanten umfassen diese als untere Einheit Familiengruppen oder Herden, die mehrere Mutter-Jungtier-Gruppen vereinen. Diese können sich wiederum zu größeren Familienverbänden und schließlich als oberste Einheit zu Clans zusammenschließen. In der Regel sind die Individuen solcher Gruppen näher miteinander verwandt. Die Familiengruppen oder Herden werden von einer Leitkuh angeführt, bei der es sich meist um ein älteres und erfahreneres Individuum handelt. Ihre Rolle ist nicht nur beim Anführen der Familiengruppe bedeutend, sie vermittelt auch wichtige Verhaltensweisen an die Kälber.[81] Die Hierarchie innerhalb der Herde ist linear organisiert, so dass beim Tod der Leitkuh überwiegend die älteste Tochter deren Rolle übernimmt. Herden stellen demnach die stabile Einheit innerhalb des Sozialgefüges des Afrikanischen Elefanten dar. Beim Asiatischen Elefanten hingegen bestehen innerhalb der Familiengruppen verschiedene engere oder weitere individuelle Bindungen. Eine Leitkuh hat hier nicht die dominante Rolle. Sowohl beim Afrikanischen als auch beim Asiatischen Elefanten kommt es in loser Abfolge zu einem Zusammengehen und wieder Aufbrechen der höheren sozialen Einheiten, was allgemein als Fission-fusion-Sozialgefüge („Trennen und wieder Zusammenkommen“) bezeichnet wird.[82] Bullen hingegen leben bei allen Elefantenarten einzelgängerisch oder organisieren sich in Junggesellengruppen, die wiederum aus Individuen verschiedener Altersstufen bestehen.[1][2]
Die verschiedenen Elefantengruppen nutzen Aktionsräume, deren Größe in der Regel vom Nahrungsangebot der entsprechenden Region abhängig ist. Sie sind umso kleiner, je feuchter und vegetationsreicher die Umgebung ist. In bewaldeten Gebieten umfassen sie häufig nur einige Dutzend bis hunderte Quadratkilometer, dehnen sich aber in wüstenartigen Landschaften auf über zehntausend Quadratkilometer aus. Zumeist schließen die Aktionsräume verschiedene Landschaftstypen ein, die jeweils nach Bedarf aufgesucht werden. Innerhalb ihrer Aktionsräume wandern die Elefantengruppen auf der Suche nach Nahrungsquellen umher. Die zurückgelegten Entfernungen sind meist gering, vielfach nur wenige Kilometer am Tag. Das Wanderungsverhalten kann aber durch äußere Umstände stark beeinflusst werden, etwa durch die Anwesenheit menschlicher Siedlungen und Nutzungsareale. Über das Jahr gesehen überwinden Elefanten aber Entfernungen von teils mehreren tausend Kilometern. An vielfach begangenen Wegen bilden sich dann sogenannte Elefantenstraßen, die über lange Zeit bestehen können und mitunter auch von anderen Tierarten genutzt werden.[1][2]
Kommunikation und kognitive Fähigkeiten
.jpg.webp)
Das Zusammenleben innerhalb der Gruppe und zwischen den einzelnen Familiengruppen ist in der Regel friedlich und kooperativ. Die Kommunikation untereinander verläuft über verschiedene optische Signale, taktile und chemische Reize sowie Lautgebungen. Wichtige Elemente für die visuelle Kommunikation sind der Rüssel und die Ohren sowie variierende Kopf- und Körperstellungen, häufig auch in unterschiedlichster Kombination miteinander. So drückt etwa ein hoch oder niedrig gehaltener Kopf dominantes oder unterwürfiges Gebaren aus. Sich aus Konfliktsituationen ergebende Kämpfe verlaufen hochritualisiert, Ausnahmen stellen hier Bullen in der Musth dar, bei denen Kämpfe mitunter lebensbedrohlich sein können. Auch für die taktile Kommunikation spielt der Rüssel eine zentrale Rolle, etwa beim komplexen Begrüßungsritual verwandter Familiengruppen. Die chemische Kommunikation beinhaltet Urin- und Kotmarken sowie die Sekrete der Temporal- beziehungsweise der Zwischenzehendrüsen. Sie ist dabei mitunter sehr zielgerichtet, da die enthaltenen Pheromone teilweise nur auf sexuell aktive Individuen stimulierend wirken.[83] Andererseits unterscheiden die Mitglieder einer Familiengruppe anhand des Geruchs mehrere dutzend enger und entfernter verwandter Tiere und auch artfremde Lebewesen.[84][85][2]

Die Elefanten nutzen eine sehr umfangreiche Lautkommunikation, die allerdings beim Afrikanischen Elefanten weitaus besser untersucht ist als beim Asiatischen. Ein Großteil der Verständigung findet im Infraschallbereich statt. Diese für Menschen unhörbaren Schwingungen werden durch die Luft und durch das Erdreich über mehrere Kilometer übertragen und sind wenig anfällig für Störungen etwa durch Reflexion oder Absorption. Außerdem funktionieren sie sowohl im freien Gelände wie auch in dichten Wäldern.[63] Charakteristisch ist vor allem ein soziales Grollen, dessen Frequenzbereich bei 10 bis 200 Hz liegt. Dieses wird in verschiedenen Situationen angewandt, dient aber zumeist dem Kontakt innerhalb und außerhalb der Familiengruppe. Die Laute variieren individuell, so dass sich die Tiere gegenseitig unterscheiden können. Das soziale Grollen kann sowohl über den Rüssel (nasal) als auch über den Kehlkopf (oral) erzeugt werden. Beide Laute unterscheiden sich in der Länge des Erzeugungsweges, der beim nasalen Grollen mindestens doppelt so lang ist. Sie weisen daher unterschiedliche Frequenzen auf und werden von den Tieren unterschiedlich eingesetzt. Nasales Grollen ertönt häufig bei Kontaktsuchen, orales Grollen jedoch innerhalb der Familiengruppe.[86][87][88] Neben diesen Lauten im niedrigen Frequenzbereich kommen auch höherfrequente vor, die teilweise bis zu 9000 Hz erreichen. Diese umfassen verschiedene Geräusche, angefangen vom bekannten Trompeten über ein Bellen, Röhren oder Schreien bis hin zu einem Schnauben oder Krächzen. Ihre Wiedergabe ist von verschiedenen Faktoren abhängig, häufig fungieren sie als Alarm- oder Warnsignale beziehungsweise stehen mit Unbehagen sowie Aufregung in Verbindung.[88] Das soziale Grollen tritt bei allen Elefantenarten am häufigsten auf, untergeordnet werden die niederfrequenten Laute auch mit den höherfrequenten verbunden. Hier sind gewisse Unterschiede zwischen den Arten zu beobachten, da sowohl beim Afrikanischen wie auch beim Asiatischen Elefanten eine Kombination höher-/niederfrequenter gegenüber nieder-/höherfrequenter besteht. Beim Waldelefanten ist dies nicht der Fall. Eventuell sind die Unterschiede landschaftsbedingt, da die eher offeneren Gebiete, die der Afrikanische und Asiatische Elefant bewohnen, einen stärkeren Windeinfluss aufweisen als die geschlossenen Wälder des Waldelefanten. Wind allerdings überprägt niederfrequente Laute stärker, so dass eine Lautfolge mit hohen Frequenzen am Anfang bei potentiellen Zuhörern eher Aufmerksamkeit erzeugt.[89] Eine Besonderheit stellt das Imitieren fremder Laute bis hin zur menschlichen Sprache dar, eine Befähigung, die ansonsten nur selten unter Säugetieren auftritt. Eventuell steht dies im Zusammenhang mit dem individuellen Erkennen innerhalb des Fission-fusion-Sozialgefüges.[90][91] Anhand akustischer Signale unterscheiden Elefanten nicht nur arteigene, sondern auch artfremde Lebewesen und können diese zusätzlich je nach eigenen Erfahrungen bestimmten Kategorien zuordnen.[92]
Neben der komplexen Kommunikation besitzen Elefanten auch bemerkenswerte kognitive Fähigkeiten. So erbrachte ein Spiegeltest an Zootieren des Asiatischen Elefanten, dass diese über ein Ichbewusstsein verfügen und sich selbst im Spiegel erkennen können, vergleichbar zu Elstern, Delfinen und Menschenaffen.[93][94] Bei weiteren Untersuchungen erlernten sie das Unterscheiden von verwandten Musterpaaren wie „schwarz/weiß“ oder „klein/groß“ und konnten sich an diese über einen langen Zeitraum erinnern. Außerdem ist nachgewiesen worden, dass Elefanten in der Lage sind, zu zählen und einfachste Additionsaufgaben zu lösen sowie unterschiedliche Mengen zu vergleichen.[95][96][97] Die Gedächtnisleistungen der Elefanten sind insofern besonders, als sie die Rufe abgewanderter oder verstorbener Familienangehöriger noch nach mehreren Jahren wiedererkennen und beantworten.[98] Unter Einfluss extrem negativer Erfahrungen erleiden die Tiere unter Umständen Traumata, deren Ursachen bis in das Fötalstadium zurückreichen oder deren Auswirkungen noch Jahre nach dem Ereignis auftreten können. Des Weiteren zeigen die Tiere verschiedene altruistische Verhaltensweisen, erkennen die Bedürfnisse anderer Gruppenmitglieder oder sind in der Lage, Koalitionen auf Zeit einzugehen. Weitere Studien erbrachten die Verwendung von Werkzeugen oder gar Luft zum Erreichen bestimmter Ziele. Vor allem Letzteres ist hervorzuheben, da es ein gewisses Verständnis für die physikalische Umwelt voraussetzt.[99] Ein überaus bemerkenswertes Verhalten ist das Aufsuchen von Knochen und Stoßzähnen verstorbener Tiere, wobei sich das nicht nur auf Familienangehörige, sondern auch auf andere Artgenossen bezieht. Verbunden sind diese Handlungen mit einem verstärkten Sekretfluss aus der Temporaldrüse und intensiven sozialen Interaktionen im Umfeld des verstorbenen Individuums.[100][101][102][103]
Ernährung und Verdauung

Die Elefanten sind ausnahmslos Pflanzenfresser. Sie haben ein umfangreiches Nahrungsspektrum, das von weichen Pflanzenteilen wie Blättern, Zweigen, Rinde, Samen und Früchten bis hin zu harten Pflanzen wie Gräsern reicht. Dadurch können sie als auf gemischte Pflanzenkost spezialisiert angesehen werden. Das Nahrungsspektrum umfasst mehrere hundert verschiedene Pflanzenarten. Die jahreszeitliche Zusammensetzung der Nahrung variiert, in der Regel nehmen die Tiere in den Regenzeiten eher grashaltige Nahrung zu sich, in den Trockenzeiten steigt der Anteil an weichen Pflanzen. Darüber hinaus gibt es auch starke räumliche Variationen, was dem jeweiligen lokalen Nahrungsangebot geschuldet ist. Die jahreszeitlichen Unterschiede im Ernährungsverhalten werden häufig mit der chemischen Zusammensetzung der Pflanzen in Verbindung gebracht, vor allem mit dem Protein- und Kohlenhydratgehalt. Generell haben Gräser einen niedrigeren Proteingehalt gegenüber weicheren Pflanzen, dafür ist ihr Anteil an Kohlenhydraten höher. Kohlenhydrate wiederum sind von Elefanten aller Altersstufen leichter verdaubar. Ein zu hoher Proteinkonsum wiederum benötigt größere Mengen an Wasser, was in trockeneren Regionen möglicherweise problematisch ist. Täglich benötigt ein einzelnes Tier durchschnittlich 3 g an Proteinen je Kilogramm Körpergewicht. Durch eine Aufnahme von Gräsern in ausreichender Menge kann ein Individuum prinzipiell seinen Bedarf sowohl an Proteinen als auch an Kohlenhydraten decken. In der Trockenzeit allerdings, wenn frische Gräser schwerer verfügbar sind, reicht dann ein nur geringer Anstieg an weichen Pflanzen in der Nahrungsmenge, um den Proteinbedarf auszugleichen.[104][1]
Durchschnittlich benötigt ein Individuum täglich rund 150 kg Nahrung (Feuchtmasse). Die Aufnahme dieser hohen Menge nimmt zwischen 17 und 19 Stunden am Tag in Anspruch.[105] Bei der Nahrungsaufnahme kommt der Rüssel zum Einsatz, insbesondere die „fingerartigen“ Fortsätze, die einzelne Halme und Gräser ergreifen können. Rinde schaben die Tiere häufig mit Hilfe der Stoßzähne ab. Die Grasnahrung wird zu etwa 45 % verwertet, da die Tiere ein weniger effizientes Verdauungssystem haben als etwa die Wiederkäuer. Im Ruhezustand benötigt ein Tier etwa 49.000 Kilokalorien täglich.[17] Primär fungiert der Magen als Reservoir für die Nahrung, die in dem sauren Milieu bei einem pH-Wert von circa 2 vorverdaut wird. Der wesentliche Teil der Nahrungszersetzung findet erst nach Passage durch den Magen in Blinddarm und Colon unter Beteiligung von Mikroorganismen (Bakterien und Protozoen) statt. Der gesamte Prozess dauert von der Nahrungsaufnahme bis zum Ausscheiden etwa 33 Stunden. Der Kot der Elefanten ist relativ grob und enthält viel faserhaltiges Material.[106][107] Ähnlich wie bei den Pferden kann er teilweise wieder aufgenommen werden, damit die enthaltenen Nahrungsstoffe besser genutzt werden.[108] Ebenso fressen Elefanten gelegentlich mineralhaltige Böden oder suchen Salzquellen auf, wodurch dem Körper wichtige Nährstoffe zugeführt werden.[109][1]
Elefanten sind wasserabhängig. In der Regel trinken Elefanten einmal täglich Wasser und benötigen dabei bis zu 140 l. Mit zunehmender Trockenheit eines Landschaftsraumes halten sich die Tiere näher an Gewässern auf, in feuchteren Gebieten steigen die Entfernungen zu Süßwasserquellen an. In Gebieten, wo keine Wasserflächen zur Verfügung stehen, graben Elefanten mit den Füßen kleine Löcher, wodurch sie wiederum anderen Tierarten den Zugang ermöglichen.[1]
Brunft, Musth und Paarung
.jpg.webp)

Elefanten können sich allgemein ganzjährig fortpflanzen, in Regionen mit stärker ausgeprägten Jahreszeiten zeichnet sich aber eine gewisse Saisonalisierung ab. Die Brunftphase der Kühe gehört zu den längsten unter den Säugetieren und währt zwischen 13 und 18 Wochen. Sie teilt sich in eine luteale Phase, die zwischen 6 und 12 Wochen anhält, und in eine folliculare Phase von 4 bis 6 Wochen Dauer. Zwischen beiden Abschnitten liegt eine kurze, nichtluteale Phase, während deren es zu einer zweimaligen erhöhten Produktion luteinisierender Hormone kommt. Erst der zweite Produktionsschub führt letztendlich nach einem Zeitraum von 12 bis 24 Stunden zur Ovulation. Wozu der erste Hormonanstieg dient, ist nicht eindeutig geklärt. Womöglich gehört er zur Fortpflanzungsstrategie der Elefanten und ermöglicht es den Kühen, frühzeitig die Aufmerksamkeit paarungsbereiter Bullen zu erwecken. Eine andere Erklärung wäre die einer physischen Vorbereitung des Körpers auf eine bevorstehende Befruchtung. Aufgrund dieses langen Zyklus sind Kühe in der Regel nur drei- bis viermal im Jahr empfangsbereit. Im überwiegenden Teil der Fälle bildet sich eine befruchtete Eizelle, der Follikel hat einen Durchmesser von 21 mm, was relativ klein ist für Tiere dieser Körpergröße. Der Status des Sexualzyklus wird über Laute im niederfrequenten Bereich und durch chemische Signale wie Pheromone im Urin mitgeteilt. Beide Kommunikationsmethoden können über lange Distanzen genutzt werden.[63][1]
Elefantenbullen erleben periodisch eine sexuelle Verhaltensänderung, deren Dauer stark variieren kann und die als Musth bezeichnet wird. Die Musth setzt im Unterschied zur Brunft zahlreicher Huftiere nicht synchron ein, sondern verläuft individuell, so dass in intakten Populationen zu jedem Zeitpunkt des Jahres wenigstens ein fortpflanzungsbereiter Bulle vorkommt. Die Asynchronität reduziert wiederum die energetischen Kosten bei Dominanzkämpfen und Rivalität. Besondere Kennzeichen der Musth finden sich in der erhöhten Aggressivität der männlichen Tiere. Dadurch können Bullen in der Musth auch physisch stärkere Individuen dominieren. Äußerlich markiert ein erhöhter Sekretausfluss an den Temporaldrüsen den Musth-Status. Einher geht die Musth mit einem extremen Anstieg des Testosteronspiegels, dabei kann die Hormonkonzentration um bis zu das 100fache gegenüber den Werten außerhalb der Musth-Phase zunehmen.[110][111][112] Bullen wandern während der Musth verstärkt umher und suchen verschiedene Herden auf, wo sie die Geschlechtsteile und andere Körperpartien der Kühe nach paarungsbereiten Individuen kontrollieren. Dabei signalisiert der Bulle selbst durch Abtasten oder Ringkämpfe mit dem Rüssel und Nackenbisse sein eigenes Interesse. Größere Aufmerksamkeit erlangen bei ihm weibliche Tiere im mittleren Abschnitt der Brunft. Beim Geschlechtsakt ist er auf die Mitarbeit der Kuh angewiesen, da sein S-förmig gewundener Penis nur bei Stillstand in die Vulva eingeführt werden kann.[63][1]
Geburt und Entwicklung

Die Tragzeit beträgt 640 bis 660 Tage oder rund 22 Monate, was die längste unter allen landlebenden Säugetieren ist. In der Regel wird nur ein Junges geboren, dessen Gewicht bis zu 100 kg betragen kann. Anfangs gibt es kaum Unterschiede in der Entwicklung zwischen männlichen und weiblichen Kälbern. Ab einem Alter von fünf bis sechs Jahren wachsen männliche Jungtiere aber deutlich schneller als weibliche. Die Entwicklung hält bei Bullen bis ins hohe Alter an, da diese fast ihr gesamtes Leben lang an Körpergröße und -gewicht zunehmen können. Bei Kühen hingegen erlahmt dieser Prozess etwa mit dem 30. Lebensjahr. Bullen sind daher im höheren Alter deutlich größer und schwerer als Kühe. Auch die soziale Entwicklung verläuft nicht gleichgerichtet. So sind die Aktivitäten junger weiblicher Tiere stets auf den Familienverband orientiert. Teilweise übernehmen sie auch die Betreuung des jüngsten Nachwuchses („allomaternale Pflege“). Nach der Geschlechtsreife verbleiben Jungkühe in der Regel in der Mutterherde. Junge männliche Kälber hingegen suchen Aktivitäten häufig außerhalb des Familienverbandes, wo sie Kontakt zu gruppenfremden Individuen aufnehmen. Im Alter von etwa neun Jahren trennen sich Jungbullen von ihrer Mutterherde und schließen sich häufig Junggesellengruppen an. Sie treten mit etwa 14 Jahren in die Pubertät ein. Ihre Fortpflanzungsaussichten sind zu diesem Zeitpunkt aber noch gering, da ihnen die körperlichen Voraussetzungen fehlen, um mit Altbullen konkurrieren zu können. Die erste Musth-Phase zeichnet sich daher auch erst in den 20er Lebensjahren ab. Generell sind Elefanten, sowohl Kühe als auch Bullen, bis ins hohe Alter fortpflanzungsfähig. Zwischen zwei Geburten können bei Kühen dreieinhalb bis neun Jahre vergehen. Dieses ausgesprochen lange Geburtsintervall macht paarungswillige Kühe relativ selten in einer Elefantenpopulation und zwingt Bullen dazu, weite Wanderungen zu unternehmen, um verschiedene Herden aufzusuchen. Das Höchstalter in freier Wildbahn wird in intakten Landschaften mit rund 60 bis 65 Jahren angenommen, was einhergeht mit dem Ausfall des letzten Mahlzahns. In Gebieten mit hohem Jagddruck seitens des Menschen, aber unter Umständen auch in menschlicher Obhut, kann die Lebenserwartung rapide zurückgehen.[1][Anm 2]
Natürliche Feinde und ökologische Bedeutung
.jpeg.webp)
Durch ihre Größe und ihr Leben im Herdenverband haben Elefanten wenige natürliche Feinde. Nur den größten Raubkatzen wie Löwen und Tigern gelingt es bisweilen, Jungtiere zu erbeuten.[113][114] In einigen Gebieten Afrikas stellen Löwen Elefanten häufiger nach als bisher angenommen. Es handelt sich hierbei um eine Anpassung an die trockenen Jahreszeiten, wenn die meisten Huftiere in nahrungsreichere Gebiete abgewandert sind. Der Großteil der erbeuteten Elefanten wird durch Jungtiere gebildet, die gerade ihre mütterliche Herde verlassen haben.[115] Im Eiszeitalter hatten Elefanten darüber hinaus wohl noch die mittlerweile ausgestorbenen Säbelzahnkatzen zu fürchten. Insbesondere für die Gattung Homotherium konnte zumindest lokal aufgezeigt werden, dass die Tiere gelegentlich ein junges Rüsseltier erlegten.[116]
Elefanten spielen eine wichtige Rolle im ökologischen Netzwerk ihrer jeweiligen Region. Sie werden daher als ecosystem engineers angesehen. Ihre Funktion äußert sich beispielsweise im Transport gefressener Samen über teils erhebliche Distanzen, was zur Weiterverbreitung von Pflanzen führt.[117] Als ein weiterer Effekt erreichen die Samen einzelner Pflanzen eine höhere Keimfähigkeit, nachdem sie den Magen-Darm-Trakt der Elefanten passiert haben. Das Entrinden oder Umknicken von Bäumen öffnet geschlossene Waldlandschaften und schafft so Nutzungsräume für andere Tierarten, da mitunter stärker strukturierte Habitate entstehen.[118] Zusätzlich können derartig geöffnete Flächen von Pionierpflanzen besiedelt werden.[119][120] Viel begangene Wege und Pfade sind in manchen Landschaften über Dutzende Kilometer sichtbar und werden auch von anderen Säugetieren frequentiert. Zusätzlich dienen angelegte Wasserlöcher, Pfützen in Trittsiegeln oder selbst Kotreste als Rückzugs- oder Fortpflanzungsräume verschiedener Lebewesen.[121][122] Neben den zahlreichen positiven Effekten kann eine übermäßige Population an Elefanten in einer Region auch verheerende Folgen für die Landschaft mit dramatischen Veränderungen haben. Vor allem die Wechselwirkung von Elefanten und Graslandschaft beziehungsweise Baumbestand sind bisher nur unvollständig untersucht.[1][2]
Systematik
Äußere Systematik
Innere Systematik der Rüsseltiere nach Cozzuol et al. 2012[123]
|
Die Elefanten (Elephantidae) sind eine Familie innerhalb der Ordnung der Rüsseltiere (Proboscidea). Sie bilden heute das einzige Mitglied dieser taxonomischen Gruppe, weshalb diese als gegenwärtig monotypisch aufgefasst werden kann. Die Rüsseltiere wiederum gruppieren sich zusammen mit den Seekühen (Sirenia) und den Schliefern (Hyracoidea) zur übergeordneten Gruppe der Paenungulata, Letztere stellen gemeinsam mit den Afroinsectiphilia die Afrotheria, eine der vier Hauptlinien der höheren Säugetiere mit einem weitgehend originär afrikanischen Ursprung. Laut molekulargenetischen Untersuchungen entstanden die Afrotheria bereits in der Oberkreide vor 90,4 bis 80,9 Millionen Jahren. Etwa 15 Millionen Jahre später teilte sich diese Ursprungsgruppe in die beiden heutigen Hauptlinien auf. Innerhalb der Paenungulata sind die Seekühe und die Rüsseltiere als engere Verwandtschaftseinheit zu betrachten, die als Tethytheria bezeichnet wird. Ihre Aufspaltung setzte in Paläozän vor rund 64 Millionen Jahren ein.[124][125][126][127][128] Etwa so weit reicht auch der Fossilbericht der Rüsseltiere zurück, womit diese eine sehr alte Gruppe darstellen. Im Laufe ihrer Stammesgeschichte erwiesen sie sich als sehr formenreich, wobei der hohe Diversifizierungsgrad als Resultat mehrerer Radiationsphasen entstand. Die einzelnen Vertreter zeigten vielfältige Anpassungen an unterschiedliche Biotope und Klimaregionen. Die einstige Verbreitung der Rüsseltiere reichte dabei von Afrika -über weite Teile Eurasiens und Amerikas. Die Elefanten sind innerhalb der Rüsseltiere als relativ junge Entwicklungslinie anzusehen und formen einen Teil der letzten Ausbreitungsphase, die im Verlauf des Miozän begann. Systematisch gehören sie zur Überfamilie der Elephantoidea. Zu dieser zählen ebenfalls die Stegodontidae, welche als die Schwestergruppe der Elefanten aufzufassen sind. Die frühesten Fossilnachweise der Elefanten sind rund 7 Millionen Jahren alt.[129][2]
Innere Systematik
Innere Systematik der Elefanten basierend auf skelettanatomischen Merkmalen nach Cozzuol et al. 2012[123]
|
Innere Systematik der Elefanten basierend auf genetischen Merkmalen nach Meyer et al. 2017[130]
|
Innerhalb der Elefanten werden zwei Unterfamilien unterschieden: die Stegotetrabelodontinae und die Elephantinae. Erstere sind nur fossil belegt und waren weitgehend auf Afrika und die Arabische Halbinsel beschränkt. Sie kennzeichnen sich durch eine lange Unterkiefersymphyse, ausgebildete untere Stoßzähne sowie durch niederkronige Backenzähne mit nur wenigen Schmelzfalten, die im nicht abgekauten Zustand zudem in der Mittelachse des Zahns unterbrochen sind – ein urtümliches Merkmal für Rüsseltiere. Der Schädel wies aber bereits die für Elefanten typische Stauchung vorn und hinten auf. Teilweise wird angenommen, dass es sich bei den Stegotetrabelodontinae um die Stammgruppe der Elefanten handelt, wahrscheinlicher repräsentieren sie aber nur einen Seitenzweig. Die Gruppe trat im Oberen Miozän auf und verschwand im Pliozän wieder.[131][132] Die Elephantinae wiederum zeigen eine Tendenz zur Reduktion der unteren Stoßzähne und zu Aufhöhung der Zahnkronen der Molaren. Die Backenzähne bestehen aus zahlreicheren Schmelzfalten mit einer Minimalanzahl von sieben auf dem hintersten Zahn. Außerdem verschwindet die mediane Einkerbung auf den Zahnkronen. Die Unterfamilie umfasst die heute noch lebenden Vertreter, die sich auf zwei Gattungen mit drei Arten verteilen. Die beiden afrikanischen Vertreter werden dabei in der Gattung der Afrikanischen Elefanten (Loxodonta) eingegliedert, die einzige asiatische Form gehört der Gattung Elephas an. Ihre Abspaltung voneinander setzte gemäß molekulargenetischen Daten vor rund 7,6 Millionen Jahren ein.[133][134] Daneben sind noch einzelne ausgestorbene Gattungen belegt, die in mehr oder weniger engen Beziehungen zu den heutigen Gattungen stehen. So gehören die Mammute (Mammuthus) zu den nächsten Verwandten der Gattung Elephas, während Palaeoloxodon neueren Erkenntnissen zufolge eine gemeinsame Gruppe mit den Afrikanischen Elefanten bildet. Der engere Verwandtschaftskreis um die heutigen afrikanischen Elefantenvertreter wird daher der Tribus der Loxodontini zugewiesen, der der asiatischen der Elephantini.[135]
Überblick über die Unterfamilien und Gattungen der Elefanten
Die Familie der Elefanten gliedert sich demnach heute folgendermaßen:[135][132]
- Familie Elephantidae Gray, 1821
- Unterfamilie Stegotetrabelodontinae Aguirre, 1969
- Stegotetrabelodon Petrocchi, 1941
- Stegodibelodon Coppens, 1972
- Unterfamilie Elephantinae Gray, 1821
- Primelephas Maglio, 1970
- Loxodonta Anonymous, 1827
- Stegoloxodon Kretzoi, 1950
- Palaeoloxodon Matsumoto, 1924
- Elephas Linnaeus, 1758
- Mammuthus Brookes, 1828
Die Stellung von Stegodibelodon innerhalb der Stegotetrabeldontinae ist nicht ganz eindeutig, da einige Autoren ihn auch zu den Elephantinae zählen.[132] Die tatsächlichen Verwandtschaftsbeziehungen der einzelnen Vertreter der Elefanten vor allem aus der Unterfamilie der Elephantinae sind genetischen Untersuchungen zufolge komplex. So kommt es verschiedentlich zu Hybridisierungen zwischen den beiden afrikanischen Elefantenarten,[136][137][138] ebenso auch zwischen den höheren taxonomischen Gruppen des Asiatischen Elefanten.[139] Darüber hinaus sind derartige genetische Vermischungen zwischen verschiedenen Mammutformen belegt.[140][141][142] Der Nachweis einzelner gemeinsamer Haplotypen sowohl bei rezenten als auch fossilen Elefantenarten reicht derzeit bis in die Stammlinie der Elefanten zurück und lässt annehmen, dass Hybridisierung zwischen einzelnen Arten bereits sehr früh einsetzte und offensichtlich auch über die Gattungsgrenzen hinweg wirkte.[143] Aus der heutigen Zeit wurde der einzige bekannte Hybride zwischen einer asiatischen Elefantenkuh und einem afrikanischen Elefantenbullen 1978 im Zoo von Chester geboren. Es handelte sich um das Bullenkalb „Motty“, das Mischmerkmale beider Arten trug, etwa in Bezug auf die Ohrgröße, aber bereits nach zehn Tagen verstarb.[144][145]
Stammesgeschichte
Ursprünge und Entwicklungstendenzen
Die Rüsseltiere sind eine vergleichsweise alte Ordnung der Säugetiere. Ihre Ursprünge reichen bis in das Paläozän des nördlichen Afrikas vor rund 60 Millionen Jahren zurück.[146] Innerhalb der Ordnung werden verschiedene Familien unterschieden, etwa die Deinotheriidae, die Gomphotheriidae, die Mammutidae und die Stegodontidae, die während verschiedener Radiationsphasen entstanden. Die Elefanten sind aus dieser Sicht relativ jung, sie gehören in die dritte und damit letzte Radiationsphase der Ordnung, die im Verlauf des Miozäns wiederum in Afrika einsetzte. Einige der älteren, bereits genannten Rüsseltierlinien, die noch aus den vorgehenden Radiationsphasen stammen, waren aber teilweise bis in das ausgehende Pleistozän Zeitgenossen der Elefanten. Evolutive Trends innerhalb der Elefanten finden sich in der Verschmälerung des Schädels vorn und hinten, der dadurch an Höhe zunahm. Die Kürzungen in der Länge hatten zur Folge, dass auch der Unterkiefer gestaucht wurde, wodurch die unteren Stoßzähne kaum mehr Platz fanden und sich zurückbildeten. In der Struktur der Backenzähne ist die Vergrößerung der Zahnkronenhöhe in Richtung Hypsodontie sowie die Zunahme der Anzahl der Schmelzfalten zu nennen. Bei letzterem Prozess verringerte sich die Schmelzbanddicke einer jeden Lamelle. Beide Veränderungen – Zunahme der Zahnkronenhöhe und der Lamellenanzahl – stehen in Zusammenhang mit einer stärkeren Anpassung an Grasnahrung.[26][129][132]
Miozän
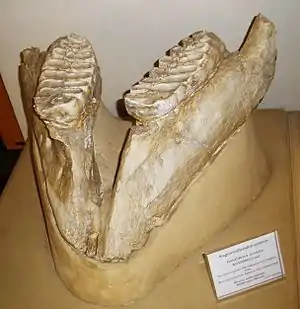
Die Entwicklungslinie der Elefanten begann im späten Miozän vor etwa 7 Millionen Jahren in Afrika. Die neuen Rüsseltiere unterschieden sich von anderen Vertretern der Ordnung durch die fehlende Zahnschmelzhülle der Stoßzähne und das Vorhandensein von Schmelzlamellen auf den Backenzähnen. Beide Merkmale gelten als besonders charakteristisch für die Angehörigen der Elefanten, allerdings entwickelten die Stegodonten unabhängig den Schmelzlamellen ähnliche Strukturen. Zu den frühesten Formen der Elefanten gehören die Vertreter der Stegotetrabelodontinae. Deren Charakterform Stegotetrabelodon besaß noch untere Stoßzähne und hatte Backenzähne mit sehr niedrigen Kronen sowie nur wenigen Lamellen, die aber in der Mitte der Zahnlängsachse geteilt waren. Trotz der niedrigen Zahnkronen verweist die Lamellenstruktur auf einen bereits zunehmenden Grasanteil im Nahrungsspektrum. Der überwiegende Teil der Funde ist auf das östliche Afrika und die Arabische Halbinsel beschränkt, einige Reste sind aber auch aus dem südlichen Europa belegt. Hervorzuheben ist etwa Lothagam in Kenia, in Europa ist Stegotetrabelodon unter anderem aus Cessaniti in Italien belegt.[147][148][129][132]
Mit Primelephas trat dann erstmals ein Vertreter der modernen Elephantinae im Oberen Miozän im östlichen Afrika in Erscheinung. Diese weitgehend nur über Gebissreste bekannte Form ist relativ gut aus der Region Djourab im nördlichen Tschad dokumentiert. Die Funde verteilen sich hier auf mehrere Fundstellen wie Toros-Menalla, Kossom-Bogoudi oder Koulà, die zwischen 7,4 und 4 Millionen Jahre alt sind. Weiteres Material fand sich im Afar-Dreieck in Äthiopien, unter anderem im Awash-Gebiet, und zusätzlich auch in Lothagam und in den Tugen Hills in Kenia. Ob die Tiere noch untere Stoßzähne trugen, ist dem paläontologischen Befund nicht eindeutig zu entnehmen. Ein charakteristisches Merkmal findet sich in den durch tiefe V-förmige Einbuchtungen getrennten Schmelzlamellen der Backenzähne.[149][150][132]
Fast zeitgleich zu Primelephas bildete sich Loxodonta heraus, nachgewiesen über einzelne Funde im östlichen Afrika wie etwa aus der Lukeino- und der Chemeron-Formation im westlichen Kenia, deren Alter zwischen 6,2 und 4 Millionen Jahren datiert. Ähnlich alte Funde früher Angehöriger der Afrikanischen Elefanten barg die Fundstelle Langebaanweg im südwestlichen Teil des Kontinentes.[151] In der Regel handelt es sich bei den frühen Funden um isolierte Zähne, die teilweise der Art Loxodonta cookei zugewiesen werden. Das typische Kennzeichen der einzelnen Angehörigen von Loxodonta zeigt sich in der rautenförmigen Ausbuchtung des Zahnschmelzes der Schmelzlamellen der Backenzähne.[132]
Auch die bekannteste ausgestorbene Elefantenform, die Gattung Mammuthus (Mammute), hat ihren Ursprung in Afrika. Die früheste hier auftretende Form ist Mammuthus subplanifrons, von der beispielsweise Reste in Langebaanweg zu Tage traten,[151] ebenso wie im Awash-Gebiet oder in der Nkondo-Formation in Uganda. Die entsprechenden Alterswerte variieren zwischen 6 und 5 Millionen Jahren. Mammuthus subplanifrons war sehr urtümlich für ein Mammut, es besaß noch niedrige Molaren mit nur wenigen, aber dicken Schmelzlamellen. Bisher ist die Art weitgehend über Zähne und Unterkiefer bekannt, ein Schädel liegt nicht vor. Jedoch zeigt ein Stoßzahnfragment assoziiert mit einigen Backenzähnen aus Virginia im südlichen Afrika bereits die markante Spiraldrehung, wie sie auch für die anderen Gattungsvertreter typisch ist. Insgesamt erwiesen sich die Backenzähne von Mammuthus subplanifrons als stark variabel. Das eher geringe Fundmaterial schränkt aber die Aussagemöglichkeiten ein, so dass momentan unklar ist, ob das Taxon nicht eventuell mehrere Arten einschließt.[26][132]
Plio- und Pleistozän
Im frühen Pliozän Afrikas lässt sich noch Stegodibelodon aus der Gruppe der Stegotetrabelodontinae nachweisen, bei dem die unteren Stoßzähne bereits reduziert waren. Die Unterkiefersympphyse zeigte sich jedoch vergleichsweise lang, ebenso bestand die mittige Teilung der Schmelzlamellen noch. Die Form ist aus dem zentralen Afrika überliefert, etwa aus den Steinbrüchen von Kollé im Tschad. Von hier wurden auch späte Nachweise von Primelephas erbracht.[152]
Loxodonta erreichte im Pliozän und im Pleistozän eine weite Verbreitung in Afrika, Fossilbelege liegen vom Norden über den Osten bis zum Süden vor. Zunächst trat Loxodonta adaurora in Erscheinung, eine Form ähnlich den heutigen Afrikanischen Elefanten, aber noch mit niedrigen Backenzähnen. Die Tiere bewohnten Mosaiklandschaften, bedeutende Fundstellen mt Resten der Art liegen aus dem Awash- und dem Omo-Gebiet in Äthiopien, aus Kanapoi oder vom westlichen Turkanasee in Kenia vor. Ähnlich alt wie Loxodonta adaurora ist Loxodonta exoptata. Im Unterschied zu ersterer Art hatte letztere höhere Zahnkronen und mehr Zahnlamellen auf den Backenzähnen. Das Verbreitungsgebiet der beiden Formen war relativ ähnlich, zusätzlich drang Loxodonta exoptata bis in das zentrale Afrika vor, wie Funde aus Koro-Toro im Tschad zeigen. Loxodonta atlantica trat wiederum hauptsächlich im Oberen Pliozän und im Pleistozän sowohl in Nord- wie auch in Südafrika auf. Die Form lässt eine starke Spezialisierung erkennen mit extrem hochkronigen Molaren und einer höheren Anzahl an Lamellen als bei jedem anderen Gattungsvertreter. Dies verweist auf eine überwiegend grasfressende Ernährung. Der heutige Afrikanische Elefant ist erstmals im Altpleistozän belegbar, zu nennen wäre hier wiederum das Awash-Gebiet. Abweichend dazu verfügt der Waldelefant über keinen Fossilnachweis. Bemerkenswert ist des Weiteren, dass Loxodonta im Gegensatz zu anderen Elefantenformen bisher nicht außerhalb Afrikas dokumentiert wurde.[132]

Die Gattung Palaeoloxodon, die mit den Afrikanischen Elefanten nahe verwandt ist, entstand ebenfalls in Afrika, wo sie sich im Verlauf des Unteren Pliozän herausbildete. Ihre Vertreter entwickelten sehr früh hochkronige Zähne mit bis zu 19 Schmelzlamellen auf dem letzten Mahlzahn, was als Anpassung an das zunehmend trockener werdende Klima in Afrika anzusehen ist.[153] Frühe Vertreter in Afrika werden zur Art Palaeoloxodon eokorensis gezählt. Eingeführt wurde die Form anhand von Zähnen aus Kanapoi in Kenia (eine ursprünglich noch ältere angenommene Art aus Ostafrika, Palaeoloxodon nawataensis, ist heute nicht mehr anerkannt[132]).[149] Palaeoloxodon war im Verlauf des Pliozäns und des Pleistozäns eine der dominanten Elefantenformen Afrikas. Hierzu gehört auch das riesige Palaeoloxodon recki, das beispielsweise an bedeutenden Fundstellen wie Olorgesailie oder Olduvai nachgewiesen ist. Die Art bestand über einen langen Zeitraum vom ausgehenden Pliozän bis zum Mittelpleistozän und wurde in Afrika dann durch Palaeoloxodon jolensis abgelöst. Letzterer hielt sich noch bis in den Übergang vom Mittel- zum Oberpleistozän, wie junge Funde unter anderem aus der Kibish-Formation von Natodomeri im nördlichen Kenia anzeigen. Prinzipiell bisher nur über Zähne überliefert, verweist deren hochkroniger Bau und zusätzlich vorgenommene Isotopenanalysen auf eine überwiegend grasfressende Lebensweise.[154] Palaeoloxodon erreichte im Pleistozän auch Eurasien, von wo mit dem gleichfalls sehr großen Palaeoloxodon antiquus (Europäischer Waldelefant) der bekannteste Vertreter überliefert ist. Dessen Verbreitungsgebiet umspannte große Areale Europas und des westlichen Asiens. Eine bedeutende Fundkollektion liegt mit mehreren vollständigen Skeletten aus dem Geiseltal vor.[155] Die hauptsächliche Nahrung bestand aus gemischter weicher und harter Pflanzenkost,[156] dementsprechend kam die Art in den Gebieten nördlich der Alpen weitgehend nur während der Warmzeiten des Mittel- und Jungpleistozäns vor. Weiter östlich, in Zentral- und Südasien, wurde der Europäische Waldelefant vom (eventuell konspezifischen) Palaeoloxodon namadicus ersetzt. Vom Europäischen Waldelefanten stammen einige Zwergelefanten ab, die im Verlauf des Pleistozäns verschiedene Inseln des Mittelmeers besiedelten. Genannt seien hier stellvertretend Palaeoloxodon falconeri (Sizilianischer Zwergelefant) von Sizilien und Malta, Palaeoloxodon tiliensis von der Insel Tilos sowie Palaeoloxodon cypriotes von Zypern.[157][69][129]
_(Late_Pleistocene%252C_42_ka%253B_Yamal_Peninsula%252C_Siberia%252C_Russia)_1_(34834312015).jpg.webp)
Neben Mammuthus subplanifrons war in Afrika noch Mammuthus africanavus präsent, letzteres beschränkte sich aber weitgehend auf das Pliozän des nördlichen und zentralen Afrikas.[132] Spätestens vor rund 3 Millionen Jahren erreichten die Mammute auch das eurasische Gebiet. In der Regel werden diese ältesten Vertreter der Mammute außerhalb Afrikas mit Mammuthus meridionalis (Südelefant) assoziiert, alternativ besteht auch die Möglichkeit einer stärkeren Aufsplitterung der Frühformen, die dann unter den Bezeichnungen Mammuthis rumanus und Mammuthus gromovi geführt werden. Unterschiede finden sich unter anderem in der Anzahl der Schmelzlamellen. Zu den frühesten Funden in Eurasien zählen einige Zähne von Cernătești in der Kleinen Walachei in Rumänien, andere nur wenig jüngere Fundstellen liegen im zentralen Italien und in England.[158][159] Innerhalb der eurasischen Mammut-Linie bildete sich zunächst Mammuthus trogontherii (Steppenmammut) heraus, das weitgehend während des frühen und mittleren Abschnitts des Pleistozäns lebte und mit einer Schulterhöhe von 4,5 m zu den größten Rüsseltiervertretern gehört.[14] Die Terminalform wird durch Mammuthus primigenius (Wollhaarmammut) repräsentiert, welches die Charakterform der kaltzeitlichen eurasischen Offenlandschaften darstellt. Sie werden als Mammutsteppe bezeichnet und beherbergten den sogenannten Mammuthus-Coelodonta-Faunenkomplex, dem als weitere namensgebende Form das Wollnashorn angehörte.[25] Als Hinweise auf diese kaltzeitliche Lebensgemeinschaft und die weit nördliche Verbreitung des Wollhaarmammuts werden noch heute gelegentlich Eismumien der Tiere im sibirischen Dauerfrostboden gefunden, die zum Teil eine hervorragende Weichteilerhaltung besitzen. Aufgrund der Anpassungen des Wollhaarmammuts an die unwirtlichen Bedingungen der Kaltzeiten gilt die Art als am stärksten spezialisierter Elefantenvertreter. Dies drückt sich unter anderem in den Backenzähnen mit ihren extrem hohen Zahnkronen und der großen Anzahl an Schmelzlamellen aus, die mitunter mehr als dreißig umfassten. Das Wollhaarmammut überquerte im Oberpleistozän auch die Beringstraße und besiedelte weite Teile von Nordamerika. Bereits zuvor hatte dies der Südelefant oder das Steppenmammut bewältigt und sich vor 1,5 bis 1,3 Millionen Jahren in Nordamerika ausgebreitet. Dort entstand mit Mammuthus columbi (Präriemammut) eine eigenständige Linie.[18][160] Im Verlauf des Oberen Pleistozäns überschnitten sich in Nordamerika die Verbreitungsgebiete von sowohl Wollhaar- als auch Präriemammut und es kam gelegentlich zur Vermischung.[140][141] Ähnlich wie bei Palaeoloxodon entstanden innerhalb der Mammuthus-Linie einzelne Zwergformen, darunter etwa Mammuthus creticus von Kreta, Mammuthus lamarmorai von Sardinien und Mammuthus exilis auf den kalifornischen Kanalinseln.[161][6]
Die Gattung Elephas als nächstverwandte Form der Mammute ist vergleichsweise spät erstmals nachweisbar. Frühe Funde fallen in das ausgehende Pliozän und kamen in den Siwaliks in Südasien zu Tage. Sie gehören der Art Elephas planifrons an. Diese wurde dann zu Beginn des Unterpleistozäns durch Elephas hysudricus ersetzt, der von Süd- bis nach Westasien vorkam. Andere Vertreter wie Elephas platycephalus traten zu diesem Zeitpunkt ebenfalls auf, sind aber bisher äußerst selten nachgewiesen.[26] Der heutige Asiatische Elefant ist erstmals gesichert aus dem Oberpleistozän belegt, einzelne Funde verweisen eventuell schon auf das Mittelpleistozän. Die Malaiische Inselwelt beherbergte mit Stegoloxodon eine eigene Form, dessen Zähne ein wenig an die der Afrikanischen Elefanten erinnern. Es handelt sich um eine Zwergform, von der aber bisher nur wenige Fossilmaterial von Sulawesi und Java bekannt ist.[162]
Holozän und Aussterben verschiedener Elefantenformen
Über das Verschwinden der verschiedenen Elefantenformen im Laufe der Stammesgeschichte liegen aufgrund des teils wenig ergiebigen Fossilberichts nur vereinzelte Informationen vor. Dies betrifft vor allem die Vertreter des afrikanischen sowie des süd- und südostasiatischen Raumes. Vergleichsweise gut ist dagegen das Aussterben einzelner Elefantenarten (und anderer Rüsseltiergruppen) im Übergang vom Pleistozän zum Holozän untersucht wie etwa verschiedener Angehöriger der Gattungen Mammuthus und Palaeoloxodon, deren Entwicklungslinien vollständig erloschen. In Eurasien verschwand das Wollhaarmammut im Zeitraum von etwa 12.300 bis 8700 Jahren vor heute. Der Rückzug der Art erfolgte dabei wohl von West nach Ost, da die letzten Daten des Auftretens in Westeuropa durchschnittlich älter sind als im nordöstlichen Asien. Im festländischen Teil Nordasiens, etwa auf der Taimyrhalbinsel, hielt sich das Wollhaarmammut bis in das Untere Holozän.[163][164] Eine kleine Population überlebte auf der Wrangelinsel noch bis in das Mittlere Holozän vor 3700 Jahren.[165] Eine weitere weit ins Holozän überlebende Gruppe war auf den Pribilof-Inseln vor der Küste Alaskas heimisch und trat dort bis um 5700 Jahre vor heute auf.[166][167] Die jüngsten Daten für das Präriemammut in Nordamerika dagegen liegen zwischen 11.400 und 9300 Jahren vor heute, die von Mammuthus exilis bei rund 11.000 Jahren.[168][169]
Während der Europäische Waldelefant in Eurasien spätestens vor rund 33.000 Jahren auf der Iberischen Halbinsel letztmals nachweisbar ist,[170] überlebten seine Abkömmlinge auf den Inseln des Mittelmeers teilweise erheblich länger. Auf Zypern war Palaeoloxodon cypriotes noch vor rund 11.500 Jahren anwesend, Palaeoloxodon tiliensis von Tilos verschwand dagegen in einem Zeitraum von vor 4400 bis 3300 Jahren.[157]
Das Ende mehrerer Elefantenlinien im Oberen Pleistozän und im Verlauf des Holozäns fällt mit der Quartären Aussterbewelle zusammen, deren Ursachen vielfach diskutiert werden. Insgesamt zog sich aber das Aussterben der Mammute und der Vertreter von Palaeoloxodon über einen mehrere Tausend Jahre langen Zeitraum hin und ist so kein einmaliges Ereignis. Hier spielen vermutlich mehrere Faktoren eine Rolle. Sie setzten sich vor allem aus Klimaveränderungen, die die ausgehende letzte Kaltzeit bedingte, und den damit verbundenen Habitatüberprägungen zusammen. Gemeinsam mit diesen hat wohl auch zumindest lokal der Mensch einen Einfluss auf das Verschwinden oder Aussterben einzelner Elefantengruppen ausgeübt, etwa durch aktive Jagd.[171]
Forschungsgeschichte
Die Bezeichnung „Elefant“ geht auf das griechische Wort ἐλέφας (elephas) zurück. Dessen Ursprung ist unbekannt, möglicherweise leitet es sich von dem hebräischen Wort ibah her, das wiederum über das Sanskrit mit ibhas vermittelt wurde. Es fand Einzug in die lateinische Sprache, in der ebur für das „Elfenbein“ steht. Elephas wurde bereits in antiker Zeit verwendet, bezog sich aber zumeist auf die Stoßzähne und weniger auf das Tier selbst.[172] Als zusammenfassende und übergeordnete Bezeichnung für die Elefanten diente Elephas bereits im 17. Jahrhundert. Im Jahr 1758 etablierte dann Linnaeus in seinem wegweisenden Werk Systema Naturae die Gattung Elephas, in der er sowohl die asiatischen als auch die afrikanischen Tiere einschloss und sie unter der Bezeichnung Elephas maximus vereinte.[173] Erst 45 Jahre später trennte Johann Friedrich Blumenbach die asiatischen und afrikanischen Formen auf artlicher Ebene.[174] Die generische Unterscheidung geht mit der offiziellen Einführung der Gattung Loxodonta auf einen unbekannten Autor 1827 zurück,[175] der aber wiederum einen zwei Jahre zuvor von Frédéric Cuvier gebrauchten Begriff verwendete.[176] Die auf den Gattungsnamen Elephas basierende Familienbezeichnung Elephantidae wurde im Jahr 1821 von John Edward Gray eingeführt. Gray definierte die Elefanten folgendermaßen: Teeth, two grinders in each jaw, composed of transverse vertical lamina, enveloped in enamel, and soldered together by a cortical substance („Zähne, zwei Mahlzähne in jedem Kiefer, bestehend aus quergestellten, senkrechten Blättern, umhüllt von Zahnschmelz und zusammengehalten von einer äußeren Substanz“).[177]
Die systematische Zuweisung der Elefanten variierte im Laufe der Zeit. Linnaeus sah die Tiere innerhalb einer Bruta genannten Gruppe, die unter anderem auch die Seekühe, Faultiere und Schuppentiere einschloss.[173] Blumenbach stellte ihnen noch verschiedene Huftiere wie die Tapire, Nashörner, Flusspferde und die Schweine zur Seite.[174] Dies blieb die prinzipielle Verwandtschaftszuordnung zum Ende des 18. und im Verlauf des 19. Jahrhunderts. Étienne Geoffroy Saint-Hilaire und Georges Cuvier fassten alle von Blumenbach genannten Huftiere im Jahr 1795 zu den Pachydermata („Dickhäuter“) zusammen,[178] einer aus heutiger Sicht in sich nicht geschlossenen Gruppe. Später fügte Cuvier noch die Pekaris, Schliefer und einige ausgestorbene Formen hinzu.[179] Im Jahr 1811 führte Johann Karl Wilhelm Illiger die Bezeichnung Proboscidea ein, in der er die Elefanten einordnete und sie nach ihrem auffälligsten Kennzeichen benannte. Illiger wies noch keine Fossilformen zu den Proboscidea.[180] Gray übernahm 1821 Illigers Ordnungseinheit und schloss in ihr neben den Elefanten zusätzlich noch die „Mastodonten“ ein, eine altertümliche und heute nicht mehr gebräuchliche Rüsseltiergruppe.[177] In seiner Schrift von 1811 hatte Illiger die Proboscidea in einer Gruppe namens Multungulata („Vielhufer“) eingegliedert, die aber konzeptionell den Pachydermata entsprachen. Bereits fünf Jahre später brach Henri Marie Ducrotay de Blainville erstmals das Konstrukt der Pachydermata auf, in dem er mehrere Gruppen an Huftieren unterschied. Hierzu gehörten unter anderem Tiere mit einer geraden Anzahl an Zehen (onguligrades à doigts pairs) und solche mit einer ungeraden Anzahl (onguligrades à doigts impairs). Die Elefanten gruppierte er als einzige Mitglieder in eine höhere Einheit namens Gravigrades.[181] Später, im Jahr 1848, griff Richard Owen den Ansatz auf und trennte die Paarhufer (Artiodactyla) und die Unpaarhufer (Perissodactyla) ab, womit er die Pachydermata endgültig aufspaltete. Die Rüsseltiere sah er zwar als prinzipiell ähnlich zu den Unpaarhufern, beließ sie aber aufgrund zahlreicher Eigentümlichkeiten wie des Rüssels in einer eigenständigen Ordnungseinheit.[182][183]
Die Nahverwandtschaft der Elefanten beziehungsweise der Proboscidea mit den Huftieren blieb nachfolgend weitgehend bestehen. Allerdings merkte Theodore Gill im Jahr 1870 eine engere Bindung zwischen den Rüsseltieren, den Seekühen und den Schliefern an, ohne dieser Gruppe einen speziellen Namen zu geben.[184] Andere Autoren belegten ähnliche Verwandtschaftsverhältnisse mit Bezeichnungen wie Taxeopoda (Edward Drinker Cope 1880 und 1890er Jahre) oder Subungulata (Richard Lydekker 1890er Jahre und Max Schlosser 1920er Jahre), die sich aber jeweils als problematisch erwiesen. George Gaylord Simpson etablierte daher im Jahr 1945 in seiner generellen Taxonomie der Säugetiere die Paenungulata als eine neue übergeordnete Gruppe für die Elefanten, Schliefer und Seekühe nebst diversen ausgestorbenen Formen.[183] Die Paenungulata sah Simpson als Bestandteil der Protungulata.[183] Dagegen führten Malcolm C. McKenna und Susan K. Bell die Paenungulata (hier als Uranotheria benannt) einschließlich der Elefanten allgemein innerhalb der Ungulata.[185] In zahlreichen Systematiken wurden die Paenungulata als näher verwandt mit den Unpaarhufern erachtet. Erst biochemische und molekulargenetische Studien aus dem Übergang vom 20. zum 21. Jahrhundert deckten auf, dass die Paenungulata und somit auch die Elefanten einer Gruppe angehören, die originär in Afrika verbreitet ist und folglich als Afrotheria bezeichnet wird.[186][187][188][189][190][124]
Zahlreiche Wissenschaftler haben die Elefanten als zentrales Forschungsthema. In der zweiten Hälfte des 20. Jahrhunderts leistete vor allen Vincent J. Maglio herausragende Arbeit zur Evolutionsgeschichte der Elefanten.[26] Er erstellte dabei auch ein Verwandtschaftsschema, das weitgehend bis heute besteht und auf Vorarbeiten von Emiliano Aguirre aus den 1960er Jahren beruht.[191] In der Folgezeit wurde dieses weiter verfeinert, unter anderm durch die Untersuchungen von Michel Beden in den 1970er und 1980er Jahren an afrikanischen Fossilfunden.[192] Studien jüngeren Datums zur Thematik wurden durch Jeheskel Shoshani und Pascal Tassy im Übergang vom 20. zum 21. Jahrhundert vorgelegt, die Autoren boten im Jahr 2005 einen breiten Überblick an.[135] Zunehmend verleihen auch genetische Untersuchungen an rezenten und fossilen Arten der Systematik der Elefanten einen Feinschliff, federführend ist hier Nadin Rohland.[133][134] Mit den rezenten Arten beschäftigten sich im ausgehenden 20. und beginnenden 21. Jahrhundert neben Shoshani vor allem George Wittemyer und Raman Sukumar.[17][2][1][193] Hervorgehoben werden müssen hier des Weiteren die Feldforschungen von Joyce H. Poole und Cynthia J. Moss, die wichtige Erkenntnisse zur Lebensweise und Sozialstruktur der Elefanten beitrugen.[111] Überwiegend die frühen Elefantenformen als Schwerpunkt ihrer wissenschaftlichen Arbeit haben William J. Sanders und Adrian Lister.[151][132][18]
Elefanten und Menschen
Vorgeschichte
Die Beziehungen zwischen Menschen und Elefanten reichen mehrere hunderttausend Jahre zurück. Dabei diente der Körper des Elefanten als wichtige Rohstoffressource, sei es für Nahrungszwecke (Elefantenfleisch) oder zur Herstellung von Werkzeugen oder Kunstgegenständen aus Knochen und Elfenbein. Reste von Elefanten finden sich relativ häufig an Fundstellen früher Menschengruppen des Alt- und Mittelpaläolithikums (vor 2,5 Millionen bis vor 40.000 Jahren), hier beispielhaft erwähnt der Südelefant in Barranc de la Boella in Katalonien,[194] der Europäische Waldelefant an der Station von Weimar-Ehringsdorf in Thüringen[195] beziehungsweise im Geiseltal in Sachsen-Anhalt[155] oder in Ficoncella sowie in Polledrara, beide in Mittelitalien,[196][197] wie auch Palaeoloxodon recki an der Station Namib IV in der Namib[198] im südlichen oder in Fejej in Äthiopien im östlichen Afrika.[199] An einzelnen Fundstellen lässt sich eine eindeutige Kadavernutzung feststellen, so wie in Gröbern in Sachsen-Anhalt.[200] Ob die Tiere damals tatsächlich schon gejagt wurden, ist nicht ganz schlüssig geklärt, jedoch deutet die rund 120.000 Jahre alte Lanze von Lehringen, die in einem Skelett eines Europäischen Waldelefanten steckte und mit mehr als zwei Dutzend Feuersteinartefakten assoziiert war, darauf hin.[201] Gelegentlich stellten die frühen Menschen auch Geräte und Werkzeuge aus Elefantenknochen her beziehungsweise nutzten Reste der Tiere in einem möglicherweise künstlerischen Kontext weiter, wofür die Mammutzahnlamelle aus Tata in Ungarn hervorgehoben werden soll.[202]


Intensiver wurden die Beziehungen zu den Elefanten im nachfolgenden Jungpaläolithikum (vor rund 40.000 bis 10.000 Jahren). Nicht nur verdichten sich die Hinweise auf eine aktive Jagd auf Elefanten wie dies etwa Funde von Mammutkadavern mit eingeschlagenen Projektilspitzen aus verschiedenen Fundstellen Sibiriens oder des östlichen Europas zeigen,[203] auch wurden Elefantenteile wesentlich häufiger als Rohmaterialquelle für die Werkzeug- und Geräteproduktion eingesetzt. Die Knochen und Stoßzähne fanden darüber hinaus Verwendung in der Kleinkunst. Sie wurden bemalt oder teilweise mit Ritzmustern versehen, andere wiederum zu Kleinfiguren überarbeitet. Herausragend sind etwa der Löwenmensch aus dem Hohlenstein-Stadel in Baden-Württemberg oder verschiedene Venusstatuetten wie die Venus von Brassempouy in Frankreich. Gleichzeitig fallen darunter auch Darstellungen von Elefanten selbst, wobei in nahezu allen bekannten Fällen das Wollhaarmammut Pate stand. Diese liegen sowohl als Ritzzeichnung als auch als Kleinplastik vor und können als die ältesten Abbildungen der Tiere angesehen werden. Bekannt sind jene aus der Vogelherdhöhle in Baden-Württemberg oder aus Dolní Věstonice in Mähren, die zwischen 40.000 und 20.000 Jahre vor heute datieren, beziehungsweise etwas jünger aus Gönnersdorf in Rheinland-Pfalz. Mitunter sind es nicht nur Objekte mit künstlerische Bedeutung, sondern auch solche mit praktischer Funktion wie es die Speerschleuder von Bruniquel in Frankreich beweist.[204] Relativ einmalig ist eine Mammutritzung aus Old Vero in Florida, die wohl ein Präriemammut darstellt und eines der wenigen bekannten paläoindianischen Kunstobjekte repräsentiert.[205] Neben der mobilen Kleinkunst wurden Mammute auch in der Höhlenkunst porträtiert, Darstellungen sind von der Iberischen Halbinsel bis zum Ural überliefert. Herausragend sind hier die Grotte Chauvet, die Höhle von Rouffignac mit besonders vielen Mammutzeichnungen, beide in Frankreich, oder die Höhle von Kapowa in Russland. Allein in der Frankokantabrischen Höhlenkunst finden sich Mammute in rund einem Sechstel der rund 300 bekannten Höhlen mit Wandkunst und erreichen einen Anteil von 6 % aller Tierdarstellungen, sie gehören somit neben Wildpferden, Auerochsen und Wisenten, Steinböcken sowie Hirschen zu den am häufigsten porträtierten Tieren.[206][207] Als weitere Besonderheit können die Mammutknochenhütten von Mesyn und Meschyritsch in der Ukraine genannt werden.[204] Mit dem Aussterben der Mammute endete auch deren bildliche Wiedergabe. Aus prähistorischer Zeit sind aber Darstellungen auch aus dem nördlichen und südlichen Afrika sowie aus Indien belegt, die sowohl den Afrikanischen als auch den Asiatischen Elefanten betreffen.[208][209]
Altertum

Eine größere Bedeutung erreichten Elefanten wieder ab dem 3. Jahrtausend v. Chr. In der bronzezeitlichen Indus-Kultur im heutigen Pakistan wurden die Tiere auf kleinen Siegeln aus Speckstein eingraviert. Die Funde deuten darauf hin, dass möglicherweise bereits zu dieser Zeit der Asiatische Elefant gezähmt und eventuell als Arbeitstier gehalten wurde.[210] Spätestens seit Mitte des 2. Jahrtausends v. Chr. berichten indische Schriften über Zähmung und Haltung von Elefanten. Ihrer großen Kraft wegen fanden sie vorwiegend Einsatz als Arbeitstiere. Überlieferungen über eine Verwendung als Kriegselefanten reichen bis in das 4. vorchristliche Jahrhundert zurück.[211][212] Von Indien aus breitete sich das Wissen um die Zähmung des Asiatischen Elefanten über Südost- bis nach Ostasien aus. Er wurde dabei in der Folgezeit auch in religiöse Zeremonien integriert. Seine teils heilige Bedeutung in der Region spiegelt sich im elefantengesichtigen Gott Ganesha des Hinduismus und in der Geburtslegende des Siddhartha Gautama im Buddhismus wider. Ihm zu Ehren zieren unter anderem steinerne Skulpturen Tempel und Paläste. Zur Zähmung wilder Tiere wurden spezielle Elefantenschulen eingerichtet, die Trainer von Tieren werden als Mahuts bezeichnet. Diese jahrhundertealte Tradition wird weitgehend in der Familie weitervererbt.[213] Einschränkend muss gesagt werden, dass trotz einer weitverbreiteten Annahme der Asiatische Elefant nie domestiziert wurde, sondern es sich vielmehr um die Zähmung von Wildtieren handelt. Nach dem Tod eines Elefanten müssen daher in der Regel neue Individuen aus den Wildbeständen eingefangen werden.[211][212]
Im alten Ägypten waren Elefanten bekannt, spielten aber im Alltag keine Rolle. Gelegentlich finden sich jedoch Tempelreliefs der Tiere. Sehr begehrt war allerdings das Elfenbein der Stoßzähne. Unter anderem von Thutmosis III. ist um 1446 v. Chr. die Jagd auf 120 Tiere in Syrien überliefert.[211][214] Dort waren in flussnahen Regionen noch bis ins 8./7. Jahrhundert v. Chr. Elefanten heimisch.[215] Deren nächste genetische Verwandte sind heute in Südostasien zu finden, weswegen einige Wissenschaftler annehmen, die Tiere wären anthropogen in Westasien eingeführt worden.[214][216] Die antiken Griechen kannten zunächst nur das Elfenbein als Handelsobjekt. Erste exakte Beschreibungen der Tiere datieren in das frühe 4. Jahrhundert v. Chr., als der Gelehrte Ktesias von Knidos vom Hof des persischen Großkönigs Dareios II. zurückgekehrt war. Bei den Feldzügen Alexanders des Großen gegen das Perserreich begegneten die Griechen erstmals dessen Kriegselefanten, angefangen mit der Schlacht von Gaugamela. Beeindruckt von der Effizienz der Tiere begann Alexander ein eigenes Elefantenheer aufzubauen. Nach seinem Tod 323 v. Chr. wurden die Kriegselefanten in den Diadochenkriegen eingesetzt. Durch den Sieg von Ptolemaios I. über Perdikkas gelangten die Tiere nach Nordafrika. In der Folgezeit versuchten die Ptolemäer, da abgeschnitten von der Verbreitung des Asiatischen Elefanten, diese durch Afrikanische zu ersetzen, die sie im heutigen Eritrea einfingen. Durch die Nutzung des Afrikanischen Elefanten seitens der Ptolemäer standen sich in der Schlacht bei Raphia im Jahr 217 v. Chr. erstmals Vertreter beider Arten als Kriegsbeteiligte gegenüber. Etwa im selben Zeitraum nutzte der karthagische Feldherr Hannibal Kriegselefanten, um auf seinem Marsch gen Rom im Zweiten Punischen Krieg die Alpen zu überqueren.[217][218][219]

Die Römer selbst waren Elefanten erstmals in der Schlacht von Heraclea um 280 v. Chr. begegnet. Die gegnerische Seite unter Pyrrhos I. setzte in dieser Auseinandersetzung zahlreiche Kriegselefanten ein und schlug die römischen Truppen, die angesichts der ihnen unbekannten riesigen Tiere (von den Römern als „lukanische Ochsen“ bezeichnet, benannt nach der dortigen Landschaft Lukanien[220]) flohen. Fünf Jahre später siegte der römische Heerführer Manius Curius Dentatus über Pyrrhus in der Schlacht bei Beneventum und zeigte den Einwohnern Roms erstmals einige gefangene Tiere bei seinem Triumphzug. Um 250 v. Chr. bezwang der römische Konsul Lucius Caecilius Metellus im Ersten Punischen Krieg auf Sizilien den karthagischen Feldherren Hasdrubal und dessen Heer, dem 120 Kriegselefanten angehörten. Metellus brachte die Elefanten auf Flößen nach Italien und führte sie ebenfalls in seinem Triumphzug mit. Spätestens um 200 v. Chr. hatten die Römer Kriegselefanten in ihr Heer eingegliedert, die unter anderem während des Zweiten Makedonisch-Römischen Krieges aufmarschierten.[221][222] Elefanten wurden aber nicht nur als Kriegswaffen eingesetzt, sondern dienten ab 169 v. Chr. auch bei Schaukämpfen gegen Tiere und Menschen. Zu erwähnen ist hier die Einweihung des ersten steinernen Theaters in Rom durch Gnaeus Pompeius Magnus 55 v. Chr., bei der unter anderem 20 Elefanten geschlachtet wurden. Darüber hinaus wurden zumindest in der Römischen Kaiserzeit auch Kunststücke von Elefanten zur Belustigung vorgeführt.[222][223]
Nach Ktesias von Knidos befassten sich in der Antike vor allem Aristoteles in seinem zoologischen Werk Historia animalium und Plinius der Ältere in seiner Naturalis historia mit Elefanten, wobei Letzterer auf das heute verlorene Werk des mauretanischen Königs Juba II. zurückgriff. Wiederholt wurden die Tiere im Altertum auf Münzen dargestellt, vor allem bei den Mächten, die Elefanten in ihrem Heer hatten (Ptolemäer, Seleukiden, Karthager), aber auch bei den Etruskern und später den römischen Kaisern. Auch auf antiken Gemmen finden sich ähnliche kleinformatige Darstellungen. In der Spätantike kamen großformatigere Abbildungen von Elefanten auf, in Mosaiken mit Jagdszenen sowie in dem neuen Genre der Buchmalerei.[222]
Mittelalter und Neuzeit

Die Bedeutung des Elefanten als Kriegs- und heiliges Tier sowie als Statussymbol setzte sich später fort. Akbar, einer der bedeutendsten Mogule, besiegte 1556 in der Zweiten Schlacht von Panipat seinen Gegner Hemu, in dessen Armee auch 1500 Kriegselefanten mitwirkten. Später, um 1580 marschierte Akbar selbst mit rund 500 Kriegselefanten und 50.000 Soldaten Richtung Kabul und vereinte endgültig das Reich.[224] Die verschiedenen Mogulherrscher hatten hunderte Elefanten in ihren Ställen, die teilweise in bis zu sieben Rangklassen eingestuft waren. Besondere Verdienste wurden manchmal mit dem Geschenk eines Elefanten belohnt. Des Weiteren fanden Elefanten neben dem Krieg als Reittiere bei der Jagd sowie bei Schaukämpfen Einsatz.[211] Die Darstellung imperialer Größe durch Elefanten ging auf die europäischen Gebiete über und verstärkte sich vor allem während der Kolonialzeit, wo die Tiere zum Teil diplomatische Geschenke bildeten. Dadurch sind einzelne Elefanten namentlich in die europäische Geschichte eingegangen. Zu nennen wären hier „Abul Abbas“ (9. Jahrhundert), „Hanno“ (16. Jahrhundert), „Soliman“ (16. Jahrhundert) und „Hansken“ (17. Jahrhundert). In der Regel handelte es sich um Vertreter des Asiatischen Elefanten, seltener wie im Falle des Elefanten Ludwigs XIV. um solche des Afrikanischen. Einige Elefanten besaßen zeitgenössische Berühmtheit und Popularität. Hierzu zählt beispielsweise „Hanno“, der unter anderem von Raffael mehrfach porträtiert wurde, darunter auch in einem lebensgroßen Fresko am Eingang des Vatikanischen Palastes, das allerdings nicht mehr erhalten ist.[225][226] Bei anderen wiederum zeigte sich ihre Bedeutung erst im Nachhinein, wie etwa bei „Hansken“, dessen Skelett im Jahr 2014 zum Typusexemplar des Asiatischen Elefanten erhoben wurde.[227] Ein Großteil der verschenkten Tiere gelangte in die Menagerien der europäischen Adelshäuser, andere gingen als Attraktion auf Rundreise. Die Menagerien wurden im Übergang von 18. zum 19. Jahrhundert durch weitgehend öffentlich zugängliche Zoos ersetzt, wobei Städte wie Wien, Paris und London den Auftakt bildeten. Bereits sehr früh wurden dabei speziell Einrichtungen für Elefanten geschaffen, so etwa 1808 in Paris oder 1831 in London.[228]
In der modernen Entwicklung zählen die Elefanten aufgrund ihrer beeindruckenden Größe zu den beliebtesten Zootieren. Aufgrund ihrer Intelligenz eignen sie sich für Dressuren im Zirkus. Allerdings ist die Haltung derartig großer Tiere nicht unproblematisch. Sie führt einerseits zu Konflikten und Unfällen mit Menschen, andererseits kann eine schlechte und nicht artgerechte Unterbringung zu verschiedenen Verhaltensstörungen führen, von denen das rhythmische Hin- und Herbewegen (Weben) vielleicht die bekannteste ist.[229][230]
Mensch-Elefant-Konflikte
Heute ist der Asiatische Elefant in rund einem Dutzend Ländern in Süd-, Südost- und Ostasien heimisch, der Afrikanische Elefant bewohnt rund drei Dutzend Länder im Afrika südlich der Sahara. Das Vorkommen des Waldelefanten in Zentral- und Westafrika ist dagegen wenig untersucht. Im südlichen Asien deckt sich das Vorkommen des Asiatischen Elefanten teilweise mit der höchsten Besiedlungsdichte des Menschen. Mehrere Länder mit Elefantenpopulationen wiederum gehören zu den ärmsten der Welt. Insbesondere durch die zunehmende Einengung der Lebensräume der Elefanten kommt es immer wieder zu Konflikten mit lokal ansässigen Menschen. Erfasst werden diese durch die „Human-Elephant-Conflict“-Statistik (HEC).[231] Dabei stehen die Elefanten bedingt durch ihre Körpergröße und soziale Lebensweise und den daraus resultierenden Platz- und Nahrungsbedarf häufig in Konkurrenz um Nahrungsressourcen zum Menschen. Dies führt beispielsweise zu Plünderung von Feldern oder zur übermäßigen Nutzung von Wasserquellen in trockenen Gebieten durch Elefanten. Außerdem sind Elefanten vergleichbar dem Menschen befähigt, starken Einfluss auf ihre unmittelbare Umgebung zu nehmen (ecosystem engineering). Die sich daraus ergebenden Konflikte führen nicht nur zu wirtschaftlichem Schaden der betroffenen Menschen, sondern können im Extremfall auch einen tödlichen Ausgang haben. Nach Schätzungen sterben allein in Indien jährlich zwischen 150 und 400 Menschen bei Zusammenstößen mit Elefanten, bis zu 500.000 Familien sind zusätzlich durch Schäden bei Feldplünderungen betroffen. Für Sri Lanka liegt die Anzahl der getöteten Menschen bei jährlich bis zu 70, während in Kenia zwischen den Jahren 2010 und 2017 rund 200 Menschen ihr Leben verloren.[193][232] Andererseits werden jährlich mehrere hunderte bis tausende Elefanten durch Menschen getötet – vielfach durch Bauern, die ihre Felderträge schützen wollen, oder als Vergeltung für menschliche Todesopfer. Weitere Tiere sterben durch die Auswirkungen menschlicher Auseinandersetzungen, etwa durch Landminen.[231] Im zusätzlichen Maße kommt noch die Wilderei hinzu. Im Jahr 2009 wurde die Zahl der für den Elfenbeinhandel in Afrika gewilderten Elefanten auf 38.000 Tiere pro Jahr geschätzt.[233]
Die Vermeidung oder Verringerung von Mensch-Elefant-Konflikten ist eine der Herausforderungen des Naturschutzes. Es bestehen momentan verschiedene Möglichkeiten, Zusammenstöße mit beziehungsweise die Schädigung wirtschaftlicher Nutzflächen durch Elefanten zu minimieren. Einen Vorrang haben beispielsweise die Erhaltung oder Einrichtung von Schutzgebieten und Migrationskorridoren, welche die umfassenden Wanderungen der einzelnen Familiengruppen ermöglichen. In unmittelbarer Nachbarschaft zum Menschen gehören hierzu des Weiteren physische Barrieren wie Zäune und Gräben sowie Abschreckung durch Feuer, Lärm, Licht oder Schaffung von Pufferzonen mit ungenießbaren Pflanzen wie Chili. Derartige Hindernisse können lokal starken Einfluss auf die Wanderungsbewegungen der Tiere ausüben. Andere Maßnahmen betreffen den Einsatz von Summgeräuschen von Bienen oder Gerüchen großer Beutegreifer, da Elefanten in beiden Fällen durch negative Erfahrungen abweisend auf diese reagieren.[234][235] Auch besteht die Möglichkeit der Installation von Detektoren, die rechtzeitig vor dem Eintreffen von Elefantengruppen warnen. Eine in der Vergangenheit vor allem in Afrika häufiger angewandte Maßnahme ist die Keulung ganzer Herden. Sie ist aber rückläufig, vielmehr werden heute problematische Individuen oder Gruppen umgesiedelt. Für eine weitere Reduzierung der Mensch-Elefant-Konflikte ist eine bessere Untersuchung und Ausweisung möglicher Konfliktherde erforderlich. Das Erkennen derartig potentiell problematischer Regionen ermöglicht dann, Alternativen sowohl für die betroffenen Menschen als auch für die Tiere zu schaffen.[193][232]
Bedrohung und Schutz
Die größte Gefährdung für die drei heute existierenden Elefantenarten ist die illegale Jagd. Diese erfolgt vor allem wegen der Stoßzähne, untergeordnet spielen auch das Fleisch als Nahrungsressource sowie Haut und Knochen als Rohstoffquelle eine Rolle. Des Weiteren wirken sich die Lebensraumzerstörung durch Abholzung der Wälder und Zersiedelung der Landschaften infolge der Ausbreitung menschlicher Siedlungen beziehungsweise Wirtschaftsflächen äußerst negativ auf die Bestände aus. Dies führt auch zu den bereits erwähnten Mensch-Elefant-Konflikten. Die IUCN stuft den Asiatischen Elefanten als „bedroht“ (endangered) ein. Der Wildbestand umfasst schätzungsweise 48.320 bis 51.680 Tiere, von denen die Hälfte ungefähr in Indien lebt. Hinzu kommen etwa 14.500 bis 16.000 Individuen, die als Nutztiere gehalten werden. Der Afrikanische Elefant gilt als „stark gefährdet“ (endangered), der Waldelefant als „vom Aussterben bedroht“ (critically endangered). Insgesamt leben in Afrika vermutlich rund 352.000 Elefanten mit dem größten Anteil im nördlichen Teil des südlichen Afrikas und in Ostafrika.[236] Alle drei heutigen Arten werden im Washingtoner Artenschutzübereinkommen (CITES) im Anhang I geführt, womit der überregionale sowie internationale Handel mit lebenden Exemplaren oder Teilen toter Individuen verboten ist.[237] Sowohl der Asiatische als auch die beiden afrikanischen Elefanten sind in zahlreichen Naturschutzgebieten präsent. Zu den wichtigen Herausforderungen gehören der Erhalt und Schutz der Lebens- und Migrationsräume der einzelnen Populationen auch über Grenzen hinweg sowie die Reduktion von Konflikten zwischen Elefanten und Menschen.[238][239][240]
Literatur
- Larry Laursen und Marc Bekoff: Loxodonta africana. Mammalian Species 92, 1978, S. 1–8
- Adrian Lister und Paul Bahn: Mammuts – Riesen der Eiszeit. Thorbecke Verlag, Sigmaringen 1997, S. 1–168, ISBN 3-7995-9050-1
- Jeheskel Shoshani und John F. Eisenberg: Elephas maximus. Mammalian Species 182, 1982, S. 1–8
- Jeheskel Shoshani und Pascal Tassy (plus weitere Autoren): Order Proboscidea – Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 173–200
- G. Wittemyer: Family Elephantidae (Elephants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 50–79, ISBN 978-84-96553-77-4
Einzelnachweise
- G. Wittemyer: Family Elephantidae (Elephants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World.Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 50–79, ISBN 978-84-96553-77-4
- Jeheskel Shoshani und Pascal Tassy (plus weitere Autoren): Order Proboscidea – Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 173–200
- Donald R. Prothero: Rhino giants: The palaeobiology of Indricotheres. Indiana University Press, 2013, S. 1–141 (S. 105), ISBN 978-0-253-00819-0
- Donald R. Prothero und Robert M. Schoch: Horns, tusks, and flippers. The evolution of hoofed mammals. Johns Hopkins University Press, Baltimore, 2003, S. 1–315 (S. 182–183), ISBN 0-8018-7135-2
- Athanassios Athanassiou, Alexandra A. E. van der Geer und George A. Lyras: Pleistocene insular Proboscidea of the Eastern Mediterranean: A review and update. Quaternary Science Reviews 218, 2019, S. 306–321
- Victoria L. Herridge und Adrian M. Lister: Extreme insular dwarfism evolved in a mammoth. Proceedings of the Royal Society series B 279 (1741), 2012, S. 3193–3200, doi:10.1098/rspb.2012.0671
- Maria Rita Palombo: Elephants in miniature. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale 2010, S. 275–295
- Per Christiansen: Body size in proboscideans, with notes on elephant metabolism. Zoological Journal of the Linnean Society 140, 2004, S. 523–549
- Asier Larramendi: Shoulder height, body mass, and shape of proboscideans. Acta Palaeontologia Polonica 61 (3), 2016, S. 537–574
- G. E. Weissengruber, G. F. Egger, J. R. Hutchinson, H. B. Groenewald, L. Elsässer, D. Famini und G. Forstenpointner: The structure of the cushions in the feet of African elephants (Loxodonta africana). Journal of Anatomy 209, 2006, S. 781–792
- Ian S. C. Parker und Alistair D. Graham: The African elephants‘ toe nails. Journal of East African Natural History 106 (1), 2017, S. 47–51
- Andreas Benz, Wolfgang Zenker, Thomas B. Hildebrandt, Gerald Weissengruber, Klaus Eulenberger und Hans Geyer: Microscopic morphology of the elephant’s hoof. Journal of Zoo and Wildlife Medicine 40 (4), 2009, S. 711–725
- Vincent J. Maglio: Evolution of Mastication in the Elephantidae. Evolution 26, 1972, S. 638–658
- Jeheskel Shoshani: Understanding proboscidean evolution: a formidable task. Tree 13, 1998, S. 480–487
- Nancy E. Todd: Qualitative Comparison of the Cranio-Dental Osteology of the Extant Elephants, Elephas Maximus (Asian Elephant) and Loxodonta africana (African Elephant). The Anatomical Record 293, 2010, S. 62–73
- Larry Laursen und Marc Bekoff: Loxodonta africana. Mammalian Species 92, 1978, S. 1–8
- Jeheskel Shoshani und John F. Eisenberg: Elephas maximus. Mammalian Species 182, 1982, S. 1–8
- Adrian Lister und Paul Bahn: Mammuts – Die Riesen der Eiszeit. Sigmaringen 1997, S. 1–168 (S. 28–29 und 80)
- Sebastian J. Pfeifer, Wolfram L. Hartramph, Ralf-Dietrich Kahlke und Frank A. Müller: Mammoth ivory was the most suitable osseous raw material for the production of Late Pleistocene big game projectile points. Scientific Reports 9, 2019, S. 2303, doi:10.1038/s41598-019-38779-1
- Arun Banerjee: Das Mammutelfenbein. In: Ulrich Joger und Ute Koch (Hrsg.): Mammuts aus Sibirien. Darmstadt, 1994, S. 38–42
- Arun Banerjee: Vergleichende Untersuchung der „Schreger-Struktur“ an Stoßzähnen von Elefanten. Mainzer Naturwissenschaftliches Archiv 42, 2004, S. 77–88
- Marie Albéric, Mason N. Dean, Aurélien Gourrier, Wolfgang Wagermaier, John W. C. Dunlop, Andreas Staude, Peter Fratzl und Ina Reiche: Relation between the Macroscopic Pattern of Elephant Ivory and Its Three-Dimensional Micro-Tubular Network. PLoS ONE 12 (1), 2017, S .e0166671, doi:10.1371/journal.pone.0166671
- Marie Albéric, Aurélien Gourrier, Wolfgang Wagermaier, Peter Fratzl und Ina Reiche: The three-dimensional arrangement of the mineralized collagen fibers in elephant ivory and its relation to mechanical and optical properties. Acta Biomaterialia 72, 2018, S. 342–351, doi:10.1016/j.actbio.2018.02.016
- Achim Paululat und Günter Purschke: Wörterbuch der Zoologie. 8. Auflage, Springer, Heidelberg 2011, S. 267, ISBN 978-3-8274-2115-9
- Ralf-Dietrich Kahlke: Die Entstehungs-, Entwicklungs- und Verbreitungsgeschichte des Oberpleistozänen Mammuthus-Coelodonta-Faunencomplexes in Eurasien (Großsäuger). Abhandlungen der Senckenbergischen Naturforschenden Gesellschaft 546, 1994, S. 1–64
- Vincent J. Maglio: Origin and evolution of the Elephantidae. Transactions of the American Philosophical Society 63, 1973, S. 1–149 (S. 14–66)
- Nancy E. Todd: New phylogenetic analysis of the family Elephantida based on cranial-dental morphology. The anatomical Record 293, 2010, S. 74–90
- Jeheskel Shoshani: Skeletal and other basic anatomical features of elephants. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of elephants and their relatives. Oxford University Press, 1996, S. 9–20
- William J. Sanders: Horizontal tooth displacement and premolar occurrence in elephants and other elephantiform proboscideans. Historical Biology 30 (1–2), 2018, S. 137–156, doi:10.1080/08912963.2017.1297436
- Genevieve A. Dumonceaux: Digestive System. In: M. E. Fowler und S. K. Mikota (Hrsg.): Biology, Medicine, and Surgery of Elephants. Blackwell Publishing Ltd, Oxford UK 2006, S. 299–308, doi:10.1002/9780470344484.ch22
- Jeheskel Shoshani, Robert C. Walter, Michael Abraha, Seife Berhe, Pascal Tassy, William J. Sanders, Gary H. Marchant, Yosief Libsekal, Tesfalidet Ghirmai und Dietmar Zinner: A proboscidean from the late Oligocene of Eritrea, a “missing link” between early Elephantiformes and Elephantimorpha, and biogeographic implications. PNAS 103 (46), 2006, S. 17296–17301, doi:10.1073/pnas.0603689103
- Christian Schiffmann, Jean-Michel Hatt, Daryl Codron und Marcus Clauss: Elephant body mass cyclity suggests effect of molar progressionon chewing efficiensy. Mammalian Biology 96, 2019, S. 81–86, doi:10.1016/j.mambio.2018.12.004
- Jeheskel Shoshani: On the Dissection of a Female Asian Elephant (Elephas maximus maximus Linnaeus, 1758) and Data from Other Elephants. Elephant 2 (1), 1982, S. 3–93
- G. E. Weissengruber, F. K. Fuss, G. Egger, G. Stanek, K. M. Hittmair und G. Forstenpointner: The elephant knee joint: morphological and biomechanical considerations. Journal of Anatomy 208, 2006, S. 59–72
- Malie M. S. Smuts und A. J.Bezuidenhout: Osteology of the thoracic limb of the African elephant (Loxodonta africana). Onderstepoort Journal of Veterinary Research 60, 1993, S. 1–14
- Malie M. S. Smuts und A. J.Bezuidenhout: Osteology of the pelvic limb of the African elephant (Loxodonta africana). Onderstepoort Journal of Veterinary Research 61, 1994, S. 51–66
- Nicholas Court: Limb posture and gait in Numidotherium koholense, a primitive proboscideanfrom the Eocene of Algeria. Zoological Journal of the Lineean Society 111, 1994, S. 297–338
- Sophie Regnault, Jonathon J. I. Dixon, Chris Warren-Smith, John R. Hutchinson und Renate Weller: Skeletal pathology and variable anatomy in elephant feet assessed using computed tomography. PeerJ 5, 2017, S. e2877, doi:10.7717/peerj.2877
- John R. Hutchinson, Cyrille Delmer, Charlotte E. Miller, Thomas Hildebrandt, Andrew A. Pitsillides und Alan Boyde: From Flat Foot to Fat Foot: Structure, Ontogeny, Function, and Evolution of Elephant ‚Sixth Toes‘. Science 334 (6063), 2011, S. 1699–1703, doi:10.1126/science.1211437
- Martin S. Fischer: Die Oberlippe des Elefanten. Zeitschrift für Säugetierkunde 52, 1987, S. 262–263 ()
- Martin S. Fischer und Uschi Trautmann: Fetuses of African elephants (Loxodonta africana) in photographs. Elephant 2, 1987, S. 40–45
- Antoni V. Milewski und Ellen S. Dierenfeld: Structural and functional comparison of the proboscis between tapirs and other extant and extinct vertebrates. Integrative Zoology 8, 2013, S. 84–94
- Polly K. Phillips und James Edward Heath: Heat exchange by the pinna of the African elephant (Loxodonta africana). Comparative Biochemy and Physiology 101 (4), 1992, S. 693–699
- Robin C. Dunkin, Dinah Wilson, Nicolas Way, Kari Johnson und Terrie M. Williams: Climate influences thermal balance and water use in African and Asian elephants: physiology can predict drivers of elephant distribution. The Journal of Experimental Biology 216, 2013, S. 2939–2952
- António F. Martins, Nigel C. Bennett, Sylvie Clavel, Herman Groenewald, Sean Hensman, Stefan Hoby, Antoine Joris, Paul R. Manger und Michel C. Milinkovitch: Locally-curved geometry generates bending cracks in the African elephant skin. Nature Communications 9, 2018, S. 3865, doi:10.1038/s41467-018-06257-3
- P. G.Wright: Why do elephants flap their ears? South African Journal of Zoology 19 (4), 1984, S. 266–269
- J. A. Estes und I. 0. Buss: Microanatomical structure and development of the African elephant's temporal gland. Mammalia 40 (3), 1976, S. 429–436
- A. Rajaram und V. Krishnamurthy: Elephant temporal gland ultrastructure and androgen secretion during musth. Current Science 85 (10), 2003, S. 1467–1471
- P. S. Easa: Chemical composition of the Temporal Gland Secretion of an Asian elephant (Elephas maximus). Elephant 2 (3),1987, S. 67–68
- I. O. Buss, L. E. Rasmussen und G. L. Smuts: Role of stress and individual recognition in the function of the African elephants' temporal gland. Mammalia 40 (3), 1976, S. 437–451
- Suzana Herculano-Huzel, Kamilla Avelino-de-Souza, Kleber Neves, Jairo Porfírio, Débora Messeder, Larissa Mattos Feijó, José Maldonado und Paul R. Manger: The elephant brain in numbers. Frontiers in Neuroanatomy 8, 2014, S. 46, doi:10.3389/fnana.2014.00046
- Anastasia S. Kharlamova, Sergei V. Saveliev, Albert V. Protopopov, Busisiwe C. Maseko, Adhil Bhagwandin, und Paul R. Manger: The Mummified Brain of a Pleistocene Woolly Mammoth (Mammuthus primigenius) Compared With the Brain of the Extant African Elephant (Loxodonta africana). The Journal of Comparative Neurology 523, 2015, S. 2326–2343
- George A. Lyras: Brain Changes during Phyletic Dwarfing in Elephants and Hippos. Brain, Behavior and Evolution 92, 2018, S. 167–181, doi:10.1159/000497268
- Marcus Clauss, Hanspeter Steinmetz, Ulrike Eulenberger, Pete Ossent, Robert Zingg, Jürgen Hummel und Jean-Michel Hatt: Observations on the length of the intestinal tract of African Loxodonta africana (Blumenbach 1797) and Asian elephants Elephas maximus (Linné 1735). European Journal of Wildlife Research 53, 2007, S. 68–72
- Patricia J. Yang, Jonathan Pham, Jerome Choo und David L. Hu: Duration of urination does not change with body size. PNAS 111 (33), 2014, S. 11932–11937
- Patricia J. Yang, Jonathan C. Pham, Jerome Choo und David L. Hu: Law of Urination: all mammals empty their bladders over the same duration. arXiv:1310.3737v3 [physics.flu-dyn] ()
- R. V. Short: The peculiar lungs of the elephant. New Scientist 316, 1962, S. 570–572
- John B. West: Snorkel breathing in the elephant explains the unique anatomy of its pleura. Respiration Physiology 126, 2001, S. 1–8
- John B. West: Why Doesn’t the Elephant Have a Pleural Space? News in Physiological Sciences 17, 2002, S. 47–50
- Oscar W. Johnson und Irven O. Buss: The testis of the African elephant (Loxodonta africana). Journal of Reproduction and Fertility 13, 1967, S. 23–30
- R. V. Short, T. Mann und Mary F. Hay: Male reproductive organs of the African elephant, Loxodonta africana. Journal of Reproduction and Fertility 13, 1967, S. 527–536
- W. R. Allen: Ovulation, pregnancy, placentation and husbandry in the African elephant (Loxodonta africana). Philosophical Transactions of the Royal Society of London, Series B 361, 2006, S. 821–834
- Thomas B. Hildebrandt, Imke Lueders, Robert Hermes, Frank Goeritz und Joseph Saragusty: Reproductive cycle of the elephants. Animal Reproduction Science 124, 201, S. 176–183
- J. M. E.Balke, W. J. Boever, M. R. Ellersieck, U. S. Seal und D. A. Smith: Anatomy of the reproductive tract of the female African elephant (Loxodonta africana) with reference to development of the techniques for artificial breeding. Journal of Reproduction and Fertility 84, 1988, S. 485–492
- J. S. Perry: The reproduction of the African elephant, Loxodonta africana. Philosophical Transactions of the Royal Society of London, Series B, Biological Sciences 237 (643), 1953, S. 93–149
- J. S. Perry: The structure and development of the reproductive organs of the female African elephant. Philosophical Transactions of the Royal Society of London, Series B, Biological Sciences 248 (743), 1964, S. 35–51
- D. A. Hungerford, Chandra H. Sharat, R.L.Snyder und F. A. Ulmer Jr.: Chromosomes of three elephants, two Asian (Elephas maximus) and one African (Loxodonta africana). Cytogenetics 5, 1966, S. 243–246
- M. L. Houck, A. T. Kumamoto, D. S. Gallagher Jr. und K.Benirschke: Comparative cytogenetics of the African elephant (Loxodonta africana) and Asiatic elephant (Elephas maximus). Cytogenetic and Cell Genetics 93 (3), 2001, S. 249–252
- Sevket Sen: A review of the Pleistocene dwarfed elephants from the Aegean islands, and their paleogeographic context. Fossil Imprint 73 (1/2), 2017, S. 76–92
- Maria Rita Palombo, Ebru Albayrak und Federica Marano: The straight-tusked Elephants from Neumark-Nord. A glance into a lost world. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale 2010, S. 219–251
- Karlheinz Fischer: Die Waldelefanten von Neumark-Nord und Gröbern. In: Dietrich Mania (Hrsg.): Neumark-Nord – Ein interglaziales Ökosystem des mittelpaläolithischen Menschen. Veröffentlichungen des Landesmuseums für Vorgeschichte in Halle 62, Halle/Saale 2010, S. 61–374
- Diego J. Álvarez-Lao, Ralf-Dietrich Kahlke, Nuria García und Dick Mol: The Padul mammoth finds — On the southernmost record of Mammuthus primigenius in Europe and its southern spread during the Late Pleistocene. Palaeogeography, Palaeoclimatology, Palaeoecology 278, 2009, S. 57–70
- Ralf-Dietrich Kahlke: The maximum geographic extension of Late Pleistocene Mammuthus primigenius (Proboscidea, Mammalia) and its limiting factors. Quaternary International 379, 2015, S. 147–154
- A. Yu. Puzachenko, A. K. Markova, P. A. Kosintsev, T. van Kolfschoten, J. van der Plicht, T. V. Kuznetsova, A. N. Tikhonov, D. V. Ponomarev, M. Kuitems und O. P. Bachura: The Eurasian mammoth distribution during the second half of the Late Pleistocene and the Holocene: Regional aspects. Quaternary International 445, 2017, S. 71–88
- Nadine Gravett, Adhil Bhagwandin, Robert Sutcliffe, Kelly Landen, Michael J. Chase, Oleg I. Lyamin, Jerome M. Siegel und Paul R. Manger: Inactivity/sleep in two wild free-roaming African elephant matriarchs – Does large body size make elephants the shortest mammalian sleepers? PLoS ONE 12 (3), 2017, S. e0171903, doi:10.1371/journal.pone.0171903
- John R. Hutchinson, Dan Famini, Richard Lair und Rodger Kram: Are fast-moving elephants really running? Nature 422, 2003, S. 493–494
- John R. Hutchinson, Delf Schwerda, Daniel J. Famini, Robert H. I. Dale, Martin S. Fischer und Rodger Kram: The locomotor kinematics of Asian and African elephants: changes with speed and size. The Journal of Experimental Biology 209, 2006, S. 3812–3827, doi:10.1242/jeb.02443
- J. J. Genin, P. A. Willems, G. A. Cavagna, R. Lair und N. C. Heglund: Biomechanics of locomotion in Asian elephants. The Journal of Experimental Biology 213, 2010, S. 694–706, doi:10.1242/jeb.035436
- Lei Ren, Charlotte E. Miller, Richard Lair und John R. Hutchinson: Integration of biomechanical compliance, leverage, and power in elephant limbs. PNAS 107 (15), 2010, S. 7078–7082
- Donald Lee Johnson: Problems in the Land Vertebrate Zoogeography of Certain Islands and the Swimming Powers of Elephants. Journal of Biogeography 7 (4), 1980, S. 383–398
- G. A. Bradshaw, Allan N. Schore, Janine L. Brown, Joyce H. Poole und Cynthia J. Moss: Elephant breakdown. Nature 433 (7028), 2005, S. 807, doi:10.1038/433807a
- Shermin de Silva und George Wittemyer: A Comparison of Social Organization in Asian Elephants and African Savannah Elephants. International Journal of Primatology 33 (5), 2012, S. 1125–1141
- L. E. L. Rasmussen und B. A. Schulte: Chemical signals in the reproduction of Asian (Elephas maximus) and African (Loxodonta africana) elephants. Animal Reproduction Science 53, 1998, S. 19–34
- Lucy A. Bates, Katito N. Sayialel, Norah W. Njiraini, Joyce H. Poole, Cynthia J. Moss und Richard W. Byrne: African elephants have expectations about the locations of out-of-sight family members. Biology Letters 4, 2008, S. 34–36
- Emily J. Polla, Cyril C. Grueter und Carolynn L. Smith: Asian Elephants (Elephas maximus) Discriminate Between Familiar and Unfamiliar Human Visual and Olfactory Cues. Animal Behavior and Cognition 5 (3), 2008, S. 279–291
- Smita Nair, Rohini, Chandra Sekhar Seelamantula und Raman Sukumar: Vocalizations of wild Asian elephants (Elephas maximus): Structural classification and social context. Journal of the Acoustic Society of America 126, 2009, S. 2768–2778
- Angela S. Stoeger, Gunnar Heilmann, Matthias Zeppelzauer, Andre Ganswindt, Sean Hensman und Benjamin D. Charlton: Visualizing sound emission of elephant vocalizations: evidence for two rumble production types. PLoS ONE 7 (11), 2012, S. e48907, doi:10.1371/journal.pone.0048907
- Angela S. Stoeger und Shermin de Silva: African and Asian Elephant Vocal Communication: A Cross-Species Comparison. In: G. Witzany (Hrsg.): Biocommunication of Animals. Springer Science & Media Press, 2014, S. 21–39
- Michael A. Pardo, Joyce H. Poole, Angela S. Stoeger, Peter H. Wrege, Caitlin E. O’Connell-Rodwell, Udaha Kapugedara Padmalal und Shermin de Silva: Differences in combinatorial calls among the 3 elephant species cannot be explained by phylogeny. Behavioral Ecology 30 (3), 2019, S. 809–820, doi:10.1093/beheco/arz018
- Joyce H. Poole, Peter L. Tyack, Angela S. Stoeger-Horwath und Stephanie Watwood: Elephants are capable of vocal learning. Nature 434, 2005, S. 455–456
- Angela S. Stoeger, Daniel Mietchen, Sukhun Oh, Shermin de Silva, Christian T. Herbst, Soowhan Kwon und W. Tecumseh Fitch: An Asian Elephant Imitates Human Speech. Current Biology 22, 2012, S. 2144–2148
- Karen McComb, Graeme Shannon, Katito N. Sayialei und Cynthia Moss: Elephants can determine ethnicity, gender, and age from acoustic cues in Human voices. PNAS 111 (14), 2014, S. 5433–5438
- Joshua M. Plotnik, Frans B. de Waal und Diana Reiss: Self-recognition in an Asian elephant. PNAS 103 (45), 2006, S. 17053–17057, doi:10.1073/pnas.0608062103
- Joshua M. Plotnik, Frans B. de Waal, Donald Moore III. und Diana Reiss: Self-recognition in the Asian elephant and future directions for cognitive research with elephants in zoological settings. Zoo Biology 29, (2), 2010, S. 179–191, doi:10.1002/zoo.20257
- Bonnie M. Perdue, Catherine F. Talbot, Adam M. Stone und Michael J. Beran: Putting the elephant back in the herd: elephant relative quantity judgments match those of other species. Animal Cognition 15, 2012, S. 955–961, doi:10.1007/s10071-012-0521-y
- Naoko Irie und Toshikazu Hasegawa: Summation by Asian Elephants (Elephas maximus). Behavioral Sciences 2, 2012, S. 50–56, doi:10.3390/bs2020050
- Naoko Irie, Mariko Hiraiwa-Hasegawa und Nobuyuki Kutsukake: Unique numerical competence of Asian elephants on the relative numerosity judgment task. Journal of Ethology 37 (1), 2019, S. 111–115, doi:10.1007/s10164-018-0563-y
- Karen McComb, Cynthia Moss, Soila Sayialel und Lucy Baker: Unusually extensive networks of vocal recognition in African elephants. Animal Behaviour 59, 2000, S. 1103–1109
- Kaori Mizuno, Naoko Irie, Mariko Hiraiwa-Hasegawa und Nobuyuki Kutsukake: Asian elephants acquire inaccessible food by blowing. Animal Cognition 19 (1), 2016, S. 215–222; doi:10.1007/s10071-015-0929-2
- Karen McComb, Lucy Baker und Cynthia Moss: African elephants show high levels of interest in the skulls and ivory of their own species. Biology Letters 2, 2006, S. 26–28
- Iain Douglas-Hamilton, Shivani Bhalla, George Wittemyer und Fritz Vollrath: Behavioural reactions of elephants towards a dying and deceased matriarch. Applied Animal Behaviour Science 100, 2006, S. 87–102
- Moti Nissani: Elephant Cognition: A Review of Recent Experiments. Gajah 28, 2008, S. 44–52
- Shifra Z. Goldenberg und George Wittemyer: Elephant behavior toward the dead: A review and insights from field observations. Primates 61 (1), 2020, S. 119–128, doi:10.1007/s10329-019-00766-5
- Nagarajan Baskaran, M. Balasubramanian, S. Swaminathan und Andajaya Desai: Feeding ecology of the Asian elephant Elephas maximus in the Nilgiri Biosphere Reserve, Southern India. Journal of the Bombay Natural History Society, 107 (1), 2010, S. 3–13
- B. W. B. Vancuylenberg: Feeding behaviour of the Asiatic elephant in South-East Sri Lanka in relation to conservation. Biological Conservation 12, 1977, S. 33–55
- W. van Hoven, R. A. Prins und A. Lankhorst: Fermentative digestion in the African elephant. South African Journal of Wildlife Research 11 (3), 1981, S. 78–86
- W. van Hoven und E. A. Boomker: Digestion. In: R. J. Hudson und R. G. White, R.G. (Hrsg.): Bioenergetics of Wild Herbivores. CRC Press, Boca Raton 1985, S. 103–120
- Bas van Geel, André Aptroot, Claudia Baittinger, Hilary H. Birks, Ian D. Bull, Hugh B. Cross, Richard B. Evershed, Barbara Gravendeel, Erwin J. O. Kompanje, Peter Kuperus, Dick Mol, Klaas G. J. Nierop, Jan Peter Pals, Alexei N. Tikhonov, Guido van Reenen und Peter H. van Tienderen: The ecological implications of a Yakutian mammoth’s last meal. Quaternary Research, 69, 2008, S. 361–376
- D. C. Houston, J. D. Gilardi und A. J. Hall: Soil consumption by elephants might help to minimize the toxic effect of plant secondary compounds in forest browse. Mammal Review 31 (3/4), 2001, S. 249–254
- M. R. Jainudeen, C. B. Katongole und R. V. Short: Plasma testosterone levels in relation to musth and sexual activity in the male Asian elephant (Elephas maximus). Journal of Reproduction and Fertility 29, 1972, S. 99–103
- Joyce H. Poole und Cynthia J. Moss: Musth in the African elephant, Loxodonta africana. Nature 292, 1981, S. 830–831
- L. E. L. Rasmussen, Anthony J. Hall-Martin and David L. Hess: Chemical profiles of male African elephants, Loxodonta africana: Physiological and ecological implications. Journal of Mammalogy 77 (2), 1996, S. 422–439
- Vratislav Mazak: Der Tiger. Nachdruck der 3. Auflage von 1983. Westarp Wissenschaften Hohenwarsleben, 2004, ISBN 3-89432-759-6
- A. J. Loveridge, J. E. Hunt, F. Murindagomo und D. W. Macdonald: Influence of drought on predation of elephant (Loxodonta africana) calves by lions (Panthera leo) in an African wooded savannah. Journal of Zoology 270 (3), 2006, S. 523–530
- R. John Power und R. X. Shem Compion: Lion Predation on Elephants in the Savuti, Chobe National Park, Botswana. African Zoology 44 (1), 2009, S. 36–44
- Mauricio Anton, Angel Galobart und Alan Turner: Co-existence of scimitar-toothed cats, lions and hominins in the European Pleistocene. Implications of the post-cranial anatomy of Homotherium latidens (Owen) for comparative palaeoecology. Quaternary Science Reviews 24, 2005, S. 1287–1301
- Ahimsa Campos-Arceiz und Steve Blake: Megagardeners of the forest – the role of elephants in seed dispersal. Acta Oecologia 37, 2011, S. 542–553
- Robert M. Pringle: Elephants as agents of habitat creation for small vertebrates at the patch scale. Ecology 89 (1), 2008, S. 26–33
- William D. Hawthorne und Marc P. E. Parren: How important are forest elephants to the survival of woody plant species in Upper Guinean forests? Journal of Tropical Ecology 16, 2000, S. 133–150.
- Lauren J. Chapman, Colin A. Chapman und Richard W. Wrangham: Balanites wilsoniana – elephant dependent dispersal? Journal of Tropical Ecology 8, 1992, S. 275–283
- Ahimsa Campos-Arceiz: Shit happens (to be useful)! Use of elephant dung as habitat by amphibians. Biotropica 41, 2009, S. 406–407
- Steven G. Platt, David P. Bickford, Myo Min Win und Thomas R. Rainwater: Water-filled Asian elephant tracks serve as breeding sites for anurans in Myanmar. Mammalia 83 (3) 2019, S. 287–289, doi:10.1515/mammalia-2017-0174
- Mario A. Cozzuol, Dimila Mothé und Leonardo S. Avilla: A critical appraisal of the phylogenetic proposals for the South American Gomphotheriidae (Proboscidea: Mammalia). Quaternary International 255, 2012, S. 36–41
- Mark S. Springer, William J. Murphy, Eduardo Eizirik und Stephen J. O’Brian: Placental mammal diversification and the Cretaceous-Tertiary boundary. PNAS 100 (3), 2003, S. 1056–1061
- Robert W. Meredith, Jan E. Janečka, John Gatesy, Oliver A. Ryder, Colleen A. Fisher, Emma C. Teeling, Alisha Goodbla, Eduardo Eizirik, Taiz L. L. Simão, Tanja Stadler, Daniel L. Rabosky, Rodney L. Honeycutt, John J. Flynn, Colleen M. Ingram, Cynthia Steiner, Tiffani L. Williams, Terence J. Robinson, Angela Burk-Herrick, Michael Westerman, Nadia A. Ayoub, Mark S. Springer und William J. Murphy: Impacts of the Cretaceous Terrestrial Revolution and KPg Extinction on Mammal Diversification. Science 334, 2011, S. 521–524
- Matjaz Kuntner, Laura J. May-Collado und Ingi Agnarsson: Phylogeny and conservation priorities of afrotherian mammals (Afrotheria, Mammalia). Zoologica Scripta 40 (1), 2011, S. 1–15
- Maureen A. O’Leary, Jonathan I. Bloch, John J. Flynn, Timothy J. Gaudin, Andres Giallombardo, Norberto P. Giannini, Suzann L. Goldberg, Brian P. Kraatz, Zhe-Xi Luo, Jin Meng, Xijun Ni, Michael J. Novacek, Fernando A. Perini, Zachary S. Randall, Guillermo W. Rougier, Eric J. Sargis, Mary T. Silcox, Nancy B. Simmons, Michelle Spaulding, Paúl M. Velazco, Marcelo Weksler, John R. Wible und Andrea L. Cirranello: The Placental Mammal Ancestor and the Post–K-Pg Radiation of Placentals. Science 339, 2013, S. 662–667
- Mark S. Springer, Anthony V. Signore, Johanna L.A. Paijmans, Jorge Velez-Juarbe, Daryl P. Domning, Cameron E. Bauer, Kai He, Lorelei Crerar, Paula F. Campos, William J. Murphy, Robert W. Meredith, John Gatesy, Eske Willerslev, Ross D. E. MacPhee, Michael Hofreiter und Kevin L. Campbell: Interordinal gene capture, the phylogenetic position of Steller’s sea cow based on molecular and morphological data, and the macroevolutionary history of Sirenia. Molecular Phylogenetics and Evolution 91, 2015, S. 178–193
- Jan van der Made: The evolution of the elephants and their relatives in the context of a changing climate and geography. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale 2010, S. 340–360
- Matthias Meyer, Eleftheria Palkopoulou, Sina Baleka, Mathias Stiller, Kirsty E. H. Penkman, Kurt W. Alt, Yasuko Ishida, Dietrich Mania, Swapan Mallick, Tom Meijer, Harald Meller, Sarah Nagel, Birgit Nickel, Sven Ostritz, Nadin Rohland, Karol Schauer, Tim Schüler, Alfred L Roca, David Reich, Beth Shapiro und Michael Hofreiter: Palaeogenomes of Eurasian straight-tusked elephants challenge the current view of elephant evolution. eLife 6, 2017, S. e25413, doi:10.7554/eLife.25413
- William Sanders: Taxonomic and systematic review of Elephantidae based on Late Miocene-Early Pliocene fossil evidence from Afro-Arabia. Journal of Vertebrater Paleontology 24 (3 suppl.), 2004, S. 109A
- William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Saegusa und Cyrille Delmer: Proboscidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 161–251 (S. 223–234)
- Nadin Rohland, Anna-Sapfo Malaspinas, Joshua L. Pollack, Montgomery Slatkin, Paul Matheus und Michael Hofreiter: Proboscidean Mitogenomics: Chronology and Mode of Elephant Evolution Using Mastodon as Outgroup. PLoS Biology 5 (8), 2007, S. e207, doi:10.1371/journal.pbio.0050207
- Nadin Rohland, David Reich, Swapan Mallick, Matthias Meyer, Richard E. Green, Nicholas J. Georgiadis, Alfred L. Roca und Michael Hofreiter: Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. PLoS Biology 8 (12), 2010, S. e1000564, doi:10.1371/journal.pbio.1000564
- Jeheskel Shoshani und Pascal Tassy. Advances in proboscidean taxonomy & classification, anatomy & physiology, and ecology & behavior. Quaternary International 126–128, 2005, S. 5–20
- Régis Debruyne: A case study of apparent conflict between molecular phylogenies: the interrelationships of African elephants. Cladistics 21, 2005, S. 31–50
- Yumie Murata, Takahiro Yonezawa, Ichiro Kihara, Toshihide Kashiwamura, Yuji Sugihara, Masato Nikaidoa, Norihiro Okada, Hideki Endo und Masami Hasegawa: Chronology of the extant African elephant species and case study of the species identification of the small African elephant with the molecular phylogenetic method. Gene 441, 2009, S. 176–186
- Samrat Mondol, Ida Moltke, John Hart, Michael Keigwin, Lisa Brown, Matthew Stephens und Samuel K. Wasser: New evidence for hybrid zones of forest and savanna elephants in Central and West Africa. Molecular Ecology 24, 2015, S. 6134–6147
- Joerns Fickel, Dietmar Lieckfeldt, Parntep Ratanakorn und Christian Pitra: Distribution of haplotypes and microsatellite alleles among Asian elephants (Elephas maximus) in Thailand. European Journal of Wildlife Research 53, 2007, S. 298–303
- Jacob Enk, Alison Devault, Regis Debruyne, Christine E. King, Todd Treangen, Dennis O’Rourke, Steven L. Salzberg, Daniel Fisher, Ross MacPhee und Hendrik Poinar: Complete Columbian mammoth mitogenome suggests interbreeding with woolly mammoths. Genome Biology 12, 2011, S. R51 (S. 1–29) ()
- Jacob Enk, Alison Devault, Christopher Widga, Jeffrey Saunders, Paul Szpak, John Southon, Jean-Marie Rouillard, Beth Shapiro, G. Brian Golding, Grant Zazula, Duane Froese, Daniel C. Fisher, Ross D. E. MacPhee und HendrikPoinar: Mammuthus Population Dynamics in Late Pleistocene North America: Divergence, Phylogeography, and Introgression. Frontiers in Ecology and Evolution 4, 2016, S. 42, doi:10.3389/fevo.2016.00042
- Dan Chang, Michael Knapp, Jacob Enk, Sebastian Lippold, Martin Kircher, Adrian Lister, Ross D. E. MacPhee, Christopher Widga, Paul Czechowski, Robert Sommer, Emily Hodges, Nikolaus Stümpel, Ian Barnes, Love Dalén, Anatoly Derevianko, Mietje Germonpré, Alexandra Hillebrand-Voiculescu, Silviu Constantin, Tatyana Kuznetsova, Dick Mol, Thomas Rathgeber, Wilfried Rosendahl, Alexey N. Tikhonov, Eske Willerslev, Greg Hannon, Carles Lalueza-Fox, Ulrich Joger, Hendrik Poinar, Michael Hofreiter und Beth Shapiro: The evolutionary and phylogeographic history of woolly mammoths: a comprehensive mitogenomic analysis. Scientific Reports 7, 2017, S. 44585, doi:10.1038/srep44585
- Eleftheria Palkopoulou, Mark Lipson, Swapan Mallick, Svend Nielsen, Nadin Rohland, Sina Baleka, Emil Karpinski, Atma M. Ivancevic, Thu-Hien To, R. Daniel Kortschak, Joy M. Raison, Zhipeng Qu, Tat-Jun Chin, Kurt W. Alt, Stefan Claesson, Love Dalén, Ross D. E. MacPhee, Harald Meller, Alfred L. Roca, Oliver A. Ryder, David Heiman, Sarah Young, Matthew Breen, Christina Williams, Bronwen L. Aken, Magali Ruffier, Elinor Karlsson, Jeremy Johnson, Federica Di Palma, Jessica Alfoldi, David L. Adelson, Thomas Mailund, Kasper Munch, Kerstin Lindblad-Toh, Michael Hofreiter, Hendrik Poinar und David Reich: A comprehensive genomic history of extinct and living elephants. PNAS 115 (11), 2018, S. E2566–E2574, doi:10.1073/pnas.1720554115
- A. L. Howard: "Motty" – birth of an African/Asian elephant at Chester Zoo. Elephant 1 (3), 1979, S. 36–41 ()
- Jerold M. Lowenstein und Jeheskel Shoshani: Proboscidean relationships based on immunological data. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of elephants and their relatives. Oxford University Press, Oxford/New York/Tokio, 1996, S. 49–54
- Emmanuel Gheerbrant: Paleocene emergence of elephant relatives and the rapid radiation of African ungulates. PNAS 106 (26), 2009, S. 10717–10721, doi:10.1073/pnas.0900251106
- Marco .P. Ferretti, Lorenzo Rook und Danilo Torre: Stegotetrabelodon (Proboscidea, Elephantidae) from the Late Miocene of Southern Italy. Journal of Vertebrate Paleontology 23 (3), 2003, S. 659–666
- Marco Peter Ferretti, Lorenzo Rook, Giuseppe Carone und Antonella Cinzia Marra: New finds of Stegotetrabelodon syrticus from the Late Miocene of Cessaniti, southern Italy. Bolletino della Società Paleontologica Italiana 56 (1), 2017, S. 89–92
- Vincent J. Maglio: Four new species of Elephantidae from the Plio-Pleistocene of northwestern Kenya. Breviora 341, 1970, S. 1–43
- Hassane Taïsso Mackaye, Yves Coppens, Patrick Vignaud, Fabrice Lihoreau und Michel Brunet: De nouveaux restes de Primelephas dans le Mio-Pliocène du Nord du Tchad et révision du genre Primelephas. Comptes Rendus Palevol 7, 2008, S. 227–236
- William J. Sanders: Taxonomic review of fossil Proboscidea (Mammalia) from Langebaanweg, South Africa. Transactions of the Royal Society of South Africa 62 (1), 2007, S. 1–16
- Hassane Taïsso Mackaye, Michel Brunet und Pascal Tassy: Selenetherium kolleensis nov. gen. nov. sp.: un nouveau Proboscidea (Mammalia) dans le Pliocène tchadien. Geobios 38, 2005, S. 765–777
- Asier Larramendi, Hanweng Zhang, Maria Rita Palombo und Marco P. Ferretti: The evolution of Palaeoloxodon skull structure: Disentangling phylogentic, sexually dimorphic, ontogenetic, and allometric morphological signals. Quaternary Science Review 229, 2020, S. 106090, doi:10.1016/j.quascirev.2019.106090
- Fredrick Kyalo Manthi, William J. Sanders, J. Michael Plavcan, Thure E. Cerling und Francis H. Brown: Late Middle Pleistocene Elephants from Natodomeri, Kenya and the Disappearance of Elephas (Proboscidea, Mammalia) in Africa. Journal of Mammalian Evolution, 2019, doi:10.1007/s10914-019-09474-9
- Federica Marano und Maria Rita Palombo: Population structure in straight-tusked elephants: a case study from Neumark Nord 1 (late Middle Pleistocene?, Sachsen-Anhalt, Germany). Bollettino della Società Paleontologica Italiana 52 (3), 2013, S. 207–218
- René Grube: Pflanzliche Nahrungsreste der fossilen Elefanten und Nashörner aus dem Interglazial von Neumark-Nord. In: Jan Michal Burdukiewicz, Lutz Fiedler, Wolf-Dieter Heinrich, Antje Justus und Enrico Brühl (Hrsg.): Erkenntnisjäger. Festschrift für Dietrich Mania. Veröffentlichungen des Landesmuseums für Vorgeschichte in Halle 57 Halle/Saale 2003, S. 221–236
- Maria Rita Palombo: Elephants in miniature. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale 2010, S. 275–295
- Adrian M. Lister, Andrei V. Sher, Hans van Essen und Guangbiao Wei: The pattern and process of mammoth evolution in Eurasia. Quaternary International 126–128, 2005, S. 49–64
- Adrian M. Lister und Hans van Essen: Mammthus rumanus (Ștefănescu), the earliest mammoth in Europe. In: A. Petculescu und E. Stiuca. (Hrsg.): Advances in Vertebrate Paleontology „Hen to Panta“. Bukarest 2003, S. 47–52
- Adrian M. Lister und A. V. Sher: Evolution and dispersal of mammoths across the Northern hemisphere Science 350 (626), 2015, S. 805–809
- V. Louise Roth: Pleistocene dwarf elephants from the California Islands. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford, New York, Tokyo, 1996, S. 249–253
- Georgi N. Markov und Haruo Saegusa: On the validity of Stegoloxodon Kretzoi, 1950 (Mammalia: Proboscidea). Zootaxa 1861, 2008, S. 55–56
- Anthony J. Stuart, Leopold D. Sulerzhitsky, Lyubov A. Orlova, Yaroslav V. Kuzmin und Adrian M. Lister: The latest woolly mammoths (Mammuthus primigenius Blumenbach) in Europe and Asia: a review of the current evidence. Quaternary Science Reviews 21, 2002, S. 1559–1569
- Yaroslav V. Kuzmin: Extinction of the woolly mammoth (Mammuthus primigenius) and woolly rhinoceros (Coelodonta antiquitatis) in Eurasia: Review of chronological and environmental issues. Boreas 39, 2010, S. 247–261
- Adrian M. Lister: Mammoths in miniature. Nature 362, 1993, S. 288–289
- J. M. Enk, D. R. Yesner, K. J. Crossen, D. W. Veltre und D. H. O’Rourke: Phylogeographic Analysis of the mid-Holocene Mammoth from Qagnax Cave, St. Paul Island, Alaska. Palaeogeography, Palaeoclimatology, Palaeoecology 273 (1–2), 2009, S. 184–190
- Douglas W. Veltre, David R. Yesner, Kristine J. Crossen, Russell W. Graham und Joan B. Coltrain: Patterns of faunal extinction and paleoclimatic change from mid-Holocene mammoth and polar bear remains, Pribilof Islands, Alaska. Quaternary Res1earch 2008, S. 40–50
- Thibaut Devièse, Thomas W. Stafford Jr., Michael R. Waters, Crista Wathen, Daniel Comeskey, Lorena Becerra-Valdivia und Thomas Higham: Increasing accuracy for the radiocarbon dating of sites occupied by the first Americans. Quaternary Science Reviews 198, 2018, S. 171–180
- Larry D. Agenbroad, John R. Johnson, Don Morris und Thomas W. Stafford: Mammoth and humans as Late Pleistocene contemporaries on Santa Rosa island. Sixth California Islands Symposium, December 1-3, 2003, S. 2–7
- Dick Mol, John de Vos und Johannes van der Plicht: The presence and extinction of Elephas antiquus Falconer and Cautley, 1847, in Europe. Quaternary International 169–170, 2007, S. 149–153
- G. M. MacDonald, D. W. Beilman, Y. V. Kuzmin, L. A. Orlova, K. V. Kremenetski, B. Shapiro, R. K. Wayne und B. van Valkenburgh: Pattern of extinction of the woolly mammoth in Beringia. Nature Communication 3, 2012, S. 893, doi:10.1038/ncomms1881
- Merlin Peris: A note on the etymology of „elephant“. Journal of the Royal Asiatic Society of Sri Lanka NS 38, 1993/1994, S. 163–168
- Carl von Linné: Systema naturae. 10. Auflage, 1758, Band 1, S. 33 ()
- Johann Friedrich Blumenbach: Handbuch der Naturgeschichte., Göttingen, 1779, S. 1–448 (S. 130–133) () und Handbuch der Naturgeschichte., Göttingen, 1797, S. 1–714 (S. 125) ()
- Anonym: Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d'après des animaux vivans; &c. par MM. Geoffroy Saint-Hilaire et F. Cuvier. Livraisons 52de et 53eme. The Zoological Journal 3, 1827, S. 140–142. (biodiversitylibrary.org)
- Fréderic Cuvier: Eléphant d’Afrique. In: Étienne Geoffroy Saint-Hilaire, Fréderic Cuvier (Hrsg.): Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d'après des animaux vivans. Tome sixième. Paris 1825. (biodiversitylibrary.org)
- John Edward Gray: On the natural arrangement of vertebrose animals. London Medical Repository 15, 1821, S. 297–310 (S. 305) ()
- Étienne Geoffroy Saint-Hilaire und Georges Cuvier: Mémoire sur une nouvelle division des Mammifères, et sur les principes qui doivent servir de base dans cette sorte de travail. Magasin Encyclopedique 2, 1795, S. 164–190 (S. 178, 189) ()
- Georges Cuvier: Le regne animal distribue d'apres son organisation pour servir de base a l'histoire naturelle des animaux et d'introduction a l'anatomie comparee. (Band 1) Paris, 1817, S. 1–540 (S. 227–242) ()
- Johann Karl Wilhelm Illiger: Prodromus systematis mammalium et avium additis terminis zoographicis utriudque classis. Berlin, 1811, S. 1–301 (S. 96) ()
- Henri Marie Ducrotay de Blainville: Prodrome d’une nouvelle distribution systèmatique du règne animal. Bulletin des Sciences 3 (3), 1816, S. 105–124 ()
- Richard Owen: Description of teeth and portions of jaws of two extinct anthrocotherioid quadrupeds (Hyopotamus vectianus and Hyop. bovinus) discovered by the Marchioness of Hastings in the Eocene deposits on the N.W. coast of the Isle of Wight: with an attempt to develope Cuvier’s idea of the classification of pachyderms by the number of their toes. The Quarterly journal of the Geological Society of London 4, 1848, S. 103–141 ()
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 243–250)
- Theodore Gill: On the relations of the orders of mammals. Proceedings of the American Association for the Advancement of Science, 19th meeting, 1870, S. 267–270 ()
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 497–504)
- Wilfried W. de Jong, Anneke Zweers und Morris Goodman: Relationship of aardvark to elephants, hyraxes and sea cows from α-crystallin sequences. Nature 292, 1981, S. 538–540
- Malcolm C. McKenna: The alpha crystallin A chain of the eye lens and mammalian phylogeny. Annales Zoologice Fennici 28, 1992, S. 349–360
- Mark S. Springer, Gregory C. Cleven, Ole Madsen, Wilfried W. de Jong, Victor G. Waddell, Heather M. Amrine und Michael J. Stanhope: Endemic African mammals shake the phylogenetic tree. Nature 388, 1997, S. 61–64
- Michael J. Stanhope, Victor G. Waddell, Ole Madsen, Wilfried de Jong, S. Blair Hedges, Gregory C. Cleven, Diana Kao und Mark S. Springer: Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals. PNAS 95, 1998, S. 9967–9972
- Michael J. Stanhope, Ole Madsen, Victor G. Waddell, Gregory C. Cleven, Wilfried W. de Jong und Mark S. Springer: Highly Congruent Molecular Support for a Diverse Superordinal Clade of Endemic African Mammals. Molecular Phylogenetics and Evolution 9 (3), 1998, S. 501–508
- Emiliano Aguirre: Evolutionary History of the Elephant. Science 164, 1969, S. 1366–1676
- Michel Beden: Données récentes sur l'évolution des Proboscidiens pendant des Plio-Pléistocène en Afrique Orientale. Bulletin de la Société géologique de France 21, 1979, S. 271–276
- R. Sukumar: The Living Elephants: Evolutionary Ecology, Behaviour, and Conservation. Oxford University Press, 2003, S. 1–477 (S. 298–351)
- M. Mosquera, P. Saladié, A. Ollé, I. Cáceres, R. Huguet, J. J. Villalaín, A. Carrancho, D. Bourl, D. Bourlès, R. Braucher und J. Vallverdú: Barranc de la Boella (Catalonia, Spain): an Acheuleanelephant butchering site from the European late Early Pleistocene. Journal of Quaternary Science 30 (7), 2015, S. 651–666
- Günter Behm-Blancke: Altsteinzeitliche Rastplätze im Travertingebiet von Taubach, Weimar, Ehringsdorf. Alt-Thüringen 4, 1960, S. 1–246 (S. 74–78)
- Daniele Aureli, Antonio Contardi, Biagio Giaccio, Valerio Modesti, Maria Rita Palombo, Roberto Rozzi, Andrea Sposato und Flavia Trucco: Straight-tusked elephants in the Middle Pleistocene of northern Latium: Preliminary report on the Ficoncella site (Tarquinia, central Italy). Quaternary International 255, 2012, S. 29–35
- Anna Paola AnzideI, Grazia Maria Bulgarelli, Paola Catalano, Eugenio Cerilli, Rosalia Gallotti, Cristina Lemorini, Salvatore Milli, Maria Rita Palombo, Walter Pantano und Ernesto Santucci: Ongoing research at the late Middle Pleistocene site of La Polledrara di Cecanibbio (central Italy), with emphasis on humaneelephant relationships. Quaternary International 255, 2012, S. 171–187
- Myra Shackley: An Acheulean industry with Elephas recki fauna from Namib IV, South West Africa (Namibia). Nature 284, 1980, S. 340–341
- P. E. Moullé, A. Echassoux, Z. Alemseged und E. Desclaux : On the presence of Elephas recki at the Oldowan prehistoric site of Fejej FJ-1 (Ethiopia). In: G. Cavarretta, P. Gioia, M. Mussi und M. R. Palombo (Hrsg.): The World of Elephants – International Congress. Consiglio Nazionale delle Ricerche Rom, 2001, S. 122–125
- Jörg Erfurt und Dietrich Mania: Zur Paläontologie des jungpleistozänen Waldelefanten von Gröbern, Kreis Gräfenhainichen. In: Dietrich Mania, Matthias Thomae, Thomas Litt und Thomas Weber (Hrsg.): Neumark – Gröbern. Beiträge zur Jagd des mittelpaläolithischen Menschen. Veröffentlichungen des Landesmuseums für Vorgeschichte in Halle 43 Berlin, 1990, S. 215–224
- Hartmut Thieme und Stefan Veil: Neue Untersuchungen zum eemzeitlichen Elefanten-Jagdplatz Lehringen, Ldkr. Verden. Die Kunde 36, 1985, S. 11–58
- Viola T. Dobosi: Ex Proboscideis – Proboscidean remains as raw material at four Palaeolithic sites, Hungary. In: G. Cavarretta, P. Gioia, M. Mussi und M. R. Palombo (Hrsg.): The World of Elephants – International Congress. Consiglio Nazionale delle Ricerche Rom, 2001, S. 429–431
- Aviad Agam und Ran Barkai: Elephant and Mammoth Hunting during the Paleolithic: A Review of the Relevant Archaeological, Ethnographic and Ethno-Historical Records. Quaternary 1 (1), 2018, S. 3, doi:10.3390/quat1010003
- Gerhard Bosinski: Die große Zeit der Eiszeitjäger. Europa zwischen 40.000 und 10.000 v. Chr. Jahrbuch des Römisch-Germanischen Zentralmuseums Mainz 34, 1987, S. 3–139 (S. 72–85, 100)
- Barbara A. Purdy, Kevin S. Jones, John J. Mecholsky, Gerald Bourne, Richard C. Hulbert Jr., Bruce J. MacFadden, Krista L. Church und Michael W. Warren: Earliest Art in the Americas: Incised Image of a Mammoth on a Mineralized Extinct Animal Bone from the Old Vero Site (8-Ir-9), Florida. Congrès de l’IFRAO, septembre 2010 – Symposium : L’art pléistocène dans les Amériques (Pré-Actes) / IFRAO Congress, September 2010 – Symposium: Pleistocene art of the Americas (Pre-Acts), 2010, S. 3–12
- Michel Lorblanchet: Höhlenmalerei. Ein Handbuch. Sigmaringen, 1997, S. 1–340 (S. 57–61)
- Ingmar M. Braun und Maria Rita Palombo: Mammuthus primigenius in the cave and portable art: An overview with a short account on the elephant fossil record in Southern Europe during the last glacial. Quaternary International 276–277, 2012, S. 61–76
- Chris Clarkson, Michael Petraglia, Ravi Korisettar, Michael Haslam, Nicole Boivin, Alison Crowther, Peter Ditchfield, Dorian Fuller, Preston Miracle, Clair Harris, Kate Connell, Hannah James und Jinu Koshy: The oldest and longest enduring microlithic sequence in India: 35 000 years of modern human occupation and change at the Jwalapuram Locality 9 rockshelter. Antiquity 83, 2009, S. 326–348
- David Coulson und Alec Campbell: Afrikanische Felsenbilder. Malereien und Gravuren auf Stein. Weingarten, 2001, S. 1–256
- Jonathan Mark Kenoyer: Indus seals: an overview of iconography and style. Ancient Sindh 9, 2006/2007, S. 7–30
- Karl Gröning und Martin Saller: Der Elefant in Natur und Kulturgeschichte. Könemann, Köln 1998, S. 110–118, 136–161, 184–187
- Raman Sukumar: The Human–Elephant Relationship through the Ages: A Brief Macro-Scale History. In: Piers Locke und Jane Buckingham (Hrsg.): Conflict, Negotiation, and Coexistence: Rethinking Human–Elephant Relations in South Asia. Oxford, 2016, doi:10.1093/acprof:oso/9780199467228.001.0001
- Lynette Hart und Sundar: Family traditions for Mahouts of Asian elephants. Anthrozoös 13 (1), 2000, S. 34–42
- Canan Çakırlar und Salima Ikram: „When elephants battle, the grass suffers.“ Power, ivory and the Syrian elephant. Levant 48 (2), 2016, S. 167–183
- Cornelia Becker: Elfenbein aus den syrischen Steppen? Gedanken zum Vorkommen von Elefanten in Nordostsyrien im Spätholozän. In: Mostefa Kokabi, Joachim Wahl (Hrsg.): Beiträge zur Archäologie und Prähistorischen Anthropologie (= Forschungen und Berichte zur Vor- und Frühgeschichte Baden-Württembergs. Band 53). Theiss, Stuttgart 1994, S. 169–181
- Linus Girdland-Flink, Ebru Albayrak und Adrian M. Lister: Genetic Insight into an Extinct Population of Asian Elephants (Elephas maximus) in the Near East. Open Quaternary 4 (2), 2018, S. 1–9, doi:10.5334/oq.36
- Lionel Casson: Ptolemy II and the hunting of African elephants. Transactions of the American Philological Association 123, 1993, S. 247–260
- Adam L. Brandt, Yohannes Hagos, Yohannes Yacob, Victor A. David, NichoLas J. Georgiadis, Jeheskel Shoshani und Alfred L. Roca: The Elephants of Gash-Barka, Eritrea: Nuclear and Mitochondrial Genetic Patterns. Journal of Heredity 105, 2013, S. 82–90
- Pierre Schneider: Again on the elephants of Raphia: Re-examination of Polybius' factual accuracy and historical method in the light of a DNA survey. Histos 10, 2016, S. 132–148
- Ulrich Huttner: Römische Antike. 2. Auflage, UTB Narr Francke Atempo Verlag, Tübingen, 2013 ISBN 978-3-8252-3919-0
- Kathryn Murphy: Elephants in the Seleucid and Roman armies, 350–150 B.C. University of Auckland, 2017, S. 1–53
- Christian Hünemörder: Elefant. In: Der Neue Pauly (DNP). Band 3, Metzler, Stuttgart 1997, ISBN 3-476-01473-8, S. 697
- Jo-Ann Shelton: Elephants, Pompey, and the reports of popular displeasure in 55 BC. In: Shannon N. Byrne und Edmund P. Cueva (Hrsg.): Veritatis Amicitiaeque Causa: Essays in Honor of Anna Lydia Motto and John R. Clark. Wauconda, Illinois, 1999, S. 231–271
- Ezad Azraai Jamsari, Mohamad Zulfazdlee Abul Hassan Ashari, Mohd. Roslan Mohd. Nor, Adibah Sulaiman, Mohd. Hafiz Safiai, Ibnor Azli Ibrahim und Md. Yazid Ahmad: Akbar (1556–1605) and India unification under the mughals. International Journal of Civil Engineering and Technology 8 (12), 2017, S. 768–781
- Matthias Winner: Raffael malt einen Elefanten. Mitteilungen des Kunsthistorischen Institutes in Florenz 11 (2–3), 1963–1965, S. 71–109
- Claudia Märtl: Von Mäusen und Elefanten. Tiere am Papsthof im 15. Jahrhundert. Deutsches Archiv für Erforschung des Mittelalters 60 (1), 2004, S. 183–199 ()
- Enrico Cappellini, Anthea Gentry, Eleftheria Palkopoulou, Yasuko Ishida, David Cram, Anna-Marie Roos, Mick Watson, Ulf S. Johansson, Bo Fernholm, Paolo Agnelli, Fausto Barbagli, D. Tim J. Littlewood, Christian D. Kelstrup, Jesper V. Olsen, Adrian M. Lister, Alfred L. Roca, Love Dalén und M. Thomas P. Gildert: Resolution of the type material of the Asian elephant, Elephas maximus Linnaeus, 1758 (Proboscidea, Elephantidae). Zoological Journal of the Linnean Society 170, 2014, S. 222–232
- Mark Haywood: A brief history of European elephant houses: from London’s imperial stables to Copenhagen’s postmodern glass houses. Paper given at the Non-human in Anthropology Conference hosted by The Charles University in Prague, November 2011
- Fred Kurt und Marion E. Garai: Bewegungsstereotypien. In: Fred Kurt (Hrsg.): Elefant in Menschenhand. Fürth, 2001, S. 287–302, ISBN 3-930831-45-7
- Tobias Dornbusch: Gedanken eines Biologen zur artgerechten Haltung. 2. Teil: Stereotypien. Elefanten in Zoo und Circus 22, 2012, S. 36–37
- Oswin Perera: The Human-Elephant Conflict: A Review of Current Status and Mitigation Methods. Gajah 30, 2009, S. 41–52 ( )
- L. Jen Shaffer, Kapil K. Khadka, Jamon Van Den Hoek und Kusum J. Naithani: Human-Elephant Conflict: A Review of Current Management Strategies and Future Directions. Frontiers in Ecology and Evolution 6, 2019, S. 235, 2019, doi:10.3389/fevo.2018.00235
- S. Wasser, B. Clark, C. Laurie: The Ivory Trail. Scientific American 301 (1), 2009, S. 68–74
- Lucy E. King, Iain Douglas-Hamilton und Fritz Vollrath: African elephants run from the sound of disturbed bees. Current Biology 17 (19), 2007, S. R832–R833, doi:10.1016/j.cub.2007.07.038
- Kim Valenta, Melissa H. Schmitt, Manfred Ayasse und Omer Nevo: The sensory ecology of fear: African elephants show aversion to olfactory predator signals. Conservation Science and Practice 3 (2), 2021, S. e306, doi:10.1111/csp2.306
- Michael J. Chase, Scott Schlossberg, Curtice R. Griffin, Philippe J. C. Bouché, Sintayehu W. Djene, Paul W. Elkan, Sam Ferreira, Falk Grossman, Edward Mtarima Kohi, Kelly Landen, Patrick Omondi, Alexis Peltier, S. A. Jeanetta Selier und Robert Sutcliffe: Continent-wide survey reveals massive decline in African savannah elephants. PeerJ 4, 2016, S. e2354, doi:10.7717/peerj.2354
- CITES: Convention on International Trade in Endangered Species of Wild Fauna and Flora. Text of the Convention. (Article III: Regulation of Trade in Specimens of Species Included in Appendix I.) Signed at Washington, D.C., on 3 March 1973; Amended at Bonn, on 22 June 1979
- C. Williams, S. K. Tiwari, V. R. Goswami, S. de Silva, A. Kumar, N. Baskaran, K. Yoganand und V. Menon: Elephas maximus. The IUCN Red List of Threatened Species 2020. e.T7140A12828813 (); zuletzt abgerufen am 26. März 2021
- K. S. Gobush, C. T. T. Edwards, D. Balfour, G. Wittemyer, F. Maisels und R. D. Taylor: Loxodonta africana. The IUCN Red List of Threatened Species 2021. e.T181008073A181022663 (); zuletzt abgerufen am 26. März 2021
- K. S. Gobush, C. T. T. Edwards, F. Maisels, G. Wittemyer, D. Balfour und R. D. Taylor: Loxodonta cyclotis. The IUCN Red List of Threatened Species 2021. e.T181007989A181019888 (); zuletzt abgerufen am 26. März 2021
Anmerkungen
- Häufig in der Literatur angegebene Rekordwerte mit Körperhöhen von 4,16 bis 4,42 m wurden an erlegten Tieren aus dem südwestlichen Afrika in seitlich liegender Position genommen; die liegende Position führt zu anatomischen Veränderungen, wodurch die Maße nicht als korrekt anzusehen sind. Gesamtlängenangaben bei diesen Tieren von 10,4 bis zu 10,7 m sind ebenfalls ungenau, da diese von der Rüssel- bis zur Schwanzspitze gemessen wurden (Werte aus dem Guinness-Buch der Rekorde 1992 und Animal Records 2007). Die genannten Verfahren entsprechen nicht den korrekten anatomischen Messmethoden der Schulterhöhe, Kopf-Rumpf-Länge und der Schwanzlänge, die auf Bezugspunkte des Skeletts bei Wirbeltieren beruhen und unter anderem vorgegebene Körperpositionen voraussetzen. Bei der Messung werden Weichteile in der Regel nicht berücksichtigt, dies betrifft auch den Rüssel, der keinen knöchernen Unterbau besitzt.
- Das maximal erreichbare individuelle Alter eines Elefanten war häufig Gegenstand von Debatten. In der Antike ging man von bis zu 200 Jahren aus, was teilweise von einigen Naturforschern des 18. und 19. Jahrhunderts übernommen wurde. Mitte der 1890er wurde dies auf rund 150 Jahre beschränkt, wobei dies auf der Annahme beruhte, dass die Lebensspanne eines Säugetieres die 5fache Zeit beträgt, die die Epyphysen eines Knochens zum verwachsen brauchen (bei Elefanten ungefähr im Alter von 30 Jahren). Noch in der zweiten Hälfte des 19. Jahrhunderts berichteten manche Forscher von über 100 Jahre alten Tieren. Erst zu Beginn des 20. Jahrhunderts zeigten Untersuchungen von Zootieren, dass kaum eines älter als 50 Jahre wurde (vergleiche auch Glover M. Allen: Zoological results of the George Vanderbilt African Expedition of 1934. Part II: The forest elephant of Africa. Proceedings of the Academy of Natural Sciences of Philadelphia 88, 1936, S. 15–44). Die auch in neuerer Zeit teilweise angegebenen Alterswerte von über 80 Jahren für einige Zootiere oder Individuen in Obhut von Mahouts werden von offizieller Seite kritisch gesehen. In der Regel handelt es sich um Wildfänge, deren Alter nur schwer einschätzbar ist (vergleiche auch HAGR: An Age entry for Elephas maximus. ()).
Weblinks
- Katalog zur Sonderausstellung „Marina und andere Elephanten“ (Phyletisches Museum in Jena; PDF; 2,1 MB)
