Gonosom
Als Geschlechtschromosom oder Gonosom (manchmal auch Heterochromosom, Heterosom oder Allosom) werden Chromosomen bezeichnet, deren Karyotyp das genetische Geschlecht eines Individuums bestimmt.
Geschlechtschromosomen bilden in einem der Geschlechter kein homologes Paar, sondern unterscheiden sich deutlich in ihrem Inhalt. Häufig unterscheiden sich die Geschlechtschromosomen auch in ihrer Größe. Das menschliche Y-Chromosom ist etwa deutlich kleiner als das X-Chromosom, bei der Weißen Lichtnelke ist das Y-Chromosom hingegen deutlich größer. Nicht-geschlechtsbestimmende Chromosomen, die Autosomen, liegen in diploiden Zellen hingegen als Paare aus nahezu identischen homologen Chromosomen vor.
Wenn das Geschlecht chromosomal bestimmt wird, wird es entsprechend den Mendelschen Regeln vererbt. Diese Form der Geschlechtsbestimmung ist im Lauf der Evolution bei verschiedenen Artengruppen unabhängig voneinander entstanden[1] und kommt beispielsweise bei Säugetieren, Vögeln und einigen Insekten[2], aber auch in Gefäßpflanzen vor. Bei anderen Arten wird das Geschlecht dagegen durch Umweltbedingungen festgelegt, z. B. durch die Temperatur bei der Embryonalentwicklung (siehe Geschlechtsdetermination).
XY/XX-System
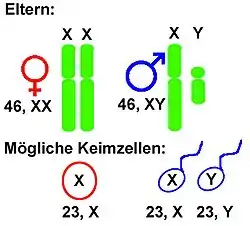
Über ein X-Y-System (im weiteren Sinne) verfügen fast alle Säugetiere (insbesondere Menschen); jeweils einige Eidechsen, Amphibien und Fische; die Taufliege Drosophila melanogaster sowie manche Pflanzen wie der Ampfer[3] und einige Lichtnelken (Silene).[4]
Bei einem XX/XY-System (X-Y-System im engeren Sinne) besitzen Weibchen zweimal das gleiche Geschlechtschromosom, nämlich zwei X-Chromosomen. Sie sind daher bezüglich der Gonosomen homozygot. Männchen haben dagegen ein X-Chromosom und ein Y-Chromosom. Diesen Zustand nennt man hemizygot. Von der Mutter wird also immer ein X-Chromosom weitergegeben, vom Vater entweder ein X- oder ein Y-Chromosom. Alle anderen Chromosomen, die Autosomen, sind in jeweils zwei Kopien vorhanden. Dieses System besitzen die meisten Säugetiere, insbesondere fast alle Theria (Beuteltiere und Plazentatiere, darunter der Mensch), nicht aber die eierlegenden Säugetiere (Kloakentiere: Monotremata).
Für Menschen konnte anhand von Patienten mit abweichender Chromosomenzahl gezeigt werden, dass für die Geschlechtsausprägung bedeutsam ist, ob ein Y-Chromosom vorhanden ist oder nicht. Auf diesem befindet sich das SRY-Gen. Ihm kommt Bedeutung bei der Ausbildung eines männlichen Genitaltraktes zu. Ist kein SRY-Gen vorhanden, kann dessen Wirkung vollständig oder zum Teil durch SOX9 und andere beteiligte Gene kompensiert werden. Bei Abwesenheit beider Gene wird laut den Ergebnissen einer Studie das Gen FOXL2 aktiv und sorgt für die Entwicklung eines weibliches Genitaltraktes.[5] Beim Turner-Syndrom haben die Betroffenen nur ein X-Chromosom und kein Y-Chromosom. Sie entwickeln in vielen Fällen einen weiblichen Genitaltrakt.[6]
In der zum Menschen führenden Entwicklungslinie haben sich die Geschlechtschromosomen vor 300 bis 200 Millionen Jahren im Perm/Trias herausgebildet.[7]
Bei manchen Arten kommen mehrere verschiedene X-Chromosomen und/oder mehrere verschiedene Y-Chromosomen vor. Als Extrembeispiel kann das Schnabeltier als Eierlegendes Säugetier (wissenschaftlich Monotremata) gelten. Bei diesem haben die Weibchen zehn X-Chromosomen (X1-X5, je zweimal) und die Männchen fünf verschiedene X- und fünf verschiedene Y-Chromosomen.[8] Die Geschlechtschromosomen des Schnabeltiers zeigen keine Homologien zu denen der Theria, d. h. der Beuteltiere und Plazentatiere, so dass davon auszugehen ist, dass ein X-Y-System zur Geschlechtsbestimmung innerhalb der Säugetiere zweimal entstanden ist.[9] Eine weitere Ausnahme — unter den Plazentatieren — ist die Oregon-Wühlmaus Microtus oregoni, deren abweichendes System sich offenbar erst in jüngerer Zeit aus dem normalen X-Y-System der Plazentatiere entwickelt hat.[10]
Bei Drosophila entwickeln sich Individuen mit einem X- und ohne Y-Chromosom zu phänotypischen, jedoch sterilen Männchen. Hier ist das Verhältnis von Autosomen zu X-Chromosomen entscheidend. Ist für jeden Satz von Autosomen ein X-Chromosom vorhanden, ist das Individuum weiblich; wenn es für zwei Sätze von Autosomen nur ein X-Chromosom gibt, ist das Individuum männlich. XXY-Individuen bilden Intersexe mit mosaikartig verteilten männlichen und weiblichen Merkmalen (sogenanntes „Salz-und-Pfeffer-Muster“) aus.
ZW/ZZ-System
Beim ZW/ZZ-System sind umgekehrt die Weibchen hemizygot, sie haben ein W- und ein Z-Chromosom, während die Männchen zwei Z-Chromosomen haben. Es kommt bei den Vögeln, den meisten Schlangen und jeweils einigen Eidechsen, Fischen und Amphibien vor. Auch haben Schmetterlinge, Köcherfliegen[11] und Erdbeeren[12] ein ZW-System.
Ein wahrscheinlicher Kandidat für das geschlechtsbestimmende Gen bei Vögeln ist DMRT1, welches auf dem Z-Chromosom, nicht aber auf dem W-Chromosom vorkommt. Weibchen haben demnach nur eine, Männchen aber zwei Kopien. Letzteres führt zur doppelten Dosis der DMRT1-Expression, welche wiederum zur Ausbildung männlicher Geschlechtsorgane führen könnte. DMRT1 ist auch bei der temperaturabhängigen Geschlechtsbestimmung bei Schildkröten und Alligatoren in männlichen Gonaden verstärkt exprimiert. Bei der Geschlechtsdifferenzierung in Menschen, Mäusen, Drosophila und Caenorhabditis elegans spielen DMRT1-homologe Gene ebenfalls verschiedene Rollen.[9]
XX/X0-System
Beim XX/X0-System haben Weibchen in der Regel zwei X-Chromosomen (XX), während die Männchen nur eins haben (X0, gesprochen „x-Null“). Es gibt kein anderes Geschlechtschromosom, die Männchen haben also ein Chromosom weniger. Diese Art der Geschlechtsdetermination ist beispielsweise bei vielen Insekten zu finden, so bei den Fischchen (Zygentoma), den Schaben (Blattodea), bei den meisten Steinfliegen (Plecoptera), Libellen (Odonata), Staubläusen (Psocoptera), Schnabelfliegen (Mecoptera), Heuschrecken (Orthoptera), Gespenstschrecken (Phasmatodea) und Fangschrecken (Mantodea), aber auch bei einigen Eintagsfliegen (Ephemeroptera) und Käfern (Coleoptera).[13] Hier ist das Verhältnis von Autosomen zu X-Chromosomen entscheidend. Bei zwei Sätzen von Autosomen und zwei X-Chromosomen entstehen Weibchen, bei zwei Sätzen von Autosomen und nur einem X-Chromosom entstehen fertile Männchen. Anders als bei Drosophila im XY/XX-System, bei der ein Satz Autosomen ohne Gonosom zur Entstehung steriler Männchen führt.
Beim XX/X0-System kann es trotz Parthenogenese zur Entstehung von Männchen kommen. Sie entstehen wenn es durch Non-Disjunction zu einer ungleichmäßigen Verteilung der X-Chromosomen kommt. Dies kann bei apomiktischer Parthenogenese während der Meiose oder bei der automiktische Parthenogenese während der Metaphase der Mitose durch das Nichttrennen von Schwesterchromatiden passieren. So entstehen Weibchen mit trisomalen X-Chromosomen (XXX) und phänotypische Männchen mit einem X-Chromosom (X0). Bei diesen sind zwar alle Zellen phänotypisch männlich, da sie aber genotypisch aufgrund der Chromosomenverteilung nicht identisch mit echten Männchen sind werden sie als intersexuelle Männchen bezeichnet. Derartige Männchen sind zwar fertil, bringen allerdings keine männlichen Nachkommen hervor.[14]
Beim Fadenwurm Caenorhabditis elegans gibt es die beiden Geschlechter Hermaphrodit und Männchen. Während die Hermaphroditen zwei X-Chromosomen haben (XX), haben die selten vorkommenden Männchen nur eins davon (X0). Die Männchen haben in diesem Fall 9 statt 10 Chromosomen.
Haplodiploidie
Bei der Haplodiploidie wird zwar das Geschlecht durch die vorhandenen Chromosomen bestimmt, es gibt jedoch keine Geschlechtschromosomen. Bei über 2000 Arten von Hautflüglern (Ameisen, Bienen, Wespen) schlüpfen aus unbefruchteten Eiern Männchen, welche daher haploid sind.[2] Sie haben demnach nur halb so viele Chromosomen wie die diploiden Weibchen (siehe auch Parthenogenese). Bei den gut untersuchten Honigbienen hat sich herausgestellt, dass ähnlich wie beim Menschen für die Geschlechtsbestimmung letztlich ein bestimmtes Gen entscheidend ist. Ist es in zwei verschiedenen Versionen vorhanden (bei den befruchteten Eiern) entstehen Weibchen. Ist es nur in einer Version vorhanden (bei unbefruchteten Eiern) entstehen Männchen. Durch Inzucht kann es dazu kommen, dass dieses Gen in befruchteten Eiern in zwei identischen Versionen vorhanden ist. Dann entstehen diploide Männchen.[2] Diese werden jedoch nach dem Schlüpfen aus dem Ei von den Arbeiterinnen aufgefressen. Auch in anderen Tiergruppen wurde Haplodiploidie beschrieben (siehe Hauptartikel Haplodiploidie).
Folgen der Hemizygotie
Während die Weibchen der Säugetiere (ausgenommen Schnabeltiere) zwei X-Chromosomen haben, haben die Männchen wie soeben beschrieben nur je ein X- und ein Y-Chromosom, sie sind hemizygot. Dies führt dazu, dass bei einem Gendefekt auf dem einzigen vorhandenen X-Chromosom dieser nicht wie bei den Weibchen durch eine funktionierende Kopie auf dem anderen Chromosom aufgefangen werden kann. Daher gibt es beim Menschen eine Reihe von Erbkrankheiten, die praktisch nur bei Männern auftreten. Die bekanntesten Beispiele sind eine Form der Bluterkrankheit, die Duchenne-Muskeldystrophie und die Rot-Grün-Blindheit.
Bei Tierarten mit ZW/ZZ-System sind umgekehrt die weiblichen Tiere häufiger von geschlechtsgebundenen Erbkrankheiten betroffen, da sie nur eine Kopie des Z-Chromosoms besitzen.[15][16][17][18]
Dosiskompensation
Als eine weitere Folge der chromosomalen Geschlechtsbestimmung liegt in einem der Geschlechter ein Chromosom zweimal vor, das beim anderen nur einmal da ist. Um zu verhindern, dass hier auch doppelt so viel Genprodukt wie im anderen Geschlecht erzeugt wird, haben verschiedene Tiergruppen verschiedene Strategien zur „Dosiskompensation“ entwickelt. Dosiskompensation selbst ist nicht geschlechtsbestimmend.
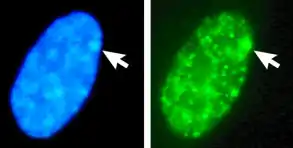
Beim Menschen, der Maus, der Katze[19][20] und möglicherweise den Säugetieren generell wird eines der beiden weiblichen X-Chromosomen inaktiviert. Das inaktive X-Chromosom erfährt dabei eine Reihe von Veränderungen, die es zum lichtmikroskopisch nachweisbaren Barr-Körperchen machen (siehe Abbildung). Dieser epigenetische Vorgang ist ausführlich in den Artikeln X-Inaktivierung und Geschlechts-Chromatin beschrieben.
Im Wurm Caenorhabditis elegans werden dagegen im Hermaphroditen beide X-Chromosomen gleichmäßig herunterreguliert. In der Fruchtfliege Drosophila melanogaster kommt es nicht zu einer X-Inaktivierung. Hier wird stattdessen das einzelne X-Chromosom im Männchen doppelt so stark abgelesen wie im Weibchen.[9]
Bei Vögeln sind die Vorgänge der Dosiskompensation noch nicht vollständig geklärt. Offenbar findet für einige Gene auf dem Z-Chromosom keine Kompensation statt, so dass sie in Männchen stärker exprimiert werden als in Weibchen. Von den Genen mit Kompensation liegt eine Mehrheit in der MHM-Region des Z-Chromosoms (MHM von englisch male hypermethylated region). In Weibchen ist diese Region von einer nicht-codierenden MHM-RNA bedeckt und reich an einer bestimmten Histon-form, die die Genexpression fördert (H4K16ac).[9][21]
Abweichungen bei der Zahl der Geschlechtschromosomen
Beim Menschen sind etliche Abweichungen in der Zahl der Geschlechtschromosomen bekannt, etwa beim Turner-Syndrom oder beim Klinefelter-Syndrom. Da bis auf eines alle X-Chromosomen (weitgehend) inaktiviert werden, sind überzählige oder ein fehlendes X-Chromosomen eher tolerierbar als zusätzliche Autosomen. Menschliche Y-Chromosomen enthalten nur sehr wenig Gene, so dass auch hier Abweichungen in der Anzahl tolerierbar sind. Eine Übersicht entsprechender Syndrome gibt der Abschnitt Abweichungen bei der Zahl der Geschlechtschromosomen im Artikel Chromosom. Im Tierreich dagegen findet sich, was die Zahl der Geschlechtschromosomen angeht, eine Vielzahl weiterer von den og. Standardmodellen abweichender Konstellationen wie zum Beispiel beim Ameisenigel mit gleich 5 XX- oder XY-Chromosomenpaaren.
Einzelnachweise
- Brian Charlesworth: The evolution of sex chromosomes. In: Science, Band 251 (1991), Nr. 4997, S. 1030–1033, doi:10.1126/science.1998119
- Panagiota Manolakou, Giagkos Lavranos, Roxani Angelopoulou: Molecular patterns of sex determination in the animal kingdom: a comparative study of the biology of reproduction. 2006. Reproductive Biology and Endocrinology, 4, 2006, S. 59. doi:10.1186/1477-7827-4-59
- Navajas-Pérez et al.: The evolution of reproductive systems and sex-determining mechanisms within Rumex (Polygonaceae) inferred from nuclear and chloroplastidial sequence data. In: Molecular Biology and Evolution. Band 22, Nr. 9, 2005, S. 1929–1939, doi:10.1093/molbev/msi186, PMID 15944442.
- F. Monéger, N. Barbacar, I. Negrutiu: Dioecious Silene at the X-road: the reasons Y. In: Sex Plant Reprod. Band 12, Nr. 4, 2000, S. 245–249, doi:10.1007/s004970050009.
- N. Henriette Uhlenhaut, Susanne Jakob, Katrin Anlag, Tobias Eisenberger, Ryohei Sekido: Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2 Ablation. In: Cell. Band 139, Nr. 6, Dezember 2009, S. 1130–1142, doi:10.1016/j.cell.2009.11.021 (elsevier.com [abgerufen am 3. August 2020]).
- Heinz-Jürgen Voß: Making Sex Revisited: Dekonstruktion des Geschlechts aus biologisch-medizinischer Perspektive. Transcript-Verlag, Bielefeld 2010.
- Lizzie Buchen: The fickle Y chromosome. In: Nature, Band 463, 2010, S. 149, doi:10.1038/463149a, Volltext
- Frank Grützner, Willem Rens, Enkhjargal Tsend-Ayush, Nisrine El-Mogharbel, Patricia C. M. O’Brien, Russell C. Jones, Malcolm A. Ferguson-Smith, Jennifer A. Marshall Graves: In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes. Nature 432(7019), 2004, S. 913–917. doi:10.1038/nature03021
- B. Payer, J.T. Lee: X Chromosome Dosage Compensation: How Mammals Keep the Balance. In: Annual review of genetics. August 2008. doi:10.1146/annurev.genet.42.110807.091711. PMID 18729722.
- Mike McRae: These Little Creatures Have The 'Weirdest Sex Chromosome System Known to Science', auf sciencealert vom 21. Mai 2021
- W. Traut, K. Sahara, F. Marec: Sex Chromosomes and Sex Determination in Lepidoptera. In: Sexual Development. Band 1, 2008, S. 332–346, doi:10.1159/000111765.
- G. M. Darrow: The strawberry: history, breeding and physiology. Holt, Rinehart & Winston, New York 1966.
- Heath Blackmon Laura Ross Doris Bachtrog: Sex Determination, Sex Chromosomes, and Karyotype Evolution in Insects. Journal of Heredity, Volume 108, Issue 1, 1 January 2017, S. 78–93.
- Thies H. Büscher: Gynandromorphismus – Halb Mann, Halb Frau – kuriose Zwitterwesen; ein Bericht mit besonderem Blick auf Gynander in der Ordnung Phasmatodea (Insecta). Arthropoda Popularis, 3/4 2015, ZAG Wirbellose e.V., Dessau-Roßlau 2015, ISSN 2190-3476, S. 26–37.
- JE. Mank und H. Ellegren: Sex linkage of sexually antagonistic genes is predicted by female, but not male effects in birds. In: Evolution. 63, 2009, S. 1464–1472, doi:10.1111/j.1558-5646.2009.00618.x.
- TF. Wright et al. Sex-linked inheritance of hearing and song in the Belgian Waterslanger canary. In: Proc R Soc Lond 2004, B (Suppl.) 271, S. S409–S412, PMC 1810118 (freier Volltext).
- P.R. Baverstock et al.: A sex-linked enzyme in birds—Z-chromosome conservation but no dosage compensation. In: Nature 296, 1982, S. 763–766, doi:10.1038/296763a0.
- Marina Dominguez-Steglich, Michael Schmid: Sex-Linkage of the Chicken Ornithine Transcarbamylase Gene. In: Hereditas. 118, 1993, S. 1–5, doi:10.1111/j.1601-5223.1993.t01-3-00001.x.
- Peter Spork-Frischling: Wie das überzählige X-Chromosom runterfährt. In: Newsletter Epigenetik. 15. Oktober 2015, abgerufen am 25. April 2018.
- Hendrik Marks, Hindrik H. D. Kerstens, Tahsin Stefan Barakat, Erik Splinter, René A. M. Dirks, Guido van Mierlo, Onkar Joshi, Shuang-Yin Wang, Tomas Babak, Cornelis A. Albers, Tüzer Kalkan, Austin Smith, Alice Jouneau, Wouter de Laat, Joost Gribnau, Hendrik G. Stunnenberg: Dynamics of gene silencing during X inactivation using allele-specific RNA-seq. In: Genome Biology. Band 16, 2015, S. 149–169, doi:10.1186/s13059-015-0698-x, PMID 26235224.
- Laura Bisoni, Laura Batlle-Morera, Adrian P. Bird, Miho Suzuki, Heather A. McQueen: Female-specific hyperacetylation of histone H4 in the chicken Z chromosome. Chromosome Res. 13(2), 2005, S. 205–214. doi:10.1007/s10577-005-1505-4