Opioide
Opioide (von altgriechisch ὄπιον ópion [ˈɔpiɔn], deutsch ‚Mohnsaft, Opium‘ und mittelgriechisch εἶδος eidos [ˈiðɔs], deutsch ‚Gestalt‘, zusammen „dem Opium ähnlich“)[1][2] ist ein Sammelbegriff für eine chemisch heterogene (uneinheitliche) Gruppe natürlicher und synthetischer sowie semisynthetischer Substanzen, die morphinartige Eigenschaften aufweisen und an Opioidrezeptoren wirksam sind. Der Begriff Opiat steht hingegen nur für die natürlicherweise im Opium vorkommenden Stoffe mit dieser Wirkung, die chemisch Alkaloide darstellen und aus dem Schlafmohn (Papaver somniferum) gewonnen werden.
Man unterscheidet körpereigene (endogene) Opioide, die eine Rolle bei der Schmerzunterdrückung im Rahmen der Stressreaktion spielen, von therapeutisch oder missbräuchlich zugeführten (exogenen) Opioiden.
Das Wirkspektrum von Opioiden ist komplex und sehr unterschiedlich. Die wichtigste Wirkung ist eine starke Schmerzlinderung (Analgesie) bei geringen kardiovaskulären Nebenwirkungen, was Opioide, genannt dann auch Opioid-Analgetika, zu unverzichtbaren und vielgenutzten Arzneimitteln in der Schmerztherapie, Anästhesie und anderen Einsatzbereichen macht. Unter den vielfältigen weiteren Wirkungen sind Sedierung und der euphorisierende Effekt zu nennen; die wichtigsten Nebenwirkungen sind Vigilanzminderung und Atemdepression, v. a. bei Überdosierung, sowie Obstipation (Verstopfung) und Entwicklung einer Abhängigkeit.[3][4]
Wirkungsweise
Die Gruppe der Opioide ist eine chemisch heterogene Untergruppe der Analgetika. Opioide wirken als Liganden (Bindungspartner) an der orthosterischen Bindungsstelle der nach ihnen benannten Rezeptoren. Diese Opioidrezeptoren befinden sich auf der Oberfläche von Nervenzellen und weiteren Zellen im ganzen Körper, sie kommen am häufigsten im Gehirn am Boden des vierten Ventrikels, in anderen Gehirnregionen und im Rückenmark vor. Sie sind zudem in der Peripherie, unter anderem im Darm, zu finden.
Opioide entfalten ihre analgetische Wirkung vorrangig im Zentralnervensystem. Ein Beispiel für ein Opioid mit ausschließlich peripherer Wirkung ist Loperamid, ein Mittel gegen Durchfall, das die Blut-Hirn-Schranke normalerweise nicht überwindet. Es bewirkt eine Verlangsamung der Darmperistaltik.
Atypische Opioide
Eine große Anzahl von Opioidagonisten wie Morphin, Fentanyl und nahezu alle gegenwärtig (2020) eingesetzten opioid-analgetischen Arzneistoffe, haben eine Bandbreite ausgeprägter, typischer Nebenwirkungen. Sie werden als Typika bezeichnet. Atypische Opioide sind Opioidanalgetika, welche ein bedeutend günstigeres Nebenwirkungsprofil als Typika haben. Der Begriff Atypika wird nicht immer ganz einheitlich verwendet, auch ist eine trennscharfe Einteilung schwierig. Beispiele für Atypika sind das Hauptalkaloid des Kratoms Mitragynin, bzw. der besonders potente Metabolit Pseudoindoxylmitragynin. Atypika können eigene „off-target“ Nebenwirkungen haben. Mitragynin etwa hemmt in hohen Dosen hERG-Kanäle. Die Ursachen der Nebenwirkungsarmut von Atypika sind nicht immer eindeutig bekannt, gleichwohl wurden in den letzten Jahrzehnten Erklärungs- und Entwicklungskonzepte erarbeitet.
Perspektiven zur Entwicklung nebenwirkungsreduzierter Opioide
Da Opioide wichtige Therapeutika sind, aber mit problematischen Nebenwirkungen behaftet, gibt es ein Bedürfnis diese durch optimierte Wirkstoffgestaltung zu reduzieren. Entsprechende Konzepte sind in Übersichtsarbeiten gründlich begutachtet worden.[5]
Rezeptoren
Mehrere unterschiedliche Typen und Subtypen der Opioidrezeptoren werden unterschieden:
| Typ | Lokalisation | Wirkung |
|---|---|---|
| μ1 und μ2 | Gehirn | Analgesie, Herz-Kreislauf-Wirkungen |
| μ2 (MOR bzw. OP3) | spinal, supraspinal | Analgesie, Atemdepression, Euphorie, Magen-Darm-Wirkung, Sucht |
| μ | peripher | Analgesie, Magen-Darm-Wirkung, Juckreiz |
| κ (Kappa) (KOR bzw. OP2) | Gehirn, spinal | Analgesie, Sedierung, Dysphorie |
| δ (Delta) (DOR bzw. OP1) | Gehirn, spinal, peripher | Magen-Darm-Wirkung, modulierende Wirkung |
| bisher nicht identifizierter Rezeptor | Miosis, Übelkeit, Erbrechen |
Der σ-Rezeptor wird heute nicht mehr zu den Opioidrezeptoren gezählt, denn auch wenn manche Opioide eine agonistische Wirkung auf diesen aufweisen, binden weder endogene Opioide an diesem Rezeptor, noch kann die Wirkung selektiver σ1-Liganden durch Naloxon/Naltrexon blockiert werden.[6]
Agonisten und Antagonisten
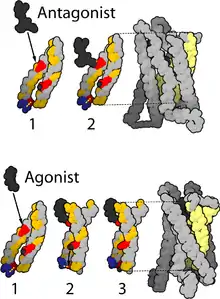
Opioide binden gruppenspezifisch unterschiedlich stark an die verschiedenen Rezeptoren, wobei sie aktivierend (Agonisten) oder hemmend (Antagonisten) wirken können, wodurch ein komplexes Wirkmuster entsteht (multiple receptor theory). Vier Gruppen werden unterschieden:
Reine Agonisten
Reine Agonisten haben eine ausschließlich aktivierende Wirkung mit einer hohen Affinität (Bindungsstärke) und hoher intrinsischer Aktivität (Wirkstärke) zu μ-Rezeptoren sowie geringerer Affinität zu κ-Rezeptoren. Meptazinol bindet selektiv am μ1-Rezeptor und vermindert so bei Fortbestehen der analgetischen Wirkung die μ2-vermittelte Atemdepression.[7] Die Wirkung dieser Stoffe lässt sich durch Antagonisten komplett aufheben. Die Kombination reiner Agonisten mit gemischten Agonisten-Antagonisten ist nicht zweckmäßig, da dadurch die Wirkung abgeschwächt wird. Die meisten in der Medizin eingesetzten Opioid-Pharmaka sind reine Agonisten, Beispiele sind Tramadol, Pethidin, Codein, Piritramid, Morphin, Levomethadon, Diethylthiambuten, Ketobemidon sowie die starken Analgetika Fentanyl, Alfentanil, Remifentanil und Sufentanil.
Gemischte Agonisten-Antagonisten
Gemischte Agonisten-Antagonisten bieten ein komplexes Wirkmuster. An μ-Rezeptoren sind sie Liganden mit einer hohen Affinität, jedoch sehr schwachen intrinsischen Aktivität, sodass eine antagonistische Wirkung resultiert. An κ-Rezeptoren hingegen sind Affinität und intrinsische Aktivität hoch (κ-Agonisten). Auch an δ-Rezeptoren wirken sie agonistisch. Im Gegensatz zu den reinen Agonisten erfolgt mit steigender Dosierung keine weitere Zunahme der Wirkungen (Ceiling-Effekt). Substanzen dieser Gruppe sind Pentazocin, Butorphanol, N-Naphthoyl-6β-naltrexamin und Nalbuphin, wobei aufgrund der Neigung zu Dysphorie, Halluzinationen, Desorientierung sowie Kreislaufstimulation (σ-Agonisten) die pharmakologische Bedeutung stark zurückgegangen ist.
Partialagonisten
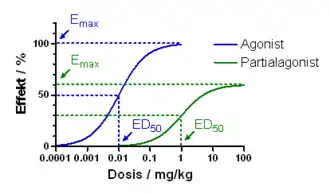
Die einzige pharmakologisch relevante Substanz ist das Buprenorphin, das an μ-Rezeptoren eine sehr hohe Affinität, eine etwa 30-mal stärkere Aktivität und längere analgetische Wirkdauer (6 bis 8 Stunden) als Morphin aufweist. Es unterliegt ebenfalls einem Ceiling-Effekt, wobei dieser aber keine therapeutische Relevanz hat, sondern nur das Risiko einer Atemdepression senkt. Buprenorphin hat die längste Wirkdauer aller Opioide.
Reine Antagonisten
Reine Antagonisten wirken an allen Rezeptortypen als kompetitive Antagonisten, jedoch mit unterschiedlicher Affinität. Sie werden meist zur Aufhebung (Antagonisierung) von agonistischen Opioid-Wirkungen (Narkosebeendigung, Gegengift bei Intoxikation, Entwöhnungsbehandlung) eingesetzt. Eingesetzte Wirkstoffe sind Naloxon und Naltrexon.
Weitere Vertreter
Weitere Beispiele für Opioide sind Acetorphin, Acetyl-α-methylfentanyl, Acetyldihydrocodein, Allylprodin, Etonitazen, Levomethorphan, Lofentanil, MDAN-21, PZM21 und Nicomorphin.
Natürliche Opioide und Opiate
Endogene Opioide
Die endogenen Opioide sind körpereigene Peptide, die im Rahmen der Stressantwort ausgeschüttet werden und zur akuten Schmerz- und Hungerunterdrückung dienen, jedoch auch mit den Sexualhormonen interagieren und an der Entstehung von Euphorie sowie der Regulation von gastrointestinaler Funktionen, Atmung, Thermoregulation und Immunreaktionen beteiligt sind. Sie werden bei Verletzungen, jedoch auch durch emotionale Stimuli und UV-Licht ausgeschüttet. Auch bei Übergewicht, psychischen Störungen, aber auch Opioidgabe ist ihre Sekretion verändert. Ein genaues Verständnis dieser komplexen Funktionen und Regulationsvorgänge fehlt bisher.
Die endogenen Opioide lassen sich in drei Gruppen einteilen. Das Vorläuferpeptid der Endorphine ist das Pro-Opiomelanocortine (POMC), woraus die Endorphine α, β und γ hervorgehen. Aus der Gruppe der Enkephaline sind die Varianten Met-Enkephalin, Leu-Enkephalin und Met-Arg-Phe-Enkephalin, die sich durch die N-terminalen Aminosäuren unterscheiden. Die Dynorphine unterteilen sich in Dynorphin A und B sowie α- und β-Neoendorphin.
Die endogenen Opioide (Neuropeptide) werden bei Säugetieren in Hypothalamus und Hypophyse produziert und unterscheiden sich in Verteilung und Rezeptoraffinität.[8]
Opiate/Opium-Alkaloide
Als Opiate werden natürliche Substanzen, die im Opium vorkommen, bezeichnet. Das Opium, das aus Schlafmohn (Papaver somniferum) gewonnen wird, besteht zu etwa 25 % aus diesen Alkaloiden. Die wichtigsten Stoffe sind Morphin (10 %), Codein (0,5 %) und Thebain (0,2 %) aus der Gruppe der Phenantrane sowie das Isochinolinderivat Noscapin (6 %), Papaverin (0,8 bis 1 %) und Narcein (0,3 %), die Benzylisochinoline sind.[9]
Kratom-Alkaloide
Die Blätter des Kratombaums (Mitragyna speciosa) enthalten die opioiden Alkaloide Mitragynin und 7-Hydroxymitragynin.[10]
In geringerer Konzentration finden sich diese Alkaloide auch in anderen Vertretern der Gattung Mitragyna.
Akuamma
Die Samen des afrikanischen Akuamma Baumes (Picralima nitida) enthalten das Opioid Akuammin, welches strukturähnlich zu den Kratomalkaloiden ist.[11]
Eckdaten gebräuchlicher Opioide
| Name | relative Potenz | minimale Wirkdauer | Klassifikation | Anmerkungen | Betäubungsmittelrechtliche Einordnung (Deutschland) |
|---|---|---|---|---|---|
| [[N-[(3R,4S)-1-[(2S)-2-Hydroxy-2-phenyl-ethyl]-3-carboethoxy-4-piperidyl]-N-phenyl-propanamid]] | 30000 | ? | Agonist | Agonist | Stärkstes bekanntes Analgetikum, nicht verschreibungsfähig (siehe Ohmefentanyl) |
| [[N-[(3R,4S)-1-[(2S)-2-Hydroxy-(2-{4-fluor-}phenyl-ethyl)]-3-methyl-4-piperidyl]-N-phenyl-propanamid]] | 18000 | ? | Agonist | Agonist | nicht verschreibungsfähig (siehe Ohmefentanyl) |
| Carfentanyl | 10000 | ? | Agonist | Agonist, zur Betäubung großer Tiere | Stärkstes veterinärmedizinisches Analgetikum, BtMG |
| Dihydroetorphin | <10000 | ? | Agonist | Agonist, findet Verwendung in China | |
| Ohmefentanyl | 6300 | ? | Agonist | Agonist | |
| Etorphin | 2000 | ? | Agonist | Agonist | |
| Sufentanil | ≈1000 | 30 min | Agonist | Stärkstes humanmedizinisches Analgetikum | verschreibungsfähiges Betäubungsmittel (BtM) |
| Remifentanil | ≈100–200 | 8–10 min | Agonist | Sehr kurze Halbwertszeit, deshalb sehr gut steuerbar. Vor allem im Rahmen der TIVA eingesetzt. | verschreibungsfähiges BtM |
| Fentanyl | 120 | 30 min | Agonist | transdermal anwendbar | verschreibungsfähiges BtM |
| Alfentanil | 30–40 | 10 min | Agonist | transdermal anwendbar | verschreibungsfähiges BtM |
| Buprenorphin | ≈30 | 6–8 h | partieller Agonist | wirkt bei alleiniger Gabe schmerzstillend, in Kombination mit Agonisten antagonistisch; Ceiling-Effekt | verschreibungsfähiges BtM |
| Hydromorphon | 7,5 | 3–5 h (unretardiert) | Agonist | sedierende Wirkung ist im Vergleich zu Morphin deutlich geringer | verschreibungsfähiges BtM |
| Levomethadon | 4 | 5–7 h | Agonist | Kumulation und starke Halbwertszeiterhöhung bei täglicher Verabreichung. | verschreibungsfähiges BtM |
| Diacetylmorphin (Heroin) / Diamorphin (DAM) | 2,5 | 3–4 h (Metabolite) | Agonist | sehr hohes Abhängigkeitspotential | ausschließlich zur Herstellung von Zubereitungen zu medizinischen Zwecken verkehrsfähiges BtM, ausschließlich zur Substitutionstherapie verschreibungsfähiges BtM |
| Methadon | 2 | 5–7 h | Agonist | siehe Levomethadon | verschreibungsfähiges BtM |
| Oxycodon | 1,5–2 | 3,5–7 h (unretardiert) | Agonist | verschreibungsfähiges BtM | |
| Hydrocodon | 1,5 | 4–8 h | Agonist | verschreibungsfähiges BtM | |
| Morphin | 1 | 2–4 h | Agonist | Referenzsubstanz der Opioide, eigentlich ein Opiat | verschreibungsfähiges BtM |
| Piritramid | 0,7 | 4–6 h | Agonist | verschreibungsfähiges BtM | |
| Nalbuphin | 0,5–0,7 | 3–6 h | gemischter Agonist-Antagonist | nicht betäubungsmittelrechtlich geregelt | |
| Tapentadol | 0,3–0,5 | 4 h (für unretardiertes Tapentadol) | Agonist am μ-Opioidrezeptor, selektiver Noradrenalin-Wiederaufnahmehemmer | verschreibungsfähiges BtM | |
| Pentazocin | 0,3 | 2–4 h | gemischter Agonist-Antagonist | verschreibungsfähiges BtM | |
| Dihydrocodein | 0,2 | 3–4 h | Agonist | verschreibungsfähiges BtM, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze | |
| Pethidin | 0,1–0,2 | 2–4 h | Agonist | verschreibungsfähiges BtM | |
| Tilidin | 0,1–0,2 | 3–4 h | Agonist | trans-Tilidin: verschreibungsfähiges Betäubungsmittel, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze und in Kombination mit Naloxon; cis-Tilidin: verkehrs-, aber nicht verschreibungsfähig. | |
| Codein | 0,1 | 4 h | Agonist | ein Opiat | verschreibungsfähiges BtM, ausgenommen sind Zubereitungen unterhalb einer festgelegten Dosisgrenze |
| Meptazinol | 0,1 | 3–4 h | my2-Agonist | nicht betäubungsmittelrechtlich geregelt | |
| Tramadol | 0,1 | 4 h | Agonist | nicht betäubungsmittelrechtlich geregelt | |
| Naloxon | gegen 0 | 1–4 h | reiner Antagonist | Wirkdauer gilt nur für intravenöse Gabe | nicht betäubungsmittelrechtlich geregelt |
| Naltrexon | gegen 0 | bis 24 h | reiner Antagonist | orale Gabe | nicht betäubungsmittelrechtlich geregelt |
| Diprenorphin | gegen 0 | ? h | reiner Antagonist | stärkster Opioid-Antagonist und somit auch bei hochpotenten Opioiden wie Buprenorphin oder Etorphin wirksam | nicht betäubungsmittelrechtlich geregelt |
| Loperamid | gegen 0 | nur an peripheren Opioid-Rezeptoren wirksam, Behandlung des Durchfalls | nicht betäubungsmittelrechtlich geregelt | ||
| Apomorphin | gegen 0 | Brechmittel, an Dopamin-Rezeptoren der Area postrema | nicht betäubungsmittelrechtlich geregelt |
Wirkungen
Analgesie
Die Schmerzbekämpfung ist die gewünschte Wirkung beim Einsatz von Opioid-Analgetika. Sie wird hauptsächlich über die μ-Rezeptoren, insbesondere μ1, jedoch auch über κ vermittelt.
Die Wirkstärke der einzelnen Substanzen wird als analgetische Potenz bezeichnet, die relativ zu Morphin angegeben wird, dessen Wert als 1 festgelegt ist. Je höher die analgetische Potenz ist, desto niedriger ist die benötigte Dosis eines Pharmakons, um eine vergleichbare Analgesie herzustellen. Pharmakodynamisch kann die Potenz mit der Effektivdosis ED50 angegeben werden.
Die maximal erreichbare Analgesie besagt, dass bei niedrigpotenten Opioiden die analgetische Wirkung im Gegensatz zu hochpotenten Substanzen nur bis zu einer bestimmten Dosissteigerung zunimmt, eine weitere Erhöhung dann jedoch keine stärkere Analgesie bewirkt, jedoch eine Zunahme der unerwünschten Wirkungen. Pharmakodynamisch ist die maximal erreichbare Analgesie ein Maß der intrinsischen Aktivität eines Wirkstoffs. Diese Werte sind auch in hohem Maß genetisch bestimmt.[15]
Opioid-Analgetika sind Bestandteil des WHO-Stufenschemas zur Therapie chronischer Schmerzen. Dieses sieht in der zweiten Stufe die Gabe eines niederpotenten Opioids zusätzlich zu einem nicht-Opioid-Analgetikum (erste Stufe), in der dritten Stufe die Anwendung einer hochpotenten Substanz vor. Daneben werden Opioid-Analgetika in vielen weiteren Bereichen der Medizin therapeutisch eingesetzt, so zur Narkoseeinleitung in der Anästhesie und vielen akuten schmerzassoziierten Erkrankungen und Verletzungen in der Notfall- und Intensivmedizin, die mit Nicht-Opioid-Schmerzmitteln nicht beherrscht werden können.[12][16] Opioide sind oft in Sicherheitsblistern verpackt und nicht in regulären Durchdrückblistern. Dies dient der Prävention der versehentlichen Einnahme bzw. als Kindersicherung.
Zur Langzeittherapie chronischer, nicht-tumorbedingter Schmerzen sind Opioide nur eingeschränkt wirksam und nur unter Berücksichtigung der tatsächlichen Schmerzlinderung (erfassbar mittels der visuellen Analogskala), der möglichen Nebenwirkungen auch der niedrigpotenteren Schmerzmedikamente und unter zusätzlichem Einsatz zusätzlicher schmerzlindernder Maßnahmen angezeigt (siehe auch Schmerztherapie).[17]
Atemdepression
Die Atemdepression ist eine schwerwiegende Nebenwirkung und der Hauptmortalitätsfaktor herkömmlicher Opioide.[18] Sie ist direkt proportional zur analgetischen Potenz des Opioids. Atemfrequenz und Atemzugvolumen nehmen ab.[19]
μ1-Opioidrezeptoren (MOR1) sind weit verbreitet im Netzwerk jener Hirnareale, die der Steuerung der Atmung und motorischen Kontrolle der oberen Atemwege, einschließlich der Funktion des Schluckens, dienen.[20] Diese Areale sind sensibel für die opioidinduzierte Atemdepression (OIAD). Die für die OIAD bedeutendste Hirnstruktur ist der im Hirnstamm gelegene Prä-Bötzingerkomplex, der als inspirativer Rhythmusgenerator Kraft und Timing der Einatmung und den Ausdruck der aktiven Ausatmung bestimmt. Rund 70–140 glutamaterge Neuronen innerhalb dieses Komplexes sind verantwortlich für die wesentlichsten Merkmale der OIAD.[21] Der parabrachiale Kern (Kölliker-Fuse-Komplex) spielt bei der OIAD eine additive Rolle. Die G-Protein-Aktivierung der MOR1 in diesem Komplex und in weiteren Hirnregionen führt durch Kopplung an den postsynaptischen Effektor GIRK zur Hyperpolarisation betroffener Neuronen und damit zur Hemmung ihrer Erregbarkeit durch Transmitter wie Glutamat.[20] Experimentell konnte durch genetische Auslöschung der MOR1 in den beiden genannten Arealen die Ausprägung einer Atemdepression, selbst gegenüber extremen Fentanyldosen, drastisch reduziert, insbesondere ein natürliches Atemrhythmusmuster aufrechterhalten werden.[21] Toleranz in Bezug auf die Atemdepression entwickelt sich langsamer und schwächer als gegenüber der analgetischen Wirkung. Der parabrachiale Kern ist kein Objekt langfristiger opioiderger Toleranzentwicklung.[18] Zur Entwicklung nebenwirkungsreduzierter Opioide werden mehrere Konzepte verfolgt, von denen es die funktionelle Selektivität bis zur Marktreife geschafft hat. Für die Annahme indes, eine bevorzugte G-Protein Aktivierung (im Englischen „G protein biased agonism“) am MOR1 ginge mechanistisch ohne weiteres einher mit der Minderung der Atemdepression, fehlt der Beweis.[22]
Indirekt hat die Atemdepression durch eine Vasodilatation (Gefäßweitstellung) auch eine Erhöhung des intrakraniellen Drucks (Hirndruck) zur Folge. Als milde Verlaufsform tritt eine Hypoventilation (verminderte Atmung) mit nur wenigen Atemzügen pro Minute auf. Typisch für diese ist, dass der Betroffene einer Aufforderung zum aktiven Atmen nachkommt (sogenannte Kommandoatmung). Bei höherer Dosierung kommt die Atmung zum Stillstand. Durch den Einsatz des Antagonisten Naloxon ist eine Atemdepression aufhebbar. Bei schmerzorientierter Gabe von Opioiden tritt in der Regel keine klinisch relevante Atemdepression auf, solange sich die Opioidgabe am Ausmaß der Schmerzreduktion orientiert und eine Überdosierung vermieden wird. Schmerz ist bezüglich Atemdepression ein Opioidantagonist.[23]
Atemnottherapie in der Palliativmedizin
Opioide können gerade in der Behandlung einer Dyspnoe als Folge fortgeschrittener Erkrankungen wie einer COPD zumindest im Terminalstadium einer Erkrankung verabreicht werden, sofern die Symptomlinderung und nicht die Beschleunigung des Sterbeprozesses angestrebt wird.[24][25] Darüber hinaus sind Opioide auch zur Linderung einer anderweitig nicht zu behandelnden Atemnot von COPD-Patienten außerhalb eines Terminalstadiums hilfreich.[26][27] Zum Einsatz kann z. B. Morphin mittels intravenöser oder subcutaner Injektion erfolgen, eine andere Möglichkeit ist die Gabe von nasal zu verabreichendem Fentanyl.[28]
Psychotrope Effekte
Eine Sedierung (Beruhigung) wird über κ-Rezeptoren bewirkt. Sie ist teilweise erwünscht (Narkose, Analgosedierung), teilweise unerwünscht (langfristige Schmerztherapie). Auch bei hoher Dosierung von Opioid-Analgetika kommt es jedoch nicht zur sicheren Ausschaltung des Bewusstseins, so dass Opioide im Rahmen einer Allgemeinanästhesie (Narkose) mit inhalativen oder intravenösen Hypnotika im Allgemeinen kombiniert werden, um Wachheits-Phänomene (Awareness) zu vermeiden.
Opioide haben weiterhin angstlösende und euphorisierende Effekte, die als verantwortlich für die psychische Komponente einer Opioid-Abhängigkeit angesehen werden. Daneben können über σ-Rezeptoren jedoch auch Dysphorie und Halluzinationen verursacht werden, was bei den gemischten Agonisten-Antagonisten eine Rolle spielt.
Übelkeit und Erbrechen
Durch die Stimulation Dopamin-abhängiger Rezeptoren in der Triggerzone der Area postrema am Boden des IV. Ventrikels wird das Brechzentrum in der Formatio reticularis stimuliert und so Übelkeit und Erbrechen (emetische Wirkung) ausgelöst. Im Rahmen einer Narkose kann dies postoperativ auftreten (postoperative nausea and vomiting, PONV). Diese Wirkung kann durch Antiemetika gemildert werden. In höherer Dosierung dämpfen Opioide das Brechzentrum jedoch, so dass dann eine antiemetische (übelkeitsmindernde) Wirkung resultiert.
Das dem Morphin verwandte Apomorphin hat eine ausgeprägte Wirkung an den Dopamin-2-Rezeptoren der Area postrema. Es kann aus diesem Grund zum Auslösen von Erbrechen bei manchen Vergiftungen genutzt werden, ist jedoch in Deutschland für diese Indikation (beim Menschen) nicht mehr zugelassen.
Obstipation
Spastische Obstipationen des Darms (Verstopfung) werden durch die Stimulierung von μ-Rezeptoren des Plexus myentericus der Darmwand mit einer Konstriktion der glatten Muskulatur bewirkt. Sie sind die relevanteste Nebenwirkung bei langfristiger Schmerzbehandlung und unterliegen nur einer geringen Toleranzentwicklung. Prophylaktisch kann die Gabe von Laktulose erfolgen.
Gewünscht ist die obstipierende Wirkung beim Einsatz des Morphin-Abkömmlings Loperamid, das als Antidiarrhoikum zur symptomatischen Therapie von schwerem Durchfall dient.
Weitere Wirkungen
Weiter kommt es zu einer Konstriktion des Sphincter oddi, wodurch der Druck im Gallengangsystem erhöht wird, was zu kolikartigen Schmerzen führen kann. Daneben ist eine Sekretstauung des Pankreas und in der Folge eine Pankreatitis möglich.
Durch denselben Mechanismus treten Entleerungsstörungen der Harnblase mit Harnverhalt auf.
Durch die Dämpfung des Hustenzentrums kommt es zu einer antitussiven (hustenmildernden) Wirkung. (Selektiv ist diese auch für das nicht morphinähnliche Opiumalkaloid und Isochinolinderivat Noscapin beschrieben). Diese Wirkung wird bei dem Antitussivum Codein und Derivaten genutzt. Bei der schnellen Injektion von hochpotenten synthetischen Opioiden wie Fentanyl bei der Narkoseeinleitung kann es initial jedoch zu einem Hustenreiz kommen.
Opioide bewirken eine zentrale Sympathikolyse (Aktivitätsminderung des sympathischen Nervensystems). Durch diese sowie eine Erhöhung der Aktivität des Nervus vagus sowie einer direkten Vasodilatation kommt es zu einem Abfall der Herzfrequenz (Bradykardie), des Blutdruckes (Hypotonie) sowie des Herzzeitvolumens. In therapeutisch üblicher Dosierung ist die Beeinträchtigung der Herz-Kreislauf-Funktion nur gering. Bei eingeschränkter Kreislaufregulation wie bei Volumenmangel (Schock), Narkose sowie unter Antihypertensiva (blutdrucksenkende Medikamente) ist jedoch ein krisenhafter Blutdruckabfall möglich. Bei der Therapie des akuten Myokardinfarktes (Herzinfarkt) und der akuten Linksherzinsuffizienz (Herzschwäche) nutzt man die kreislaufdämpfende Wirkung zur Entlastung der Herzfunktion und zur Senkung des myokardialen Sauerstoffverbrauchs.
Eine Miosis (Verengung der Pupille) wird durch die Stimulation des parasympathischen Edinger-Westphal-Kern im Mittelhirn und die dadurch verursachte Kontraktion des Musculus sphincter pupillae ausgelöst. Beim Vorliegen einer Opioid-Vergiftung mit Sauerstoffmangel (s. u.) kann auch eine Mydriasis (Erweiterung der Pupille) auftreten.
Bolusinjektionen hochpotenter Opioide im Rahmen der Narkose können eine Muskelrigidität (Muskelsteifigkeit) auslösen, die vor allem Thorax (Brustkorb) und Abdomen (Bauch) betrifft (wooden chest), wodurch die Maskenbeatmung bei der Narkoseeinleitung erschwert wird. Der Mechanismus ist unklar. Besonders ausgeprägt ist diese unerwünschte Wirkung bei Alfentanil und Remifentanil. Im Rahmen der modernen Kombinationsnarkose spielt dieses Phänomen aufgrund der eingesetzten Muskelrelaxanzien nur noch eine untergeordnete Rolle.
Opioide können weiterhin Juckreiz (Pruritus) auslösen. Dies kommt durch eine Überlappung von Schmerz- und Juckreiz-assoziierten peripheren Mediatoren und Rezeptoren zustande.[29]
Opioide sind keine Trigger für die maligne Hyperthermie und haben keine toxische (giftige) Wirkung auf Leber und Niere. Sie setzen Histamin frei.
Intoxikation
Eine akute Intoxikation mit Opioiden kann im Rahmen einer Überdosierung bei Abhängigkeit, meist in Unkenntnis der Opioid-Konzentration sowie in suizidaler Absicht, akzidentiell (unabsichtlich), iatrogen (als Folge einer medizinischen Behandlung) oder auch bei einem Body-Packer-Syndrom bei Drogenkurieren vorkommen. Zudem ist bei gleichzeitiger Einnahme von Benzodiazepinen das Risiko einer Opioid-assoziierten Überdosierung bis zu fünfmal so hoch wie bei alleiniger Einnahme von Opioiden.[30]
Die typische Symptomen-Trias der Opioid-Intoxikation besteht aus Atemdepression, nicht erweckbarem Koma und Miosis mit stecknadelkopfgroßen Pupillen. Bei tiefer Bewusstlosigkeit kann jedoch auch eine Mydriasis auftreten. Durch die insuffiziente Atmung besteht eine Hypoxie (Sauerstoffmangel) mit Zyanose, unter Umständen kann es zu einem Lungenödem kommen. Eventuell kann eine Cheyne-Stokes-Atmung beobachtet werden. Weiterhin tritt eine Kreislaufschwäche mit Bradykardie (Pulsverlangsamung) und Hypotension (Blutdruckabfall) ein. Der Muskeltonus ist herabgesetzt, die Reflexe sind abgeschwächt oder aufgehoben. Differenzialdiagnostisch kommt eine Vergiftung mit Clonidin in Betracht, deren Erscheinungsbild sehr ähnlich sein kann.
Die Therapie einer Opioid-Vergiftung ist primär symptomatisch und besteht in der Sicherung der Vitalfunktionen. Die wichtigste Maßnahme ist das Freihalten der Atemwege bei Ateminsuffizienz, falls erforderlich durch eine endotracheale Intubation und kontrollierte Beatmung mit Sauerstoff. Die Kreislaufinsuffizienz macht eine Schockbehandlung mit Volumengabe über großlumige Venenverweilkanülen erforderlich. Auftretende Krämpfe werden mit Benzodiazepinen behandelt.
Als spezifisches Antidot wird Naloxon eingesetzt, das als Antagonist an allen Opioid-Rezeptoren wirkt. Dieses wird in repetitiven Gaben bis zur deutlichen Besserung der klinischen Symptomatik eingesetzt (Titrationsantagonisierung). Vorsicht ist bei Abhängigen geboten, bei denen dadurch ein akutes Entzugssyndrom ausgelöst werden kann. Bei der Antagonisierung von länger wirksamen Opioiden kann es wegen der recht kurzen Halbwertszeit von Naloxon zu einem Rebound-Phänomen, der Remorphinisierung, kommen.[13]
Laut Weltdrogenbericht 2017 sind Opioide im Zusammenhang mit illegalem Drogenmissbrauch die schädlichsten Rauschdrogen und weltweit für 70 % aller negativen Gesundheitsfolgen verantwortlich.[31][32]
Toleranz, Abhängigkeit und Entzug
Die Toleranzentwicklung (Gewöhnung) bei Opioiden bezeichnet die Wirkungsabschwächung und Verkürzung der Wirkdauer bei wiederholter Zufuhr, die durch eine Dosiserhöhung ausgeglichen wird. Es handelt sich um eine pharmakodynamische Toleranz, die hauptsächlich auf einer gesteigerten Enzymaktivität der intrazellulären Adenylatzyklase beruht.[33]
Die Toleranzausbildung ist charakteristischerweise für die analgetische, euphorische und atemdepressive Wirkung schneller als für die spasmogenen peripheren Effekte und die Miosis. Bei endogenen Opioiden wird die Toleranzentwicklung durch eine Aufnahme und Aufarbeitung der Rezeptoren in die Zelle verhindert.[34] Bei unterbrochener Opioidzufuhr kommt es zur Entzugssymptomatik, die auf einer vermehrten Freisetzung von Noradrenalin beruht. Die Entzugssymptomatik ist ein Diagnosekriterium für eine entstandene Abhängigkeit.[35]
Ein Entzug von Opioiden kann im ambulanten oder stationären Bereich bzw. ohne ärztliche Hilfe als sog. „kalter Entzug“ oder mit „qualifizierten“ Methoden durchgeführt werden. Der Schweregrad des Opioidentzugssyndrom kann mittels verschiedener validierter Beurteilungsbögen erhoben werden und ist abhängig von mehreren Faktoren. Eine psychosoziale Betreuung, die im Übrigen auch ein begünstigender Faktor für einen erfolgreichen Entzug an und für sich ist, soll diesem folgen, da damit eine länger dauernde bzw. anhaltende Abstinenz erleichtert wird. Eine psychosoziale Betreuung wird auch für Personen, die sich in Substitutionsprogrammen befinden, gefordert. Letztere sind die anerkannte Therapie für eine Abhängigkeit von Opioiden, insbesondere der Heroin-Abhängigkeit.
Werden Opioide zur Schmerztherapie eingesetzt, tritt eine Toleranzentwicklung und Abhängigkeit (bei ausreichender und zeitkonstanter Dosierung) nicht auf. Ein lautstarkes Verlangen nach vermehrten Opioidgaben ist hier als Zeichen einer Unterdosierung zu werten.[4]
Rechtliche Aspekte
Den nationalen Gesetzen liegt das Einheitsabkommen über die Betäubungsmittel zugrunde, vormals Internationales Opiumabkommen.
In Deutschland wird die Verkehrsfähigkeit von Betäubungsmitteln durch das Betäubungsmittelgesetz (BtMG) geregelt; in der Schweiz (Betäubungsmittelgesetz) und Österreich (Suchtmittelgesetz) gelten entsprechende Gesetze. Opioide sind je nach Sucht- bzw. Missbrauchspotential entweder in allen Konzentrationen (siehe auch Übersichtstabelle), ab einer bestimmten Konzentration (Codein, Tilidin mit Naloxon, Dextropropoxyphen) oder aber überhaupt nicht (Tramadol und Nalbuphin) beschränkt.
Literatur
- J. Eckart, K. Jaeger, Th. Möllhoff (Hrsg.): Kompendium Anästhesiologie. ecomed 2010, ISBN 978-3-609-71361-8.
- Enno Freye: Opioide in der Medizin. Springer, Heidelberg 2008; 8. Auflage ebenda 2010.
- Karow, Lang-Roth: Allgemeine und spezielle Pharmakologie und Toxikologie. 14. Auflage 2005. Eigenverlag.
- S3-Leitlinie: Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS), AWMF-Registernummer 145/003, Stand 09/2014
- Jan M. van Ree, Mirjam A. F. M. Gerrits, Louk J. M. J. Vanderschuren: Opioids, Reward and Addiction: An Encounter of Biology, Psychology, and Medicine. Pharmacological Reviews 51 (2), 1999, S. 341–396 (online Volltext)
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg/ New York u. a. 1999, ISBN 3-540-65024-5, S. 26–35.
- Eberhard Klaschik: Schmerztherapie und Symptomkontrolle in der Palliativmedizin. In: Stein Husebø, Eberhard Klaschik (Hrsg.): Palliativmedizin. 5. Auflage, Springer, Heidelberg 2009, ISBN 3-642-01548-4, S. 207–313, hier: S. 229–263 (Opioidanalgetika).
Weblinks
Einzelnachweise
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 17. September 2019]).
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck. Vieweg & Sohn, Braunschweig 1914 (zeno.org [abgerufen am 17. September 2019]).
- J. Porter, H. Jick: Addiction rare in patients treated with narcotics. In: New England Journal of Medicine, Band 302, 1980, S. 123.
- Enno Freye: Opioide in der Medizin. 8. Auflage. Springer, 2010.
- Machelska H, Celik MÖ: Advances in Achieving Opioid Analgesia Without Side Effects. In: Front Pharmacol. 9, 2018, S. 1388. doi:10.3389/fphar.2018.01388. PMID 30555325. PMC 6282113 (freier Volltext).
- W. R. Martin, C. G. Eades, J. A. Thompson, R. E. Huppler, P. E. Gilbert: The effects of morphine- and nalorphine- like drugs in the nondependent and morphine-dependent chronic spinal dog. In: J. Pharmacol. Exp. Ther. Band 197, Nr. 3, 1976, S. 517–532, PMID 945347.
- Fachinformation Meptid(R) Stand September 2007.
- D. J. Rowbotham: Endogenous opioids, placebo response, and pain. In: Lancet, Band 357, Nr. 9272, 16. Juni 2001, S. 1901–1902. PMID 11425407.
- Lüllmann, Mohr: Pharmakologie und Toxikologie, 15. Auflage 2003. ISBN 3-13-368515-5
- Kratom (Mitragyna speciosa). Europäische Beobachtungsstelle für Drogen und Drogensucht, abgerufen am 14. Oktober 2017.
- J. R. Menzies, S. J. Paterson, M. Duwiejua, A. D. Corbett: Opioid activity of alkaloids extracted from Picralima nitida (fam. Apocynaceae). In: European Journal of Pharmacology. Band 350, Nr. 1, 29. Mai 1998, ISSN 0014-2999, S. 101–108, PMID 9683021.
- Jochen Schulte am Esch, Hanswerner Bause, Eberhard Kochs: Anästhesie, Intensivmedizin, Notfallmedizin, Schmerztherapie. Thieme, Stuttgart, 3. Auflage 2006. ISBN 3-13-119083-3.
- Karow, Lang-Roth: Allgemeine und spezielle Pharmakologie und Toxikologie. 14. Auflage 2005. Eigenverlag.
- Frank Detlev, Richling Schneider: Fakten. Arzneimittel 2007. Thieme, Stuttgart 2006, ISBN 3-13-140543-0.
- Martin S. Angst, Nicholas G. Phillips et al.: Pain sensitivity and opioid analgesia: a pharmacogenomic twin study. In: Pain. 2012. doi:10.1016/j.pain.2012.02.022.
- H. McQuay: Opioids in pain management. Review. In: The Lancet, Band 353, Nr. 9171, 26. Juni 1999, S. 2229–2232. PMID 10393001.
- AWMF-Leitlinie: Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS) (PDF; 1,3 MB), abgerufen am 16. Dezember 2015.
- E. S. Levitt, J. T. Williams: Desensitization and Tolerance of Mu Opioid Receptors on Pontine Kölliker-Fuse Neurons. In: Mol Pharmacol. 93, Nr. 1, Januar 2018, S. 8–13. doi:10.1124/mol.117.109603. PMID 29097440.
- Pharmakologie und Toxikologie. 2. Auflage. Georg Thieme Verlag, Stuttgart 2016, ISBN 978-3-13-142862-2, doi:10.1055/b-003-129299 (thieme.de [abgerufen am 21. Oktober 2020]).
- Levitt ES, Abdala AP, Paton JF, Bissonnette JM, Williams JT: μ opioid receptor activation hyperpolarizes respiratory-controlling Kölliker-Fuse neurons and suppresses post-inspiratory drive. In: J Physiol. 593, Nr. 19, Oktober 2015, S. 4453–69. doi:10.1113/JP270822. PMID 26175072.
- Bachmutsky I, Wei XP, Kish E, Yackle K: Opioids depress breathing through two small brainstem sites. In: Elife. 9, Februar 2020. doi:10.7554/eLife.52694. PMID 32073401.
- A. Kliewer, A. Gillis, R. Hill, F. Schmiedel, C. Bailey, E. Kelly, G. Henderson, M. J. Christie, S. Schulz: Morphine-induced respiratory depression is independent of β-arrestin2 signalling. In: British Journal of Pharmacology. 177, Nr. 13, Juli 2020, S. 2923–2931. doi:10.1111/bph.15004. PMID 32052419.
- Husebø, Klaschik: Palliativmedizin, Springer Medizin Verlag Heidelberg, 2006, 4. Auflage. ISBN 978-3-540-29888-5.
- A. J. Jennings, A. N. Davies, J. P. T. Higgins et al.: A systematic review of the use of opioids in the management of dyspnoea. In: Thorax, Band 57, 2002, S. 939–944.
- James R. Runo, E. Wesley Ely: Treating dyspnea in a patient with advanced chronic obstructive pulmonary disease – Evidence-Based Case Review. In: West J Med., Band 175, Nr. 3, September 2001, S. 197–201. PMC 1071542 (freier Volltext).
- G. Rocker, R. Horton, D. Currow, D. Goodridge, J. Young, S. Booth: Palliation of dyspnoea in advanced COPD: revisiting a role for opioids. In: Thorax, Band 64, Nr. 10, Oktober 2009, S. 910–915. PMID 19786716.
- B. Varkey: Opioids for palliation of refractory dyspnea in chronic obstructive pulmonary disease patients. In: Curr Opin Pulm Med., Band 16, Nr. 2, März 2010, S. 150–154. PMID 20071992.
- Atemnot in der Palliativversorgung, Schmerztherapie, DGS, Ausgabe 2.2011, 27. Jg.
- A. Ikoma et al.: The neurobiology of itch. (Review) In: Nat Rev Neurosci, Band 7, Nr. 7, Juli 2006, S. 535–547. PMID 16791143.
- I. Hernandez, M. He, M. M. Brooks et al.: Exposure-Response Association Between Concurrent Opioid and Benzodiazepine Use and Risk of Opioid-Related Overdose in Medicare Part D Beneficiaries. In: JAMA Network Open, 22. Juni 2018, 1(2):e180919. doi:10.1001/jamanetworkopen.2018.0919
- agt: World Drug Report 2017. Abgerufen am 5. Dezember 2017.
- World Drug Report. Abgerufen am 5. Dezember 2017.
- E. Freye, L. Latasch: Toleranzentwicklung unter Opioidgabe – Molekulare Mechanismen und klinische Bedeutung. In: Anasthesiol. Intensivmed. Notfallmed. Schmerzther., Band 38, Nr. 1, Januar 2003, S. 14–26. PMID 12522725.
- T. Koch et al.: Receptor endocytosis counteracts the development of opioid tolerance. In: Mol Pharmacol., Band 67, Nr. 1, Januar 2005, S. 280–287. PMID 15475572.
- J. Cami, M. Farre: Drug addiction. (Review) In: N. Engl. J. Med., Band 349, Nr. 10, 4. September 2003, S. 975–986. PMID 12954747.